文章信息
- 安宁, 张桂彬, 李明伟, 陈秀萍, 胡文舜, 陈发兴
- AN Ning, ZHANG Guibin, LI Mingwei, CHEN Xiuping, HU Wenshun, CHEN Faxing
- 提取剂和酶处理对龙眼可溶性糖提取的影响
- Effects of extraction agents and enzyme treatment on the extraction of longan soluble sugar
- 亚热带农业研究, 2019, 15(2): 110-114
- Subtropical Agriculture Research, 2019, 15(2): 110-114.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2019.02.007
-
文章历史
- 收稿日期: 2019-04-18
2. 福建省农业科学院果树研究所, 福建 福州 350013
2. Fruit Orchids Research Institute, Fujian Academy of Agricultural Science, Fuzhou, Fujian 350013, China
龙眼是我国亚热带名优果树,果实营养丰富,富含糖、有机酸和Vc,被视为珍贵补品[1]。糖是果实品质和风味物质的主要成分,是氨基酸、维生素、色素和芳香物质等营养成分的合成物质,糖的含量、种类及组成比例是决定果实品质的重要因子[2]。成熟的龙眼果实主要包括蔗糖、果糖和葡萄糖3种可溶性糖[3]。根据单糖与双糖的比例可将龙眼分为:蔗糖积累型、还原糖积累型和中间类型[4]。
高效液相色谱法(high performance liquid chromatography, HPLC)是目前最常用的糖成分测定方法,操作简便且效果理想[5-6]。HPLC测定前通常以水和乙醇溶液做可溶性糖提取剂[7]。由于植物体内存在水解酶,需要采用适当的方法破坏或抑制酶活[8],微波能快速使酶钝化失活,灭酶效果较好[9]。当前龙眼果实可溶性糖的提取多采用水提法[10]或乙醇法[4, 11],但不同提取剂的比较及果肉杀酶与否对提取率的影响尚未见报道,在苹果、桃、荔枝、葡萄等其他果树上也鲜见相关报道。本研究以乙醇溶液和水为提取剂分别对龙眼果肉进行杀酶与不杀酶处理,比较不同提取方法下的蔗糖、葡萄糖、果糖及总糖含量变化,分析不同提取剂和杀酶与否对提取龙眼果实可溶性糖的影响,以确定龙眼果实可溶性糖的最适提取方法。
1 材料与方法 1.1 供试材料供试品种为‘四季龙眼’,2019年1月中旬采自国家果树种质(福州)龙眼圃。从不同龙眼树上随机选择成熟度基本一致、大小均匀、无机械损伤和病虫害侵染的果实,混合均匀。
1.2 标准曲线的建立分别将色谱纯级的固体标准品(蔗糖、葡萄糖和果糖)配置成不同浓度的标准溶液。蔗糖质量浓度梯度为5、15、25、35、45 mg·mL-1,葡萄糖和果糖均为1、3、5、7、9 mg·mL-1。经0.45 μm微孔滤膜过滤,用HPLC测定,以峰面积对质量浓度制作标准曲线。
1.3 提取方法试验设置杀酶—乙醇法、不杀酶—乙醇法、杀酶—水提法和不杀酶—水提法共4个处理,每个处理4次重复。取约50 g‘四季龙眼’果肉,混匀后随机平均分为2份,一份进行杀酶,一份不杀酶。杀酶方法参照王绍林[9]和帅良等[10]方法并加以改良,即将果肉放入微波炉中火处理30 s。2份样品经液氮研磨后,各准确称取8份2.00 g。
1.3.1 乙醇提取参照陈秀萍等[12]方法,并加以改良。加7.00 mL体积分数为85%乙醇于37 ℃水浴提取20 min,13 500 r·min-1离心10 min,倒出上清液,提取3次(后2次均加6 mL 85%乙醇),合并上清液,于65 ℃烘箱浓缩约40 h,用超纯水溶解,定容至10 mL,经0.45 μm微孔滤膜过滤。
1.3.2 水提取加7.00 mL超纯水于37 ℃水浴提取20 min,13 500 r·min-1离心10 min,倒出上清液,定容至10 mL,经0.45 μm微孔滤膜过滤。
1.4 检测与分析用高效液相色谱仪(Waters e2695, USA)测定可溶性糖含量。色谱柱为Waters的Sugar-PakTM Ⅰ柱,流动相为脱气后的超纯水,每次进样10 μL,流速为0.4 mL·min-1,柱温为65 ℃。Waters 2414示差检测器检测洗脱峰。EmpowerTM 3软件控制系统运行与处理色谱结果。总糖以蔗糖、葡萄糖和果糖之和计。
采用Excel 2010软件处理数据,SPSS统计软件进行显著性检验和相关性分析。
2 结果与分析 2.1 标准曲线的建立标样中各组分的出峰顺序依次为:蔗糖、葡萄糖和果糖,其出峰时间分别为9.919、12.273、14.656 min,所有组分在30 min内完成出峰。对测得的数值进行相关分析和线性回归分析(图 1)表明,相关系数分别为0.998 8、0.993 6、0.999 1,说明蔗糖、葡萄糖和果糖在线性范围内(分别为5~45、1~9、1~9 mg·mL-1)均保持很好的线性关系。
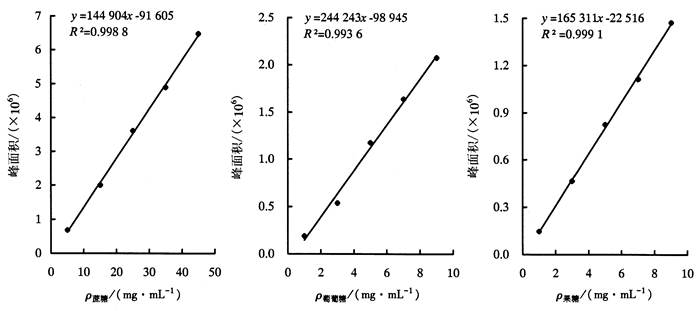
|
图 1 蔗糖、葡萄糖和果糖的标准曲线 Figure 1 Standard curve of sucrose, glucose and fructose |
从测得的可溶性糖组分含量(表 1)可以看出,4种方法的龙眼果肉糖分提取量存在差异。3种糖分和总糖提取量由高至低均为:杀酶—乙醇法>不杀酶—乙醇法>杀酶—水提法>不杀酶—水提法。杀酶—乙醇法和不杀酶—水提法在蔗糖、葡萄糖、果糖提取量上分别相差40.70、7.56、5.49 mg·g-1,在总糖提取量上相差53.75 mg·g-1。由方差分析可知,除了水作为提取剂时杀酶与否对葡萄糖和果糖提取量差异不显著,乙醇作为提取剂时杀酶与否对葡萄糖提取量差异显著(P < 0.05),其余两两之间差异均达极显著水平(P < 0.01)。
| mg·g-1 | ||||
| 提取方法 | w蔗糖 | w葡萄糖 | w果糖 | w总糖 |
| 杀酶—乙醇法 | 135.55±2.67aA | 22.36±1.18aA | 24.01±1.63aA | 181.92±5.36aA |
| 不杀酶—乙醇法 | 127.20±1.86bB | 21.17±0.64bA | 20.80±0.80bB | 169.17±3.13bB |
| 杀酶—水提法 | 106.61±9.02cC | 15.57±1.39cB | 19.12±1.83cC | 141.30±12.12cC |
| 不杀酶—水提法 | 94.85±4.88dD | 14.80±0.68cB | 18.52±0.75cC | 128.17±6.19dD |
| 1)同列数值后附不同大小写字母者分别表示差异达0.01、0.05显著水平。 | ||||
由表 1可知,杀酶时用乙醇提取的蔗糖、葡萄糖、果糖含量分别是用水提取的1.27、1.44、1.26倍,分别相差28.94、6.79、4.89 mg·g-1,总糖相差40.62 mg·g-1,均表现为极显著差异;不杀酶时用乙醇提取的蔗糖、葡萄糖、果糖含量分别是用水提取的1.34、1.43、1.12倍,分别相差32.36、6.37、2.28 mg·g-1,总糖相差41.00 mg·g-1,均表现为极显著差异。由上可见,在相同条件下用乙醇提取糖的总体效果是水的1.31倍,表明85%乙醇溶液的可溶性糖提取率显著比水好。
2.4 酶处理对龙眼可溶性糖提取量的影响由表 1可知,醇提条件下,杀酶后蔗糖、葡萄糖、果糖提取量分别是不杀酶的1.07、1.06、1.15倍,分别相差8.35、1.19、3.21 mg·g-1,总糖相差12.75 mg·g-1,差异达显著或极显著水平;水提条件下,杀酶后蔗糖、葡萄糖、果糖提取量分别是不杀酶的1.12、1.05、1.03倍,总糖相差13.13 mg·g-1,蔗糖、总糖提取量上表现为极显著差异,在葡萄糖和果糖上两者相差均不到1 mg·g-1,差异不显著。由上可见,在相同条件下杀酶后提取糖的总体效果是不杀酶的1.08倍,表明先进行杀酶更能充分提取可溶性糖。
3 讨论与结论 3.1 品种特性本研究表明,不同提取方法对龙眼果实可溶性糖含量的测定具有明显影响,乙醇法提取率比水提法高,且提取前先对果肉进行杀酶能更充分提取糖。4种处理中‘四季龙眼’蔗糖与总糖比例均接近75%,比一般的龙眼品种比例高很多。陈秀萍等[3]报道,63份龙眼种质资源果实中蔗糖占总糖含量的42.8%~81.4%,平均为62.5%,以‘四季龙眼’比值最高。该结果与本研究基本一致,体现了‘四季龙眼’的品种特征。本试验所测定的‘四季龙眼’蔗糖与总糖比例略低于陈秀萍等[3]的报道,可能由于摘取果实季节不同而导致。
3.2 机理分析 3.2.1 提取剂龙眼果实的糖代谢主要受蔗糖磷酸合成酶、蔗糖合成酶、酸性转化酶和中性转化酶的调控和影响[13]。糖分积累是在这些酶的综合作用下进行的,同时伴随着呼吸消耗。乙醇法比水提法的糖提取率更高可能是由于与水相比,乙醇作为有机溶剂能降低多数酶的催化活性。在有机溶剂中,酶与底物接触会受到扩散限制和立体障碍的影响,或者酶分子的动态结构和构象发生改变,从而影响酶的催化活性[14]。如王悦等[15]发现,当乙醇浓度超过22%时,N-乙酰-β-D-氨基葡萄糖苷酶出现活力抑制;张佳佳等[16]发现,随着乙醇浓度的增加,乙酰胆碱酯酶活力呈不同程度的减小,这些研究均表明乙醇能抑制酶的活性。
3.2.2 酶处理对果肉进行杀酶处理更能充分提取糖。颜思语等[17]以苹果、橙子、梨为材料,发现微波加热能提高3种水果的可溶性糖含量,这与本试验结果相一致。可能由于杀酶处理破坏了果肉组织和细胞,有助于提取可溶性糖;也可能由于果肉在研磨过程中造成机械损伤,会导致呼吸强度的增加[18],从而消耗更多的有机物,导致糖分减少,若在果肉研磨之前进行杀酶处理,则能快速抑制果肉细胞呼吸作用而降低糖分的消耗。因此,无论提取剂是乙醇溶液还是水,杀酶处理都能提高糖的提取率,对这两种方法起到优化作用。此外,水作为提取剂时杀酶与否在葡萄糖和果糖含量上差异不显著,这可能由于水提取的糖含量低,而所用材料的葡萄糖和果糖含量本身也比较低,导致其在杀酶与不杀酶处理上差别不大。
综上所述,龙眼果实可溶性糖提取量的高低主要取决于有无充分抑制酶的活性。杀酶—乙醇法中杀酶处理和乙醇双重抑制酶的活性,糖提取量最高;而不杀酶—水提法没有抑制酶活性,糖提取量最低。
3.3 实际应用乙醇法虽然能测得更准确的可溶性糖含量,但提取糖后需要除掉乙醇导致试验耗时较长,如本试验采用65 ℃烘箱进行浓缩,耗时将近48 h,而且步骤繁琐、费时费力。水提法则步骤简单、省时省力,加以杀酶处理后提取率较高。因此,在提取果实可溶性糖时,若要获得尽可能精确的含量数据,以杀酶—乙醇法最好;若需要测定大样本果实的可溶性糖,以杀酶—水提法为宜。龙眼属于糖直接积累型[19],对于淀粉转化型和中间类型的果实需进一步比较分析。
| [1] | 陈杰忠. 果树栽培学各论:南方本[M]. 4版. 北京: 中国农业出版社, 2011: 83-84. |
| [2] | 张上隆, 陈昆松. 果实品质形成与调控的分子生理[M]. 北京: 中国农业出版社, 2007: 1. |
| [3] | 陈秀萍, 邓朝军, 胡文舜, 等. 龙眼种质资源果实糖组分及含量特征分析[J]. 果树学报, 2015, 32(3): 420–426. |
| [4] | 胡志群, 李建光, 王惠聪. 不同龙眼品种果实品质和糖酸组分分析[J]. 果树学报, 2006, 23(4): 568–571. |
| [5] | 徐慧, 王磊, 饶桂维. 高效液相色谱法同时测定苹果中3种糖及主成分分析和聚类分析[J]. 化学分析计量, 2018, 27(5): 16–20. DOI: 10.3969/j.issn.1008-6145.2018.05.004 |
| [6] | MAGWAZA L S, OPARA U L. Analytical methods for determination of sugars and sweetness of horticultural products-A review[J]. Scientia Horticulturae, 2015, 184: 179–192. DOI: 10.1016/j.scienta.2015.01.001 |
| [7] | 丁晓雯, 李诚, 李巨秀. 食品分析[M]. 北京: 中国农业大学出版社, 2016: 86-87. |
| [8] | 吴继洲, 孔令义. 天然药物化学[M]. 北京: 中国医药科技出版社, 2008: 207-208. |
| [9] | 王绍林. 微波炉知识问答[M]. 北京: 机械工业出版社, 1998: 105-107. |
| [10] | 帅良, 钱盼红, 刘文浩, 等. 不同龙眼品种果实成熟时糖含量及其特征研究[J]. 热带作物学报, 2016, 37(5): 915–921. DOI: 10.3969/j.issn.1000-2561.2016.05.011 |
| [11] | 林婧烨, 柯李晶, 鲁伟, 等. 高效液相色谱法测定龙眼果中水溶性单糖和寡糖[J]. 食品与生物技术学报, 2009, 28(4): 513–516. DOI: 10.3321/j.issn:1673-1689.2009.04.017 |
| [12] | 陈秀萍, 邓朝军, 许奇志, 等. 4个枇杷品种果实糖组分含量及其分布研究[J]. 福建农业学报, 2015, 30(2): 141–145. DOI: 10.3969/j.issn.1008-0384.2015.02.007 |
| [13] | 刘丽琴, 李伟才, 舒波, 等. 蔗糖代谢相关酶在'石硖'龙眼假种皮糖积累中的作用[J]. 果树学报, 2015, 32(4): 653–657. |
| [14] | 彭立凤. 有机溶剂对酶催化活性和选择性的影响[J]. 化学进展, 2000, 12(3): 296–304. DOI: 10.3321/j.issn:1005-281X.2000.03.006 |
| [15] | 王悦, 谢晓兰, 王勤, 等. 乙醇对南美白对虾N-乙酰-β-D-氨基葡萄糖苷酶活力与构象的影响[J]. 厦门大学学报(自然科学版), 2004, 43(z1): 28–31. DOI: 10.3321/j.issn:0438-0479.2004.z1.008 |
| [16] | 张佳佳, 刘丽斌, 刘智钧, 等. 乙醇体系中酶抑制法检测氨基甲酸乙酯的研究[J]. 食品工业科技, 2015, 36(2): 65–69, 74. |
| [17] | 颜思语, 潘静娴. 不同温度及加温方式对几种水果冬季鲜吃品质的影响[J]. 食品工业科技, 2013, 34(19): 80–83. |
| [18] | 罗云波, 生吉萍. 园艺产品贮藏加工学:贮藏篇[M]. 2版. 北京: 中国农业大学出版社, 2010: 4-7. |
| [19] | 陈俊伟, 张上隆, 张良诚. 果实中糖的运输、代谢与积累及其调控[J]. 植物生理与分子生物学学报, 2004, 30(1): 1–10. |
 2019,Vol. 15
2019,Vol. 15


