文章信息
- 张惠婷, 程文健, 赵卉双, 钟机, 陈丽娇
- ZHANG Hui-ting, CHENG Wen-jian, ZHAO Hui-shuang, ZHONG Ji, CHEN Li-jiao
- 碱性蛋白酶酶解缢蛏制备多肽工艺
- Optimal conditions of peptides extraction from Sinonovacula constricta by alkaline protease
- 亚热带农业研究, 2015, 11(04): 271-276
- JOURNAL OF AERONAUTICAL MATERIALS, 2015, 11(04): 271-276.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2015.04.011
-
文章历史
- 收稿日期: 2015-09-16
缢蛏是软体动物门竹蛏科水产动物[1]。在我国沿海地区,尤其在气候比较温暖的福建、浙江和广东等地缢蛏产量较高[2]。缢蛏富含蛋白质以及钙、磷、铁、碘等矿物质,热量、脂肪含量较低[3],是一种食用价值极高的高蛋白低脂肪水产动物。蛋白质是人体内不可缺少的重要营养物质[4]。但蛋白质相对分子质量较大且结构复杂,不易被人体消化吸收[5]。因此,如何提高蛋白质的消化利用率,成为当前研究热点。将蛋白质水解成小分子的生物活性多肽,是提高蛋白质消化利用率的有效方法之一,且已有研究表明,二肽以上的多肽能被人体完整吸收[6]。
生物活性多肽是指具有特定氨基酸序列的生物活性物质[7],不但能提供生长发育所需的营养物质,还具有免疫调节、抗高血压、抗病毒、抗细菌等多种生理活性[8]。生物活性多肽的制备方法以酶解法应用最广泛[9]。由于酶水解具有较高的选择性[10],且受pH、料液比、酶解温度、酶添加量、酶解时间等因素的影响,因此,利用酶解法制备多肽时,酶的选择及酶解条件的控制尤为重要。碱性蛋白酶是来源于枯草杆菌的一种内切酶,能水解含谷氨酸(Glu)、亮氨酸(Leu)、甲硫氨酸(Met)、酪氨酸(Tyr)、赖氨酸(Lys)、色氨酸(Trp)的肽键[11],水解位点较多。利用碱性蛋白酶对蛋白质进行水解,生物活性肽得率高。因此,本研究采用碱性蛋白酶对缢蛏进行水解,并在单因素试验基础上采用正交试验优化酶解工艺,为酶解法制备缢蛏多肽提供依据。
1 材料与方法 1.1 原料与设备 1.1.1 原料缢蛏购于福州市永辉超市;碱性蛋白酶购于北京索莱宝科技有限公司,酶活性为203 000 U·g-1;Gly-Gly-Tyr-Arg四肽标准品购于Sigma公司。
1.1.2 设备BS 224S型电子分析天平[赛多利斯科学仪器(北京)有限公司];T6新世纪紫外可见分光光度计(北京普析通用仪器有限责任公司);TGL-16C型台式离心机(上海安亭科学仪器厂);PB-10型pH计[赛多利斯科学仪器(北京)有限公司]。
1.2 试验方法 1.2.1 酶解流程缢蛏绞碎酶解灭酶粗提液离心取上清液测定多肽含量。
1.2.2 主要成分的测定(1)水分:采用直接干燥法[12];(2)蛋白质:采用凯氏定氮法[13]。(3)粗脂肪:采用索氏提取法[14]。
1.2.3 多肽含量的测定凡具有2个直接连接的肽键都有双缩脲反应[15]。因此,参照文献[16, 17]多肽含量的测定方法,获得四肽标准品的质量浓度[X/(mg·mL-1)]与其光密度(Y)之间的回归方程为:Y=0.144 3X+0.001 7,R2=0.999 8,X∈(0,1)。
称取10 g缢蛏,在特定酶解工艺参数下水解后,90 ℃水浴中灭酶10 min,冷却后将水解产物在8 000 r·min-1离心15 min,取上清液A。量取上清液A以及等体积三氯乙酸水溶液(0.1 g·mL-1),混匀、静置10 min后,4 000 r·min-1离心15 min,取上清液B。将上清液B与双缩脲试剂按3∶2的体积比加入试管中反应10 min后,2 000 r·min-1离心10 min,取上清液测定D540 nm,再根据所得的标准四肽回归方程,计算上清液B中多肽含量。

(1)单因素试验:准确称取10 g缢蛏,酶解,固定其他因素,分别考察pH值(8.0、9.0、10.0、11.0、12.0)、料液比(1∶1.0、1∶2.0、1∶3.0、1∶4.0、1∶5.0、1∶6.0)、温度(30、40、50、60、70 ℃)、酶添加量(1.0%、2.0%、3.0%、4.0%、5.0%、6.0%)和酶解时间(1.0、2.0、3.0、4.0、5.0、6.0 h)对缢蛏多肽含量的影响。按1.2.3 方法测定缢蛏多肽含量,每组重复3次,取平均值。
(2)正交试验:采用L25(56)正交试验设计优化碱性蛋白酶的酶解工艺。试验因素及水平见表 1。
| 水平 | 因素 | ||||
| pH值 | 酶添加量/% | 料液比 | 温度/℃ | 时间/h | |
| 1 | 8.0 | 1.0 | 1∶2.0 | 30 | 1.0 |
| 2 | 8.5 | 1.5 | 1∶2.5 | 35 | 1.5 |
| 3 | 9.0 | 2.0 | 1∶3.0 | 40 | 2.0 |
| 4 | 9.5 | 2.5 | 1∶3.5 | 45 | 2.5 |
| 5 | 10.0 | 3.0 | 1∶4.0 | 50 | 3.0 |
测定表明,缢蛏水分含量为80.74%、蛋白质含量为15.51%、粗脂肪含量为2.35%,其余成分含量仅占1.40%。由此可见,除水分外鲜缢蛏中蛋白质含量最高,适合作为制备生物多肽的原料。
2.2 pH值对碱性蛋白酶酶解效果的影响由图 1可知,反应液pH值在8.0-11.0之间时,多肽含量呈缓慢的先上升后下降趋势,当pH值为9.0时,达到最高水平;当pH值>11.0时,可能由于反应液碱性过高导致碱性蛋白酶活性降低,多肽含量也开始明显下降。因此,采用碱性蛋白酶酶解缢蛏的较佳 pH值为9.0左右。
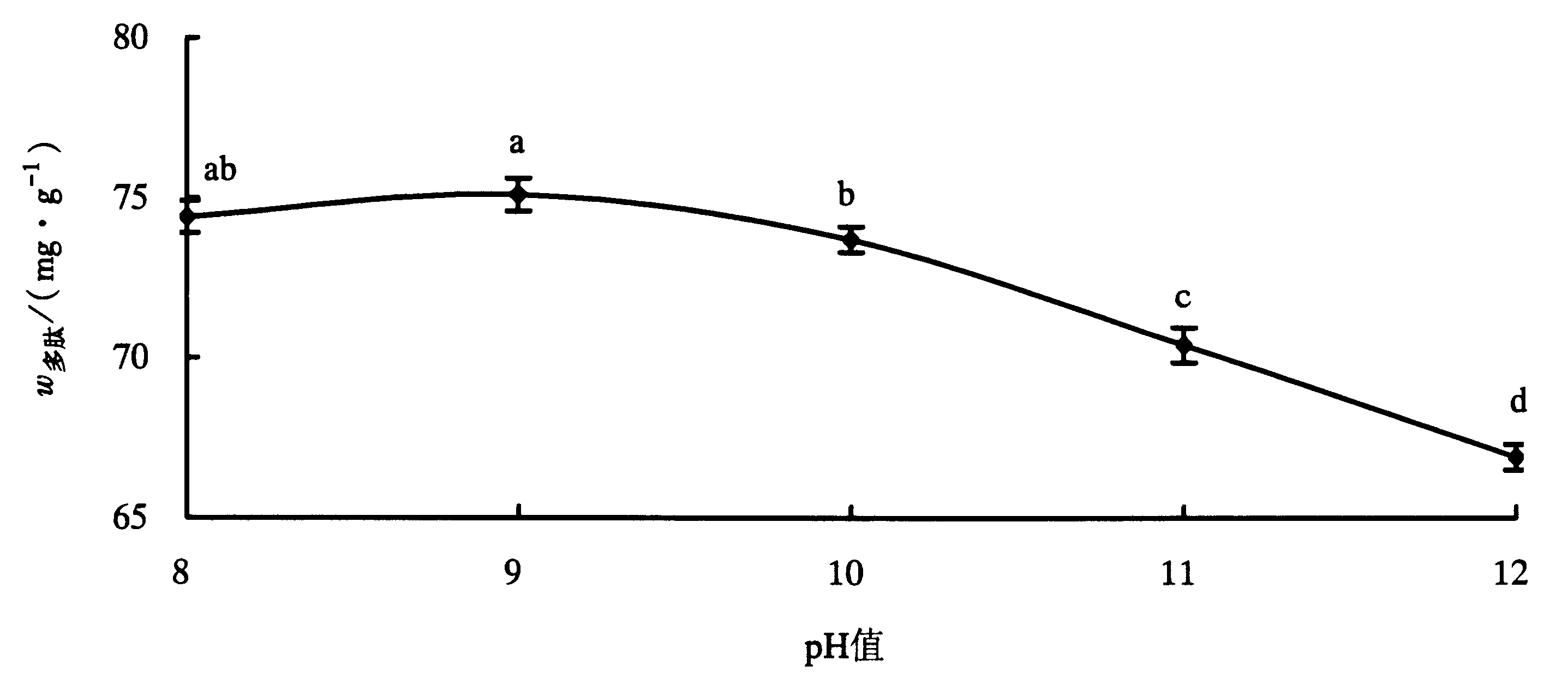
| 图 1 pH值对碱性蛋白酶酶解效果的影响 Fig.1 Effects of hydrolytic pH on the yield of peptides |
由图 2可知,料液比在1∶1.0至1∶2.0之间时,由于反应体系中溶液少,碱性蛋白酶扩散速度较慢,导致酶与底物接触的机会也较少,多肽含量上升趋势缓慢。而当料液比在1∶2.0至1∶3.0之间时,多肽含量上升趋势较快,料液比为1∶3.0时达到最高水平。之后可能由于反应体系中溶液增多,降低了底物与酶分子结合的机会,多肽含量开始下降。综合来看,料液比选取1∶3.0左右为宜。

| 图 2 料液比对碱性蛋白酶酶解效果的影响 Fig.2 Effects of hydrolytic solid-liquid ratio on the yield of peptides |
由图 3可知,酶解温度在30-50 ℃之间时,碱性蛋白酶酶解效果较稳定。当温度达到40 ℃时,多肽含量最高。当温度>50 ℃时,温度过高导致部分碱性蛋白酶失活,且使绝大部分缢蛏蛋白发生变性,导致多肽含量急剧下降。因此,酶解温度选择40 ℃左右较佳。

| 图 3 酶解温度对碱性蛋白酶酶解效果的影响 Fig.3 Effects of hydrolytic temperature on the yield of peptides |
由图 4可知,当酶添加量在1.0%-2.0%之间时,多肽含量呈上升趋势。而当酶添加量在2.0%-3.0%之间时,由于反应体系中酶量相对较充足,除将缢蛏蛋白进行水解外,还将酶解过程中产生的大分子多肽水解成小分子肽或氨基酸,降低多肽含量。当酶添加量>3.0%时,由于反应体系中缢蛏蛋白已经较完全水解,且水解液中的肽段切点已不适合碱性蛋白酶,多肽含量无明显变化。因此,酶添加量应控制在2.0%左右。

| 图 4 酶添加量对碱性蛋白酶酶解效果的影响 Fig.4 Effects of hydrolytic enzyme added on the yield of peptides |
由图 5可知,在酶解前期,多肽含量随酶解时间延长呈上升趋势,在2.0 h时,多肽含量最高,达到78.5 mg·g-1。而>2.0 h时,由于水解液中有限数量的碱性蛋白酶除将缢蛏蛋白进行水解外,还将水解过程中产生的大分子多肽水解成更小分子的肽或氨基酸,从而降低了多肽含量。因此,酶解时间控制在2.0 h效果较佳。

| 图 5 酶解时间对碱性蛋白酶酶解效果的影响 Fig.5 Effects of hydrolytic time on the yield of peptides |
正交试验优化酶解工艺结果见表 2。对表 2中极差R值进行比较可知,5个因素对多肽含量影响程度依次为:酶添加量>料液比>时间>温度>pH值。由表 2中K值可知,最优水平为:pH=9.5、酶添加量1.5%、料液比1∶3.0、温度45 ℃、时间2.5 h。
| 试验号 | pH值 | 酶添加量/% | 料液比 | 温度/℃ | 时间/h | 空列 | w多肽 |
| mg·g-1 | |||||||
| 1 | 1(8.0) | 1(1.0) | 1(1∶2.0) | 1(30) | 1(1.0) | 1 | 60.5±0.7 |
| 2 | 1 | 2(1.5) | 2(1∶2.5) | 2(35) | 2(1.5) | 2 | 74.7±0.5 |
| 3 | 1 | 3(2.0) | 3(1∶3.0) | 3(40) | 3(2.0) | 3 | 77.8±0.6 |
| 4 | 1 | 4(2.5) | 4(1∶3.5) | 4(45) | 4(2.5) | 4 | 79.2±0.4 |
| 5 | 1 | 5(3.0) | 5(1∶4.0) | 5(50) | 5(3.0) | 5 | 65.3±0.4 |
| 6 | 2(8.5) | 1 | 2 | 3 | 4 | 5 | 70.0±0.4 |
| 7 | 2 | 2 | 3 | 4 | 5 | 1 | 80.6±0.4 |
| 8 | 2 | 3 | 4 | 5 | 1 | 2 | 72.0±0.5 |
| 9 | 2 | 4 | 5 | 1 | 2 | 3 | 71.2±0.4 |
| 10 | 2 | 5 | 1 | 2 | 3 | 4 | 67.7±0.5 |
| 11 | 3(9.0) | 1 | 3 | 5 | 2 | 4 | 67.0±0.6 |
| 12 | 3 | 2 | 4 | 1 | 3 | 5 | 75.6±0.4 |
| 13 | 3 | 3 | 5 | 2 | 4 | 1 | 79.0±0.5 |
| 14 | 3 | 4 | 1 | 3 | 5 | 2 | 71.5±0.5 |
| 15 | 3 | 5 | 2 | 4 | 1 | 3 | 67.1±0.4 |
| 16 | 4(9.5) | 1 | 4 | 2 | 5 | 3 | 72.7±0.6 |
| 17 | 4 | 2 | 5 | 3 | 1 | 4 | 78.2±0.3 |
| 18 | 4 | 3 | 1 | 4 | 2 | 5 | 75.0±0.5 |
| 19 | 4 | 4 | 2 | 5 | 3 | 1 | 76.4±0.4 |
| 20 | 4 | 5 | 3 | 1 | 4 | 2 | 73.0±0.4 |
| 21 | 5(10.0) | 1 | 5 | 4 | 3 | 2 | 70.5±0.5 |
| 22 | 5 | 2 | 1 | 5 | 4 | 3 | 71.0±0.5 |
| 23 | 5 | 3 | 2 | 1 | 5 | 4 | 75.8±0.5 |
| 24 | 5 | 4 | 3 | 2 | 1 | 5 | 73.4±0.3 |
| 25 | 5 | 5 | 4 | 3 | 2 | 1 | 64.6±0.4 |
| K1 | 357.5 | 340.7 | 345.7 | 356.1 | 351.2 | 361.1 | |
| K2 | 361.5 | 380.1 | 364.0 | 367.5 | 352.5 | 361.7 | |
| K3 | 360.2 | 379.6 | 371.8 | 362.1 | 368.0 | 359.8 | |
| K4 | 375.3 | 371.7 | 364.1 | 372.4 | 372.2 | 367.9 | |
| K5 | 355.3 | 337.7 | 364.2 | 351.7 | 365.9 | 359.3 | |
| k1 | 71.5 | 68.1 | 69.1 | 71.2 | 70.2 | 72.2 | |
| k2 | 72.3 | 76.0 | 72.8 | 73.5 | 70.5 | 72.3 | |
| k3 | 72.0 | 75.9 | 74.4 | 72.4 | 73.6 | 72.0 | |
| k4 | 75.1 | 74.3 | 72.8 | 74.5 | 74.4 | 73.6 | |
| k5 | 71.1 | 67.5 | 72.8 | 70.3 | 73.2 | 71.9 | |
| R | 4.0 | 8.5 | 5.2 | 4.1 | 4.2 | 1.7 |
应用DPS数据处理系统进行方差分析,结果见表 3。由表 3可知,5个因素对多肽含量影响顺序为:酶添加量>料液比>时间>温度>pH值,与极差分析结果相一致。酶添加量F值极显著,说明碱性蛋白酶酶添加量在1.0%-3.0%之间,对多肽含量有极显著影响,这与图 4变化趋势相一致;料液比、时间F值显著,说明在碱性蛋白酶酶解工艺中料液比、酶解时间对多肽含量有显著影响,这与图 2、图 5变化趋势相符;pH值、温度F值不显著,说明pH值、温度对多肽含量影响都不显著。根据表 2、表 3的结果,选择pH值为9.5、酶添加量1.5%、料液比1∶3.0、温度45 ℃、时间2.5 h为最佳组合。
| 1)F0.05(4,4)=6.39,F0.01(4,4)=15.98;*、**分别表示差异达显著、极显著水平。 | |||||
| 变异来源 | 平方和 | 自由度 | 均方 | F值 | 显著性 |
| pH值 | 49.102 4 | 4 | 12.275 6 | 5.132 8 | |
| 酶添加量 | 355.126 4 | 4 | 88.781 6 | 37.122 3 | ** |
| 料液比 | 74.994 4 | 4 | 18.748 6 | 7.839 4 | * |
| 温度 | 55.862 4 | 4 | 13.965 6 | 5.839 4 | |
| 时间 | 72.426 4 | 4 | 18.106 6 | 7.570 9 | * |
| 空列 | 9.566 4 | 4 | 2.391 6 | ||
| 误差 | 9.566 4 | 4 | 2.391 6 | ||
| 总和 | 617.078 4 | ||||
将正交试验所得最优组合进行3次验证试验,结果显示最优组合下多肽含量达(81.3±0.4) mg·g-1,表明碱性蛋白酶酶解工艺参数优化成功。
3 结论利用碱性蛋白酶酶解缢蛏蛋白,在单因素试验基础上,采用正交试验优化缢蛏多肽的制备工艺条件,以期得到缢蛏多肽制备的最适酶解环境。结果表明最适条件为:pH值9.5、酶添加量1.5%、料液比1∶3.0、酶解温度45 ℃、酶解时间2.5 h,在此工艺条件下每克鲜缢蛏可提取多肽(81.3±0.4) mg。
| [1] | 王冬群.缢蛏育苗过程中几个问题的探讨[J].河北渔业,2004(3):9,22. |
| [2] | 安贤惠,李联泰.缢蛏研究现状及发展前景[J].科学养鱼,2005(1):4-5. |
| [3] | 雷晓凌,吴红棉,范秀萍,等.缢蛏肉的食品化学特性及其营养液的研制[J].海洋科学,2004,28(12):4-7. |
| [4] | 阚建全.食品化学[M].北京:中国农业大学出版社,2002:146-148. |
| [5] | 孔令明,李芳,陶永霞,等.多肽的功能活性与研究进展[J].中国食品添加剂,2009(3):71-73. |
| [6] | 索江华,李凤玲,郭春燕.活性肽的生理功能与制备方法研究进展[J].中国饲料,2014(23):30-33. |
| [7] | DE CASTRO R J S, SATO H H. Biologically active peptides: Processes for their generation, purification and identification and applications as natural additives in the food and pharmaceutical industries[J]. Food Research International, 2015,74:185-198. |
| [8] | 李维,兰海楠,郭风,等.生物活性肽的研究进展[J].中国畜牧兽医,2012,39(10):105-107. |
| [9] | 刘海军,乐超银,邵伟,等.生物活性肽研究进展[J].中国酿造,2010(5):5-8. |
| [10] | 崔和平,郭兴凤.食源性降血压肽制备研究进展[J].粮食与油脂,2013,26(2):5-8. |
| [11] | 蒋海萍.蓝圆鲹蛋白制备抗氧化肽的研究[D].南宁:广西大学,2014. |
| [12] | 中华人民共和国卫生部.食品中水分的测定:GB 5009.3—2010[S].北京:中国标准出版社,2010. |
| [13] | 中华人民共和国卫生部.食品中蛋白质的测定:GB 5009.5—2010[S].北京:中国标准出版社,2010. |
| [14] | 孙晓光,尹健.食品中粗脂肪的测定:GB/T 14772—2008[S].北京:中国标准出版社,2009. |
| [15] | 毕葳,邢延一,李燕燕,等.应用双缩脲反应测定鳖甲中总肽含量的方法学研究[J].中国实验方剂学杂志,2011,17(15):63-65. |
| [16] | 李理,张静.蛋白水解产物中多肽得率的测定方法研究[J].现代食品科技,2010,26(8):884-888. |
| [17] | 鲁伟,任国谱,宋俊梅.蛋白水解液中多肽含量的测定方法[J].食品科学,2005,26(7):169-171. |
 2015, Vol. 11
2015, Vol. 11

