文章信息
- 王晓国, 周主贵, 李冬萍, 李秀玲, 张金莲, 陈廷速
- WANG Xiao-guo, ZHOU Zhu-gui, LI Dong-ping, LI Xiu-ling, ZHANG Jin-lian, CHEN Ting-su
- 同色兜兰菌根真菌染色方法比较
- Comparison of five staining methods for orchid mycorrhizal fungi in Paphiopedilum concolor roots
- 亚热带农业研究, 2015, 11(04): 267-270
- JOURNAL OF AERONAUTICAL MATERIALS, 2015, 11(04): 267-270.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2015.04.010
-
文章历史
- 收稿日期: 2015-08-20
2. 广西农业科学院微生物研究所, 广西 南宁 530007
2. Microbiology Research Institute, Guangxi Academy of Agricultural Sciences, Nanning, Guangxi 530007, China
兜兰属(Paphiopedilum)植物是最受欢迎的兰科植物之一,具有极高的观赏价值[1]。随着国际花卉市场对兜兰的大量需求,以及持续的采集压力致使我国野生兜兰种群数目锐减,部分兜兰在野外已极难发现[2]。恢复兜兰种群数量是保护兜兰的有效途径之一[3, 4],然而兰科植物微小的种子本身无法贮存养分。在自然条件下其种子萌发阶段完全依靠菌根真菌为其提供养分[5],但人工种植过程中缺少兰科真菌的作用,制约了兰科植物种群恢复的进程[6]。研究表明,菌根对多种植物的生长发育有促进作用,兰科植物也与特定的菌根真菌相结合而汲取养分[7, 8, 9]。自然条件下,兰科菌根真菌促进种子萌发,有助于植株吸收无机养分和水分[10]。因此,菌根真菌对兰科植物生长发育极为重要,在兰科植物人工栽培中引入菌根化育苗技术具有广阔的应用前景。
兰科菌根真菌的形态学特征与鉴定、共生关系的研究均涉及到菌根结构观察与侵染率测定。由于研究者所采用的染色方法不同[11, 12, 13],其研究结果往往缺乏可比性。因此,有必要对现有的兰科菌根染色方法进行比较和改良。本研究以同色兜兰营养根为材料,对比酸性品红、台酚蓝、苏丹红Ⅳ、苯胺蓝和墨水等5种染色剂对其菌根真菌的染色效果,以期建立高效、准确的同色兜兰菌根染色方法,为兜兰菌根研究提供基础。
1 材料与方法 1.1 试验材料同色兜兰植株采集于广西雅长兰科植物自然保护区,现保存于广西农业科学院花卉研究所兰科植物资源圃中。选择资源圃中健康植株的营养根作为试验材料。
1.2 试验方法 1.2.1 脱色时间采集同色兜兰生长良好的营养根,用已消毒的剪刀截取4-5 cm的根3-4段。在自来水下冲洗干净,切成2-3 cm的小段,用滤纸吸干水,加0.2 g·mL-1 KOH 溶液完全浸泡根系,90 ℃分别水浴3、5、7、9 h,然后用自来水轻轻冲洗3次。用10% H2O2脱色5 h后用自来水冲洗3次。加2% HCl溶液室温酸化30 min,去掉HCl 溶液,用自来水轻轻冲洗3次。用5% 醋酸墨水染色,即以5 mL派克纯黑书写墨水加95 mL家用白醋配制。染色液室温过夜后,将根段放在水中保存。
1.2.2 5种染色方法对比用5种染色剂进行染色处理,各染色剂配制如下。①苯胺蓝染色液:0.1 g苯胺蓝+100 mL 95%酒精;②酸性品红染色液:0.15 g酸性品红+100 mL乳酸+100 mL甘油+100 mL蒸馏水;③苏丹红Ⅳ染色液:0.1 g+苏丹红Ⅳ染料+10 mL 95%酒精+10 mL甘油;④台酚蓝染色液:0.05 g台酚蓝+100 mL乳酸+100 mL甘油+100 mL蒸馏水;⑤醋酸墨水染色液:5 mL派克(Quink)纯黑书写墨水+95 mL家用白醋。各处理均采用 1.2.1 所述方法,但90 ℃水浴5 h;①-④染色后的根段在乳酸甘油溶液(乳酸∶甘油∶蒸馏水为1∶2∶1)中保存,⑤染色后的根段在蒸馏水中保存。
1.2.3制片与显微镜观察 挑取脱色处理后的根段于载玻片上,加2-3滴乳酸于根系使其起褪色作用,盖上24 mm×50 mm盖玻片,用手指将根段稍用力压扁。使用奥林巴斯CX41显微镜观察和拍照。
2 结果与分析 2.1 脱色时间对同色兜兰菌根染色效果的影响同色兜兰菌根不同脱色时间下染色效果差异较大(图 1)。从图 1可见,3 h处理的菌根皮层杂质未消煮干净,造成皮层染色较深,反差不明显;7 h处理的菌根皮层杂质少,但部分皮层细胞破裂,染色背景杂;9 h处理的菌根皮层多数已经消煮烂,皮层细胞破裂较多,细胞内容物染色,不易进行压片观察;5 h处理的菌根皮层比较干净,杂质少,染色效果较好。
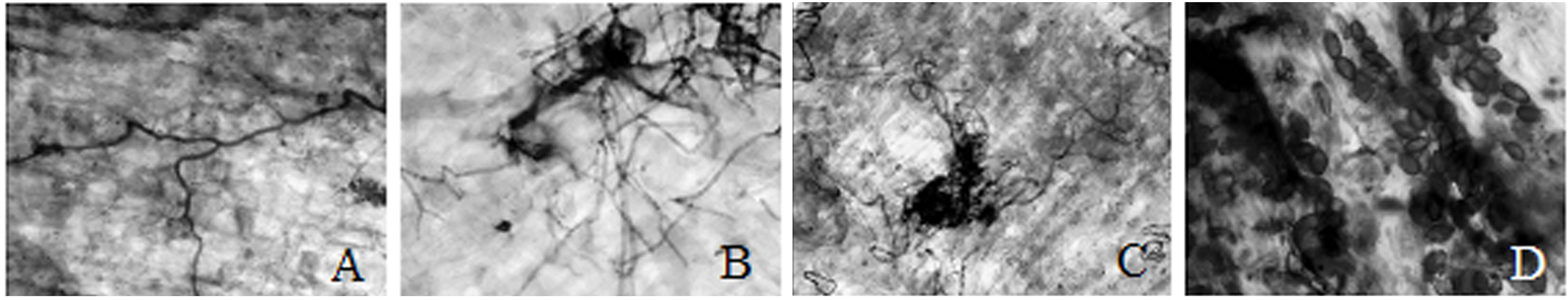
| 图 1 不同脱色时间下同色兜兰菌根皮层染色效果(×10) Fig.1 Dye results of P.concolor mycorrhiza in different treatment durations |
同色兜兰菌根5种染色效果见图 2。其中,酸性品红和苏丹红Ⅳ染色方法操作简便,但是兜兰菌根真菌很难上色,仅见根皮层被染上相同或略浅的颜色,极少见菌丝着色;苯胺蓝染色效果一般,根内杂质被染上较深的颜色;台酚蓝染色效果可靠稳定,但皮层被染上相同或略浅的颜色,菌根真菌与皮层组织之间颜色反差小;墨水染色对菌根真菌的染色效果较好,能清楚地观察到菌根真菌的泡囊和菌丝着色牢固。

| 图 2 同色兜兰菌根5种染色效果对比及菌根真菌形态 Fig.2 Comparison among five staining results in P.concolor mycorrhiza and mycorrhizal fungi morphology |
兰科真菌是兰科植物特有的一类菌根真菌,其在兰科植物根内具有明显的菌丝圈、菌丝团、菌丝结及菌丝消解的针状结晶等结构。墨水染色方法可以清晰地观察到兰科真菌不同时期的形态,也能够较好地染色观察到其他菌根真菌的菌丝和泡囊(图 3)。此方法适用于同色兜兰菌根真菌鉴别和侵染率统计。其他4种染色方法对兰科真菌的染色效果不理想,对其他菌根真菌的染色效果也达不到观察目的。由此可见,醋酸墨水染色方法可以较好地区分兰科真菌和其他菌根真菌。
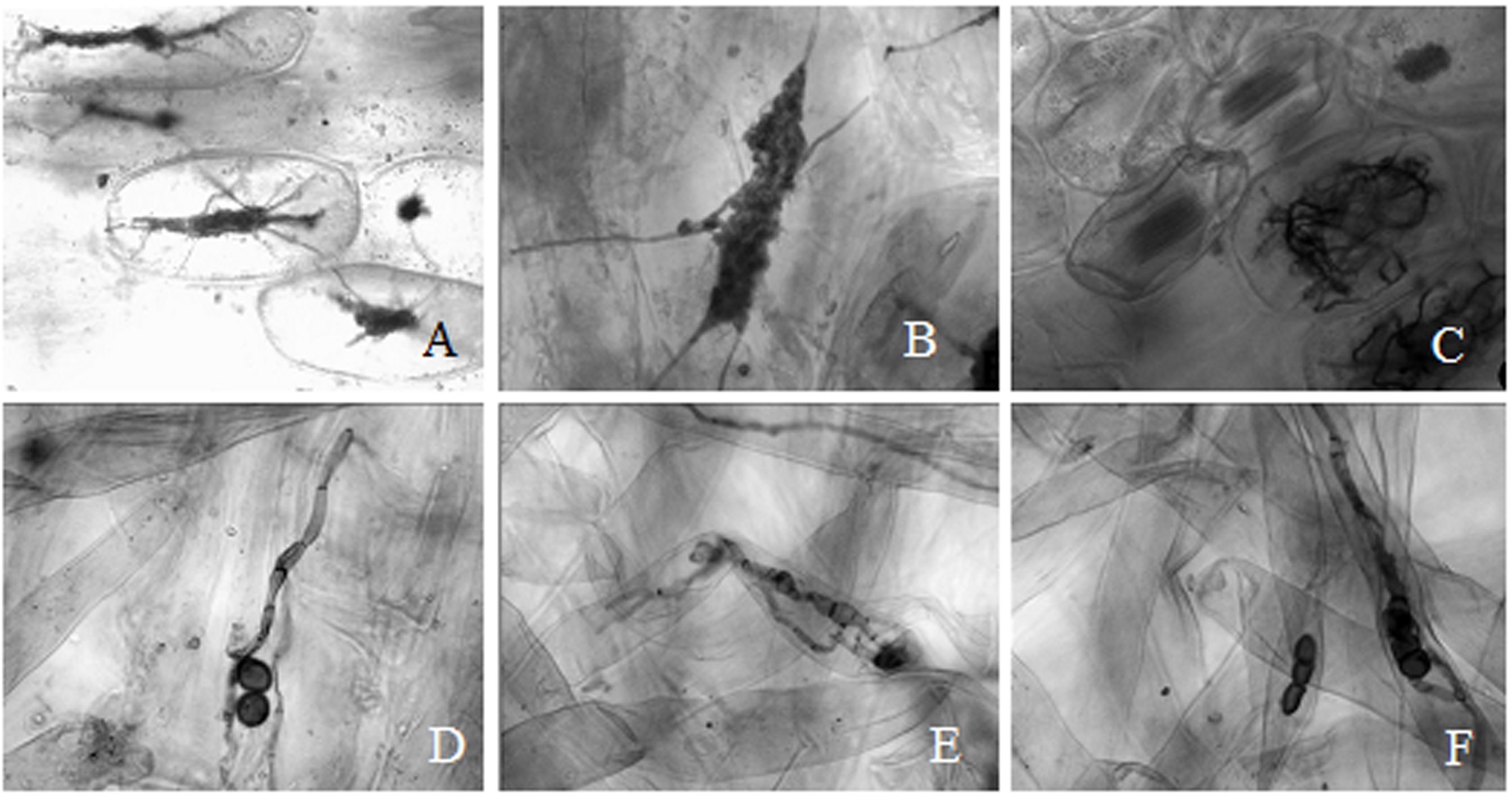
| 图 3 墨水染色同色兜兰菌根 Fig.3 Ink-vinegar stained P.concolor mycorrhiza |
对比5种染色方法的染色效果、成本、试剂毒性和根段保存时间(表 1),墨水染色具有无毒、成本低、清晰度高、反差大和染色效果佳的特点。菌根染色后能够较好地观察不同菌根真菌形态,便于对兰科菌根真菌鉴别和侵染率的统计。
| 染色剂 | 染色效果 | 反差效果 | 成本 | 毒性 | 保存时间 |
| 元·g-1 | |||||
| 酸性品红 | 效果差,菌丝未着色,不好观察 | 反差不明显 | 44 | 致癌疑似物 | 持续褪色 |
| 台酚蓝 | 效果一般,泡囊、菌丝能着色,根表皮也染上略浅的颜色 | 反差不明显 | 14 | 致癌疑似物 | 很久不褪色 |
| 苏丹红Ⅳ | 效果差,皮层杂质易染色,菌丝未着色 | 反差不明显 | 3 | 致癌疑似物 | 很久不褪色 |
| 苯胺蓝 | 效果一般,皮层杂质着色,菌丝未着色 | 反差明显 | 24 | 致癌疑似物 | 很久不褪色 |
| 墨水(Quink) | 效果较好,菌丝、泡囊深蓝色,皮层淡粉色 | 反差明显,易于观察 | 2 | 无毒 | 很久不褪色 |
以兰科真菌为目标进行染色时,会有其他种类真菌同时被染色,这些真菌是非兰科真菌的内生真菌,与兰科真菌形态差异较大,极易区分,利用醋酸墨水染色方法可以对兜兰其他内生真菌进行观察(图 2)。酸性品红染色时,皮层被染上淡淡的红色,菌丝不能着色;用苏丹红Ⅳ染色时,仅皮层的杂质着色,看不见菌丝着色;而用苯胺蓝染色时,一般的杂质也能染上较深的颜色,无菌丝着色;用台酚蓝染色时,泡囊、菌丝都能着色,有部分杂质也着色,根皮层也染上略浅的颜色,反差不明显、不易观察;采用醋酸黑色墨水染色时,菌丝着色十分牢固,经过清水长时间浸泡脱色后,根皮层组织可以接近完全脱色,然而真菌的菌丝仍然保持鲜明的蓝色,可以通过形态特征的比较,区分兰科真菌与其他根外真菌。与此相比,酸性品红和苏丹红Ⅳ染色后,皮层组织与真菌在脱色阶段是同步脱色的,当皮层组织脱色至无色透明时,真菌菌丝的形态亦不再可辨。通过比较可知,经过墨水染色的根系,根内的菌丝等结构着色很深,与背景反差大,而且其他各种结构表现都比其他几种染色剂染色效果好。
本研究表明,醋酸墨水染色法对区分兰科真菌与其他共生真菌更有效,在观察菌丝的形态、入侵方式和统计侵染率时,可以减少误差。在醋酸墨水染色法中使用Quink黑色墨水为染色剂,既兼顾染色效果又低毒性。
| [1] | 郎楷永,陈心启,罗毅波,等.中国植物志·兜兰属:第17卷[M].北京:科学出版社,1999. |
| [2] | 罗毅波,贾建生,王春玲.初论中国兜兰属植物的保护策略及其潜在资源优势[J].生物多样性, 2003,11(6):491-498. |
| [3] | HOSSAIN M M, KANT R, VAN P T, et al. The application of biotechnology to orchids[J]. Critical Reviews in Plant Sciences, 2013,32(2):69-139. |
| [4] | ARDITTI J. Factors affecting the germination of orchid seeds[J]. The Botanical Review, 1967,33(1):1-97. |
| [5] | 陈瑞蕊,林先贵,施亚琴.兰科菌根的研究进展[J].应用与环境生物学报,2003,9(1):97-101. |
| [6] | DEARNALEY J D W. Further advances in orchid mycorrhizal research[J]. Mycorrhiza, 2007,17(6):475-486. |
| [7] | 郑超文,肖娅萍.兰科菌根真菌研究方法的概述[J].微生物学杂志,2014,34(4):85-89. |
| [8] | 刘润进,李晓林.丛枝菌根及其应用[M].北京:科学出版社,2000. |
| [9] | 范黎,郭顺星,徐锦堂.我国部分兰科植物菌根的内生真菌种类研究[J].山西大学学报(自然科学版),1998,21(2):169-177. |
| [10] | ZENG S J, ZHANG Y, DA SILVA J A T, et al. Seed biology and in vitro seed germination of Cypripedium[J]. Critical Reviews in Biotechnology, 2014,34(4):358-371. |
| [11] | 吕梅,伍建榕,马焕成.春兰菌根的显微结构观察[J].西南林学院学报,2005,25(2):8-11. |
| [12] | 陈廷速,李松,张金莲,等.丛枝菌根(AM)真菌对甘蔗根系侵染研究[J].西南农业学报,2011,24(5):1757-1760. |
| [13] | 杨亚宁,巴雷,白晓楠,等.一种改进的丛枝菌根染色方法[J].生态学报,2010,30(3):774-779. |
 2015, Vol. 11
2015, Vol. 11


