文章信息
- 李敏, 叶丝蕊, 邱栋梁
- LI Min, YE Si-rui, QIU Dong-liang
- 鸳鸯茉莉花瓣蛋白质双向电泳技术的优化
- Optimization of two-dimensional electrophoresis technology for Brunfelsia acuminate petals
- 亚热带农业研究, 2015, 11(04): 262-266
- JOURNAL OF AERONAUTICAL MATERIALS, 2015, 11(04): 262-266.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2015.04.009
-
文章历史
- 收稿日期: 2015-08-21
鸳鸯茉莉(Brunfelsia acuminate)又名双色茉莉,为茄科(Solanaceae)鸳鸯茉莉属常绿灌木,原产巴西。花开期间芳香四溢,花的颜色在开后2-3 d内从深紫色逐渐变为白色,由于花开有先后,在同株上能同时见到紫色和白色的花[1],具有极高的观赏价值。目前对鸳鸯茉莉的研究报道已有很多[1, 2, 3],但对其在蛋白组方面的研究鲜见报道。
双向电泳技术是蛋白质分离较为常用的方法,在蛋白质组研究中应用广泛[4]。双向电泳体系对不同材料的要求不同。在双向电泳试验中,关键步骤的优化是影响电泳图谱质量高低的主要因素。欧高政等[5]对双向电泳技术在‘四季蜜’龙眼花芽上的应用进行优化改进,获得了较好的2-DE图谱。朱小姝等[6]对蝴蝶兰叶片进行了双向电泳关键步骤的优化,也获得了最佳应用体系。本研究以鸳鸯茉莉花瓣为材料,利用酚抽提法优化其蛋白质双向电泳体系,以期为进一步研究鸳鸯茉莉蛋白质组以及差异蛋白质的质谱鉴定提供支持。
1 材料与方法 1.1 材料鸳鸯茉莉花瓣采自福建农林大学校园。花瓣采摘后立即用液氮速冻,并保存于-80 ℃冰箱中备用。
(1)蛋白提取液:100 mmol·L-1 Tris-HCl(pH 8.0)+50 mmol·L-1抗坏血酸+100 mmol·L-1 KCl+50 mmol·L-1硼砂+1% Triton-100+2% β-琉基乙醇+0.7 mol·L-1蔗糖;(2)裂解液:7 mol·L-1尿素+2 mol·L-1硫脲+2% 两性电解质载体+40 mmol·L-1 DTT(现加)+4% CHAPS;(3)上样水化液:7 mol·L-1尿素+2 mol·L-1硫脲+2% CHAPS+0.5% IPG Buffer+0.001%溴酚蓝+40 mmol·L-1 DTT;(4)平衡液Ⅰ:50 mmol·L-1 Tris-HCl(pH 8.8)+6 mol·L-1尿素+30%甘油+2% SDS+1% DTT+0.002%溴酚蓝;(5)平衡液Ⅱ:50 mmol·L-1 Tris-HCl(pH 8.8)+30%甘油+6 mol·L-1尿素+2% SDS+2.5%碘乙酰胺+0.002%溴酚蓝;(6)考马斯亮蓝染色液:0.05% R250+10%乙酸+50%甲醇+40% ddH2O;(7)脱色液:30%甲醇+10%乙酸+60% ddH2O。
1.2 仪器与设备Ettan IPG phorⅠ等点聚焦系统、EttanTM DALT SIX垂直板电泳系统、ImagescannerⅡ图像扫描仪,均购自GE Healthcare公司;高速冷冻离心机,购自大连科瑞科技有限公司;水平摇床,购自北京六一仪器厂;恒温水浴锅,购自上海一恒科学仪器有限公司;旋涡混合器,购自江苏海门其林贝尔仪器制造有限公司。
1.3 样品制备采用酚抽法,参照文献[7]的方法进行样品制备。将6 g鸳鸯茉莉花瓣样品在研钵中用液氮充分研磨成粉末,待液氮挥发完后,向研钵中加入18 mL蛋白提取液。待研钵中的提取液溶化后,继续研磨,使花瓣粉末充分溶解在提取液中。将研钵中的提取液转移到50 mL离心管中,加入等体积Tris-饱和酚(pH 8.0),使用旋涡混合器充分涡旋,使Tris-饱和酚与提取液混合均匀,4 ℃、5 500 g,离心10 min,取酚层至新的50 mL离心管中,再加入等体积酚提取液,涡旋混匀。4 ℃、5 500 g,离心10 min,取酚层至50 mL离心管中,加入6倍体积在-20 ℃下预冷的含0.1 mol·L-1乙酸铵的甲醇溶液,将离心管置于-20 ℃冰箱中过夜。次日将离心管取出,4 ℃、20 000 g离心20 min,倒掉上清液,用预冷的甲醇溶液冲洗离心管壁上的蛋白,使蛋白完全悬浮在甲醇溶液中,-20 ℃静置1 h。4 ℃、20 000 g离心20 min,弃去离心管中的甲醇溶液,用含0.07% β-巯基乙醇的丙酮溶液冲洗沉淀,使沉淀悬浮在溶液中并放置在-20 ℃条件下静置1 h。此步骤重复1次。4 ℃、20 000 g离心20 min,弃去上清液,然后用少量预冷的丙酮冲洗蛋白并分装至1.5 mL离心管中,4 ℃、17 000 g离心15 min,弃去上清液,所得的蛋白沉淀在-20 ℃下真空干燥,干燥好的蛋白干粉迅速置于-80 ℃保存,备用。
1.4 蛋白的裂解与定量取出约15 mg蛋白粉末,在离心管中加入300 μL蛋白裂解液,用超声波震荡20 min,待蛋白粉末完全溶解后,放入37 ℃水浴锅中水浴2.5 h,其间每隔30 min涡旋1次。室温、20 000 g离心15 min,将上清液转移到新的离心管中,立即用于蛋白质含量的测定和双向电泳分析。
采用Bradford法[8]进行蛋白质含量测定。用紫外分光光度计测定各样品溶液的D595 nm,并绘制标准曲线。依照标准曲线得出样品的蛋白质浓度,并用于后续试验。
1.5 第一向等点聚焦 1.5.1 固相pH梯度胶条的水化根据蛋白质定量结果计算出所需的蛋白溶液体积,加入上样水化液补足到450 μL后涡旋混匀,最终上样总体积为450 μL。将蛋白样品溶液均匀加入到胶条槽中,并把去掉保护膜的IPG干胶条放入胶条槽中。吸取800 μL矿物油将胶条表面均匀覆盖,进行第一向电泳。运行条件为20 ℃,等电聚焦程序:200 V(1 h)-500 V(1 h)-1 000 V(1 h)-Gradient-8 000 V(0.5 h)-8 000 V(6 h)-1 000 V(2 h),最大电流为50 mA。
1.5.2 胶条平衡提前配制10 mL平衡液Ⅰ和10 mL平衡液Ⅱ。电聚焦完成后取出 IPG胶条,将胶条置于干净的滤纸上吸取胶条表面的矿物油,用电极缓冲液轻轻冲洗胶面,将胶条放入平衡液Ⅰ中平衡15 min之后转入平衡液Ⅱ中平衡15 min,胶条要完全被平衡液覆盖。2次平衡结束后,用镊子将胶条取出,用电泳缓冲液冲洗胶条表面后转移到SDS-PAGE凝胶上准备第二向电泳。
1.6 SDS-PAGE电泳用12%SDS-PAGE凝胶配方提前配制好分离胶(表 1)。将平衡后的IPG胶条转移到SDS分离胶,用低溶点琼脂糖封胶,再加入高熔点琼脂糖将胶条封好。琼脂糖凝固后进行SDS-PAGE电泳。室内温度控制在20 ℃左右,等到溴酚蓝指示条带将要到达凝胶底部边缘时终止电泳。
| 1)Tris-HCl的pH值为8.8。 | |
| 试剂 | 用量/mL |
| 30% Acr-bis | 144.00 |
| 1.5 mol·L-1Tris-HCl | 90.00 |
| 10% SDS | 3.60 |
| ddH2O | 120.42 |
| 10% AP | 1.80 |
| TEMED | 0.18 |
| 总计 | 360.00 |
电泳结束后,用考马斯亮兰染色法参照文献[9]进行染色。将胶条取出放入已过滤好的染色液中,放在水平摇床上轻摇2 h;染色结束后,将染色液倒掉或过滤回收,用蒸馏水将胶条清洗后再加入适量的脱色液脱色,期间多次更换脱色液直至背景清晰为止。
1.6.2 凝胶图像扫描脱色完成后,用ddH2O将凝胶上残留的脱色液冲洗干净,然后使用Images canner Ⅱ 图像扫描仪进行凝胶图像扫描。扫描结束后取出凝胶,用保鲜膜密封,4 ℃下保存,备用。
2 结果与分析 2.1 蛋白质含量利用Bradford法进行蛋白质含量测定,以牛血清蛋白的蛋白质浓度为横坐标,每组D595 nm的平均值为纵坐标绘制标准曲线(图 1)。标准曲线的方程式以y=ax+b的形式表示,其中x为蛋白质含量,y为D595 nm值。根据标准曲线的方程式计算出鸳鸯茉莉花瓣蛋白质浓度,优化IPG胶条选择及上样量所用的浓度分别为9.91和10.72 μg·mL-1。
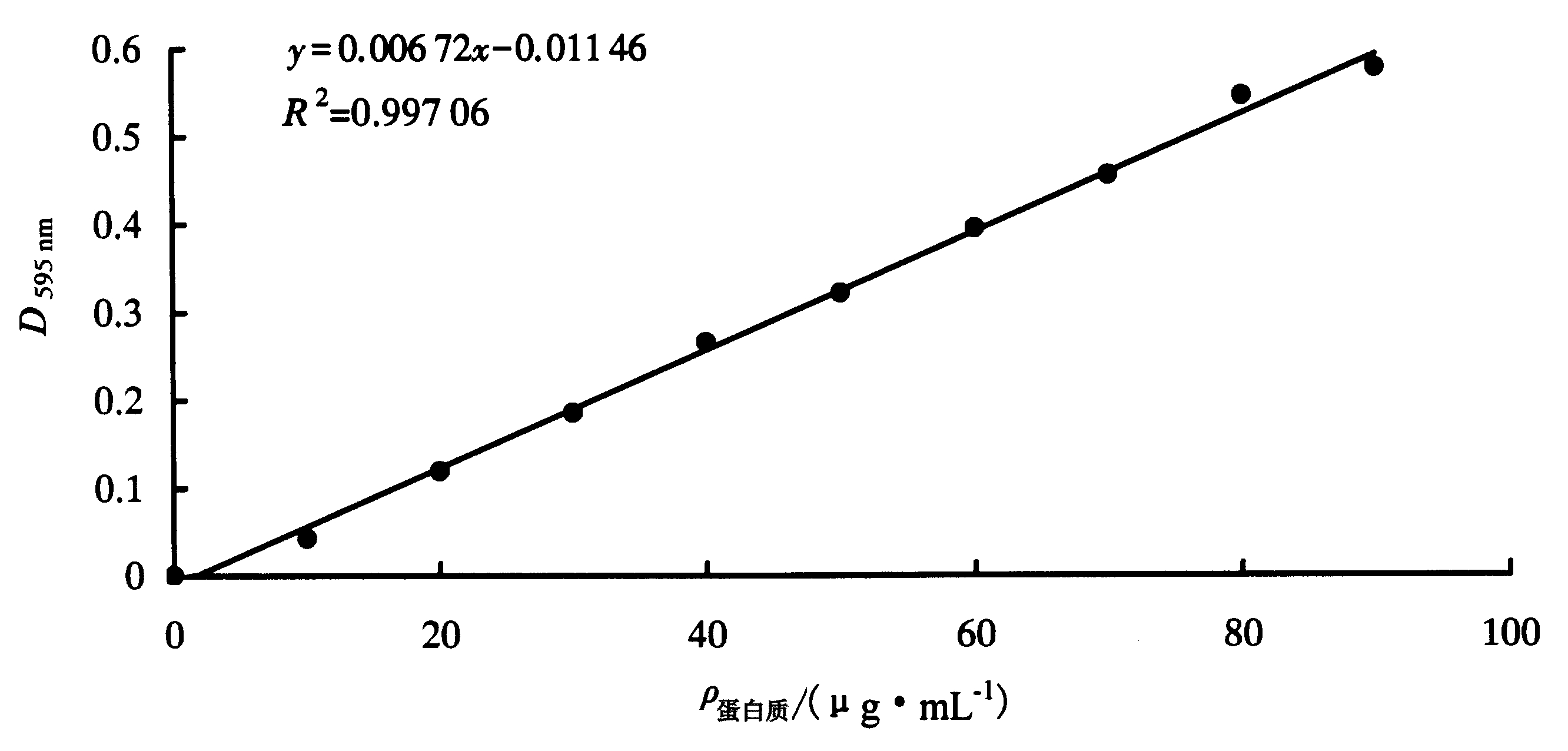
| 图 1 Bradford法测定鸳鸯茉莉花瓣蛋白质含量标准曲线 Fig.1 Standard curve of protein content determined in B.acuminate petals by Bradford method |
参考文献[9, 10],本研究分别使用pH值为3.0-5.6及4.0-7.0两种胶条对第一向电泳胶条的选择进一步优化。结果表明,参照文献[9],设置上样量为1.3 mg的蛋白质含量,不同pH胶条获得的2-DE图谱有明显的区别(图 2)。采用24 cm、pH值为3.0-5.6得到的电泳图谱分离效果较好,但得到的蛋白不全面(图 2A);采用24 cm、pH值为4.0-7.0的胶条获得的2-DE图谱蛋白质分离效果虽不及前者,但能清晰地看到更多的蛋白质点(图 2B)。综上所述,鸳鸯茉莉花瓣蛋白在pH值为4.0-7.0胶条上得到的2-DE图谱较为理想,鸳鸯茉莉花瓣大部分的蛋白也分布在此范围内。
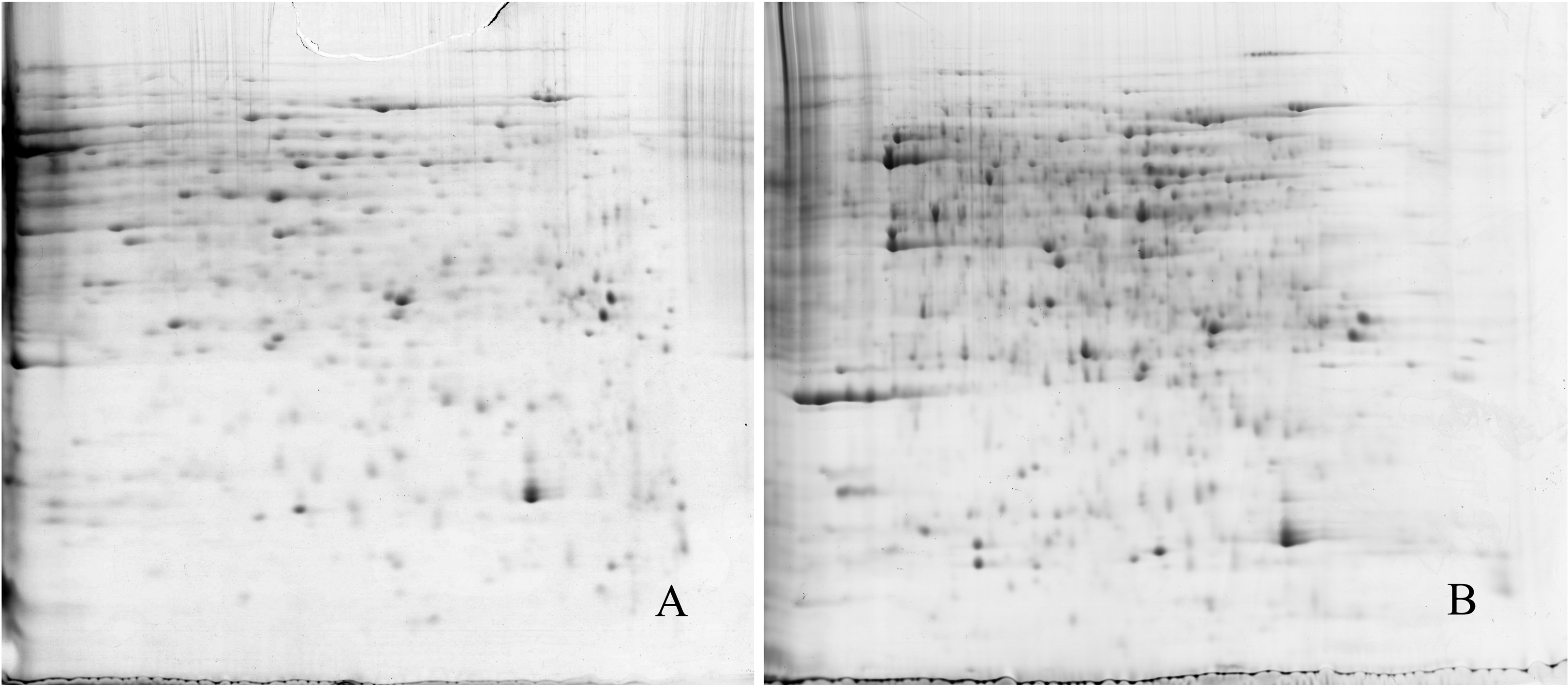
| 图 2 鸳鸯茉莉花瓣总蛋白不同IPG胶条的2-DE图谱 Fig.2 Images of 2-DE in B.acuminate total proteins from different IPG strips |
选择24 cm、pH值为4.0-7.0 IPG胶条,不同上样量的2-DE图谱见图 3。上样量为1.3 mg时,2-DE图谱上的蛋白点少且不清晰、分辨率低,会影响后期软件分析(图 3A)。上样量为1.5 mg时,2-DE图谱蛋白点多且呈圆形或椭圆形,蛋白点分离效果与前者相比较好(图 3B)。因此,对于24 cm、pH值为4.0-7.0 的IPG胶条,选用鸳鸯茉莉总蛋白上样量为1.5 mg较为合适。
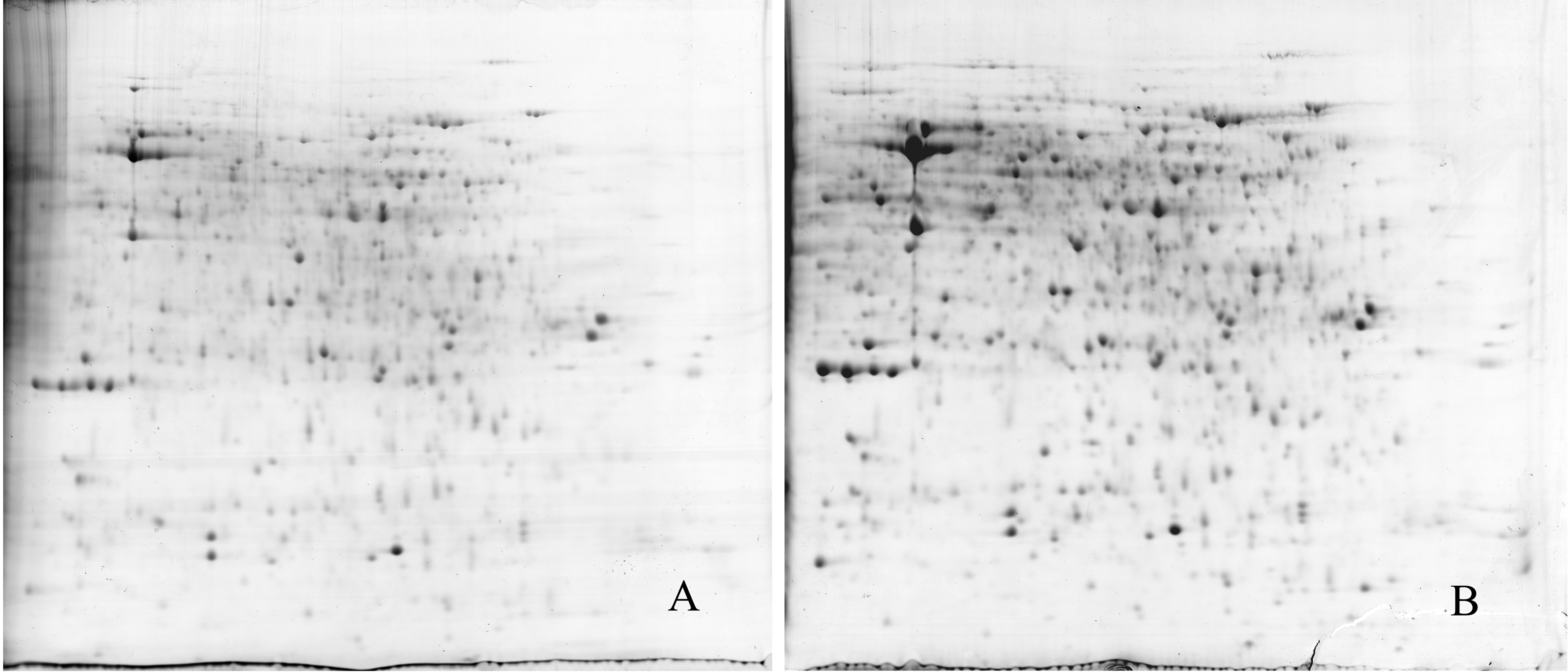
| 图 3 鸳鸯茉莉花瓣总蛋白不同上样量的2-DE图谱 Fig.3 Images of 2-DE in B.acuminate total proteins from different loaded proteins |
近年来,双向电泳技术在农业、医学、植物等领域得到广泛应用,对果实、叶片等蛋白质的研究报道越来越多,不同的材料、组织器官等都有不同的应用体系[11]。双向电泳分离技术试验过程受多种因素影响,只有进行优化才能获得较好的试验结果。在进行第一向等点聚焦电泳时,首先要选择合适的IPG胶条,胶条长度、pH范围均会导致蛋白点分布不均匀、酸碱端不能有效分离,直接影响2-DE图谱的质量。Bar-akiva et al[10]采用pH值为3-10、13 cm的IPG胶条对鸳鸯茉莉花瓣进行双向电泳试验,蛋白点不多,分离效果不好。本研究采用了pH值为3.0-5.6、24 cm和pH值为4.0-7.0、24 cm两种IPG胶条进行进一步优化,其中,pH值为4.0-7.0的IPG胶条2-DE图谱质量相对较好。蛋白质上样量与胶条长度密切相关。上样量较大会使等点聚焦受到影响,电压上升较慢,导致部分蛋白出现共迁移现象,即不同的蛋白质出现在胶条的相同位置[6];上样量较少会使蛋白点不清晰并且不利于软件的检测,且蛋白点的数量也随着上样量的减少而降低[12]。有些蛋白有可能在胶条上无法显示,直接影响试验结果。
本试验表明,鸳鸯茉莉花瓣双向电泳技术优化最佳条件为:鸳鸯茉莉花瓣蛋白质图谱在24 cm、pH值为4.0 -7.0的IPG胶条范围内,上样量为1.5 mg,所得出的2-DE图谱背景清晰、蛋白点明显且拖尾较少,有利于后续的试验。
| [1] | 曹玉婷.鸳鸯茉莉花瓣色素合成关键酶基因cDNA及CHS基因启动子的克隆[D].福州:福建农林大学,2012. |
| [2] | VAKNIN H, BAR-AKIVA A, OVADIA R, et al. Active anthocyanin degradation in Brunfelsia calycina (yesterday-today-tomorrow) flowers[J]. Planta, 2005,222(1):19-26. |
| [3] | ZIPORG, DUARTEP, CARQUEIJEIROI. In planta anthocyanin degradation by a vacuolar class Ⅲ peroxidase in Brunfelsia calycina flowers[J]. New Phytologist, 2015,205(2):653-665. |
| [4] | 蒋际谋,刘浩,王玲霞,等.龙眼种子蛋白质组双向电泳技术的优化[J].亚热带农业研究,2010,6(4):275-279. |
| [5] | 欧高政,陈清西.‘四季蜜’龙眼花芽总蛋白质提取方法及双向电泳体系的优化[J].热带作物学报,2014,35(6):1095-1101. |
| [6] | 朱小姝,叶庆生.蝴蝶兰叶片蛋白质提取及双向电泳体系优化[J].亚热带植物科学,2014,43(3):206-211. |
| [7] | LIU H, LIU Y Z, ZHENG S Q, et al. Comparative proteomic analysis of longan (Dimocarpus longan Lour.) seed abortion[J]. Planta, 2010,231(4):847-860. |
| [8] | BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976,72(1-2):248-254. |
| [9] | 陈义勇.不同发育时期杨梅果肉差异表达蛋白及其功能研究[D].福州:福建农林大学,2014. |
| [10] | BAR-AKIVA A, OVADIA R, ROGACHEV I, et al. Metabolic networking in Brunfelsia calycina petals after flower opening[J]. Journal of Experimental Botany, 2010,61(5):1393-1403. |
| [11] | 马斌,孙骏威,余初浪,等.枇杷叶片和果实总蛋白质提取及双向电泳的优化方法[J].果树学报,2011,28(2):358-362. |
| [12] | 石海波,王云生,冯勇,等.玉米籽粒蛋白质双向电泳技术体系的优化[J].华北农学报,2015,30(1):171-176. |
 2015, Vol. 11
2015, Vol. 11


