文章信息
- 李旭娟, 李纯佳, 陆鑫, 毛钧, 刘洪博, 林秀琴, 徐超华, 刘新龙
- LI Xu-juan, LI Chun-jia, LU Xin, MAO Jun, LIU Hong-bo, LIN Xiu-qin, XU Chao-hua, LIU Xin-long
- 云南八倍体割手密抗逆功能标记遗传多样性探讨
- Analysis of genetic diversity among octoploid clones of Saccharum spontaneum L. from Yunnan with functional markers of stress resistance genes
- 亚热带农业研究, 2015, 11(04): 222-229
- JOURNAL OF AERONAUTICAL MATERIALS, 2015, 11(04): 222-229.
- DOI: 10.13321/j.cnki.subtrop.agric.res.2015.04.002
-
文章历史
- 收稿日期: 2015-08-06
割手密(Saccharum spontaneum L.)即甘蔗细茎野生种,又名甜根子草、小巴茅,为禾本科(Gramineae)蜀黍族(Andropogoneae)甘蔗属(Saccharum L.)多年生草本植物,具有适应性广、分蘖多、抗逆性强等优良特性[1],是甘蔗品种选育上利用最早、成效最明显的野生种质,也是品种抗逆性、分蘖性、适应性等优良性状的主要基因来源[2]。中国是割手密的原产地之一,在我国北纬18°15′-33°20′、东经97°-122°,海拔1-2 460 m地区均有分布[3]。割手密是一种复杂的多倍体植物,染色体数(2n)在40-128之间,染色体基数为8,其中以2n=64、80、96、112和128等5种染色体类型为主[4, 5]。据蔡青等[6]报道,国家甘蔗种质资源圃保育的整倍体割手密主要有4种,分别为2n=64、72、80、96,其中2n=80(十倍体)的材料数最多,其次为 2n=64(八倍体)[7]。
研究表明,整倍体割手密对甘蔗遗传育种具有重要的利用和开发价值。如十四倍体的爪哇割手密(2n=112)、八倍体的印度割手密和云南75-2-11(2n=64)以及十倍体的崖城割手密(2n=80)[4, 8, 9],在品种产量和抗逆性改良上发挥了重要作用。八倍体割手密是我国倍数较低的整倍体割手密,目前国家甘蔗种质资源圃保育的八倍体割手密主要采自云南内陆热带亚热带区域,具有丰富的生态类型。为了解云南八倍体割手密在抗逆基因上的遗传变异状况及在抗逆性状改良上的应用前景,本研究选用根据植物耐高温[热激蛋白70(HSP70)10]、WRKY1转录因子[11]]和抗旱相关蛋白[脱水绑定因子(DREB)12]、水通道蛋白(Aquaporin)[13]]开发的功能标记(SCB174、SCB190、 DBF/Arb1、DBF/Arb2、Aqua/Arb1)对云南八倍体割手密资源进行抗逆基因的分子遗传多样性分析,以期为该类资源的合理利用提供依据。
1 材料与方法 1.1 试验材料所有材料叶片由国家甘蔗种质资源圃提供,圃内目前保育有30份云南八倍体割手密。根据采集地地理信息,按照每个县取1份材料的标准,共选择22份材料(云南82-149、云南83-238、云南82-9、云南75-1-10、云南蒙自割手密、云南82-63、云南82-58、云南84-268、云南82-79、云南4号、云南83-160、云南83-228、云南75-2-11、云南82-140、云南75-2-2、云南82-20、云南82-59、云南82-14、云南83-213、云南83-225、云南82-25、云南83-227)作为研究对象,同时选用13份育成品种超过10个以上的甘蔗骨干亲本(Co1001、F108、F134、粤糖57-423、云蔗65-225、新台糖1号、崖城71-374、粤糖59-65、桂糖11、CP67-412、CP72-1210、Co419、POJ2878)和2009-2015年云南省推广面积连续排名前十的10份云南主栽甘蔗品种(新台糖22号、新台糖25号、新台糖16号、新台糖10号、新台糖20号、粤糖93-159、粤糖86-368、粤糖00-236、桂糖21、闽糖69-421,由云南省农业科学院甘蔗研究所统计,数据还未发表)作为CK。
1.2 试验方法 1.2.1 甘蔗基因组DNA提取选取上述45份材料新鲜植株幼嫩叶片,迅速剪碎后液氮速冻并研磨成粉末,离心管分装后按照全式金PlantZol试剂盒提取各材料DNA。DNA质量检测参考文献[14]的方法。
1.2.2 功能标记引物信息及PCR选用Marconi et al[15]报道的2对甘蔗耐高温基因标记引物(SCB174和SCB190)和Creste et al[16]报道的抗旱相关基因DBF、Aqua的正向引物与随机引物的反向引物组成3对功能标记引物(DBF/Arb1、DBF/Arb2、Aqua/Arb1)对参试材料进行PCR扩增。功能标记引物详细信息见表 1。PCR反应体系和程序参照Hu et al[17]研究报道。扩增产物经95 ℃变性后用5.0%变性聚丙烯酰胺凝胶电泳分离,并参考刘新龙等[18]建立的快速银染法染色观察。
| 标记引物 | 对应基因 | 功能特点 | Gene Bank登录号 | 序列(5′-3′) |
| SCB174 | HSP70 | 耐高温 | CAA47948 | GGAGATGCTGCGGAGGTGGTT |
| GCCGCTTCCTCATCATATTCTTCTC | ||||
| SCB190 | WRKY1 | 耐高温 | NM_001112367 | TTCCTTCTGTCACCATTCATTTG |
| CCCCTCGATGCTGATTGTTAC | ||||
| DBF | DREB | 抗旱相关 | CA077947 | CTCTGCCACCACCACCTC |
| Aqua | AQP | 抗旱相关 | CA086489 | ATCTCCGGCGGCCACAT |
| Arb1 | GACTGCGTACGAATTAAT | |||
| Arb2 | GACTGCGTACGAATTGAC |
PCR产物电泳条带统计、多态信息量计算以及UPGMA聚类等参考李旭娟等[14]方法。然后通过Popgen 32和GenALEx 6.3软件分析八倍体割手密分别与骨干亲本和主栽品种群体间的遗传分化系数、基因流和方差分量以及变异来源比率。
2 结果与分析 2.1 引物多态性分析电泳条带统计分析结果见表 2。45份材料共获得113个扩增片段,其中106个属多态性条带,平均每对引物有21条,平均多态性条带比例为93.81%,平均多态信息量为0.914 0;群体特异带共17个,平均每对引物3个。从耐高温相关功能标记引物SCB174和SCB190来看,云南八倍体材料有12条群体特异带,骨干亲本有2条群体特异带,而主栽品种中没有;从抗旱基因功能标记引物DBF/Arb1、DBF/Arb2和Aqua/Arb1来看,云南八倍体材料有3条群体特异带,骨干亲本和主栽品种中都没有。从引物多态性条带比例和多态信息量来看,除引物SCB174外,云南八倍体割手密多态性最高,而且拥有较多的群体特异带。
| 标记 | 材料类型 | 总条带数 | 多态性条带 | 群体特异带 | 多态性条带比例 | 多态信息量 |
| 条 | 条 | 条 | % | |||
| SCB174 | 云南八倍体 | 18 | 16 | 8 | 88.89 | 0.826 5 |
| 骨干亲本(CK) | 11 | 9 | 1 | 81.82 | 0.899 5 | |
| 主栽品种(CK) | 11 | 9 | 0 | 81.82 | 0.880 0 | |
| SCB190 | 云南八倍体 | 14 | 13 | 4 | 92.86 | 0.951 2 |
| 骨干亲本(CK) | 11 | 10 | 1 | 90.91 | 0.923 1 | |
| 主栽品种(CK) | 10 | 9 | 0 | 90.00 | 0.900 0 | |
| DBF/Arb1 | 云南八倍体 | 25 | 10 | 2 | 40.00 | 0.951 2 |
| 骨干亲本(CK) | 23 | 10 | 0 | 43.48 | 0.923 1 | |
| 主栽品种(CK) | 21 | 8 | 0 | 38.10 | 0.900 0 | |
| DBF/Arb2 | 云南八倍体 | 26 | 25 | 1 | 96.15 | 0.954 5 |
| 骨干亲本(CK) | 25 | 19 | 0 | 76.00 | 0.923 1 | |
| 主栽品种(CK) | 24 | 20 | 0 | 83.33 | 0.900 0 | |
| Aqua/Arb1 | 云南八倍体 | 25 | 22 | 0 | 88.00 | 0.954 5 |
| 骨干亲本(CK) | 25 | 17 | 0 | 68.00 | 0.923 1 | |
| 主栽品种(CK) | 25 | 17 | 0 | 68.00 | 0.900 0 | |
| 平均 | 23 | 21 | 3 | 93.81 | 0.914 0 | |
| 合计 | 113 | 106 | 17 | / | / |
根据电泳结果分析云南八倍体、骨干亲本和主栽品种之间的Jaccard 相似性系数分布状况(图 1)。(1)抗旱相关功能标记。云南八倍体割手密材料间相似性系数在0.388-0.757之间,差值为0.369,平均值为0.649,主要集中分布在0.400-0.600之间;骨干亲本材料间相似性系数在0.634-0.841之间,差值为0.207,平均值为0.752,主要集中分布在0.600-0.800之间;主栽品种材料间相似性系数在0.646-0.866之间,差值为0.220,平均值为0.779,主要集中分布在0.600-0.800之间。(2)耐高温相关功能标记。云南八倍体割手密材料间相似性系数在0.286-0.929之间,差值为0.643,平均值为0.545,主要集中在0.400-0.600以及0.600-0.800之间;骨干亲本材料间相似性系数在0.683-0.951之间,差值为0.268,平均值为0.819,主要集中在0.800-1.000之间;主栽品种材料间相似性系数在0.707-0.902之间,差值为0.195,平均值为0.826,主要集中在0.800-1.000之间。以上分析表明,无论抗旱还是耐高温功能标记,云南八倍体割手密材料间拥有较大的遗传差异,变异较为广泛,而骨干亲本和主栽品种遗传差异较小,所含遗传变异相对较少。
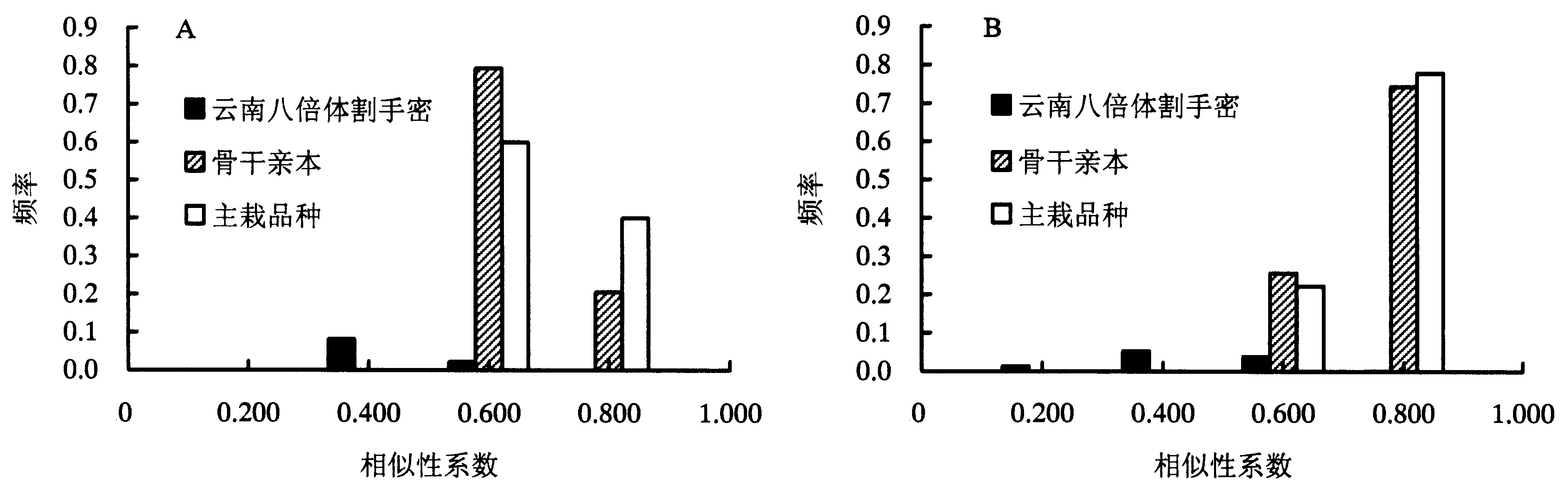
| 图 1 不同材料间相似性系数分布频率 Fig.1 Distribution of Jaccard similarity coefficients among the Yunnan octoploid S.spontaneum population and two check populations (key parental lines and major cultivars) |
参考文献[19]中的群体遗传学研究方法,分别对云南八倍体割手密与骨干亲本和主栽品种之间的遗传分化系数、基因流和方差分量以及变异来源进行分析。从表 3可以看出,总体来看,云南八倍体割手密无论是与骨干亲本还是与主栽品种间都存在较低的遗传分化系数(大多0.2左右);基因流除SCB190表现较高(高达2.357),DBF/Arb1较低(0.483 2)外,其余都在1.5左右;遗传变异主要来自于组内。从群体间差异看,5个标记除了DBF/Arb2外,均表现为云南八倍体割手密与骨干亲本间的基因流大于其与主栽品种间的,说明在耐高温标记SCB174、SCB190和抗旱标记DBF/Arb1、Aqua/Arb1上,主栽品种含有的相关八倍体割手密血缘更少,还有待进一步开发利用。因此在后续的甘蔗育种中应进一步加大云南八倍体割手密资源的利用力度。提高甘蔗耐高温抗性可着重考虑SCB174,即热激蛋白基因HSP70,而提高抗旱性可偏重考虑Aqua/Arb1标记,即水通道蛋白基因AQP。
| 标记 | 抗逆性 | 分组 | 遗传分化系数 | 基因流 | 方差来源 | 方差分量 | 变异来源比率 |
| % | |||||||
| SCB174 | 耐高温 | 云南八倍体与骨干亲本 | 0.251 0 | 1.492 0 | 组间 | 17.556 | 36 |
| 组内 | 55.930 | 64 | |||||
| 云南八倍体与主栽品种 | 0.254 5 | 1.464 5 | 组间 | 18.573 | 43 | ||
| 组内 | 49.645 | 57 | |||||
| SCB190 | 耐高温 | 云南八倍体与骨干亲本 | 0.175 0 | 2.357 0 | 组间 | 15.458 | 29 |
| 组内 | 65.685 | 71 | |||||
| 云南八倍体与主栽品种 | 0.180 7 | 2.266 4 | 组间 | 14.483 | 31 | ||
| 组内 | 59.455 | 69 | |||||
| DBF/Arb1 | 抗旱 | 云南八倍体与骨干亲本 | 0.471 1 | 0.561 5 | 组间 | 37.392 | 51 |
| 组内 | 67.979 | 49 | |||||
| 云南八倍体与主栽品种 | 0.508 5 | 0.483 2 | 组间 | 35.786 | 55 | ||
| 组内 | 60.964 | 45 | |||||
| DBF/Arb2 | 抗旱 | 云南八倍体与骨干亲本 | 0.241 0 | 1.574 9 | 组间 | 36.358 | 31 |
| 组内 | 144.556 | 69 | |||||
| 云南八倍体与主栽品种 | 0.215 1 | 1.824 8 | 组间 | 29.511 | 30 | ||
| 组内 | 127.364 | 70 | |||||
| Aqua/Arb1 | 抗旱 | 云南八倍体与骨干亲本 | 0.257 6 | 1.440 8 | 组间 | 31.065 | 28 |
| 组内 | 142.192 | 72 | |||||
| 云南八倍体与主栽品种 | 0.279 3 | 1.290 1 | 组间 | 29.250 | 30 | ||
| 组内 | 126.000 | 70 |
对云南八倍体割手密、骨干亲本和主栽品种进行UPGMA分子聚类,结果见图 2、图 3。依据所选抗旱基因功能标记聚类可将45份材料划分为两大组(A1和A2),其中A1组全部由22份云南八倍体割手密组成,A2组包括骨干亲本和主栽品种。同样,依据本文所选耐高温相关基因功能标记聚类将所有材料划分为B1和B2两大组,B1组全部由22份云南八倍体割手密组成;B2组由骨干亲本和主栽品种组成。由聚类结果可知,云南八倍体割手密材料在所选抗旱和耐高温相关功能标记方面都与骨干亲本和主栽品种具有明显的遗传差异,而骨干亲本和我国主栽品种则具有较近的亲缘关系,由此可以初步判断云南八倍体割手密资源在所选耐高温和抗旱基因方面还存在较大的遗传差异,还有许多遗传变异未充分渗入到现代甘蔗品种血缘中。因此,该类材料在甘蔗品种抗逆性状改良上具有较大的利用价值。

| 图 2 云南八倍体割手密、甘蔗骨干亲本和主栽品种抗旱功能标记UPGMA聚类图 Fig.2 A genetic similarity-based UPGMA dendrogram for octoploid clones of S.spontaneum from Yunnan,sugarcane key parental lines, and major sugarcane cultivars assessed by functional markers of drought resistance genes |

| 图 3 云南八倍体割手密、甘蔗骨干亲本和主栽品种耐高温功能标记UPGMA聚类图 Fig.3 A genetic similarity-based UPGMA dendrogram for octoploid clones of S.spontaneum from Yunnan,sugarcane key parental lines, and major sugarcane cultivars assessed by functional markers of heat tolerance genes |
近年来受全球温室效应影响,我国蔗区受干旱和高温等极端天气影响较严重,且极端气候持续时间较长,这对我国甘蔗产量造成严重损失。同时在其他优势作物的竞争下,甘蔗生产立地条件逐渐恶化,这些不利条件对我国甘蔗产业的健康持续发展带来冲击。对此,通过加快抗逆品种选育和良种更替来解决以上问题显得尤为重要[4]。割手密是现代甘蔗品种的重要野生亲本,蕴含丰富的抗性基因遗传变异,但目前用于甘蔗遗传育种中的割手密材料还较为有限,许多优异基因未被充分挖掘和利用[20]。因此,加大割手密资源的利用对甘蔗品种改良具有重要意义。
功能标记是在鉴别基因序列的表型功能后,挖掘该序列中的多态性信息及对应序列的表型效应后,从具有多态性、控制生态/农艺性状的序列模体内部开发出的能够区分和预测等(复)位基因及相对性状的DNA标记[21]。功能标记在开发过程中积累了大量关于控制表型的序列模体特征和位置信息,有助于种质资源创新中发掘有利基因,此外,功能标记也能更准确地描述基因的多样性并能更精确地筛选和追踪已知基因[22]。近年来,随着公共数据库中大量基因EST序列信息的丰富,越来越多的功能标记被开发出来,为资源的准确评价和高效利用提供指导[23]。针对甘蔗种质资源,国内外在糖分、抗旱、耐寒相关基因方面陆续开发出一些功能标记,并用于甘蔗种质资源的评价和遗传多样性研究,证实使用功能标记揭示资源间亲缘关系、多样性水平和遗传变异是可行的[24, 25, 26, 27]。
本研究表明,与植物耐高温胁迫响应相关的HSP70、WRKY1类转录因子和与抗旱密切相关的脱水绑定因子DREB、水通道蛋白Aqua[10, 11, 12],云南八倍体割手密资源比骨干亲本和主栽品种表现出较高的多态性,平均多态性比率达93.81%;更广的相似性系数分布范围(耐高温:0.286-0.929,抗旱:0.388-0.757);另外,群体分化和UPGMA聚类也表明八倍体割手密与2个CK群体表现出较大的遗传差异,说明在相关抗旱和耐高温分子标记方面八倍体割手密具有丰富的遗传多样性,这与李旭娟等[14]、刘建乐等[28]、刘洪博等[29]、黄忠兴等[30]、刘新龙等[31]研究结果相类似。可见,云南八倍体割手密在HSP70、WRKY1、DREB、Aqua等抗逆基因功能标记方面比当地甘蔗骨干亲本和主栽品种拥有更为丰富的遗传变异,在甘蔗品种抗逆性状改良上还具有较大的开发利用价值。因此,应进一步加大这类野生亲本资源的利用力度。
| [1] | 刘建乐,白昌军,严琳玲,等.割手密种质资源的营养价值评价[J].广东农业科学,2014,41(2):19-24. |
| [2] | 常丹,鄢家俊,白史且,等.割手密种质资源研究进展[J].草业科学,2011,28(4):636-641. |
| [3] | 常丹,鄢家俊,白史且,等.野生割手密种质生产性能评价[J].中国农学通报,2012,28(3):206-212. |
| [4] | 张木清,王华忠,白晨.糖料作物遗传改良与高效育种[M].北京:中国农业出版社,2006:51-52. |
| [5] | 刘新龙,苏火生,应雄美,等.中国十倍体割手密资源的表型相关性及遗传多样性[J].湖南农业大学学报(自然科学版),2012,38(6):574-579. |
| [6] | 蔡青,文建成,范源洪,等.甘蔗属及其近缘植物的染色体分析[J].西南农业学报,2002,15(2):16-19. |
| [7] | ZHANG J S, NAGAI C, YU Q Y, et al. Genome size variation in three Saccharum species[J]. Euphytica, 2012,185(3):511-519. |
| [8] | 陈如凯.现代甘蔗遗传育种[M].北京:中国农业出版社,2011:1-19. |
| [9] | 林日坚,刘水娣.甘蔗属拔地那(Badila)和崖城割手密(Spontaneum)核型的比较研究[J].甘蔗糖业,1986(8):9-12. |
| [10] | 齐妍,徐兆师,李盼松,等.植物热激蛋白70的分子作用机理及其利用研究进展[J].植物遗传资源学报,2013,14(3):507-511. |
| [11] | 伍林涛,杜才富,张敏琴,等.WRKY转录因子的结构及其在植物抗逆境胁迫中的功能[J].分子植物育种,2013,11(4):634-638. |
| [12] | 张建华,姬虎太,张定一,等.植物DREB转录因子研究进展[J].山西农业科学,2012,40(1):79-83. |
| [13] | 李红梅,万小荣,何生根.植物水孔蛋白最新研究进展[J].生物化学与生物物理进展,2010,37(1):29-35. |
| [14] | 李旭娟,徐超华,刘洪博,等.中国十倍体割手密资源抗逆功能标记的遗传多样性分析[J].西北植物学报,2014,34(8):1540-1548. |
| [15] | MARCONI T G, COSTA E A, MIRANDA H R, et al. Functional markers for gene mapping and genetic diversity studies in sugarcane[J]. BMC Research Notes, 2011,4:264. |
| [16] | CRESTE S, ACCORONI K A G, PINTO L R, et al. Genetic variability among sugarcane genotypes based on polymorphisms in sucrose metabolism and drought tolerance genes[J]. Euphytica, 2010,172(3):435-446. |
| [17] | HU J G, VICK B A. Targetregion amplification polymorphism: a novel marker technique for plant genotyping[J]. Plant Molecular Biology Reporter, 2003,21(3):289-294. |
| [18] | 刘新龙,蔡青,毕燕,等.甘蔗AFLP标记和SSR标记的PAGE胶快速银染检测方法[J].江苏农业学报,2009,25(2):433- 435. |
| [19] | 刘新龙,蔡青,吴才文,等.甘蔗品种资源的表型遗传多样性[J].生物多样性,2010,18(1):37-43. |
| [20] | 吴才文, JACKSON P, 刘家勇,等.甘蔗野生种割手密远缘杂交后代品质性状的遗传研究[J].植物遗传资源学报,2011,12(1):59-63. |
| [21] | POCZAI P, VARGA I, LAOS M, et al. Advances in plant gene-targeted and functional markers: a review[J]. Plant Methods, 2013,9:6. |
| [22] | 贺道华,雷忠萍,邢宏宜.功能标记的开发、特点和应用研究进展[J].西北农林科技大学学报(自然科学版),2009, 37(1):110-116. |
| [23] | GUPTA P K, RUSTGI S. Molecular markers from the transcribed/expressed region of the genome in higher plants[J]. Functional & Integrative Genomics, 2004,4(3):139-162. |
| [24] | ALWALA S, SUMAN A, ARRO J A, et al. Target region amplification polymorphism (TRAP) for assessing genetic diversity in sugarcane germplasm collections[J]. Crop Science, 2005,46(1):448-455. |
| [25] | 宋伟, 王风格, 易红梅, 等.功能标记及在品种鉴定和辅助育种中的应用前景[J].分子植物育种, 2009,7(3):612-618. |
| [26] | 阙友雄,陈天生,许莉萍,等.甘蔗重要种质的TRAP标记遗传多样性分析[J].农业生物技术学报,2009,17(3):496-503. |
| [27] | 许莉萍,阙友雄,苏亚春.基于蔗糖代谢基因多态性的甘蔗基因型遗传多样性[J].中国农业科学,2011,44(9):1788-1797. |
| [28] | 刘建乐,白昌军,严琳玲,等.割手密种质资源遗传多样性的ISSR分析[J].热带作物学报,2014,35(1):68-73. |
| [29] | 刘洪博,应雄美,毛钧,等.11份割手密遗传多样性的SSR分析[J].植物遗传资源学报,2013,14(3):542-546. |
| [30] | 黄忠兴,周峰,王勤南,等.国内外割手密资源农艺性状表型遗传多样性分析[J].植物遗传资源学报,2012,13(5):825-829. |
| [31] | 刘新龙,苏火生,刘洪博,等.云南八倍体割手密资源产量和品质性状相关性和聚类分析[J].西南农业学报,2014,27(4):1382-1386. |
 2015, Vol. 11
2015, Vol. 11


