文章信息
- 曹晓蓓 , 樊李红 , 吴鸣虎 , 杨晶 . 2016
- CAO Xiaobei, FAN Lihong, WU Minghu, YANG Jing . 2016
- 3-氯-2-羟丙基三甲基氯化铵壳聚糖复合水凝胶的辐射法制备及其性能
- Radiation Preparation and Properties of 3-Chloro-2-Hydroxypropyl Trimethylammonium Chloride Chitosan Composite Hydrogel
- 武汉大学学报(理学版), 2016, 62(4): 355-360
- Journal of Wuhan University(Natural Science Edition), 2016, 62(4): 355-360
- http://dx.doi.org/10.14188/j.1671-8836.2016.04.009
-
文章历史
- 收稿日期:2015-03-21

2. 武汉理工大学 化学化工与生命科学学院,湖北 武汉 430070
2. School of Chemistry, Chemical Engineering and Life Sciences, Wuhan University of Technology, Wuhan 430070, Hubei, China
水凝胶具有良好的吸水性能,不易溶于水或被水分解,溶胀后仍能保持亲水性网络结构以及优异性能.作为一种重要的高分子材料,水凝胶可作为医用伤口敷料、药物缓释系统以及各类接触性透镜中的亲水性材料[1, 2].作为伤口敷料,水凝胶具备以下特性:如高度的柔软性可以减缓伤口的疼痛[3];良好的吸水性使其能吸收伤口中渗出的组织液,并能保持创面湿润,防止与伤口粘合造成的二次伤害[4];高透明度便于观察伤口情况[5, 6]等.因此,水凝胶被大量应用于临床治疗中.
壳聚糖是甲壳素的部分脱乙酰衍生物,由于具有多种优良的生物特性而被广泛地研究[7].壳聚糖分子结构上存在着很多具有独特生物功能和物化性质的羟基和氨基[8].这些羟基和氨基可以发生多种化学反应,从而得到不同的壳聚糖衍生物.壳聚糖经过季铵化改性可以得到壳聚糖季铵盐.改性得到的壳聚糖季铵盐水溶性较壳聚糖有较大的改观,不但保持了壳聚糖本身优良的生物降解性、生物相容性以及血液相容性,同时因为季铵盐基团的引入还拥有良好的抗菌性和吸湿保湿性,解决了湿性愈合和感染的矛盾[9].
目前,运用较多的制备水凝胶的方法主要有:化学制备法、化学交联法以及辐射制备法等.1986年波兰科学家Rosiak等首次采用辐射交联法制备水凝胶,该方法具有工艺条件温和、制备过程简单、得到的产物纯度高等特点[10].此外,在进行辐射交联的同时也对制备的水凝胶进行了杀菌消毒,得到的产物更加适用于医用领域.由于辐射制备法这些显著的优良特性,使之得到了越来越多的关注和研究.单独的壳聚糖季铵盐在较高的辐照强度下不易交联且得到的凝胶机械性能较弱.本实验将壳聚糖季铵盐引入聚乙烯醇和聚氧化乙烯的共混液中,通过辐射交联得到的一种新型水凝胶,并考察了该水凝胶的凝胶分数、溶胀性能、保水性能、机械性能以及抗菌性能.
1 实验部分 1.1 试剂和仪器试剂:壳聚糖(脱乙酰度93.23%,浙江玉环生物有限公司);一氯乙酸、氯化钠、亚硫酸氢钠、聚乙烯醇(PVA-1788) 、聚氧化乙烯(PEO,Mv~300 000) 均为分析纯(阿拉丁试剂);三甲基氯化铵分析纯(国峰精细化学试剂).
仪器:RE-2000型超净工作台(上海亚荣生化仪器厂);Nicoet 170SX型傅立叶变换红外光谱仪;Hitachi S-570型扫描电子显微镜;CMT8502型微机控制电子万能试验机(深圳新三思材料检测有限公司).钴源由湖北省农业科学院辐照中心提供.实验用水为蒸馏水.
1.2 复合水凝胶的制备取83.72 g 3-氯-2-羟丙基三甲基氯化铵(HACC)溶解于45.08 g蒸馏水中,用15%稀NaOH调至pH 8.0,再加入16.00 g壳聚糖,置于三口烧瓶中于恒温85 ℃下反应72 h,将样品转移至烧杯中,调节pH值至7.0.再将样品加水溶解,并置于透析膜中透析72 h,期间每隔24 h换一次水[11].将透析后的样品置于旋转蒸发器中蒸干,得到HACC初产品,烘箱中45 ℃烘干备用.
取一定量PVA,PEO和HACC于三口烧瓶中配成10%的溶液,恒温85 ℃搅拌6 h至混合均匀,将混合均匀的溶液装瓶除氧后待辐照交联[12].室温下,在60Co源的γ射线下辐射交联,辐射强度分别为20,30,40,50,60 kGy.所得水凝胶贮存于冷柜中备用.
1.3 产物表征分别将抽提后的水凝胶样品和辐照前的聚合物共混溶液于45 ℃烘干研磨成粉末,KBr压片法测其红外光谱.将处于溶胀平衡的水凝胶样品置于冷冻干燥机中于-52 ℃下进行冷冻干燥,再将样品切片后置于扫描电镜下观察其形貌.
1.4 性能测试 1.4.1 凝胶分数取一定量凝胶样品在干燥烘箱中烘干至恒重,称其质量记作m1.室温下将样品在蒸馏水中抽提72 h,期间每隔12 h更换一次水.抽提后的水凝胶样品烘干至恒重,称其质量记作m2.水凝胶的凝胶分数(%)按下式计算:
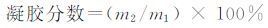
|
将抽提后的水凝胶干燥后(质量md)室温下于蒸馏水中浸泡48 h直到水凝胶达到溶胀平衡,用滤纸吸干残留水分,称其质量ms.按下式计算水凝胶样品的溶胀性能(%):
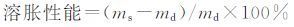
|
将水凝胶样品置于蒸馏水中浸泡至溶胀平衡,用滤纸吸干残留水分称其质量记作m1;将吸水后的水凝胶置于烘箱50 ℃烘干24 h.每隔5 h测量水凝胶的质量m2,直至水凝胶恒重称其终质量m3.按下式计算水蒸发率(%):
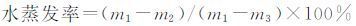
|
室温下将水凝胶样品切割成75 mm×13 mm(长×宽)哑铃状.样品的中部凹陷部分呈矩形,而哑铃柄部两侧各为一个长度(L) 30 mm哑铃形,宽(W) 4 mm,并由卡尺测量水凝胶样品的厚度(D).并用拉伸机器以200 mm/min的速度对样品的拉伸强度和断裂伸长率进行测定.拉伸强度(MPa)和断裂伸长率(%)分别按下式计算:
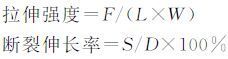
|
其中,F(N)为样品拉伸至刚断裂时施加在样品上的拉力,S(mm)为样品拉伸至刚断裂时刻的伸长长度,W/D/L(mm)分别为样品的宽度、厚度和长度.
1.4.5 抗菌性能考察了水凝胶样品对金黄色葡萄球菌和大肠杆菌的抗菌性.将细菌接种于琼脂培养基中后,水凝胶样品切成均匀薄片后放置于培养皿中央,将培养皿放置在34 ℃恒温培养箱中培养24 h,观察是否有抑菌圈产生.
2 结果与分析 2.1 红外光谱图 1为PEO、PVA、HACC以及在40 kGy辐照强度下制得的水凝胶的红外光谱.其中,PVA的红外光谱中出现了几个比较明显的特征峰:3 450 cm-1处对应—OH的伸缩振动峰;1 635 cm-1处对应C=O的振动伸缩峰;2 910 cm-1处对应C骨架中C—H的伸缩振动峰;1 100 cm-1和1 355 cm-1处出现最强吸收峰,为CH—OH基团的吸收峰[12].对于PEO:在1 100 cm-1处有C—O的伸缩振动峰[13].壳聚糖季铵盐的特征吸收峰为1 656 cm-1 和1 480 cm-1处,这是由于壳聚糖季铵盐化后新产生的氨甲基导致的.再来观察水凝胶的吸收峰,从1 480 cm-1的吸收峰可以看出新制得的水凝胶保留了壳聚糖季铵盐的氨甲基结构.由此可以看出辐照过程对聚合物分子的化学结构基本没有影响,壳聚糖季铵盐的功能性基团没有变化,而其抑菌性能主要是由氨基官能团决定的,因此制得的水凝胶仍有抑菌性[14].此外,从3 420 cm-1和2 800 cm-1处的吸收峰分别为羟基与羟基,羟基与氨基之间的氢键作用峰.
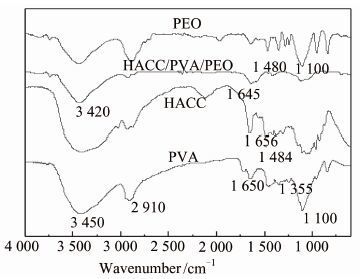
|
| 图 1 HACC,PVA,PEO以及HACC/PVA/PEO水凝胶的红外光谱 Figure 1 FT-IR spectra of PVA,PEO,HACC and HACC/PVA/PEO |
对水凝胶样品进行SEM分析,如图 2所示.可以看到,该水凝胶样品具有良好的三维网络结构,含有大量分布均匀的微孔,微孔之间呈相互连通的孔状结构.该结构能够扩大水凝胶的比表面积和与水接触的面积,成为水迅速进入水凝胶内部的通道,提高水凝胶的溶胀速度,保证水凝胶的吸水和储水能力[14].对比40 kGy(图 2A)和30 kGy(图 2B)辐照强度下制备的水凝胶样品的SEM图可以看出,随着辐照强度的增加,水凝胶表面的孔隙数量也是在增加的.
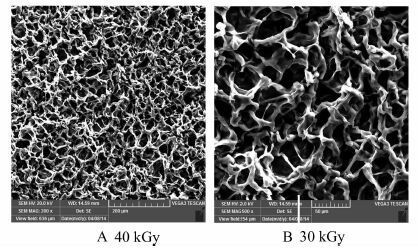
|
| 图 2 不同辐照强度下的HACC/PVA/PEO水凝胶电镜扫描图 Figure 2 SEM of hydrogel prepared at different irradiation dose mHACC:mPVA/PEO=1∶1 |
图 3为不同辐照强度以及物料比对凝胶分数的影响.在相同的物料比条件下随着辐照强度的不断增加,水凝胶样品的凝胶分数不断增大,表明高强度的辐照有利于体系发生交联形成具有网络结构的水凝胶[15].而在相同辐照强度下,水凝胶的凝胶分数随着体系中HACC含量的增加而不断减小,这主要是因为高强度辐照强度会引起壳聚糖及其衍生物的降解[16].或者说其降解过程大于交联过程,所以体系中HACC含量的增加必然会导致水凝胶体系的交联度的降低,因此得到的水凝胶的凝胶分数也会降低.
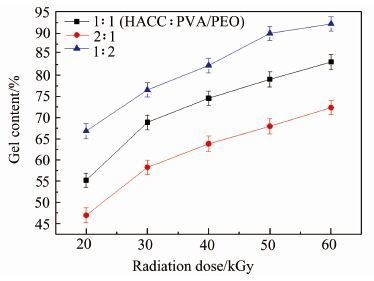
|
| 图 3 不同辐照强度以及物料比对凝胶分数的影响 Figure 3 Gel content of HACC/PVA/PEO hydrogel prepared at different radiation dose and material ratio |
考察了不同辐照强度下的水凝胶的溶胀性能,如图 4所示.可以看出,不同辐照强度下制得的水凝胶随着浸泡时间的增加其溶胀率不断增大直至达到溶胀平衡.所有水凝胶到达溶胀平衡后的溶胀率在1 050%~4 130%的范围内,从图 2中也可以看出,符合作为伤口敷料的性能要求[17].

|
| 图 4 不同辐照强度(A)及物料比(B)对溶胀性能的影响 Figure 4 Swelling percentage of HACC/PVA/PEO hydrogel prepared at different radiation dose (A) and material ratio(B) A:mHACC∶ mPVA/PEO =1∶1;B:40 kGy |
从图 4A可以看出,在相同物料比条件下随着辐照强度的增加,水凝胶的溶胀性能减弱.这主要是因为随着辐照强度的增大,水凝胶内部网络结构的交联度变大,使得水凝胶的网络结构变得紧密,大分子链伸展变得更加困难,水凝胶网络结构之间的空隙变小,致使封存水的空间变少导致水凝胶的溶胀性能降低.从图 4B中可以看出,在相同辐照强度下,随着HACC在体系中的含量不断增加,水凝胶的溶胀率也不断增加.这主要是因为壳聚糖及其衍生物的加入可能会导致水凝胶的结构变得比较松散,致使体系中的大分子链可以更容易地得到伸展.同时,HACC中含有大量的亲水性基团(如:—OH和—NH2),也可以在一定程度上使水凝胶的平衡溶胀率得到提高.
2.5 水蒸发率考察了不同辐照强度及不同物料比对水蒸发率的影响,结果见图 5.可以看出,不同辐照强度下得到的水凝胶的失水趋势是相似的,水凝胶都是在5~10 h内大量失水,失水率达到66%~82%;而当时间增加到15~20 h,水凝胶的失水速率明显减缓,24 h后达到平衡,水凝胶的平衡失水率在76%~87%之间,符合理想敷料的要求[18].此外,从图 5A还可以看出,随着辐照强度的增加,水凝胶的失水率不断增加,但增加率并不大,平衡失水率的差距也较小.实验得到的水凝胶的平衡失水率均小于90%,说明仍有一大部分水封存在水凝胶中,为伤口提供了理想的润湿愈合环境.从图 5B中可以看出在相同辐照强度下,随着体系中HACC含量的不断增加,制备得到的水凝胶的失水率和失水速率.

|
| 图 5 不同辐照强度(A)及物料比(B)对水蒸发率的影响 Figure 5 Water loss rate of HACC/PVA/PEO hydrogel prepared at different radiation dose (A) and material ratio(B) A:mHACC∶ mPVA/PEO =1∶1;B:40 kGy |
考察了不同辐照强度及物料比对拉伸强度及断裂伸长率的影响,结果如图 6所示.可以得知,制备的水凝胶具备一定的机械性能,当辐照强度为40 kGy时拉伸强最大达到3.2 MPa,符合理想敷料的机械强度(>1.2 MPa)[19].当辐照强度小于40 kGy时,随着辐照强度的不断增加,水凝胶的拉伸强度也不断提高.这是因为辐照强度的增加提高了交联后聚合物分子的交联密度,从而使水凝胶的拉伸强度提高.但是,在强度大于40 kGy后,随着辐照强度的不断增加,辐射对于高分子的降解作用也会有一定程度的增强,辐照的这种降解作用使得水凝胶变脆,从而使拉伸强度和断裂伸长率降低.从图 6B可以看出,在相同辐照强度下HACC含量的增加会导致共混水凝胶的断裂伸长率降低.

|
| 图 6 不同辐照强度以及物料比对拉伸强度(A)和断裂伸长率(B)的影响 Figure 6 Tensile strength(A) and elongation(B) of HACC/PVA/PEO hydrogel prepared at different radiation dose and material ratio |
伤口若直接暴露在空气中容易感染细菌,而细菌的滋生易引起伤口感染并延迟伤口的愈合.当辐照剂量为40 kGy,壳聚糖季铵盐(HACC)与聚乙烯醇(PVA)/聚氧化乙烯(PEO)共混比为1∶1时,水凝胶的抗张强度达到3.2 MPa,且具备良好的溶胀性能以及水蒸发率.因此,测试了辐照剂量为40 kGy物料比为1∶1的水凝胶对于金黄色葡萄球菌和大肠杆菌的抗菌性实验如图 7所示.HACC/PVA/PEO水凝胶对金黄色葡萄球菌和大肠杆菌均表现出良好的抑制作用(图 7B,D),而PEO/PVA水凝胶几乎没有表现出抗菌性(图 7A,C).HACC/PVA/PEO水凝胶具备抗菌性主要源于壳聚糖季铵盐分子链上带正电荷的季铵基团与细菌表面带负电荷的细胞结合,使蛋白质改性,导致细菌被絮凝、聚沉,从而抑制了细菌的繁殖能力[20, 21].

|
| 图 7 PVA/PEO及HACC/PVA/PEO水凝胶分别对金黄色葡萄球菌(A,B)和大肠杆菌(C,D)的抗菌性能 Figure 7 Effect PVA/PEO hydrogel and HACC/PVA/PEO hydrogel on growth of S. aureus (A,B) and E. coli (C,D) strains |
本实验采用辐照交联法在PVA/PEO体系中引入HACC,得到了一种新型水凝胶.当辐照剂量为40 kGy,HACC与PVA/PEO共混比为1∶1时所得复合水凝胶的抗张强度、溶胀性能及水蒸发率均达到理想伤口敷料的要求,并且对金黄色葡糖球菌和大肠杆菌表现出了良好的抑制作用.在后续研究中,我们将进一步考察该水凝胶作为伤口敷料用于临床应用中的实际效果并不断改进.
| [1] | SAI P, BABU M. Collagen based dressings-A review[J]. Burns, 2000, 26 (1) : 54 –62. |
| [2] | JONES A, VAUGHAN D. Hydrogel dressings in the management of a variety of wound types: A review[J]. Journal of Orthopaedic Nursing, 2005, 9 (1) : S1 –S11. |
| [3] | LI H N, YANG J, HU X N, et al. Superabsorbent polysaccharide hydrogels based on pullulan derivate as antibacterial release wound dressing[J]. Journal of Biomedical Materials Research Part A, 2011, 98A (1) : 31 –39. |
| [4] | WINTER G D. Formation of the scab and the rate of epithelization of superficial wounds in the skin of the young domestic pig[J]. Nature, 1962, 193 (4812) : 293 –294. |
| [5] | GAO J, FRISKEN B J. Influence of reaction conditions on the synthesis of self-cross-linked N-isopropylacrylamide microgels[J]. Langmuir, 2003, 19 (13) : 5217 –5222. |
| [6] | HENNINK W E, NOSTRUM C F V. Novel crosslinking methods to design hydrogels[J]. Advanced Drug Delivery Reviews, 2002, 54 (1) : 13 –36. |
| [7] | KUMIRSKA J, WEINHOLD M X, THOMING J, et al. Biomedical activity of chitin/chitosan based materials-influence of physicochemical properties apart from molecular weight and degree of N-Acetylation[J]. Polymers, 2011, 3 (4) : 1875 –1901. |
| [8] | MUZZARELLI R A A. Chitins and chitosans for the repair of wounded skin, nerve, cartilage and bone[J]. Carbohydrate Polymers, 2009, 76 (2) : 167 –182. |
| [9] | BOUCARD N, VITON C, AGAY D, et al. The use of physical hydrogels of chitosan for skin regeneration following third-degree burns[J]. Biomaterials, 2007, 28 (24) : 3478 –3488. |
| [10] | GERESH S, DAWADI R P, ARAD S. Chemical modifications of biopolymers: quaternization of the extracellular polysaccharide of the red microalga Porphyridium sp[J]. Carbohydrate Polymers, 2000, 43 (1) : 75 –80. |
| [11] | YEVLAMPIEVA N P, GORSHKOVA M Y, VOLKOVA I F, et al. Molecular properties of modified chitosan containing a quaternary amino group[J]. Polymer Science Series A, 2011, 53 (2) : 124 –132. |
| [12] | VIJAYABASKAR V, BHATTACHARYA S, TIKKU V K, et al. Electron beam initiated modification of acrylic elastomer in presence of polyfunctional monomers[J]. Radiation Physics and Chemistry, 2004, 71 (5) : 1045 –1058. |
| [13] | ABD EL-MOHDY H L. Radiation synthesis of nanosilver/poly vinyl alcohol/cellulose acetate/gelatin hydrogels for wound dressing[J]. Journal of Polymer Research, 2013, 20 (6) : 1511 –1512. |
| [14] | GATES J L, HOLLOWAY G A. A comparison of wound environments[J]. Ostomy Wound Manage, 1992, 38 (8) : 34 –37. |
| [15] | SHEKUNOV B Y, CHATTOPADHYAY P, TONG H H Y, et al. Particle size analysis in pharmaceutics: Principles, methods and applications[J]. Pharmaceutical Research, 2007, 24 (2) : 203 –227. |
| [16] | NAHA P C, BHATTACHARYA K, TENUTA T, et al. Intracellular localisation, geno- and cytotoxic response of polyN-isopropylacrylamide (PNIPAM) nanoparticles to human keratinocyte (HaCaT) and colon cells (SW 480) [J]. Toxicology Letters, 2010, 198 (2) : 134 –143. |
| [17] | CHI W L, QIN C Q, ZENG L T, et al. Microbiocidal activity of chitosan-N-2-hydroxypropyl trimethyl ammonium chloride[J]. Journal of Applied Polymer Science, 2007, 103 (6) : 3851 –3856. |
| [18] | VARGHESE M C, BALIN A K, CARTER D M, et al. Local environment of chronic wounds under synthetic dressing[J]. Archives of Dermatology, 1986, 122 : 52 –57. |
| [19] | TAN S T, ROBERTS R H, BLAKE G B. Comparing DuoDERM ER with scarlet red in the treatment of split skin graft donor sites[J]. British Journal of Plastic Surgery, 1993, 46 (1) : 79 –81. |
| [20] | JIANG S, WANG L, YU H J, et al. Preparation of crosslinked polystyrenes with quaternary ammonium and their antibacterial behavior[J]. Reactive & Functional Polymers, 2005, 62 (2) : 209 –213. |
| [21] | TOMIC S L, MICIC M M, DOBIC S N, et al. Smart poly(2-hydroxyethyl methacrylate/itaconic acid) hydrogels for biomedical application[J]. Radiation Physics and Chemistry, 2010, 79 (5) : 643 –649. |
 2016, Vol. 62
2016, Vol. 62





