文章信息
- 蔡丽华, 乐强, 曾庆寰, 吉瑞冬
- CAI Lihua, YUE Qiang, ZENG Qinghuan, JI Ruidong
- 吡啶双酰胺基Schiff碱仲胺的合成及其抗菌活性
- Synthesis of Schiff Bases Amine Containing Pyridine Ring and Amide Bridge and Its Antibacterial Activity
- 武汉大学学报(理学版), 2017, 63(3): 241-245
- Journal of Wuhan University(Natural Science Edition), 2017, 63(3): 241-245
- http://dx.doi.org/10.14188/j.1671-8836.2017.03.008
-
文章历史
- 收稿日期:2016-04-22

水杨醛类Schiff碱是水杨醛的衍生物,具有抑菌、抗菌、抗癌、抗病毒活性等特点.Schiff碱的合成可以自由选择反应物,改变取代基及取代基的位置,便于开发大量结构新颖的产品[1].在Schiff碱中引入吡啶等杂环,使Schiff碱更容易与其他金属离子配位,合成得到多种新型的Schiff碱配合物,可以广泛地应用到工业废水的处理,抗肺结核、抗麻风病、抗细菌和抗病毒传染药物的研究[2].将Schiff碱还原成仲胺比Schiff碱具有更多优点,如:更好的配位活性等.C=N双键还原为可自由旋转的C—N单键,更有利于与金属离子络合,其应用领域也更宽广[3].另外,C=N双键的还原将会增加N—H键的数目,可使药物分子通过氢键与受体作用,从而会增强药物分子的药效,获得更好的抗菌效果[4, 5].
本文以2, 6-吡啶二甲酸、乙二胺、水杨醛等为主要原料,制备了一系列吡啶双酰基Schiff碱,并在NaBH4的作用下,还原为相应的仲胺,表征了物质的结构,并对其抗菌活性进行了检测,以期探索出具有更好抗菌活性的水杨醛类Schiff碱药物.
1 实验部分仪器:元素分析用MOD-1106型元素分析仪(Carlo-Erba公司)测定;红外(IR)光谱(400~4 000 cm-1)用Shimadzu FT-IR 3000型红外光谱仪测定(KBr压片);质谱(MS)用Waters 6220 Accurate-Mass Q-TOF型液质(LC-MS)联用仪测定;一维质子核磁共振氢谱(1H NMR)用Variant Mercury-VX 300型核磁共振仪测定,以二甲基甲酰胺(DMF)为溶剂.
试剂:SOCl2,乙二胺为市售分析纯试剂,使用前经减压蒸馏处理;其他溶剂和试剂除特别注明外均为分析纯或化学纯级,使用前未进一步处理.大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis)均为武汉工商学院实验室保藏菌种,牛肉膏蛋白胨培养基(自制):牛肉膏3 g,蛋白胨10 g,氯化钠5 g,琼脂15~20 g,加水至1 000 mL,pH调至7.0~7.2左右.
1.2 样品合成水杨醛类Schiff碱仲胺的合成路径见图 1.
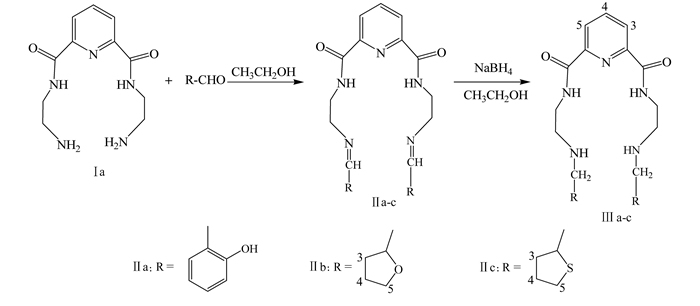
|
| 图 1 水杨醛类Schiff碱仲胺的合成路线 Figure 1 Synthesis of salicylaldehyde Schiff base secondary amines |
N, N′-双(2-胺基乙基)-2, 6-吡啶二甲酰胺(Ⅰa)的合成方法见参考文献[1].
水杨醛类Schiff碱(Ⅱa, b, c):参照文献[6, 7], 将4 mmol制备得到的Ⅰa溶于40 mL乙醇,磁力搅拌下缓慢滴至40 mL含8.8 mmol水杨醛的乙醇溶液中,加热回流4 h后冷却至室温,待沉淀完全后过滤,滤饼依次用乙醇、乙醚各洗涤3次,真空干燥后得粗产品,用20 mL氯仿或乙醇重结晶后得纯品.
水杨醛Schiff碱Ⅱa:亮黄色粉末1.63 g;产率89%,熔点191~193 ℃;LC-MS谱图数据(m/z):460(M+1);元素分析(C25H25N5O4)计算值(%):C 65.35, H 5.48, N 15.24,测试值(%):C 65.58, H 5.27, N 15.11%.
糠醛Schiff碱(Ⅱb):白色粉末0.55 g,产率34%,熔点198~200 ℃;LC-MS谱图数据(m/z):408 (M+1),元素分析(C21H25N5O4)计算值(%):C 61.92, H 5.16, N 17.20%,实测值(%):C 61.28, H 5.01, N 16.98%.
噻吩甲醛Schiff碱(Ⅱc):白色粉末1.44 g,产率86%,熔点202~204 ℃.LC-MS谱图数据(m/z):441 (M+2);元素分析(C21H21N5O2S2)计算值(%):C 57.40, H 4.78, N 15.95%,实测值(%):C 57.85, H 4.27, N15.69%.
Ⅱa, b, c的IR及1H NMR谱图数据分别见表 1,2.
| 化合物 | ν(OH/H2O, N-H) | νamide Ⅰ | νC=N | νC-N | νamide Ⅱ | νpy | νph |
| Ⅱa | 3 354 | 1 676 | 1 633 | — | 1 535 | 1 492,1 272 | 760,660 |
| Ⅲa | 3 287 | 1 663 | — | 1 398 | 1 541 | 1 459,1 256 | 753,617 |
| Ⅱb | 3 338 | 1 673 | 1 645 | — | 1 532 | 1 447,1 380 | 758,645 |
| Ⅲb | 3 304 | 1 667 | — | 1 345 | 1 539 | 1 446,1 219 | 742,647 |
| Ⅱc | 3 322 | 1 664 | 1 625 | — | 1 536 | 1 450,1 295 | 730,664 |
| Ⅲc | 3 099 | 1 615 | — | 1 376 | 1 537 | 1 440,1 274 | 759,718 |
| 化合物 | amide H | NC—H | —CH2— | Pyridine ring | R | Secondary amide Hamine |
| Ⅱa | 8.25(br) | 7.33(s) | 3.85(s, 4H); 3.48(q, 4H) |
8.37(d, 2H, H-3, 5); 8.01(t, 1H, H-4) |
13.56(s, 2H, O-H); 7.26(d, 2H); 7.16(q, 2H); 6.87(m, 4H) |
— |
| Ⅲa | 4.85(br) | — | 3.75(m, 8H); 2.98(t, 4H) |
7.25(m, 3H) | 8.89(OH, 2H) 6.89(m, 8H) |
4.85(br, 2H) |
| Ⅱb | 8.91(br) | 8.08 (s) | 3.79(br, 8H); | 8.30(d, 2H, H-3, 5); 7.99(t, 1H, H-4) |
7.39(s(e), H-5; 6.75(d(e), H-3); 6.42(d(e), H-4) |
— |
| Ⅲb | 8.20(br) | — | 3.59(m, 8H); 2.75(t, 4H) |
7.34(m, 3H) | 6.89(m, 6H) | 4.53(br, 2H) |
| Ⅱc | 8.55(br) | 8.39(s) | 3.77(t, 8H) | 8.33(s, 2H, H-3, 5); 8.02(t, 1H, H-4) |
7.40(d(e), H-5); 7.31(t(e), H-3); 7.07(q(e), H-4) |
— |
| Ⅲc | 7.37(br) | — | 4.02(t, 4H); 3.61(t, 4H); 2.46(t, 4H) |
7.14(m, 3H) | 6.96(m, 6H) | 4.35(br, 2H) |
将4 mmol制备得到的Ⅰa溶于40 mL乙醇,磁力搅拌下缓慢滴入到40 mL含8.8 mmol水杨醛的乙醇溶液中,加热回流4 h后冷却至室温.在低于20 ℃条件下,缓慢(恒压漏斗)滴加3倍量的NaBH4的20 mL乙醇溶液,滴加完毕后,继续搅拌反应过夜,蒸去溶剂并减压至干燥,再加60 mL水搅拌5~10 min,用30 mL乙酸乙酯萃取3次,合并萃取液用30 mL的水洗涤3次,合并有机层用无水硫酸钠干燥.先简单蒸馏除去大部分溶剂,再减压抽滤,得到粗产品,再用20 mL乙醇重结晶后得纯品.3个样品在一般的有机溶剂如乙醇或氯仿中均有较好的溶解性,水杨醛类仲胺固体对光、空气较稳定,且不吸潮.
水杨醛Schiff碱仲胺(Ⅲa):淡黄色粉末1.28 g,产率69.4%,熔点118~122 ℃;元素分析(C25H29N5O4)计算值(%):C 64.79, H 6.26, N 15.12;实测值(%):C 65.04,H 6.41,N 15.32;LC-MS谱图数据(m/z):464.2(M+1).
糠醛Schiff碱仲胺(Ⅲb):黄棕色粘稠液体1.03 g,产率62.7%,熔点110~113 ℃;元素分析(C21H29N5O4)计算值(%):C 60.72,H 6.99,N 16.87;实测值(%):C 60.96,H 6.71,N 17.06;LC-MS谱图数据(m/z):416.4(M+1).
噻吩甲醛Schiff碱仲胺(Ⅲc):白色晶体0.74 g,产率41.72%,熔点103~105 ℃;元素分析(C21H25N5O2S2)计算值(%):C 56.88,H 5.64,N 17.06;实测值(%):C 57.21,H 5.48,N 17.40;LC-MS谱图数据(m/z):444.5(M+1).Ⅲa, b, c的IR及1H NMR谱图数据分别见表 1,表 2.
1.3 抗菌活性实验在牛肉膏蛋白胨的试管斜面培养基上,分别接种E. coli,S. aureus,B. subtilis,活化3次后,接种于液体培养基中,放置在37℃恒温培养箱中培养,血球计数板记数,使菌体浓度达到1.5×108个/mL[8, 9].
试管稀释法[10]测定抗菌活性.取已灭菌试管,用无菌培养基做溶剂准确配制2.5 g/L的水杨醛Schiff碱药品溶液,超声波振荡溶解,移取10 mL至1号已灭菌的试管中,逐级稀释使1~5号试管药液浓度分别为2.5,1.0,0.5,0.2,0.1 g/L.6号试管不加药品,作为空白对照.同样方法配制其仲胺的药液.所有药液煮沸后冷却.用微量移液枪从1~6号试管中分别按200:1(培养基/菌液)的体积比加入E. coli菌液.再依次对S. aureus和B. subtilis进行平行实验.把不同浓度含药菌液的试管于37 ℃恒温培养24 h,取出,用肉眼观察,未看到有菌生长的试管中的最低药液浓度为MIC.以无菌培养基为参比在580 nm波长下测定每只试管药液的OD(光密度)值.
2 结果与讨论 2.1 IR光谱分析水杨醛类Schiff仲胺Ⅲa, b, c的IR图谱数据见表 1.
在所合成化合物的IR谱图中,水杨醛Schiff碱仲胺相对于其Schiff碱的特征吸收峰几乎都向低波数方向发生了位移.以化合物Ⅱa和Ⅲa为例,N—H或O—H伸缩振动吸收峰从3 354 cm-1(Ⅱa)移至3 287 cm-1(Ⅲa);酰胺C=O伸缩振动吸收峰从1 676 cm-1(Ⅱa)移至1 663 cm-1(Ⅲa);1 492,1 272 cm-1(Ⅱa)处的吡啶环弯曲振动吸收峰移至1 459,1 256 cm-1(Ⅲa);760,660 cm-1(Ⅱa)处的芳环面外弯曲振动吸收峰移至753.3,617 cm-1(Ⅲa).
通过对比发现,Ⅱa, b, c中CH=N的吸收峰(1 633、1 645、1 625 cm-1)消失,而分别在Ⅲa, b, c中于1 398、1 345、1 376 cm-1处出现了C—N伸缩振动中强吸收峰,从而证实CH=N还原生成仲胺C—N(—H).
2.2 1H NMR分析水杨醛类仲胺Ⅲa, b, c的1H NMR谱图数据见表 2.对比文献[11]知:水杨醛类Schiff碱Ⅱa, b, c中亚胺C原子上的质子信号(—N=CH—)位于7.33,8.08,8.39处.还原之后的仲胺Ⅲa, b, c中该质子信号消失,分别增加了4.85(br, 2H),4.53(br, 2H),4.35(br, 2H),为还原后(CH2)—N—H中N上的质子信号,而Ⅱa, b, c中2.98(t, 4H),2.75(t, 4H),2.46(t, 4H)为还原后CH2—N(—H)中C上的质子信号,从而证实Schiff碱双臂上的对称CH=N还原生成CH2—N(—H).
2.3 水杨醛Schiff碱及其仲胺的抗菌活性含药菌液置于37 ℃恒温培养箱中孵育24 h后,肉眼观察可以发现,浓度大于0.5 g·L-1的试管,几乎未发现细菌生长,所以MIC值在0.5~1.0 g·L-1之间, Ⅱa,Ⅲa对3种受试菌种的OD值结果见图 2.可以看出,对于同一种受试菌种,水杨醛Schiff碱仲胺的抑菌效果明显优于水杨醛Schiff碱抑菌效果.在3种受试菌中,水杨醛Schiff碱与其仲胺对革兰氏阴性菌E. coli的抗菌作用最为明显,表示同种药物对不同细菌的抗菌能力不同,不同药物对同种细菌的抗菌能力也不同.
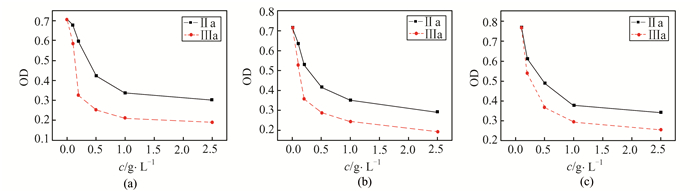
|
| 图 2 Ⅱa,Ⅲa对3种受试菌种的抗菌活性 Figure 2 The antibacterial activity on E. coli, S. aureus and B. subtilis of Ⅱa, Ⅲa (a):E. coli; (b): S. aureus; (c):B. subtilis |
水杨醛仲胺的抑菌效果明显优于水杨醛Schiff碱的抑菌效果.从结构上看,可能是由于将Schiff碱还原成仲胺类化合物,这类化合物比Schiff碱类物质更稳定.从生物学效能上看,一方面是由于水杨醛Schiff碱仲胺有较好的水溶性,能穿透细菌的细胞壁,深入细菌的内部,抑制DNA螺旋酶的活性,造成药物遗传物质不可逆的损伤,从而影响微生物的DNA及蛋白质的合成,使其生长繁殖受到抑制;另一方面,在还原剂NaBH4的作用下,还原以后的C=N双键会增加N—H键的数目,使药物分子通过氢键与受体作用,增强药物分子的药效,从而对细菌起到了一定的抑制作用[11].
3 结论本文合成了3个水杨醛类Schiff碱及其仲胺,并采用红外,氢核磁共振,质谱等分析方法对样品的结构进行表征,证实了其结构.水杨醛Schiff碱及其仲胺的抗菌实验结果表明,被还原的Schiff碱的抗菌、抑菌效果明显增强.根据构效理论,不同的Schiff碱引入的杂环不同,抗菌和抑菌效果也不同.这为研究其他类型Schiff碱仲胺的合成提供了新思路.同时,这些新型的Schiff碱仲胺,由于还原C=N双键将会增加N—H键的数目,更易于和金属离子形成配合物,从而进一步增强抗菌、抑菌的效果.
| [1] | CAI L H, HU P Z, DU X L, et al. Synthesis and characterization of open ring complexes formed in the reaction of lanthanides with salicyladehyde Schiff base containing pyridine and amide bridge[J]. Asian Journal of Chemistry, 2005, 17(2) : 969–974. |
| [2] | 张雄, 蔡丽华, 黄丽芬, 等. 糠醛双Schiff碱及其铜配合物的合成与抗菌活性研究[J]. 化学与生物工程, 2010, 27(4) : 51–53. ZHANG X, CAI L H, HUANG L F, et al. Synthesis and biological activity of Furan Schiff base and Cu(Ⅱ) complexes[J]. Chemistry & Bioengineerin, 2010, 27(4) : 51–53(Ch). DOI:10.3969/j.issn.1672-5425.2010.04.014 |
| [3] | WU L M, LI Q, JIN L F, et al. Synthesis and structure of the acylhydrazone Schiff bases[J]. Chinese Journal of Structure Chemistry, 2010, 29(9) : 1399–1403. |
| [4] | 陈超越, 马超, 向建南, 等. 水杨醛葡萄糖苷对氨基苯酚席夫碱的合成[J]. 合成化学, 2008, 16(3) : 301–303. CHEN C Y, MA C, XIANG J N, et al. Synthesis of Schiff base with salicyladehyde glucoside and 4-aminophenol[J]. Chinese Jounal of Synthetic Chemisty, 2008, 16(3) : 301–303(Ch). DOI:10.3969/j.issn.1005-1511.2008.03.015 |
| [5] | JIN C, FAN W B, JIA Y J, et al. Encapsulation of transition metal tetrahydro-Schiff base complexes in zeolite Y and their catalytic properties forthe oxidation of cycloalkanes[J]. Journal of Molecular Catalysis A Chemical, 2006, 249(1) : 23–30. DOI:10.1016/j.molcata.2005.12.035 |
| [6] | 蔡丽华, 黄丽芬, 朱静静, 等. 含吡啶酰胺基双Schiff碱的过渡金属配合物的合成[J]. 精细石油化工, 2010, 27(2) : 16–20. CAI L H, HUANG L F, ZHU J J, et al. Synthesis of open ring complexes formed in the reaction of transition metals with Schiff base containing pyridine ring and amide bridge[J]. Speciality Petrochemicals, 2010, 27(2) : 16–20(Ch). DOI:10.3969/j.issn.1003-9384.2010.02.005 |
| [7] | CAI L H, HU P Z, DU X L, et al. Synthesis and spectrum of new Schiff bases as polydentate ligands and potential antibacterial reagents[J]. Indian Journal of Chemistry, 2007, 46B(3) : 523–528. |
| [8] | LIU Y, LIU Y, WANG C, et al. Microcalorimetric studies of the inhibition of sodium azide on the mitochondrial metabolism of fish liver tissue[J]. Thermochimica Acta, 2000, 351(1-2) : 51–54. DOI:10.1016/S0040-6031(00)00415-9 |
| [9] | REN S, WANG R, KOMATSU K, et al. Synthesis, biological evaluation, and quantitative structure-activity relationship analysis of new Schiff bases of hydroxysemicarbazide as potential antitumor agents[J]. Journal of Medicinal Chemistry, 2002, 45(2) : 410–419. DOI:10.1021/jm010252q |
| [10] | ANITHA C, SHEELA C D, THANMARAJ P, et al. Spectroscopic studies and biological evaluation of some transition metal complexes of azo Schiff-base ligand derived from (1-phenyl-2, 3-dimethyl-4-aminopyrazol-5-one) and 5-((4-chlorophenyl)diazenyl)-2-hydroxybenzaldehyde[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2012, 96(10) : 493–500. DOI:10.1016/j.saa.2012.05.053 |
| [11] | HUANG C C, CHANG H T. Selective gold nanoparticle based turn-on fluorescent sensors for detection of mercury(Ⅱ) in aqueous solution[J]. Analytical Chemistry, 2006, 78(24) : 8332–8338. DOI:10.1021/ac061487i |
 2017, Vol. 63
2017, Vol. 63





