文章信息
- 余舒琪, 瞿旭东
- YU Shuqi, QU Xudong
- 用于选择性优产雄烯二酮的工业小金色分枝杆菌的基因改造
- Genetic Engineering of an Industrial Mycobacterium neoaurum Strain for Selectively Producing Androstenedione
- 武汉大学学报(理学版), 2017, 63(1): 51-56
- Journal of Wuhan University(Natural Science Edition), 2017, 63(1): 51-56
- http://dx.doi.org/10.14188/j.1671-8836.2017.01.006
-
文章历史
- 收稿日期:2016-03-06

甾体药物在临床上占有重要地位,全球市场对甾体药物平均年销售额在400亿美元以上,约占世界医药产品总额的10%[1].甾体药物的生产方式分为化学合成和微生物转化法,其中微生物法环境污染小,生产成本低,通过转化可获得雄烯-4-醇-3,17-二酮(4-雄烯二酮,4-AD)和雄甾-1,4-二烯-3,17-二酮(1,4-雄烯二酮,ADD)等甾体药物的重要中间体[2~4].目前,已发现有许多微生物能降解植物甾醇,如诺卡式菌和分枝杆菌[5, 6]等.微生物通过体内的甾醇转化酶系可以高效降解植物甾醇侧链,20世纪70年代初,应用微生物降解胆甾醇生产ADD获得成功[7, 8].
目前,我国仍主要以依赖于从植物中提取甾体前体[9],并利用化学方法降解生产ADD [10].由于该方法能耗和人工成本均较高,环境污染较大,因此亟需在微生物降解领域,特别是菌种选育方面取得突破.近年来,一些甾醇降解菌株基因组测序的完成,以及甾醇降解机制的深入研究,为运用基因工程手段构建高产稳定的甾醇转化工程菌株提供了重要的基础[11~13].分枝杆菌降解植物甾醇过程中,植物甾醇首先在一系列酶的转化下生成4-AD,而后在3-ketosteroid-Δ1-dehydrogenase(KstD)酶催化下将4-AD转化成ADD [14~16](见图1).KstD酶作为膜结合蛋白在微生物体内的表达量有限,因此在甾醇转化的过程中往往只有部分的4-AD被转化成ADD [17].而由于4-AD和ADD化学性质相近,两者的分离纯化非常困难.有研究报道,通过基因工程方法可以阻断或过表达kstD基因,实现优产4-AD或ADD [17~19].
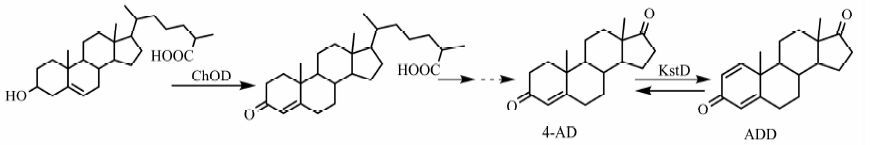
|
| 图 1 小金色分枝杆菌降解植物甾醇侧链合成4-AD或ADD Figure 1 Synthesis of 4-AD or ADD from the degradation of steroid side chain by Mycobacterium neoaurum |
本研究对一株工业用生产4-AD和ADD的小金色分枝杆菌(Mycobacterium neoaurum)的kstD基因进行改造,使甾醇的转化产物主要为4-AD或ADD,可望为工业优产4-AD和ADD提供理论依据.
1 实验部分 1.1 材料与仪器小金色分枝杆菌(MN-WT,仙琚药业公司);在MN-WT基础上敲除了kstD基因的突变菌株MN-ΔkstD(本实验构建);在MN-ΔkstD基础上过表达修复后的kstD*基因的突变菌株MN-ΔkstD-kstD*(本实验构建).
pK18mobsacB基因敲除质粒(武汉淼灵生物科技有限公司):利用该质粒上的致死自杀基因sacB在蔗糖培养基上进行反筛选,可快速获得基因无痕敲除菌株[20];PMV307是带有强启动子pG13的整合型质粒,由PMV306[11, 18](华东理工大学魏东芝老师提供)改造:强启动子pG13(序列见表1)首先由基因合成获得,而后被克隆至PMV306的EcoRV-EcoRI位点;pMD18-T质粒(Takara公司);E.coli DH5a菌种(本实验室保存).
| Function | Primers | Sequence (restriction sites are unlined) | Note |
|
kstD knockout | kstD-L-F kstD-L-R kstD-R-F kstD-R-R |
ATCTAGACTCCTTGATCGAGGCGGTGATC ACTCGAGCGTCACGCTGCAGAACCTCGTTG ACTCGAGGTGCGTTGCGCGACGACAACTC AAAGCTTGTGTCCGGCATCGACGCATCTG |
Xba Ⅰ Xho Ⅰ Xho Ⅰ Hind Ⅲ |
| kstD | kstD-F | AGAATTCCCTCGTAATCTCATCAGGCCCT | EcoR Ⅰ |
| clone | kstD-R | ATGTCGACTCAGGCCTTTCCAGCGAGAT | Sal Ⅰ |
|
kstD repair |
E6A-F E6A-R L138S-F L138S-R V193A-F V193A-R |
GTGTTCTACATGACTGCCCAGGACTACAGTGTCT AGACACTGTAGTCCTGGGCAGTCATGTAGAACAC TAAGGCCACCGGCCGCTCGGTCGAGCCCAAGCCGT ACGGCTTGGGCTCGACCGAGCGGCCGGTGGCCTTA GCTGCGCAGCATCAAGGCGGGTGTGCGGTCGGTGT ACACCGACCGCACACCCGCCTTGATGCTGCGCAGC |
Mutated codons are indicated by italics |
|
Strong promoter | pG13 |
AGATATCGATCGCCACTAGCGCCGCGGTCGGAATC AGCGCACTGGCCGCCGGAGCGGTCAGCTACCTGTT GCTGCGCCGCTTCGCTTTCTAGCACCGACGTCCCGG CGCCAGCAGCTACCTCTCGAGCAAACGTTTTGCGCG CCCGAAAAATAAGTCGTTGCAGAACTTTCATGAATTAG GCCTTGCTGCGCCCAGGCTCCAGTAGTAGAAATGGAG TCACGGCAGCCCGGTGAAGCCAAGGTCGAACCGGAA GAGAAGGTTCGTCCTCCCGACCCGGGCACCCAGCAC GGCCCCCGGAACCCACGCGGAGTCATAGCCGCGATA ATGGCAGAAGTGTTGCGGGCCTGCGTAATTGCGAAATT CAGATGGTGCCGGCGGCCCTTTGGGTGGGGCTGCAGC CAGAAGGGTCGCAAAAGCGCCGAGGCCAACCCACGC AGCCCACAAATGCACGCTTGGTAACCGAGAATTCCGG | EcoRV EcoRI |
高保真酶PrimerSTAR、限制性内切酶、T4连接酶(Takara公司);PCR Taq酶(鼎国生物公司);质粒提取试剂盒、胶回收试剂盒(生工生物工程(上海)公司).
实验涉及引物见表1.
Lemco培养基:peptone 5 g/L,lemco 5 g/L,NaCl 5 g/L.发酵种子培养基:葡萄糖6 g/L,NaNO3 5.4 g/L,甘油2 g/L,酵母提取物15 g/L,(NH4)2HPO4 0.6 g/L,吐温-80 10 g/L,pH 8.0.发酵培养基:大豆饼粉15 g/L,柠檬酸2.2 g/L,尿素0.5 g/L,(NH4)2HPO4 1.5 g/L,MgSO4 0.5 g/L,FeSO4 0.1 g/L,CaCO3 3 g/L,吐温-80 10 g/L,HP-β-CD 40 g/L,植物甾醇30 g/L,pH 7.0~7.2,灭菌后补加灭菌过的葡萄糖20 g/L.
仪器:5810R型高速冷冻离心机(Eppendorf公司);bio-RAD电泳仪(Bio-Rad公司);GBOXBOX-EF型凝胶成像仪(Syngene公司);SIL-20A型岛津HPLC (检测器UV240nm,Shimadzu公司);LTQ Orbitrap XL高分辨液相色谱质谱联用仪(HRESI-MS,Thermo Fisher Scientific公司).
1.2 实验方法 1.2.1 感受态的制备将菌种活化后扩大培养,按1%接种量接于含有50 mL培养基的500 mL摇瓶中,30 ℃,200 r/min至光密度OD600 nm=1.2左右,将菌液于冰水中静置1 h,4 500 r/min,4 ℃,离心10 min,收集菌体,用预冷的10%甘油洗涤,再次离心10 min,收集菌体,重复3次.最后加入500~1 000 μL的10%甘油重悬,按每管100 μL分装至预冷的无菌EP管中.
1.2.2 重组质粒的构建利用表1中的引物kstD-L-F和kstD-L-R以MN-WT野生菌株的DNA为模板扩增出基因置换的上游同源臂(1.7 kb),以引物kstD-R-F和kstD-R-R扩增出下游同源臂(1.6 kb).用高保真酶PrimerSTAR 进行PCR(聚合酶链式反应),结束后加入1 μL Taq酶,72 ℃反应30 min,在平末端的DNA两端加上A尾,经胶回收后克隆至pMD18-T中,测序验证.以限制性内切酶XbaⅠ和XhoⅠ切割带有上游同源臂的质粒,以XhoⅠ和HindⅢ切割带有下游同源臂的质粒,回收相应的同源臂片段,克隆至XbaI-HindⅢ双酶切的pK8mobsacB质粒中,得到用于基因敲除的质粒.
依次利用表1中的引物E6A-F、E6A-R,L138S-F、L138S-R和V193A-F、V193A-R,进行PCR,得到点突变的序列(A转为E,S转为L,A转为V).其中,Glu为谷氨酸(简称E),Ala为丙氨酸(简称A),Leu为亮氨酸(简称L),Ser为丝氨酸(简称S),Val为缬氨酸(简称V).通过点突变,得到修复的kstD*基因.随后以EcoRⅠ和SalⅠ酶切pMV307质粒,将kstD*基因克隆至该质粒中,得到用于强化表达kstD*基因的质粒.
1.2.3 基因敲除将所构建的重组质粒在大肠杆菌进行扩大培养,按手提法进行质粒提取[21].
将制备的重组质粒加入感受态中,混匀后静置15 min,转移至经过预冷的2 mm电转杯中,2.5 kV,23 ms的条件下进行电转化,然后于冰上静置10 min,加入1 mL的Lemco重悬细胞,30 ℃,200 r/min培养2~3 h,涂布于含有30 μg/mL卡那霉素的Lemco培养板上,30 ℃培养3~5 d.能够在含有卡那霉素平板上长出的单菌落说明发生了第一次同源重组.挑取单菌落于液体的Lemco培养基中进行传代松弛,连续进行两次转接传代,用无菌的二次蒸馏水将传代培养的菌液进行梯度稀释,然后按以下方式涂布于相应的平板,10-2于A(Lemco+Kan+Suc),C(Lemco+Suc);10-4于B(Lemco+Kan),D(Lemco+Suc)(Suc为10%蔗糖).如果出现A平板上的克隆远小于B平板,说明蔗糖致死基因sacB在分枝杆菌的基因组中整合并起到了相应的致死效应.挑取CD平板上的单克隆,分别在Lemco和Lemco+Kan平板上进行接种,剔除少量蔗糖致死效应失效的克隆菌株.挑取10~20株能够在Lemco平板上生长而不能在Lemco+Kan平板上生长的菌株,转接至液体培养基中扩大培养.将这些菌株的DNA以及野生型的菌株的DNA分别用验证引物进行PCR,分析基因大小确证基因是否发生缺失.
1.2.4 发酵产物的检测待发酵转化结束,取发酵液离心去除菌体,用等体积的乙酸乙酯对发酵液进行两次20 min的超声萃取,收集萃取液,低温减压旋蒸,用等体积的乙腈进行复溶,0.22 μm滤膜过滤.通过C18反相柱对发酵产物进行HPLC分析[22],条件如下:流速1 mL/min,流动相A(水),B(乙腈);0~20 min,50%~90% B;20~25 min,90% B;进样量10 μL.
2 结果与讨论 2.1 kstD基因缺失菌株的转化产物分析在植物甾醇的降解途径中(见图1)[14~16],催化4-AD到ADD转化的酶为KstD;通过分析M. neoaurum ATCC 25795的基因组[23],找到其中存在3种KstD同工酶(KstD1~3)[13],分别以9-OH AD、睾酮、4-AD为最适底物,KstD1和KstD 3参与构成甾醇代谢的两条主要代谢流通路.本研究中的工业菌株MN-WT降解植物甾醇的产物中含65.0% 4-AD和27.0% ADD,推测其基因组存在一条与kstD3同源的基因.为彻底消除产物中的ADD,对分枝杆菌中的kstD基因进行敲除.按实验方法制备重组质粒,并转化至MN-WT的感受态中,通过在蔗糖培养基上的筛选获得了kstD缺失的突变株.突变菌株的基因型经PCR验证,结果如图2所示.
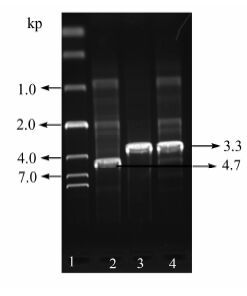
|
| 图 2 分枝杆菌kstD基因缺失突变与回复突变的凝胶电泳图 1:10 000 DNA Marker;2:回复突变株;3/4:kstD基因缺失突变株 Figure 2 Gel electrophoresis of the kstD deletion type and restoration type 1:10 000 DNA Marker;2:PCR products of restoration type; 3/4:PCR products of kstD deletion type |
对野生型及kstD缺失的突变菌株的转化产物进行HPLC分析(见图3),采用液相峰面积比(归一化法)计算各物质含量(见表2).野生型菌株发酵产物中,4-AD占总发酵产物的65.0%,还含有部分的ADD;而kstD基因缺失菌中4-AD上升到79.3%,ADD不再产生,kstD基因的缺失使得4-AD转化为ADD的途径完全被阻断.

|
| 图 3 不同菌株转化植物甾醇的发酵产物的HPLC谱图 1:MN-WT;2: MN-kstD;3:MN-ΔkstD-kstD* Figure 3 HPLC spectra of the fermentation products from degrading phytosterols by different strains |
利用表1中的引物kstD-F和kstD-R克隆了MN-WT菌株中的kstD基因,发现其相对于ATCC 25795中的kstD基因存在3个点突变:Glu-6→Ala,Leu-138→Ser,Val-193→Ala.我们推测,这些突变位点是该工业菌株在诱变育种过程中引入的,它们减弱了KstD3酶的活性,阻碍了4-AD向ADD的转变.为使该菌株能够优产ADD,首先按实验方法得到用于强化表达kstD*基因的质粒,电转入敲除了kstD的MN-ΔkstD菌株中,获得MN-ΔkstD-kstD*菌株.
对MN-ΔkstD-kstD*菌株降解甾醇的发酵产物进行HPLC分析,结果如图3、表2所示.采用液相峰面积比(归一化法),原始菌株中4-AD占所有代谢产物的65.0%,ADD占所有代谢产物的27.0%;强化表达kstD后,4-AD占所有代谢产物的22.0%,ADD占所有代谢产物的63.0%.经过修复后强化表达的kstD*,可以催化产生大量ADD,证实了该策略的有效性.
| % | |||
| Strain | 4-AD | ADD | residual |
| MN-WT | 65.0 | 27.0 | 8.0 |
| MN-ΔkstD | 79.3 | 0 | 20.7 |
| MN-ΔkstD-kstD* | 22.0 | 63.0 | 15.0 |
本研究利用基因工程手段,对用于生产4-AD和ADD的工业用小金色分枝杆菌的kstD基因进行敲除、过表达修复后kstD*基因,获得两株突变菌株可以选择性地优产4-AD或ADD.与野生型菌株相比,在前50 h,敲除了kstD基因的菌株在甾醇培养基上的生长无明显影响,此后迅速增长至OD600 nm=1.2,与原始菌几乎接近.后续研究可以继续选择其他来源的kstD基因,以及进一步强化表达kstD基因来提高ADD的转化率.此外,由于使用kstD基因缺失菌株作为kstD基因的强化表达母体,故在发酵产物中还残留一些副产物,可以通过选择性敲除生成这些杂质的菌株为母体,实现副产物最大限度的清除,进一步提升生产力.
| [1] | 张乐乐, 张显, 邵明龙, 等. 表达3-甾酮-Δ~1-脱氢酶降解植物甾醇合成雄甾-1,4-二烯-3,17-二酮[J]. 生物工程学报, 2015, 11 : 1589–1600. ZHANG L L, ZHANG X, SHAO M L, et al. Overexpressing 3-ketosteroid-Δ1-dehydrogenase for degrading phytosterols into androst-1,4-diene-3,17-dione[J]. Chinese Journal of Biotechnology, 2015, 11 : 1589–1600(Ch). DOI:10.13345/j.cjb.140579(Ch) |
| [2] | 赵丽萍. 分枝杆菌降解植物甾醇生产雄烯二酮的发酵研究[D]. 保定:河北农业大学, 2008. ZHAO L P. Study on Fermentation of Degrading Phytosterol Into and Rostenone by Mycobacterium[D]. Baoding: Hebei Agricultural University, 2008(Ch). http://cn.bing.com/academic/profile?id=24461437f8a3a91c982f12c0a4eab4c6&encoded=0&v=paper_preview&mkt=zh-cn |
| [3] | 张裕卿, 王东青. 植物甾醇微生物转化制备甾体药物中间体的研究进展[J]. 微生物学通报, 2006, 33(2) : 142–146. ZHANG Y Q, WANG D Q. Advances in microbial transformation of phytosterol into steroid medicine intermediates[J]. Microbiology, 2006, 33(2) : 142–146(Ch). DOI:10.3969/j.issn.0253-2654.2006.02.029(Ch) |
| [4] | 张蓓娜. 天然甾醇资源的利用——1.2-甲氧基雌二醇的合成 2.从ADD合成高效皮质激素结构转化关键方法的探索和研究[D]. 上海: 复旦大学, 2006. ZHANG B N. The Utility of Natural Sterols Study—1.Synthesis of 2-methoxyestradiol 2. Study on Some Key Points for Converting ADD to Highly Active Glucocorticoids[D]. Shanghai: Fudan University, 2006(Ch). http://cdmd.cnki.com.cn/Article/CDMD-10246-2007069012.htm |
| [5] | 杨英. 微生物转化植物甾醇制备甾体药物关键中间体研究[D]. 合肥:合肥工业大学, 2009. YANG Y. Study on Bioconversion of Phytosteril into Steroid Medicine Intermediates by Mycobacter[D]. Hefei: Hefei University of Technology, 2009(Ch). http://cn.bing.com/academic/profile?id=468af48d03750bb66328176395082401&encoded=0&v=paper_preview&mkt=zh-cn |
| [6] | 徐阳光. 分枝杆菌降解植物甾醇侧链过程基础研究[D]. 杭州:浙江大学, 2014. XU Y G. Side-chain Cleavage of Phvtosterols by Mycobacterium sp MB 3683[D]. Hangzhou: Zhejiang University, 2014(Ch). http://cn.bing.com/academic/profile?id=007fa4b49a16c7f0b6c97e4a86181535&encoded=0&v=paper_preview&mkt=zh-cn |
| [7] | 车成彬, 刘景春, 吴宝华. 大豆甾醇侧链的生物降解[J]. 哈尔滨理工大学学报, 2002, 7(1) : 93–95. CHE C B, LIU J C, WU B H. Microbial transformation of soybean sterol[J]. Journal of Harbin University of Science and Technology, 2002, 7(1) : 93–95(Ch). DOI:10.3969/j.issn.1007-2683.2002.01.028(Ch) |
| [8] | ARIMA K, NAGASAWA M, BAE M. Microbial transformation of sterols. Part Ⅰ. Decomposition of cholesterol by microorganisms[J]. Agricultural Biological Chemistry, 1969, 33 : 1636. DOI:10.1271/bbb1961.33.1636. |
| [9] | 吴庆安, 吴红卫, 柏挺. 植物油脚中植物甾醇作为甾体药物原料的发展前景[J]. 现代化工, 2015(7) : 4–6. WU Q A, WU H W, BO T. Prospects of phytosterol from vegetable oil residue as raw materials for steroid drugs[J]. Modern Chemical Engineering, 2015(7) : 4–6(Ch). |
| [10] | 张小燕, 阮晖, 何国庆. 微生物降解植物甾醇侧链生产雄甾烯二酮的研究进展[J]. 中国食品学报, 2012, 12(7) : 162–170. ZHANG X Y, RUAN H, HE G Q. Advances in microbial transformation of phytosterols to androstenedione[J]. Journal of Chinese Institute of Food Science and Technology, 2012, 12(7) : 162–170(Ch). DOI:10.3969/j.issn.1009-7848.2012.07.024(Ch) |
| [11] | 姚抗. 分枝杆菌甾醇代谢机制的解析以及其代谢工程改造应用于制备重要甾药中间体的研究[D]. 上海:华东理工大学, 2014. YAO K. Investigation into the Molecular Mechanism of Microbial Sterol Degradation and Its Metabolic Engineering for the Production of Steroid Pharmaceutical[D]. Shanghai: East China University of Science and Technology, 2014(Ch). http://cn.bing.com/academic/profile?id=1165dc787bde2b0ff44a851ece468e7a&encoded=0&v=paper_preview&mkt=zh-cn |
| [12] | 魏巍. Mycobacterium neoaurum NwIB-01降解甾醇母核关键酶3-甾酮-Δ1-脱氢酶和3-甾酮-9α-羟化酶基因的鉴定及其基因工程改造[D]. 上海:华东理工大学, 2010. WEI W. Identifieation and Gene Modification of Key Genes about 3-Ketosteroid-Δ1-dehydrogenase and 3-Ketosteroid-9α-Hydroxylase involved in steroid Nucleus Degradation in Mycobacterium neoaurum NwIB-01 and Strain Development via Genetic Manipulation [D]. Shanghai: East China University of Science and Technology, 2010(Ch). http://cdmd.cnki.com.cn/Article/CDMD-10251-2010138215.htm |
| [13] | XIE R L, SHEN Y B, WANG M, et al. Genetic differences in ksdD influence on the ADD/AD ratio of Mycobacterium neoaurum[J]. Journal of Industrial Microbiology & Biotechnology, 2015, 42(4) : 507–513. DOI:10.1007/s10295-014-1577-2 |
| [14] | 张成刚, 王风清, 魏东芝. 分枝杆菌Mycobacterium Neoaurum NwIB-01 3-甾酮-Δ1-脱氢酶基因的克隆表达[J]. 化学与生物工程, 2011, 7 : 39–43. ZHANG C G, WANG F Q, WEI D Z. The Clone and Expression of 3-Ketosteroid-Δ1-dehydrogenase from Mycobacterium Neoaurum NwIB-01[J]. Chemistry & Bioengineering, 2011, 7 : 39–43(Ch). DOI:10.3969/j.issn.1672-5425.2011.07.009(Ch) |
| [15] | 陈苗苗, 林良才, 魏东芝, 等. 烟曲霉Aspergillus Fumigatus 3-甾酮-Δ1-脱氢酶基因的克隆、异源表达和活性鉴定[J]. 化学与生物工程, 2011, 7 : 29–34. CHEN M M, LIN L C, WEI D Z, et al. Cloning heterologous expression and activity identification of 3-ketosteroid-Δ1-dehydrogenase from Aspergillus Fumigatus[J]. Chemistry & Bioengineering, 2011, 7 : 29–34(Ch). DOI:10.3969/j.issn.1672-5425.2011.07.007(Ch) |
| [16] | 韩冷. 新金色分枝杆菌中AD转化为ADD关键酶KSDD的研究[D]. 无锡:江南大学, 2010. HAN L. Study on the Key Enzyme KSDD in the Bioconversion of AD Into ADD in Mycobacterium Neoaurum [D]. Wuxi: Jiangnan University, 2010(Ch). http://cn.bing.com/academic/profile?id=094e8e1cf7e0edc8642a5dab365fd5a1&encoded=0&v=paper_preview&mkt=zh-cn |
| [17] | 李玉, 田琳, 刘逸寒, 等. 微生物3-甾酮-Δ1-脱氢酶的研究进展[J]. 药物生物技术, 2007, 14(2) : 149–152. LI Y, TIAN L, LIU Y H, et al. The research advances on 3-ketosteroid-Δ1-dehydrogenase of microorganism[J]. Pharmaceutical Biotechnology, 2007, 14(2) : 149–152(Ch). DOI:10.3969/j.issn.1005-8915.2007.02.017(Ch) |
| [18] | WEI W, FAN S Y, WANG F Q, et al. Accumulation of androstadiene-dione by overexpression of heterologous 3-ketosteroid-Δ1-dehydrogenase in Mycobacterium neoaurum NwIB-01[M]. 2014: 1947-1954. |
| [19] | WEI W, FAN S Y, WANG F Q, et al. A new steroid-transforming strain of Mycobacterium neoaurum and cloning of 3-ketosteroid 9a-hydroxylase in NwIB-01[J]. Applied Biochemistry and Biotechnology, 2010, 162(5) : 1446–1456. DOI:10.1007/s12010-010-8919-y |
| [20] | 刘学胜, 贾全栋, 张伟国. 产丁二酸谷氨酸棒状杆菌基因缺失代谢工程菌株的构建[J]. 微生物学通报, 2013, 40(5) : 739–748. LIU X S, JIA Q D, ZHANG W G. Construction a metabolic engineering strain to produce succinic acid from Corynebacterium glutamicum by gene deletion mutation[J]. Microbiology, 2013, 40(5) : 739–748(Ch). |
| [21] | 黄培堂. 分子克隆实验指南精编版[M]. 2008. HUANG P T. The Condensed Protocols from Molecular cloning: A Laboratory Manual[M]. Beijing: Chemical Industry Press, 2008(Ch). |
| [22] | 杨英, 姜绍通, 赵俊平, 等. 微生物转化植物甾醇为雄烯二酮检测方法的建立[J]. 食品与发酵工业, 2008, 11 : 152–155. YANG Y, JIANG S T, ZHAO J P, et al. Method for detecting the transformation of phytosterol to androst-4-ene-3,17-dione with microorganism[J]. Food and Fermentation Industries, 2008, 11 : 152–155(Ch). |
| [23] | YAO K, XU L Q, WANG F Q, et al. Characterization and engineering of 3-ketosteroid-Δ1-dehydrogenase and 3-ketosteroid-9α-hydroxylase in Mycobacterium neoaurum ATCC 25795 to produce 9α-hydroxy-4-androstene-3,17-dione through the catabolism of sterols[J]. Metabolic Engineering, 2014, 24 : 181–191. DOI:10.1016/j.ymben.2014.05.005 |
 2017, Vol. 63
2017, Vol. 63





