文章信息
- 艾书伦, 程巳雪
- AI Shulun, CHENG Sixue
- 钙类纳米粒子基因传递体系研究进展
- Advances in Calcium Based Nanoparticles for Gene Delivery
- 武汉大学学报(理学版), 2017, 63(1): 1-8
- Journal of Wuhan University(Natural Science Edition), 2017, 63(1): 1-8
- http://dx.doi.org/10.14188/j.1671-8836.2017.01.001
-
文章历史
- 收稿日期:2016-09-30

基因治疗是通过核酸治疗剂在细胞内以特定的途径和方式发挥作用、从而达到治疗疾病目的的一种治疗方法.在癌症等重大疑难疾病治疗中,基因治疗一直被寄予厚望.核酸类治疗剂(包括pDNA,siRNA,shRNA,ODN等)必须进入细胞才能发挥功能.然而核酸分子本身很难进入细胞,通常需要与基因载体结合,即通过基因传递体系将其传递到细胞内.基因载体包括病毒载体和非病毒载体两大类.病毒载体具有传递效率高,但潜在的安全问题、可能诱发的免疫原性以及生产成本过高等缺陷极大地限制其应用.非病毒载体主要包括阳离子聚合物[1, 2]、脂质体[3]、多肽[4]、无机纳米粒子[5]以及其复合材料[6],与病毒载体相比安全性好,但转染率较低、作用时间短,部分非病毒载体存在较为明显的毒性,如某些阳离子聚合物所带的正电荷易破坏细胞膜和线粒体膜,导致显著的细胞毒性.因此,研制安全、高效的基因传递体系仍然是基因治疗研究的重点与热点.
在无机纳米粒子非病毒基因载体中,钙类纳米粒子具有优异的生物相容性和生物降解性[5],与其他基因载体相比具有安全性高的显著优势.用于基因传递的钙类纳米粒子源于磷酸钙共沉淀基因转染技术.磷酸钙共沉淀是一种经典的基因转染方法,于1973年提出[5, 7],目前仍然是体外基因转染最常用的方法之一,广泛用于各种细胞包括干细胞的基因传递[8].钙类纳米基因传递体系可通过注射、口服等多种途径给药[9, 10],在基因治疗方面具有广泛的应用.该方法[7]通过将含有氯离子的溶液与含有磷酸根的溶液混合(其一含DNA),带正电的钙离子与DNA链上或溶液中带负电的磷酸根相互作用,形成磷酸钙/DNA(CaP/DNA)共沉淀纳米粒子,然后在内吞作用下被细胞摄入.磷酸钙可以保护DNA免受降解[11],从而达到基因表达的效果.但这种共沉淀法制得的CaP/DNA纳米粒子易聚集,转染效果受实验条件影响大,实验重复性差[9].
为了克服磷酸钙基因转染技术的缺陷,研究人员对磷酸钙基因转染技术进行优化,对磷酸钙载体进行改性,并发展了其他含钙纳米粒子(如碳酸钙)作为基因载体,本文就磷酸钙、碳酸钙等钙类纳米粒子的形貌结构优化、组分调控以及功能化等策略来提高基因传递效率方面的工作进行介绍.
1 钙类纳米粒子基因传递体系的形貌及结构调控 1.1 磷酸钙体系的形貌及结构调控 1.1.1 优化制备条件CaP/DNA纳米粒子的共沉淀制备条件,如钙磷比、无机离子强度、DNA浓度、混合速率、温度、pH、沉淀时间等,是影响其粒子的形貌、结构以及基因传递效率的关键.
Olton等[12]研究发现控制钙磷摩尔比在100~300之间,用注射泵将含CaCl2和质粒DNA(pDNA)的溶液与Na3PO4溶液(其中还含有NaCl、KCl、葡萄糖、缓冲组分)以恒定的速率混合,可将CaP/DNA共沉淀纳米粒子的粒径控制在50 nm以内,且对DNA的包封率能够达到90%,在HeLa等细胞中可获得最优化的转染效率.
Pedraza等[13]将制得的CaP纳米粒子通过0.22 μm的滤膜过滤后,再与DNA复合将DNA分子吸附在表面,得到CaP/DNA纳米粒子.由于过滤步骤能较好地控制粒径,因此能显著提高其在NIH-3T3等细胞中介导基因转染的效率.
除上述方法外,还可以通过层层组装形成多层结构的CaP/DNA纳米粒子.Sokolova等[14]先将含Ca(NO3)2的水溶液与含(NH4)2HPO4的水溶液混合制得CaP纳米颗粒,然后加入到DNA溶液中,得到核为CaP、外层为DNA的纳米粒子,再重复上述两个过程,就可在纳米粒子表面再形成CaP层和DNA层,如此反复,可得到多层结构的CaP/DNA纳米粒子(图1).与共沉淀包封DNA的纳米粒子相比,多层结构的CaP/DNA纳米粒子的基因传递性能有所改善,而且其转染的细胞中钙的含量与标准的磷酸钙转染技术相比显著降低,对细胞的影响更小[15].与CaP/DNA体系类似,多层结构的CaP/siRNA纳米粒子的基因传递效率也比普通的CaP/siRNA纳米粒子的基因传递效率明显提高[16].
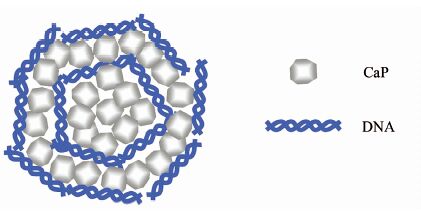
|
| 图 1 多层结构的CaP/DNA纳米粒子基因传递体系 Figure 1 Multi-layered CaP/DNA nanoparticle gene delivery system |
除了在水相中制备,CaP/DNA纳米粒子还可以通过微乳法制备,如Bisht等[17]分别将含CaCl2和pDNA的水溶液以及含Na2HPO4、缓冲组分和pDNA的水溶液分散在含表面活性剂的己烷中,搅拌形成微乳,再将两种微乳混合,得到粒径为30~40 nm的CaP/DNA纳米粒子,随着储存时间的延长,粒径增大,24 h后,粒径约为250 nm.Hou等[18]用微乳法制备的负载反义寡核苷酸(anti ODN)的多孔磷酸钙纳米粒子尺寸在50~70 nm,能保护anti ODN不被核酸酶降解,从而阻止mRNA转录合成蛋白质,在肿瘤治疗方面具有应用前景.
1.1.2 采用固相转染法纳米尺寸的钙盐类基因传递体系在水相中易发生聚集而使粒径变大.固相转染可以克服纳米粒子在水中稳定性差、易聚集的缺点,如:将CaP/DNA包封在聚乙丙交酯纳米颗粒中可使其尺寸稳定、粒径得到较好控制,从而达到较高的转染效率[19].
在固相转染过程中,负载CaP/DNA的固相载体材料对基因传递的效果也有影响,如:将新制备CaP/DNA纳米粒子立即负载到胆酸功能化星形聚乳酸薄膜中,除水后干态的CaP/DNA纳米粒子尺寸不会变化,存放一段时间再用于基因传递依然有良好的基因传递效果.与普通的线形聚乳酸相比,胆酸功能化星形聚乳酸在特定分子量范围内(Mw<10 000)具有表面降解机理、降解速率快,因此适合作为基因传递纳米粒子的固相载体,其介导固相基因转染的效率在同等条件下远高于线形聚乳酸[20, 21].
1.2 碳酸钙体系的形貌及结构调控碳酸钙是近年来新兴的一种无机纳米粒子基因载体.碳酸钙基因传递纳米粒子CaCO3/DNA[22]是在钙离子大大过量的条件下,将含有钙离子、DNA的水溶液和含碳酸根离子的水溶液混合,通过共沉淀方法制备得到.制备方法简便、重现性好,且不需要加入缓冲溶液控制pH值,得到的纳米粒子转染效率较高,可以同时有效包封基因和化疗药物进行共传递[23].由于这些优点,碳酸钙在基因传递领域受到了越来越多的关注.
另外,Zhao等[24]研究发现碳酸根溶液中加入少量磷酸根,即将碳酸钙和磷酸钙这两种组分同时引入共沉淀体系,得到的CaCO3/CaP/DNA纳米粒子与CaCO3/DNA或CaP/DNA纳米粒子相比转染效率明显提高,这是由于少量CaP组分的存在能防止纳米粒子中的无机组分结晶、抑制纳米粒子聚集,从而提高细胞摄入和基因传递效率.
2 多组分含钙杂化纳米粒子基因传递体系及其功能化虽然通过优化制备条件可以调控钙盐类基因传递纳米粒子(CaP/DNA,CaCO3/DNA)的粒径和结构,但所得到的纳米粒子在制备后需要立即用于基因传递才能获得良好的基因传递效果.这是因为钙盐类基因传递纳米粒子的稳定性欠佳,在溶液中易发生结构变化(如结晶、微晶变成大晶体)、粒径增大、聚集等,导致细胞摄取不足,基因传递效率降低.
在CaP,CaCO3类钙盐纳米粒子介导的基因传递过程中,钙盐/核酸纳米粒子通过内吞方式进入靶细胞后,在内涵体/溶酶体中的酸性环境中钙盐的溶解度增大,释放出离子,促使载体/DNA复合物及游离DNA从内涵体/溶酶体中逃逸出来,但部分DNA仍有可能在内涵体/溶酶体中被降解;而逃逸出来进入细胞质中的载体/DNA复合物及DNA又有一部分可能被酶降解,其余的载体/DNA复合物或DNA则进入细胞核,表达出相应的蛋白[5].因此,为了更有效地调控基因传递纳米粒子的粒径,在传递过程中更有效地保护DNA,可在纳米粒子中引入其他组分,如高分子、脂质、小分子化合物等,构建多组分含钙纳米粒子基因传递体系,以提高基因传递效率.
2.1 含高分子的钙类杂化纳米粒子基因传递体系在含钙的基因传递体系中引入高分子是提高其稳定性和基因传递效率的一种重要方法.其中,含聚乙二醇(PEG)链段的聚合物是一类常见改性高分子.例如,在磷酸钙共沉淀体系中引入聚乙二醇-聚天冬氨酸(PEG-PAA)嵌段共聚物[25~27]、聚乙二醇-聚甲基丙烯酸嵌段共聚物(PEG-PMA)[28]形成以CaP、聚阴离子链段、核酸为核,PEG链段为外层的基因传递纳米粒子(图2).这些体系中由于分子间的静电作用力,钙离子和带负电的水溶性高分子共沉淀时能较好地结合在纳米粒子中,形成较稳定的杂化纳米粒子.嵌段共聚物的引入能更好地控制粒径,提高纳米粒子的稳定性和对核酸类治疗剂包括pDNA,siRNA,ODN的传递效果.
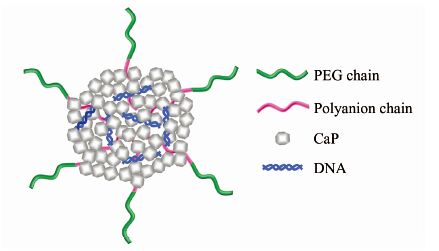
|
| 图 2 嵌段共聚物(含PEG链段和带负电的链段)修饰的CaP/DNA基因传递纳米粒子 Figure 2 CaP/DNA nanoparticle gene delivery system decorated by a copolymer with a PEG block and a negatively charged block |
此外,含聚乙二醇链段和聚氧丙烯醚链段的嵌段共聚物Pluronic F-127也可以用于修饰磷酸钙,得到的纳米粒子结合siRNA的能力强,基因传递效率明显提高[29].
Pittella等[30, 31]将聚乙二醇和同时含亚氨基和羧基的pH敏感聚合物(CPP)的嵌段共聚物(PEG-CCP)引入CaP基因传递体系,PEG-CCP在酸性的内涵体/溶酶体中降解、由带负电变为带正电,使得内涵体膜不稳定,利于内涵体逃逸.用该体系负载VEGF siRNA,可有效实现基因沉默,从而抑制肿瘤生长.
Giger等[32]将PEG-胺丁羟磷酸盐或PEG-五磷酸肌醇包封在磷酸钙纳米粒子中,其稳定性得到提高,通过内吞作用进入细胞后,内涵体的酸性环境促使siRNA释放,可有效下调Bcl-2蛋白的表达.
Xie等[33]发现PEG接枝羧甲基壳聚糖(PEG-CMCS)和磷酸钙杂化得到的纳米粒子具有很好的siRNA负载性能和良好的血清稳定性.PEG-CMCS的加入能够显著提高基因沉默效果,负载hTERT siRNA的纳米粒子在裸鼠体内表现出良好的HepG2移植瘤抑制效果.
除了含PEG链段的高分子外,天然高分子及其衍生物对钙盐类基因传递体系也有良好的改性效果.如:Zhao等[34]将水溶性天然高分子海藻酸钠加入到碳酸钠溶液中,与含CaCl2,DNA的溶液混合共沉淀,得到海藻酸/CaCO3/DNA杂化纳米粒子.海藻酸分子链上的羧基与钙离子结合,能够有效防止碳酸钙结晶,从而控制纳米粒子的粒径,同时,海藻酸形成亲水性外层使杂化粒子呈现较强的稳定性,能有效提高碳酸钙体系对荧光素酶和荧光蛋白报告基因的表达.该体系还可以用于基因和药物的共传递(图3),同时负载p53质粒和阿霉素的纳米粒子能有效抑制肿瘤细胞的生长[35].其他用于改性钙盐类基因传递体系的天然高分子还有壳聚糖及其衍生物等[36, 37].
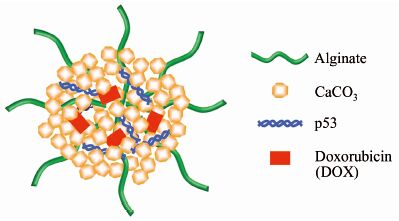
|
| 图 3 天然高分子海藻酸修饰的CaCO3/p53/DOX基因与药物共传递纳米粒子 Figure 3 Natural polymer (alginate) decorated CaCO3/p53/DOX nanoparticle gene and drug co-delivery system |
除上述钙盐/高分子杂化基因传递体系,也有高分子/钙离子复合基因传递体系的研究报道[38, 39],如含2-甲基丙烯酰氧基乙基磷酰胆碱(MPC)单元的均聚物和共聚物的高分子链上的磷酸根可与钙离子形成复合体系,负载并传递siRNA,达到良好的基因沉默效果[38].
2.2 含脂质的钙类杂化纳米粒子基因传递体系脂质也是一类用以提高钙类基因载体稳定性和基因传递效率的常用改性剂.如,Li等[40, 41]通过微乳法制备CaP/siRNA纳米粒子,在其表面修饰上含二油酰基-丙基-三甲胺(DOTAP)和胆固醇的脂质外层,可以方便地引入靶向基团,在体系中加入键接了茴香酰胺靶向基团的PEG化磷脂衍生物就可以在纳米粒子表面引入靶向基团,达到靶向传递的效果.Zhang等[42]利用表面修饰了脂质的CaP纳米粒子共传递siRNA和化疗药物吉西他滨,在动物实验和体外细胞实验中均获得良好的肿瘤抑制效果.
另外,也有不含磷酸根的钙离子/脂质复合基因传递体系如DOPG/DOPE-Ca2+-pDNA复合纳米粒子的相关报道[43].
2.3 含其他小分子组分的钙类杂化纳米粒子基因传递体系小分子组分也可以用于钙类纳米基因传递体系的改性,如:Chowdhury等[44]在钙盐基因传递纳米粒子的制备过程中添加氟和锡离子可使纳米粒子在酸性条件下加速溶解、快速释放出DNA,从而显著提高基因的表达.Mostaghaci等[45]用偶联剂N-(2-氨乙基)-3-氨丙基三甲氧基硅烷改性CaP纳米粒子,可提高纳米粒子稳定性,得到粒径分布更窄的改性CaP纳米粒子,提高对DNA的包封率和传递效率.Yang等[46]用磷酸氯喹替代普通的磷酸盐,将与CaCl2通过共沉淀制备负载DNA的纳米粒子包封在PLGA纳米粒子中,得到复合纳米基因传递体系.由于磷酸氯喹利于内涵体逃逸,故其体内体外均有良好的基因传递效果.也有研究发现在CaP/DNA纳米粒子制备时加入柠檬酸盐可以更好地控制粒径,从而提高转染效率[47].
2.4 含生物活性组分的钙类杂化纳米粒子基因传递体系通过加入具有穿膜、靶向、核定位等功能的生物活性组分提高基因传递效率近年来成为备受关注的改性方法.
KALA是一种具有穿膜、增强内涵体逃逸功能的阳离子细胞穿透肽,将其引入CaCO3体系,组装得到多肽功能化基因与药物共传递纳米粒子可用于p53质粒和阿霉素的共传递[48].KALA组分的存在能明显增加纳米粒子的细胞摄取,从而提高基因传递效率,更有效地抑制肿瘤细胞生长.与常规的溶液相转染类似,将KALA加入CaP体系得到的纳米粒子负载在高分子膜上用于固相转染,也能明显提高固相转染的效率[49].鱼精蛋白是一种富含精氨酸序列、带正电的生物相容性生物大分子,具有增强细胞摄取、提高核转运的功能.在CaCO3基因传递体系中引入鱼精蛋白也可以明显提高基因传递效率[50].而在CaCO3基因传递体系中同时引入鱼精蛋白和KALA制备的双多肽功能化基因传递体系(图4)与单多肽功能化体系相比转染效率进一步提高,可以在与远低于常规体外转染用DNA浓度的条件下获得良好的基因表达效果[51].
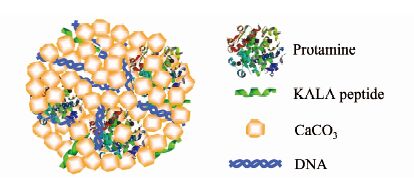
|
| 图 4 多肽双功能化的CaCO3/DNA基因传递纳米粒子 Figure 4 Dual peptide functionalized CaCO3/DNA nanoparticle gene delivery system |
为了实现组织、细胞靶向传递,将靶向组分引入钙类基因载体是一种重要的功能化策略.例如,Liang等[52]将靶向组分生物素化肝素在共沉淀时加入CaCO3/CaP体系,通过自组装共沉淀可制备高分子/无机杂化纳米粒子,用于基因与药物的共传递.由于生物素对肿瘤细胞的靶向作用,纳米粒子的肿瘤细胞摄取明显提高,对肿瘤细胞的抑制作用也相应增强.
Qiu等[53]在CaP/siRNA纳米粒子表面修饰亲水性阿仑膦酸钠-透明质酸接枝共聚物制备了肿瘤靶向传递体系(图5),不仅大大提高了物理稳定性,还可以在肿瘤细胞的CD44受体介导作用下,实现siRNA的靶向传递,抑制肿瘤生长.
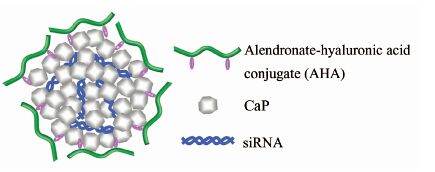
|
| 图 5 肿瘤靶向CaP-AHA/siRNA基因传递纳米粒子 Figure 5 CaP-AHA/siRNA nanoparticle gene delivery system for tumor targeting delivery |
Jebali等[54]在PEG修饰的CaP纳米粒子表面通过碳二亚胺(EDC)偶合键接脂质二油酰磷脂酰乙醇胺(DOPE)和Anti-E6抗体.由于Anti-E6抗体对宫颈癌细胞具有靶向作用,该纳米粒子的细胞摄取得到显著提高,而由于DOPE有利于溶酶体逃逸,故该纳米粒子对反义寡核苷酸具有良好的传递效果.Hu等[55]将DNA和线性或单环CR8C(Cys-(Arg)8-Cys)多肽复合负载到表面带有半乳糖靶向基团及PEG链段的脂质体涂覆的CaP纳米粒子中.由于半乳糖基团的肝靶向作用,纳米粒子主要被肝细胞摄取,而多肽的存在能够有效提高核转运和质粒DNA的表达.与线性CR8C相比,单环CR8C对基因传递效率的提高效果更为明显.
此外,将靶向基团引入钙类纳米基因传递体系的方法还有通过生物素-亲和素作用引入含靶向基团的生物素化融合肽[56]、在CaP表面涂覆SiO2后再键接靶向抗体[57]等.
2 总结与展望综合上述,目前已有多种优化制备纳米磷酸钙、碳酸钙纳米粒子基因传递体系的方法以及多种功能化改性方法.笔者认为,该领域未来的研究将集中在:1) 进一步研究钙类纳米粒子的功能化,赋予其多种功能,使基因传递体系能更有效地克服各种细胞外及细胞内传递屏障;2) 针对各类不同的核酸治疗剂、特别是随着生物医学等相关学科的发展而不断出现的新型核酸治疗剂(如CRISPR/Cas9基因编辑系统),优化钙类纳米粒子传递体系的结构和性能;3) 针对不同的传递目标,根据病变的性质和程度,调控基因在特定组织、器官、细胞内的传递,以达到最优的治疗效果.
在对钙类纳米粒子进行各种功能化的同时,我们应特别重视保持钙类纳米粒子优异的生物相容性和生物降解性,注意避免因功能化而引入生物相容性不够理想、不能生物降解的组分.当然,由于基因传递是涉及生物、医学、化学、材料等多学科的交叉领域,各学科研究者的共同合作显得尤为重要,只有加强不同学科的交流合作,才能使这一领域的研究不断深入,实现该纳米材料在医学等领域的实际应用.
| [1] | GUO X, HUANG L. Recent advances in nonviral vectors for gene delivery[J]. Accounts of Chemical Research, 2012, 45(7) : 971–979. DOI:10.1021/ar200151m |
| [2] | HUANG Y, DING X, QI Y, et al. Reduction-responsive multifunctional hyperbranched polyaminoglycosides with excellent antibacterial activity, biocompatibility and gene transfection capability[J]. Biomaterials, 2016, 106 : 134–143. DOI:10.1016/j.biomaterials.2016.08.025 |
| [3] | JIANG Q, YUE D, NIE Y, et al. Specially-made lipid-based assemblies for improving transmembrane gene delivery: comparison of basic amino acid residue rich periphery[J]. Molecular Pharmaceutics, 2016, 13(6) : 1809–1821. DOI:10.1021/acs.molpharmaceut.5b00967 |
| [4] | LEI Q, YANG J, CHEN S, et al. Fabrication of novel reduction-sensitive gene vectors based on three-armed peptides[J]. Macromolecular Bioscience, 2014, 14(4) : 546–556. DOI:10.1002/mabi.201300422 |
| [5] | SOKOLOVA V, EPPLE M. Inorganic nanoparticles as carriers of nucleic acids into cells[J]. Angewandte Chemie International Edition, 2008, 47(8) : 1382–1395. DOI:10.1002/anie.200703039 |
| [6] | REZAEE M, OSKUEE R K, NASSIRLI H, et al. Progress in the development of lipopolyplexes as efficient non-viral gene delivery systems[J]. Journal of Controlled Release, 2016, 236 : 1–14. DOI:10.1016/j.jconrel.2016.06.023 |
| [7] | GRAHAMF L, VAN DER EB A J. A new technique for the assay of infectivity of human adenovirus 5 DNA[J]. Virology, 1973, 52(2) : 456–467. DOI:10.1016/0042-6822(73)90341-3 |
| [8] | CAO X, DENG W, QU R, et al. Non-viral co-delivery of the four Yamanaka factors for generation of human induced pluripotent stem cells via calcium phosphate nanocomposite particles[J]. Advanced Functional Materials, 2013, 23(43) : 5403–5411. DOI:10.1002/adfm.201203646 |
| [9] | MAITRA A. Calcium phosphate nanoparticles: Second-generation nonviral vectors in gene therapy[J]. Expert Review of Molecular Diagnostics, 2005, 5(6) : 893–905. DOI:10.1586/14737159.5.6.893 |
| [10] | WANG Y, YAMAMOTO Y, SHIGEMORI S, et al. Inhibitory/suppressive oligodeoxynucleotide nanocapsules as simple oral delivery devices for preventing atopic dermatitis in mice[J]. Molecular Therapy, 2015, 23(2) : 297–309. DOI:10.1038/mt.2014.239 |
| [11] | BERTRAN O, REVILLA-LPEZ G, CASANOVAS J, et al. Dissolving hydroxyolite: A DNA molecule into its hydroxyapatite mold[J]. Chemistry-A European Journal, 2016, 22(19) : 6631–6636. DOI:10.1002/chem.201600703 |
| [12] | OLTON D, LI J, WILSON M E, et al. Nanostructured calcium phosphates (NanoCaPs) for non-viral gene delivery: Influence of the synthesis parameters on transfection efficiency[J]. Biomaterials, 2007, 28(6) : 1267–1279. DOI:10.1016/j.biomaterials.2006.10.026 |
| [13] | PEDRAZA C E, BASSETT D C, MCKEE M D, et al. The importance of particle size and DNA condensation salt for calcium phosphate nanoparticle transfection[J]. Biomaterials, 2008, 29(23) : 3384–3392. DOI:10.1016/j.biomaterials.2008.04.043 |
| [14] | SOKOLOVA V V, RADTKE I, HEUMANN R, et al. Effective transfection of cells with multi-shell calcium phosphate-DNA nanoparticles[J]. Biomaterials, 2006, 27(16) : 3147–3153. DOI:10.1016/j.biomaterials.2005.12.030 |
| [15] | NEUMANN S, KOVTUN A, DIETZEL I D, et al. The use of size-defined DNA-functionalized calcium phosphate nanoparticles tominimise intracellular calcium disturbance during transfection[J]. Biomaterials, 2009, 30(35) : 6794–6802. DOI:10.1016/j.biomaterials.2009.08.043 |
| [16] | SOKOLOVA V, KOVTUN A, PRYMAK O, et al. Functionalisation of calcium phosphate nanoparticles by oligonucleotides and their application for gene silencing[J]. Journal of Materials Chemistry, 2006, 17(8) : 721–727. DOI:10.1039/b612699e |
| [17] | BISHT S, BHAKTA G, MITRA S, et al. pDNA loaded calcium phosphate nanoparticles: Highly efficient non-viral vector for gene delivery[J]. International Journal of Pharmaceutics, 2005, 288(1) : 157–168. DOI:10.1016/j.ijpharm.2004.07.035 |
| [18] | HOU S, MA H, JI Y, et al. A calcium phosphate nanoparticle-based biocarrier for efficient cellular delivery of antisense oligodeoxynucleotides[J]. ACS Applied Materials & Interfaces, 2013, 5(3) : 1131–1136. DOI:10.1021/am3028926 |
| [19] | JIE T, CHEN J Y, JING L, et al. Calcium phosphate embedded PLGA nanoparticles: A promising gene delivery vector with high gene loading and transfection efficiency[J]. International Journal of Pharmaceutics, 2012, 431(1-2) : 210–221. DOI:10.1016/j.ijpharm.2012.04.046 |
| [20] | ZHANG Q, ZHAO D, ZHANG X Z, et al. Calcium phosphate/DNA co-precipitates encapsulated fast degrading polymer films for substrate-mediated gene delivery[J]. Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2009, 91B(1) : 172–180. DOI:10.1002/jbm.b.31387 |
| [21] | LI Y Q, LI F, ZHANG X Z, et al. Three dimensional fast degrading polymer films for delivery of calcium phosphate/DNA co-precipitates in solid-phase transfection[J]. Journal of Materials Chemistry, 2009, 19(37) : 6733–6739. DOI:10.1039/B906003K |
| [22] | CHEN S, LI F, ZHUO R X, et al. Efficient non-viral gene delivery mediated by nanostructured calcium carbonate in solution-based transfection and solid-phase transfection[J]. Molecular Biosystems, 2011, 7(10) : 2841–2847. DOI:10.1039/c1mb05147d |
| [23] | CHEN S, ZHAO D, LI F, et al. Co-delivery of genes and drugs with nanostructured calcium carbonate for cancer therapy[J]. RSC Advances, 2012, 2(5) : 1820–1826. DOI:10.1039/c1ra00527h |
| [24] | ZHAO D, WANG C Q, ZHUO R X, et al. Modification of nanostructured calcium carbonate for efficient gene delivery[J]. Colloids & Surfaces B Biointerfaces, 2014, 118 : 111–116. DOI:10.1016/j.colsurfb.2014.03.007 |
| [25] | KAKIZAWA Y, KATAOKA K. Block copolymer self-assembly intomonodispersive nanoparticles with hybrid core of antisense DNA and calcium phosphate[J]. Langmuir, 2002, 18(12) : 4539–4543. DOI:10.1021/la011736s |
| [26] | KAKIZAWA Y, MIYATA K, FURUKAWA S, et al. Size-controlled formation of a calcium phosphate-based organic-inorganic hybrid vector for gene delivery using poly(ethylene glycol)-block-poly(aspartic acid)[J]. Advanced Materials, 2004, 16(8) : 699–702. DOI:10.1002/adma.200305782 |
| [27] | KAKIZAWA Y, FURUKAWA S, KATAOKA K. Block copolymer-coated calcium phosphate nanoparticles sensing intracellular environment foroligodeoxynucleotide and siRNA delivery[J]. Journal of Controlled Release, 2004, 97(2) : 345–356. DOI:10.1016/j.jconrel.2004.03.031 |
| [28] | KAKIZAWA Y, FURUKAWA S, ISHII A, et al. Organic-inorganic hybrid-nanocarrier of siRNA constructing through the self-assembly of calcium phosphate and PEG-based block aniomer[J]. Journal of Controlled Release, 2006, 111(3) : 368–370. DOI:10.1016/j.jconrel.2006.01.004 |
| [29] | QIN L, SUN Y, LIU P, et al. F127/Calcium phosphate hybrid nanoparticles: a promising vector for improving siRNA delivery and gene silencing[J]. Journal of Biomaterials Science Polymer Edition, 2013, 24(15) : 1757–1766. DOI:10.1080/09205063.2013.801702 |
| [30] | PITTELLA F, MIYATA K, MAEDA Y, et al. Pancreatic cancer therapy by systemic administration of VEGFsiRNA contained in calcium phosphate/charge-conversional polymer hybrid nanoparticles[J]. Journal of Controlled Release, 2012, 161(3) : 868–874. DOI:10.1016/j.jconrel.2012.05.005 |
| [31] | PITTELLA F, ZHANG M, YAN L, et al. Enhanced endosomal escape of siRNA-incorporating hybrid nanoparticles from calcium phosphate and PEG-block charge-conversional polymer for efficient gene knockdown with negligible cytotoxicity[J]. Biomaterials, 2011, 32(11) : 3106–3114. DOI:10.1016/j.biomaterials.2010.12.057 |
| [32] | GIGER E V, CASTAGNER B, RIKKNEN J, et al. siRNA Transfection with calcium phosphate nanoparticles stabilized with pegylated chelators[J]. Advanced Healthcare Materials, 2013, 2(1) : 134–144. DOI:10.1002/adhm.201200088 |
| [33] | XIE Y, QIAO H, SU Z, et al. PEGylated carboxymethyl chitosan/calcium phosphate hybrid anionic nanoparticles mediated hTERT siRNA delivery for anticancer therapy[J]. Biomaterials, 2014, 35(27) : 7978–7991. DOI:10.1016/j.biomaterials.2014.05.068 |
| [34] | ZHAO D, ZHUO R X, CHENG S X. Alginate modified nanostructured calcium carbonate with enhanced delivery efficiency for gene and drug delivery[J]. Molecular Biosystems, 2011, 8(3) : 753–759. DOI:10.1039/c1mb05337j |
| [35] | ZHAO D, LIU C J, ZHUO R X, et al. Alginate/CaCO3 hybrid nanoparticles for efficient codelivery of antitumor gene and drug[J]. Molecular Pharmaceutics, 2012, 9(10) : 2887–2893. DOI:10.1021/mp3002123 |
| [36] | WANG J W, CHEN C Y, KUO Y M. Preparation and characterization of chitosan-coated hydroxyapatite nanoparticles as a promising non-viral vector for gene delivery[J]. Journal of Applied Polymer Science, 2011, 121(6) : 3531–3540. DOI:10.1002/app.34140 |
| [37] | CHOI B, CUI Z K, KIM S, et al. Glutamine-chitosan modified calcium phosphate nanoparticles for efficient siRNA delivery and osteogenic differentiation[J]. Journal of Materials Chemistry B, 2015, 3(31) : 6448–6455. DOI:10.1039/c5tb00843c |
| [38] | AHMED M, ISHIHARA K, NARAIN R. Calcium mediated formation of phosphorylcholine-based polyplexes for efficient knockdown of epidermal growth factor receptors (EGFR) in HeLa cells[J]. Chemical Communications, 2014, 50(22) : 2943–2946. DOI:10.1039/c4cc00181h |
| [39] | WU S Y, CHANG L T, PENG S, et al. Calcium-activated gene transfection from DNA/poly(amic acid-co-imide) complexes[J]. International Journal of Nanomedicine, 2015, 10 : 1637–1647. DOI:10.2147/IJN.S76502 |
| [40] | LI J, CHEN Y C, TSENG Y C, et al. Biodegradable calcium phosphate nanoparticle with lipid coating for systemic siRNA delivery[J]. Journal of Controlled Release, 2010, 142(3) : 416–421. DOI:10.1016/j.jconrel.2009.11.008 |
| [41] | LI J, YANG Y, HUANG L. Calcium phosphate nanoparticles with an asymmetric lipid bilayer coating forsiRNA delivery to the tumor[J]. Journal of Controlled Release, 2012, 158(1) : 108–114. DOI:10.1016/j.jconrel.2011.10.020 |
| [42] | ZHANG Y, PENG L, MUMPER R J, et al. Combinational delivery of c-myc siRNA and nucleoside analogs in a single, synthetic nanocarrier for targeted cancer therapy[J]. Biomaterials, 2013, 34(33) : 8459–8468. DOI:10.1016/j.biomaterials.2013.07.050 |
| [43] | BARRNBERDN A L, YLAMOS B, MALFOIS M, et al. Ca2+-mediated anionic lipid-plasmid DNA lipoplexes. Electrochemical, structural, and biochemical studies[J]. Langmuir, 2014, 30(39) : 11704–11713. DOI:10.1021/la502823z |
| [44] | CHOWDHURY E H, MARUYAMA A, KANO A, et al. pH-sensing nano-crystals of carbonate apatite: Effects on intracellular delivery and release of DNA for efficient expression into mammalian cells[J]. Gene, 2006, 376(1) : 87–94. DOI:10.1016/j.gene.2006.02.028 |
| [45] | MOSTAGHACI B, LORETZ B, HABERKORN R, et al. One-step synthesis of nanosized and stable amino-functionalized calcium phosphate particles for DNA transfection[J]. Chemistry of Materials, 2013, 25(18) : 3667–3671. DOI:10.1021/cm401886u |
| [46] | YANG C L, HU T T, CAO H, et al. Facile construction of chloroquine containing PLGA-based pDNA delivery system for efficient tumor and pancreatitis targeting in vitro and in vivo[J]. Molecular Pharmaceutics, 2015, 12(6) : 2167–2179. DOI:10.1021/acs.molpharmaceut.5b00155 |
| [47] | KHAN M A, WU V M, GHOSH S, et al. Gene delivery using calcium phosphate nanoparticles: Optimization of the transfection process and the effects of citrate and poly(l-lysine) as additives[J]. Journal of Colloid & Interface Science, 2016, 471 : 48–58. DOI:10.1016/j.jcis.2016.03.007 |
| [48] | ZHAO D, ZHUO R X, CHENG S X. Modification of calcium carbonate based gene and drug delivery systems by a cell-penetrating peptide[J]. Molecular Biosystems, 2012, 8(12) : 3288–3294. DOI:10.1039/c2mb25233c |
| [49] | SI C, ZHUO R X, CHENG S X. Enhanced gene transfection with addition of a cell-penetrating peptide in substrate-mediated gene delivery[J]. Journal of Gene Medicine, 2010, 12(8) : 705–713. DOI:10.1002/jgm.1488 |
| [50] | WANG C Q, WU J L, ZHUO R X, et al. Protamine sulfate-calcium carbonate-plasmid DNA ternary nanoparticles for efficient gene delivery[J]. Molecular Biosystems, 2014, 10(3) : 672–678. DOI:10.1039/c3mb70502a |
| [51] | WANG C Q, GONG M Q, WU J L, et al. Dual-functionalized calcium carbonate based gene delivery system for efficient gene delivery[J]. RSC Advances, 2014, 4(73) : 38623–38629. DOI:10.1039/c4ra05468g |
| [52] | LIANG P, WANG C Q, CHEN H, et al. Multi-functional heparin-biotin/heparin/calcium carbonate/calcium phosphate nanoparticles for targeting co-delivery of gene and drug[J]. Polymer International, 2014, 64(5) : 647–653. DOI:10.1002/pi.4824 |
| [53] | QIU C, WEI W, SUN J, et al. Systemic delivery of siRNA by hyaluronan-functionalized calcium phosphate nanoparticles for tumor-targeted therapy[J]. Nanos-cale, 2016, 8(26) : 13033–13044. DOI:10.1039/c6nr04034a |
| [54] | JEBALI A, KALANTAR S M, HEKMATIMOGHADDAM S, et al. Surface modification of tri-calcium phosphate nanoparticles by DOPE and/or anti-E6 antibody to enhance uptake of antisense of E6 mRNA[J]. Colloids & Surfaces B Biointerfaces, 2015, 126 : 297–302. DOI:10.1016/j.colsurfb.2014.12.040 |
| [55] | HU Y, HAYNES M T, WANG Y, et al. A highly efficient synthetic vector:Non-hydrodynamic delivery of DNA to hepatocyte nuclei in vivo[J]. ACS Nano, 2013, 7(6) : 5376–5384. DOI:10.1021/nn4012384 |
| [56] | 吴聪, 王超群, 程巳雪. 用于基因传递的多肽功能化天然高分子/碳酸钙杂化纳米粒子的制备[J]. 武汉大学学报(理学版), 2016, 62(4) : 320–324. WU C, WANG C Q, CHENG S X. Peptide functionalized natural polymer/calcium carbonate hybrid nanoparticles for gene delivery[J]. Wuhan University Journal of Natural Sciences, 2016, 62(4) : 320–324(Ch). DOI:10.14188/j.1671-8836.2016.04.003(Ch) |
| [57] | KOZLOVA D, CHERNOUSOVA S, KNUSCHKE T, et al. Cell targeting by antibody-functionalized calcium phosphate nanoparticles[J]. Journal of Materials Chemistry, 2012, 22(2) : 396–404. DOI:10.1039/c1jm14683a |
 2017, Vol. 63
2017, Vol. 63





