文章信息
- 樊李红, 曹敏驰, 童骏, 易嘉琰, 温辉高, 聂敏
- FAN Lihong, CAO Minchi, TONG Jun, YI Jiayan, WEN Huigao, NIE Min
- 羟丁基壳聚糖/氧化石墨烯复合水凝胶的制备及其性能
- Preparation and Performance of Hydroxybutyl Chitosan/Graphene Oxide Composite Hydrogel
- 武汉大学学报(理学版), 2017, 63(3): 234-240
- Journal of Wuhan University(Natural Science Edition), 2017, 63(3): 234-240
- http://dx.doi.org/10.14188/j.1671-8836.2017.03.007
-
文章历史
- 收稿日期:2016-11-24

2. 武汉理工大学 材料 科学与工程学院,湖北 武汉 430070;
3. 武汉大学 口腔医院,湖北 武汉 430079
2. School of Materials Science and Engineering, Wuhan University of Technology, Wuhan 430070, Hubei, China;
3. Hospital of Stomatology, Wuhan University, Wuhan 430079, Hubei, China
壳聚糖(chitosan,CS)是一种天然阳离子多糖,具有良好的生物相容性、生物可降解性、抗菌性等特点,广泛应用于生物医药、组织工程、化妆品、食品、化工等诸多领域[1].由于壳聚糖分子链上分布着许多氨基和羟基,能够形成分子内和分子间氢键,故其只在弱酸中溶解[2].因此,将壳聚糖进行改性,引入新的活性基团,在改善壳聚糖水溶性的同时赋予其新的性能,已成为近年来壳聚糖的研究热点之一.
近年来,羟丁基壳聚糖(hydroxybuyl chitosan, HBC)已进入许多研究者的视野.作为一种新型壳聚糖衍生物,它具有良好的水溶性,其水溶液在一定温度下可自发交联形成温敏性水凝胶,避免了化学交联剂的残留,已被运用于防止术后黏连、细胞3D培养、组织工程材料、药物载体等方面[3],然而,其在牙周组织修复方面的研究鲜有报道.但羟丁基壳聚糖水凝胶机械性能和稳定性较差,大大限制了其应用范围.将纳米粒子与水凝胶复合制备复合水凝胶是一种增强水凝胶机械性能和稳定性的有效方法.氧化石墨烯(graphene oxide, GO)具有良好的力学性能、热性能和生物相容性,在其表面含有大量羧基、羟基等含氧基团,能稳定分散在水中,可用来提升水凝胶的力学性能和稳定性[4].
本文以壳聚糖为原料,1,2-环氧丁烷为醚化剂,制备羟丁基壳聚糖,然后将氧化石墨烯加入羟丁基壳聚糖中制备羟丁基壳聚糖/氧化石墨烯复合水凝胶,以期获得具有促进牙周组织修复的水凝胶材料,并采用红外、扫描电镜和流变仪考察不同氧化石墨烯加入量对水凝胶结构及性能的影响,同时通过牙周膜成纤维细胞的细胞增殖和凋亡实验考察了复合水凝胶的生物学性能.
1 实验部分 1.1 主要材料及仪器材料:纳米石墨粉(阿拉丁试剂);壳聚糖(CS,脱乙酰度92%,浙江金壳药业有限公司);1,2-环氧丁烷(分析纯,东京化成工业株式会社);第三代牙周膜成纤维细胞(PDLCs)取自武汉大学口腔医院;实验用水为去离子水,其他试剂均为分析纯.
仪器:VEGA 3型扫描电子显微镜(SEM, TESCAN公司);170SX型傅立叶变换红外光谱仪(FT-IR, Nicolet公司);INVIN型激光拉曼光谱仪(RENIS HAW公司);DNM-9602型酶标仪(北京普拉公司);JEM-2100F型透射电子显微镜(TEM, JOEL公司);MoFlo-XDP型流式细胞仪(Beckman公司);AR2000型流变仪(TA公司);Eclipse TE300型倒置显微镜(Nikon公司)等.
1.2 实验方法 1.2.1 羟丁基壳聚糖的制备羟丁基壳聚糖的制备参照文献[3]并进行了一定改进.
碱化:10 g NaOH加入10 mL蒸馏水中,待冷却后加入10 g壳聚糖,充分搅拌后放入-20 ℃冰箱冷冻过夜.
羟丁基化:取上述碱化壳聚糖30 g,置于干燥的圆底烧瓶中,加入100 mL异丙醇和100 mL蒸馏水,常温下充分搅拌6 h,加入一定量十二烷基硫酸钠(SDS),逐滴滴加200 mL的环氧丁烷,升温至60 ℃,搅拌反应12 h,待反应结束后调节产物pH至中性,透析3 d,离心取上清液,冷冻干燥后即得羟丁基壳聚糖(图 1).
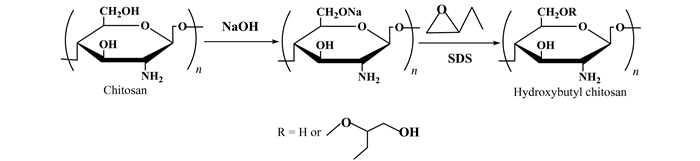
|
| 图 1 羟丁基壳聚糖的制备 Figure 1 The synthesis of Hydroxybutyl Chitosan |
预氧化:室温下,先将20 mL浓硫酸加入三口烧瓶中,后依次加入2 g石墨粉,1 g K2S2O8,1 g P2O5,升温至80 ℃,磁力搅拌反应6 h,缓慢降至室温,产物过滤、洗涤、烘干备用.
氧化:在冰水浴中,将2 g预氧化石墨粉缓慢加入100 mL浓硫酸中,随后,分批缓慢加入6 g高锰酸钾,控制反应温度低于15 ℃,搅拌反应30 min,后升温至35 ℃反应6 h,迅速加入500 mL蒸馏水搅拌均匀,逐滴加入30%H2O2直至溶液变为亮黄色且无气泡产生,趁热过滤,洗涤,直至滤液呈中性,纯化后得到氧化石墨烯.
1.2.3 羟丁基壳聚糖/氧化石墨烯水凝胶的制备分别称取0,10,30,50 mg氧化石墨烯,置于15 mL离心管中,加入10 mL蒸馏水,摇晃均匀,超声,得0,1,3,5 g/L的氧化石墨烯分散液.
称取一定量的羟丁基壳聚糖,加入蒸馏水,配制成3%的水溶液,4 ℃下溶解24 h.待充分溶解后,分别加入上述不同浓度的氧化石墨烯分散液,充分搅拌,分散均匀后即得到羟丁基壳聚糖/氧化石墨烯(HBOG)水凝胶,置于4 ℃冰箱中备用,根据氧化石墨烯加入量的不同,将水凝胶分别标记为HBOG-0,HBOG-1,HBOG-3,HBOG-5.
1.2.4 样品表征红外光谱(FT-IR):将氧化石墨烯、壳聚糖、羟丁基壳聚糖和复合水凝胶样品烘干后研磨成粉末,采用溴化钾压片法,制成薄膜圆片,以傅里叶变换红外光谱仪在波数范围为4 000~400 cm-1扫描样品的FT-IR光谱图.
拉曼光谱(Raman):室温下使用532 nm激发光源对氧化石墨烯样品进行检测.
透射电镜(TEM):将大约5 μL氧化石墨烯样品液滴加在支持膜上,将铜网冷冻干燥后在200 kV的加速电压下检测样品.
扫描电镜(SEM):将制得的水凝胶冷冻干燥,取样品内部截面真空喷金后观测并拍照.
1.2.5 流变性能测试使用动态剪切流变仪AR2000测试羟丁基壳聚糖/氧化石墨烯水凝胶的流变性能.实验条件如下:平板样品台25 mm,平板和样品台之间距离0.5 mm,温度测试范围10~40 ℃,频率1 rad/s;应变0.5%,加热和冷却速率1.0 ℃/min.测试时迅速将样品从冰浴中滴加到样品台上,然后在表面滴加硅油以防止水分蒸发影响流变测试的准确性.
1.2.6 细胞增殖实验浸提液的制备:称取一定量的羟丁基壳聚糖粉末,在紫外灯下照射2 h消毒后,置于12孔细胞培养板中,加入无菌蒸馏水,配制3%的羟丁基壳聚糖,放入4 ℃冰箱中溶解1 d.待充分溶解后,分别加入无菌的0,1,3,5 g/L的氧化石墨烯分散液混匀,置于37 ℃恒温培养箱中,待样品成为水凝胶后取出,紫外照射1 h消毒,随后将样品放置于添加了一定量新鲜细胞培养基的6孔细胞培养板中,于37 ℃、5% CO2的细胞培养箱中孵育24 h,用0.22 μm滤膜过滤后收集获得不同水凝胶浸提液,用新鲜培养基梯度倍比稀释(1:1,1:2,1:4),备用.
将PDLCs细胞置入细胞培养瓶中,用含15%胎牛血清的α-MEM培养基于37 ℃、5% CO2的培养箱中培养.传代后,将PDLCs细胞接种于96孔细胞培养板中(6 000细胞/孔),加入100 μL新鲜培养基培养24 h使细胞贴壁.加入100 μL上述制备的不同水凝胶浸提液(设5个复孔),培养24 h后加入20 μL MTT溶液,避光反应4 h,弃去孔中培养基并加入150 μL的二甲基亚砜(DMSO),反应10 min,摇床震荡使MTT甲瓒晶体溶解,使用酶标仪在490 nm处测定光密度[6].按(1) 式计算细胞的存活率,其中:ODs为实验组光密度,ODb为空白组光密度,ODc为阳性对照组光密度.
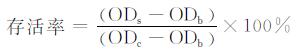
|
(1) |
在无菌条件下,将PDLCs细胞置入细胞培养瓶中,用含15%胎牛血清的α-MEM培养基于37 ℃、5% CO2的培养箱中培养.传代后,将PDLCs接种于6孔细胞培养板中(5×105细胞/孔),加入1 mL新鲜培养基培养24 h使细胞贴壁.将6孔板中培养基移出,并用PBS缓冲溶液冲洗3次后,每孔加入1 mL上述制备的不同水凝胶浸提液,继续培养24 h.吸出孔板中的液体,胰蛋白酶消化2~3 min,1 000 r/min离心5 min弃上清液收集细胞.参照细胞凋亡检测试剂盒说明书操作,取500 μL的工作液将收集的细胞重悬,然后加入5 μL的Annexin Ⅴ-FITC(异硫氰酸荧光素标记的磷脂结合蛋白Ⅴ)溶液,轻轻混匀,避光室温孵育15 min,加入5 μL的PI(碘化丙啶)轻轻混匀,冰浴避光放置5 min,1 h内使用流式细胞仪上机检测.
2 结果与讨论 2.1 氧化石墨烯的表征分析图 2为氧化石墨烯的FT-TR光谱图.从图中可以看出氧化石墨烯在3 399 cm-1有一个宽峰,其归属于O—H的伸缩振动吸收峰,1 731 cm-1处为C=O的伸缩振动吸收峰,1 400 cm-1处为O—H的变形振动吸收峰,1 052 cm-1处为C—O—C的伸缩振动吸收峰[7].
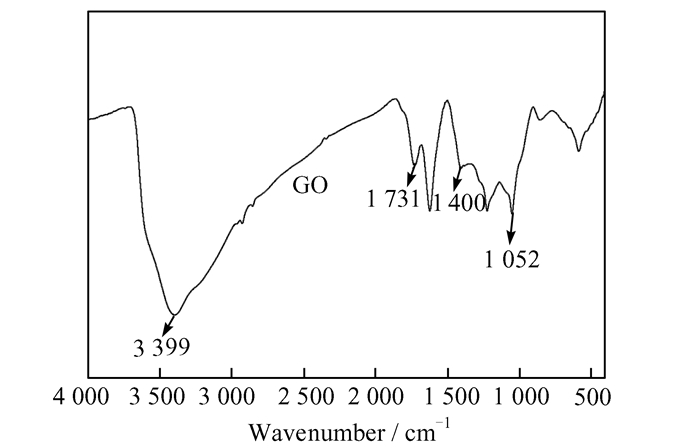
|
| 图 2 GO的FT-IR光谱 Figure 2 FT-IR spectrum of GO |
氧化石墨烯的TEM照片如图 3所示.从图 3中可知,氧化石墨烯含有若干个石墨片层并且出现褶皱现象,这些褶皱能够阻止在干燥过程中由范德华力引起的团聚[8].

|
| 图 3 GO的TEM图 Figure 3 TEM photo of GO aqueous solution |
Raman光谱可以用来检测石墨在氧化过程中的碳结构的变化,图 4显示了一个典型的GO的拉曼光谱图,1 590 cm-1处为G峰,1 350 cm-1处为D峰,而ID/IG的值显示石墨结构的规整程度(ID/IG=1.02),比值越小表示规整程度越大,说明氧化过程对石墨结构产生了破坏[9].
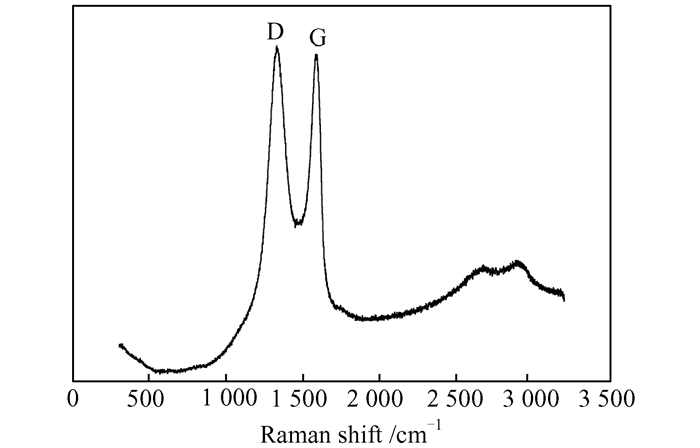
|
| 图 4 GO的拉曼光谱图 Figure 4 Raman spectrum of GO |
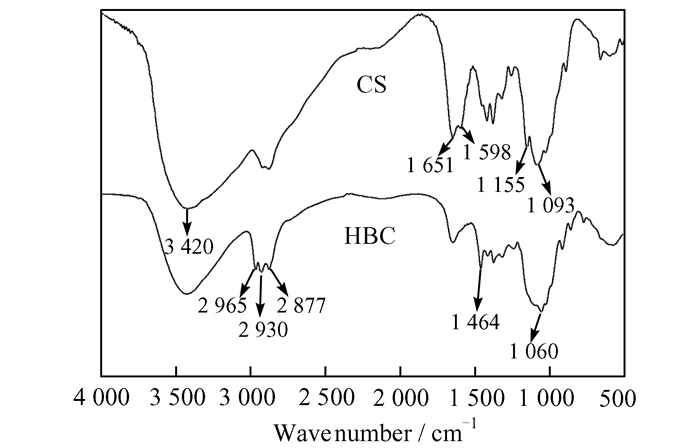
壳聚糖、羟丁基壳聚糖的红外光谱如图 5所示,从图 5中可看出壳聚糖在3 420,1 651,1 598,1 155 cm-1处出现了吸收峰,其分别归属于O—H的伸缩振动吸收峰和N—H伸缩振动峰的叠加,C=O伸缩振动吸收峰,伯胺基的N—H弯曲振动峰和C6位—OH的吸收峰.对比羟丁基壳聚糖的红外图谱可以发现,复合水凝胶在2 877~2 965 cm-1和1 464 cm-1处出现了明显的新吸收峰,分别归属于C—H的伸缩振动和不对称振动吸收峰,表明改性后的产物增加—CH3、—CH2,即引入了羟丁基基团[3];壳聚糖原C6位—OH的C—O吸收峰从1 093 cm-1位移至1 060 cm-1处,并有明显加强,同时1 155 cm-1处的吸收峰消失,表明羟丁基化反应发生在C6位上.
|
| 图 5 壳聚糖、羟丁基壳聚糖的FT-IR光谱 Figure 5 FT-IR spectra of chitosan, hydroxybutyl chitosan |
图 6为HBOG-0,HBOG-1,HBOG-3,HBOG-5水凝胶的红外图谱,可以看出,加入氧化石墨烯后的复合水凝胶红外光谱无明显变化,保留了羟丁基壳聚糖在2 877~2 965 cm-1和1 464 cm-1处特征峰,仅有部分峰的偏移和增强,说明氧化石墨烯与羟丁基壳聚糖之间并未发生化学反应,氧化石墨烯通过氢键与羟丁基壳聚糖分子链结合.

|
| 图 6 HBOG-0,HBOG-1、HBOG-3、HBOG-5水凝胶的FT-IR光谱 Figure 6 FT-IR spectra of HBOG-0, HBOG-1, HBOG-3 and HBOG-5 hydrogels |
图 7为不同氧化石墨烯含量的羟丁基壳聚糖/氧化石墨烯水凝胶在不同放大倍率下的SEM图.可以看出,羟丁基壳聚糖/氧化石墨烯水凝胶的三维结构呈层状,连续而稳定,含有许多微孔结构且较均匀地分布在水凝胶内部.对比不同水凝胶样品可以发现,仅有HBOG-0水凝胶的孔壁在冻干过程中发生了坍塌,说明氧化石墨烯加入后增强了水凝胶结构的稳定性[6].

|
| 图 7 HBOG-0(A1,A2)、HBOG-1(B1,B2)、HBOG-3(C1,C2)、HBOG-5(D1,D2)水凝胶的SEM图 Figure 7 SEM images of HBOG-0 (A1, A2), HBOG-1 (B1, B2), HBOG-3 (C1, C2) and HBOG-5 (D1, D2) hydrogels |
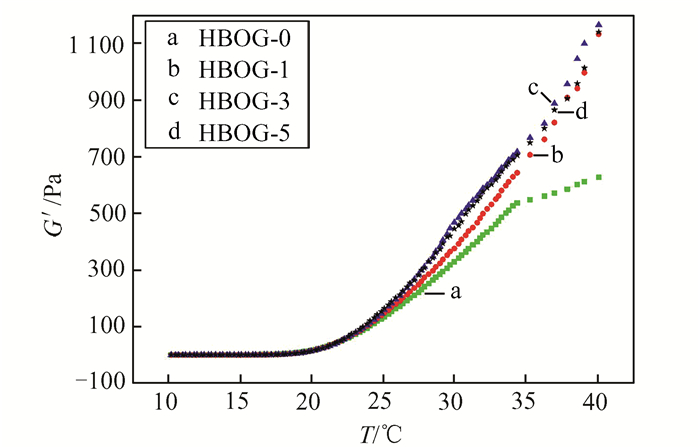
图 8描述了复合水凝胶随着温度变化时储能模量G′和损耗模量G″的变化.可以看出,4种水凝胶的相转变温度分别为16.7,17.2,18.0,17.7 ℃,氧化石墨烯的加入对水凝胶的相转变温度影响较小,水凝胶的凝胶化过程主要由羟丁基壳聚糖决定,氧化石墨烯的加入并不影响羟丁基壳聚糖本身优秀的温敏性.图 9描述了复合水凝胶随着温度变化时储能模量G′的变化,从图 9中可以看出,氧化石墨烯的加入使得水凝胶的储能模量上升,在40 ℃时最为明显,HBOG-0水凝胶的储能模量仅有626 Pa,加入氧化石墨烯后,复合水凝胶的储能模量最高可达到1 165 Pa,其中HBOG-3和HBOG-5水凝胶的储能模量略高于HBOG-1水凝胶,故氧化石墨烯的加入不会影响羟丁基壳聚糖的优良温敏性能,而且可以在一定程度上提高复合水凝胶的力学性能,使水凝胶有更稳定的结构.

|
| 图 8 复合水凝胶的储能模量G′和损耗模量G″ Figure 8 Elastic modulus (G′) and viscous modulus (G″) of composite hydrogels A: HBOG-0; B: HBOG-1; C: HBOG-3; D: HBOG-5 |
|
| 图 9 复合水凝胶的储能模量对比 Figure 9 Comparison of elastic modulus of composite hydrogels |
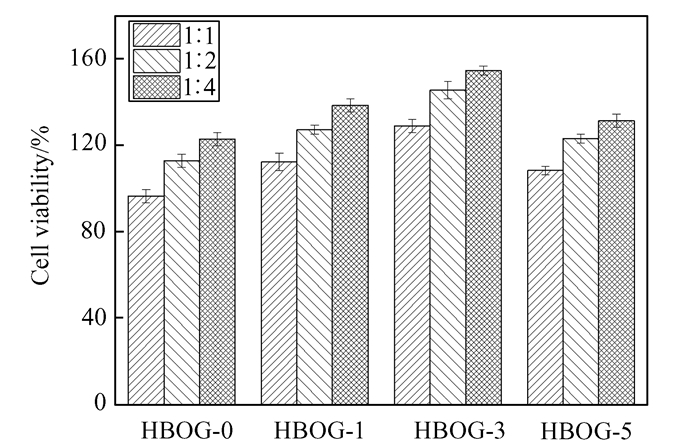
图 10描述了不同羟丁基壳聚糖/氧化石墨烯水凝胶浸提液在一定稀释倍率(1:1, 1:2, 1:4) 下的细胞存活率.可以看出,氧化石墨烯的加入在一定程度上可以提升水凝胶的细胞存活率,且随着氧化石墨烯加入量的增加细胞存活率呈现先增后减的趋势,这与之前的研究结果[10]类似,可能是由于氧化石墨烯含有的大量含氧基团对细胞增殖、分化的促进作用所致,但在氧化石墨烯浓度高时显示出一定细胞毒性.
|
| 图 10 HBOG-0,HBOG-1,HBOG-3,HBOG-5水凝胶对细胞存活率的影响 Figure 10 The influence of HBOG-0, HBOG-1, HBOG-3, HBOG-5 hydrogels on viability of PDLCs |
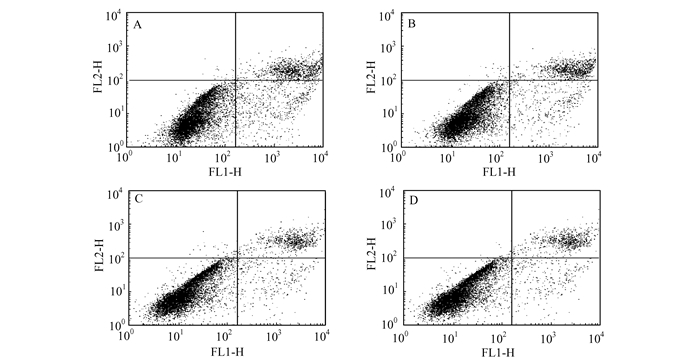
图 11(其中,FLI-H为Annexin Ⅴ-FITC通道,FL2-H为PI通道)描述的是HBOG-0(A)、HBOG-1(B)、HBOG-3(C)、HBOG-5(D)水凝胶对PDLCs细胞凋亡的影响.可以看出:各组细胞均存在正常细胞(左下象限)、早期凋亡细胞(右下象限)、晚期凋亡细胞(右上象限)、坏死细胞(左上象限),但均以正常细胞为主,坏死细胞很少;A、B、C、D组的正常细胞分别为80.30±0.20%、83.58±0.17%、89.16±0.38%,88.20±0.30%,说明加入氧化石墨烯到羟丁基壳聚糖水凝胶中有促进细胞增殖,减慢细胞凋亡的作用,在一定程度上可以提升复合水凝胶的生物相容性.
|
| 图 11 复合水凝胶对PDLCs细胞凋亡的影响 Figure 11 The influence of composite hydrogels on apoptosis of PDLCs A: HBOG-0; B: HBOG-1; C: HBOG-3; D: HBOG-5 |
本文以1, 2-环氧丁烷为醚化剂,以十二烷基硫酸钠为相转移催化剂,制备羟丁基壳聚糖,以改进的Hummers法制备氧化石墨烯,然后将氧化石墨烯与羟丁基壳聚糖复合制得HBOG复合水凝胶,并对水凝胶进行了一系列表征和性能测试.结果表明,氧化石墨烯的加入对羟丁基壳聚糖分子结构和温敏性没有明显影响,两者通过分子间的氢键结合,并能在一定程度上增强水凝胶的力学性能和稳定性,且随着氧化石墨烯加入量的增大,力学性能和稳定性显示出上升的趋势.体外细胞增殖和凋亡实验表明所有复合水凝胶对PDLCs细胞均无细胞毒性,随着氧化石墨烯加入量的增大,复合水凝胶对PDLCs的细胞增殖率呈现先促进后抑制的趋势,氧化石墨烯的加入减缓了细胞的凋亡,表明氧化石墨烯的加入提升了水凝胶的生物相容性.该研究表明,羟丁基壳聚糖/氧化石墨烯水凝胶在口腔牙周修复方面有潜在的应用价值.
| [1] | ZHAI M L, ZHAO L, YOSHⅡ F, et al. Study on antibacterial starch/chitosan blend film formed under the action of irradiation[J]. Carbohydrate Polymers, 2004, 57(1) : 83–88. DOI:10.1016/j.carbpol.2004.04.003 |
| [2] | MIAO J, CHENG H, GAO C J, et al. Preparation and characterization of N, O-carboxymethyl chitosan (NOCC)/polysulfone (PS) composite nanofiltration membranes[J]. Journal of Membrane Science, 2006, 280(1-2) : 478–484. DOI:10.1016/j.memsci.2006.02.003 |
| [3] | WEI C Z, HOU C L, GU Q S, et al. A thermosensitive chitosan-based hydrogel barrier for post-operative adhesions prevention[J]. Biomaterials, 2009, 30(29) : 5534–5540. DOI:10.1016/j.biomaterials.2009.05.084 |
| [4] | SHIN S R, AGHAEI-GHAREH-BOLAGHB, DANG T T, et al. Cell-laden microengineered and mechanically tunablehybrid hydrogels of gelatin and grapheneoxide[J]. Advanced Materials, 2013, 25(44) : 6385–6391. DOI:10.1002/adma.201301082 |
| [5] | MARCANO D V, KOSYNKIN J M, BERLIN A, et al. Improved synthesis of graphene oxide[J]. ACS Nano, 2010, 4(8) : 4806–4814. DOI:10.1021/nn1006368 |
| [6] | 樊李红, 易嘉琰, 童骏, 等. 羟丙基壳聚糖/氧化魔芋/氧化石墨烯水凝胶的制备及表征[J]. 武汉大学学报(理学版), 2016, 62(4) : 361–367. FAN L H, YI J Y, TONG J, et al. Preparation and characterization of hydroxypropyl chitosan/ oxidized konjac glucomannan/graphene oxide hydrogel[J]. Journal of Wuhan University (Natural Science Edition), 2016, 62(4) : 361–367(Ch). |
| [7] | SHUAI C J, FENG P, GAO C D, et al. Graphene oxide reinforced poly(vinyl alcohol): Nanocomposite scaffolds for tissue engineering applications[J]. RSC Advances, 2015, 5(32) : 25416–25423. DOI:10.1039/C4RA16702C |
| [8] | XUE R R, XIN X, WANG L, et al. A systematic study of the effect of molecular weights of polyvinyl alcohol on polyvinyl alcohol-graphene oxide composite hydrogels[J]. Physical Chemistry Chemical Physics, 2015, 17(7) : 5431–5440. DOI:10.1039/C4CP05766J |
| [9] | YOON H H, BHANG S H, KIM T, et al. Dual roles of grapheme oxide in chondrogenic differentiation of adult stem cells: Cell-adhesion substrate and growth factor-delivery carrier[J]. Advanced Functional Materials, 2014, 24(41) : 6455–6464. DOI:10.1002/adfm.201400793 |
| [10] | SHIN S R, BOLAGH B A G, DANG T T. Cell-laden microengineered and mechanically tunable hybrid hydrogels of gelatin and graphene oxide[J]. Advanced Materials, 2013, 25(44) : 6385–6391. DOI:10.1002/adma.201301082 |
 2017, Vol. 63
2017, Vol. 63




