文章信息
- 谌林, 余甜雨, 朱晗, 李贞, 刘志洪
- SHEN Lin, YU Tianyu, ZHU Han, LI Zhen, LIU Zhihong
- 基于上转换纳米材料的体外检测技术
- Detection Methods in vitro Based on Upconversion Nanoparticles
- 武汉大学学报(理学版), 2018, 64(1): 1-16
- Journal of Wuhan University(Natural Science Edition), 2018, 64(1): 1-16
- http://dx.doi.org/10.14188/j.1671-8836.2018.01.001
-
文章历史
- 收稿日期:2017-10-19

上转换纳米材料(upconversion nanoparticles, UCNPs)是一类稀土离子掺杂的无机纳米材料.由于三价的稀土离子具有丰富的电子能级和长寿命的亚稳态能级,因而其中间亚稳态能级可以连续吸收两个或多个低能量的近红外光子,到达更高能级的激发态,然后再回到基态发射出一个高能量光子,实现上转换发光过程[1].上转换发光是一种非线性发光现象,其本质是反斯托克斯(anti-Stokes)发光[2],即长波激发(通常是980 nm的红外光激发),短波发射.
下转换过程是将短波长光转换为更长波长的光,常用的下转换材料有有机染料和量子点.由于大多数有机染料都会发生光漂白[3~5],因此使用染料作为荧光团检测目标物时会发生信号消失现象,导致检测失败.与有机染料相比,量子点摩尔吸光系数大[6],量子产率更高,发射峰窄[7],发射波长可调,光稳定性好;但是量子点由于含有Cd、Se等元素而具有一定的毒性[8],因而会对人类健康和环境造成潜在的危害[9, 10].此外,下转换材料一般由紫外、可见光激发,因此生物样品会产生背景荧光[11, 12],导致信噪比较低,从而降低检测灵敏度;而且较高能量的激发光也会对生物组织产生光损伤.
与常用的下转换材料有机染料、量子点相比,上转换纳米材料有其鲜明的特点.上转换纳米材料由于其近红外激发的性质,可以有效地避免生物样本本身的自发荧光和散射光的干扰,而且能有效降低紫外或者可见光激发对生物样品的光损伤[13~15].此外,上转换纳米材料还有反斯托克斯位移大、荧光发射峰窄、化学稳定性好、光稳定性好等优点[1, 16, 17],在生物成像和生物检测等领域有着明显的优势.
本篇综述由以下4部分组成:上转换发光机理、上转换纳米材料的合成及修饰,以及基于上转换纳米材料的体外检测.
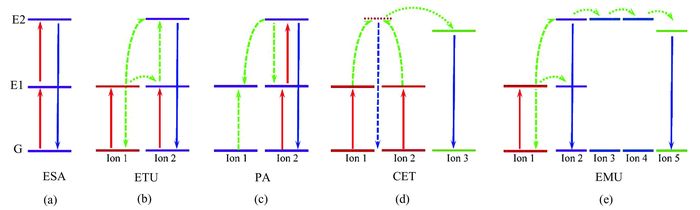
1 上转换纳米材料的发光机理上转换发光过程主要来自于稀土离子内4f-4f轨道电子跃迁.在外层的5s和5p电子屏蔽下,稀土离子的4f电子能够发出尖锐的线状发射峰,从而能很好地抗光漂白和光降解[17].此外,虽然稀土离子内层4f电子跃迁基于量子选择力学是禁止的,但是局部晶体场诱导混合更高电子构型的f组态后,4f电子间可以发生弛豫[18, 19].由于4f-4f电子间跃迁禁止,三价稀土离子通常具有长寿命发光(达毫秒级别),因此其激发态能够连续吸收几个光子,并且允许激发态离子间发生相互作用,从而发生稀土离子间的能量转移过程[17].掺杂稀土离子的这些特点决定了基本的上转换发光机制,包括激发态吸收、能量转移上转换、光子雪崩、协同能量转移、能量迁移上转换[20],如图 1所示.
|
| 图 1 上转换机理过程的示意图 Figure 1 Schematic representations of UC processes |
激发态吸收(excited state absorption,ESA)指处于基态的稀土离子连续泵浦吸收两个或者多个光子到达更高能级的激发态,然后再辐射跃迁返回基态的过程[21],是上转换发光过程中最基本的发光机理.其具体过程如图 1(a)所示,处于基态G的稀土离子吸收一个光子跃迁至亚稳态的中间能级E1,即基态吸收;此时,如果第二个泵浦光子的能量与亚稳态能级E1和更高能级激发态E2之间的能量差刚好匹配,则处于亚稳态能级E1的离子能够再吸收一个光子跃迁至E2能级,然后再从E2能级返回至基态G实现上转换发光.激发态吸收实质上是一种单离子吸收过程,不依赖于掺杂稀土离子的浓度.
1.2 能量转移上转换与只需单个离子的激发态吸收过程不同,能量转移上转换(energy transfer upconversion,ETU)需要相邻的两种功能不同的离子,即敏化剂和激活剂[22~24].如图 1(b)所示,在低能量光子的激发下,具有更大吸收截面的敏化剂(离子1)首先吸收一个泵浦光子从基态G到达亚稳态能级E1,然后通过偶极-偶极相互作用将能量以非辐射方式传递给处于基态G或E1激发态的激活剂(离子2),使激活剂到达能量更高的E2能级,而敏化剂本身返回至基态.由于能量转移上转换过程中的上转换效率依赖于相邻敏化剂-激活剂之间的平均距离,而稀土离子的掺杂浓度决定了相邻离子之间的距离,因此能量转移上转换过程对稀土离子的掺杂浓度有一定的要求.
1.3 光子雪崩光子雪崩(photon avalanche,PA)是涉及到激发态吸收和交叉驰豫两个过程的循环结果,其过程如图 1(c)所示.离子2通过较弱的非共振基态吸收跃迁到E1能级,然后通过激发态吸收到达更高能量的E2能级;随后,处于E2能级的离子2与处于基态G的离子1发生交叉驰豫,产生2个处于E1能级的离子,最后离子1再将能量转移给离子2,形成一个完整的循环.处于E1能级的两个离子重复以上ESA和ETU两个过程,就可以形成4个处于E1能级的离子,以此类推,就会形成8、16、32个这样的离子,呈指数增长趋势,如同“雪崩效应”一般,从E1能级吸收能量到达E2能级的离子2也会更多,当离子2从E2能级返回E1能级时产生上转换荧光[25, 26].由于光子雪崩过程依赖于中间能级激发态离子数的积累,所以明显的光子雪崩过程只发生在稀土离子掺杂浓度足够高的体系中.
1.4 协同能量转移如图 1(d)所示,协同能量转移(cooperative energy transfer,CET)需要3个离子中心,通常离子1和2是同一种类型.吸收激发光能量后,敏化剂离子1和2跃迁至E1能级,然后协同激活虚拟的激发态E2,并将能量转移给相邻激活剂离子3,将离子3激发到更高能级的激发态;处于激发态的离子3弛豫回基态G,发射出上转换荧光[27].
1.5 能量迁移上转换对于没有合适中间能级的激活剂,为了进一步提高其上转换发光的效率,Liu课题组[28, 29]提出了一种新的能量转移机制,即能量迁移上转换(energy-migration upconversion,EMU).如图 1(e)所示,在典型的能量迁移上转换过程中,4种类型的发光中心:敏化剂(离子1)、储能剂(离子2)、迁移剂(离子3,4)、激活剂(离子5),以精准的浓度掺杂在不同的壳层中,通过以下步骤发射上转换荧光:1)储能剂通过能量转移上转换跃迁至高能级的激发态;2)激发态的储能剂将能量迁移给迁移剂,随后核壳界面处的迁移剂离子间进一步发生能量转移;3)邻近的激活剂捕获能量.最后储能剂和激活剂返回至基态,发射出上转换荧光.
2 上转换纳米材料的合成方法开发组成、晶相、形状、大小可控的高质量的上转换纳米材料合成方法,对调节上转换纳米材料的化学、光学性能,以及拓展其在不同领域的潜在应用前景都至关重要.迄今为止,不同课题组都报道了许多上转换纳米材料的合成方法,其中常用的有热分解法、水热/溶剂热法、沉淀/共沉淀法.
2.1 热分解法热分解法是指有机金属前驱体在高沸点溶剂中,无水无氧条件下,高温分解的过程.在热分解法中,通常稀土三氟乙酸盐或醋酸盐为前驱体,十八烯(1-octadecene,ODE)为最常用的高沸点有机溶剂,而油酸(oleic acid,OA)和油胺(oleylamine,OM)等含有极性官能团的试剂则作为表面惰性配体,通过其在纳米颗粒不同晶面的选择性吸附来调节纳米颗粒的尺寸和形貌.随着温度增加,C—F键被破坏,纳米晶成核过程开始.晶体成核和生长是形成均一纳米粒子的两个关键步骤,通过调节反应温度、升温速率和前驱体浓度等合成条件可以精确地控制这两个过程的发生[17].2005年,严纯华课题组利用该方法以La(CF3COO)3为前驱体,OA/ODE为溶剂合成了单分散的LaF3纳米晶[30],反应时间、温度、溶剂配比等反应条件对纳米颗粒的形貌、尺寸及均一性都有较大影响.随后,该课题组拓展了三氟乙酸盐热分解法,用于合成多种形貌(三角形、六边形、四边形、多边形、之字形纳米片、多面体及纳米杆)稀土氟化物和氧氟化物纳米颗粒[31].利用热分解法合成的上转换纳米颗粒形貌尺寸均一、单分散性好,是UCNPs合成常用的方法之一,但其合成条件很苛刻,需要高温(330 ℃以上),操作复杂(无水氧、原料需快速注射进入等),后处理繁琐,且副产物对人体有毒.
2.2 水热/溶剂热法水热/溶剂热法是指在高压反应釜中,过热溶剂及高压条件下合成纳米颗粒的方法.由于高压条件能增加反应物的溶解性和反应性,因此该方法合成的纳米颗粒结晶度较好.此外,该方法相较于热分解法,反应条件较为温和且灵活可控.稀土氧化物、硝酸盐、盐酸盐等常作为该方法的前驱体,而NH4F、NaF则常用来充当氟源.李亚栋课题组[32~34]在UCNPs的溶剂热合成方面做了很多工作,提出三相界面(liquid, solid and solution phases, LLS)发生相转化与相分离的方法合成UCNPs.
2.3 沉淀/共沉淀法沉淀/共沉淀法是指通过几种离子的连续沉淀过程形成纳米颗粒.与热分解法相比,沉淀/共沉淀法操作更简便,反应条件更温和,仪器设备价格低廉,反应时间短.但是不同离子沉淀速率的差别对纳米粒子的形成有显著影响,因此,通常通过加入表面配体或助溶剂来解决沉淀过程中发生的问题.
在水相中利用沉淀/共沉淀法制备纳米晶体时,材料的结晶度较差,需要进行后续的热处理.通常,稀土盐酸盐、硝酸盐用于提供稀土离子,NaF和NH4F作为氟源.van Veggel课题组[35]报道了一种以稀土硝酸盐和NaF为前驱体,在乙醇和水的混合溶剂中合成LaF3的共沉淀法.该方法通过加入表面活性剂调节不同离子的沉淀速度,从而控制纳米粒子的生长,最终获得粒径为10 nm的LaF3纳米颗粒.在有机相中进行的沉淀/共沉淀法通常由稀土油酸盐、醋酸盐、盐酸盐和硝酸盐提供稀土离子,由NaF和NH4F提供氟源,以OA/ODE作为溶剂来合成上转换纳米粒子.Zhang课题组[36]于2008年报道该合成方法,合成了形貌可控的六方相NaYF4:Yb, Er/Tm纳米颗粒.在该合成过程中,氟化物在室温下成核,当温度升高时,晶核进一步生长,通过改变表面配体的浓度可以获得纳米片、纳米颗粒等不同形貌的纳米材料.
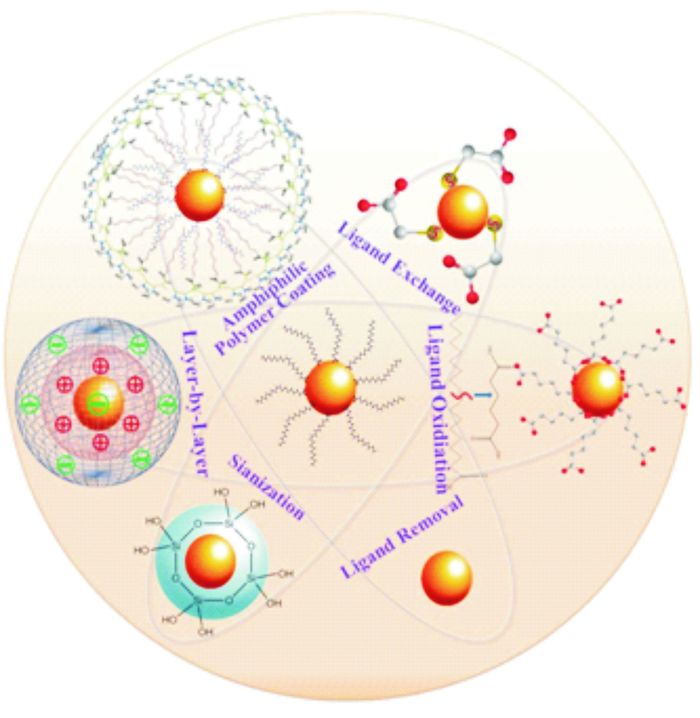
3 上转换纳米材料的修饰方法通过上述合成方法得到的UCNPs通常是疏水性的,无法进行后面的荧光标记和生物应用,从而限制了材料的应用,因而对UCNPs表面进行水溶性和功能化修饰显得尤为重要.常用的UCNPs水溶性修饰方法,包括配体交换、配体清除、配体氧化、层层组装和表面硅烷化[17](如图 2).
配体交换即利用亲水配体取代UCNPs表面的原有配体而不影响UCNPs的化学及光物理性质,是对UCNPs进行改性的常用方法之一.一般合成的油相UCNPs表面为OA配体,其一端是长链,一端是与稀土离子配位的羧基,因此一般选择与稀土离子配位能力更强的多齿配体或者过量的单齿配体来有效取代表面配体OA,增加其水溶性.目前为止,已报道成功用于UCNPs表面配体交换的亲水配体有聚丙烯酸(poly(acrylic acid),PAA)[37],己二酸(adipic acid,HDA)[38],柠檬酸[39],聚乙烯亚胺(polyethylenimine,PEI)[40]等.其中最常用的是PAA和PEI,因为PAA中过量的羧基、PEI中过量的氨基不仅可以增加其水溶性,也有利于后续的生物标记.
3.2 配体消除配体消除即直接去掉包覆在UCNPs表面的配体,得到裸露的UCNPs.这种方法操作相对简单,利用酸处理或者超声辅助乙醇处理即可.Wang等[41]利用超声辅助乙醇处理,利用乙醇彻底洗涤,得到裸露表面的UCNPs.Capobianco小组[42]则利用酸处理,使UCNPs表面油酸质子化而脱落.该法得到的裸露的UCNPs表面存在大量稀土离子Ln3+,仍保持较强的配位作用,可以通过螯合或者静电作用进行后续的生物应用.
3.3 配体氧化配体氧化是基于对碳碳双键(R-C=C-R′)选择性氧化的一种水溶性修饰方法.该方法对UCNPs表面原有配体有一定要求,需至少含有一个不饱和键,因此通常只有表面为油酸或者油胺的UCNPs可以使用该方法.Chen等[43]利用Lemieux-von Rudloff(高锰酸钾和高碘酸钠的酸性溶液)试剂,将UCNPs表面的OA氧化为壬二酸,实现UCNPs的水溶性修饰.
3.4 层层组装层层组装法涉及到多个静电吸附过程,即利用静电作用将带有相反电荷的离子连续吸附在上转换纳米材料的表面,以此实现改性.Wang等[44]利用带正电荷的聚烯丙胺盐酸盐(PAH)和带负电荷的聚苯乙烯磺酸盐(PSS)之间的静电作用制备PAH/PSS/PAH包覆的UCNPs.由于其表面含有大量的氨基,可用于后续的生物应用.
3.5 表面硅烷化表面硅烷化即通过硅烷化试剂的水解作用在UCNPs表面包覆一层SiO2,因此也称SiO2包覆法.由于SiO2化学稳定性好,生物相容性好,且光学透明,因此可在其表面进一步引入氨基、羧基和巯基等官能团,满足后续的生物偶联需要.根据UCNPs表面的配体不同,表面硅烷化可以分为两种不同的方法:适于表面为亲水配体的Stober法[45]和适于表面配体为疏水配体的反相微乳液法[46~48].
3.6 两亲聚合物包覆两亲聚合物包覆即利用两亲聚合物的疏水部分与UCNPs表面的疏水配体之间的范德华力,将其固定在纳米粒子表面,而其亲水部分则游离出来提供水溶性以及作为官能团使用.
4 上转换纳米材料在体外检测中的应用在蛋白质鉴定、DNA免疫分析以及早期癌症诊断等生物医学应用中,对各种目标物进行高灵敏、高特异性的检测是基本且必不可少的[49~51].在各种体外检测的方法中,荧光检测方法因其简单的光学信号传导机制、高灵敏度和响应速度快等特点,现已成为一种基本的分析手段[52~56].传统的荧光探针(如有机染料、量子点)存在高噪音背景,可能对生物组织造成光损伤,发生光漂,存在潜在的毒性等不足,而上转换纳米材料因其近红外激发的本质,能很好地克服以上缺陷.稀土离子掺杂的上转换纳米材料只需低能量的近红外光子激发,而生物样品在近红外区几乎没有响应,因而可以有效地避免生物样品的自发荧光和散射光干扰;此外,其大的反斯托克斯位移可以消除激发光源的影响;窄的多色发射峰可以有效地进行多目标物检测,而不受交叉影响.基于以上特点,UCNPs在过去的十年间已对许多分析物进行了新颖、有效的检测.根据信号检测方式,本文将其分为两大类:均相检测和非均相检测.
4.1 均相检测均相实验作为一种液相分析方法,能够直接在溶液中通过简单的“混合-读取”步骤进行检测,因而成为实际应用中最为方便的快速检测方法.均相实验一般基于与距离相关的能量转移过程,即能量供体与邻近能量受体之间的长程偶极之间的作用.
荧光共振能量转移(fluorescence resonance energy transfer, FRET)是一项优良的均相检测技术,其理论基础在于能量供体-受体对的FRET效率不受体系中共存物质的影响.此外,由于FRET效率与能量供受体对之间距离的六次方成反比,可作为有效的光学分子尺测量1.0~6.0 nm之间的距离[57].因此,基于FRET的分析方法具有在复杂基质中特异性识别和检测物质的特点,在核酸杂交、免疫分析和生物大分子相互作用研究等领域应用广泛[58~60].
理想的FRET体系供受体对需满足以下要求:1)能量受体的吸收光谱与能量供体的发射光谱要有足够大的重叠积分;2)受体与供体的发射光谱不重叠;3)受体不会被供体的激发波长直接激发.这就导致传统的单光子激发的FRET存在两个不可忽略的缺陷,一是在紫外或者可见光激发下,来自生物样本的背景荧光和散射光干扰严重,导致检测的信噪比降低,灵敏度下降;二是如果供受体的激发光谱有一定的重叠时,常常造成供受体同时被激发,产生“假阳性”信号[61, 62].
为克服传统FRET分析中的上述问题,使用具有反斯托克斯发射的上转换荧光材料作为能量供体无疑是一种理想的选择.以UCNPs作为能量供体的FRET技术,我们称之为UC-FRET技术,最早是在2005年由李亚栋课题组[44]、Kuningas课题组[63]分别独立提出.Wang等[44]以纳米金作为能量受体,将UCNPs与纳米金分别标记生物素,通过生物素和亲和素的特异性识别作用,对体系中游离的亲和素实现夹心识别、定量检测.Kuningas等[63]则是以生物素化的荧光蛋白作为能量受体,亲和素修饰的UCNPs作为能量供体,对体系中游离的生物素通过竞争法实现检测.
4.1.1 对生物分子的检测 4.1.1.1 蛋白Xu课题组早期拓展了UC-FRET模型在蛋白检测方面的应用.Wang等[64]于2009年以纳米金作为能量受体,构建了UC-FRET夹心免疫传感器用于检测羊抗人IgG.该实验中,UCNPs表面修饰兔抗羊IgG,纳米金表面修饰人IgG,当羊抗人IgG存在时,由于抗原抗体间的特异性识别反应而形成夹心免疫产物,拉近供受体间的距离从而发生FRET过程,UCNPs的荧光猝灭程度与羊抗人IgG的浓度呈相关性,其检出限可以达到0.88×10-6 g·L-1.Jo等[65]则直接利用糖化血红蛋白作为能量受体实现对其的检测.通过在Er-UCNPs表面修饰上糖化血红蛋白的抗体,可直接识别在541 nm处有吸收的目标物,并同时猝灭其荧光.与利用聚间苯二胺纳米球(PMPD)与能量供体间的物理作用构建UC-FRET传感器[66]不同,Wang等[67]则是构建共价的UC-FRET模型检测透明质酸酶,利用PMPD表面丰富的氨基,与UCNPs上修饰的透明质酸上的羧基偶联,而在酶的作用下阻断FRET过程.该体系不仅进一步降低了背景噪音,而且还提高了探针的稳定性.
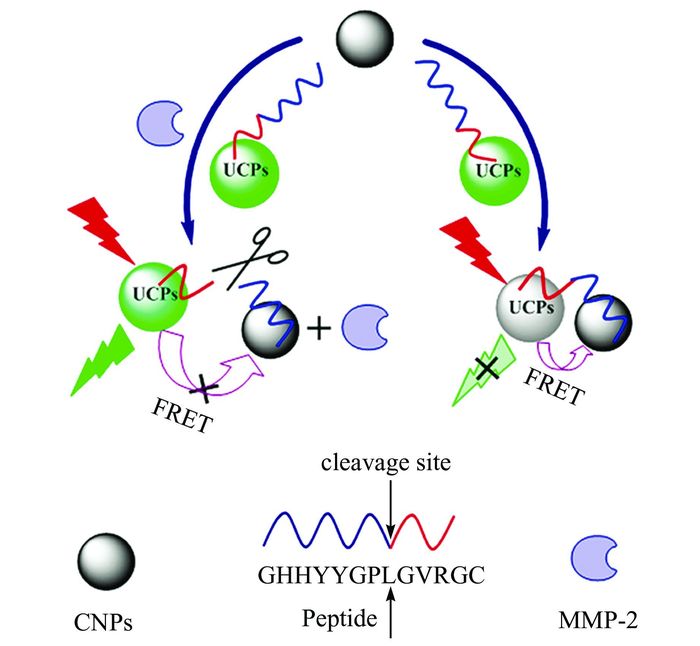
Liu课题组在免标记检测蛋白方面也做了一定的工作[68, 69].Wang等[68]将碳纳米颗粒(carbon nanoparticles, CNPs)作为能量受体引入UC-FRET体系,利用UCNPs表面标记的凝血酶适配体与目标物结合前后的构象变化,改变单链核酸适配体与CNPs之间π—π堆积的程度,从而改变CNPs与UCNPs之间的距离以及二者之间的FRET效率,实现对人血浆样本凝血酶简单、快速地检测.随后,又发展了基于CNPs的UC-FRET传感器用于检测肿瘤标志物基质金属蛋白酶2 (matrix metalloproteinase 2, MMP-2).在MMP-2的检测中(如图 3),将核酸适配体替换为具有特异性识别功能的多肽底物,其含有MMP-2特异性识别的切割底物氨基酸序列(PLGVR)和一段π电子结构丰富的序列(HHYY,4个芳香性残基)[69].该多肽探针可以通过π—π堆积与CNPs发生作用,从而拉近UCNPs与CNPs之间的距离,猝灭UCNPs的荧光;而MMP-2特异性识别、切割多肽底物后使荧光供受体分离,UCNPs的荧光恢复.该MMP-2传感器在血浆和全血中的检测都表现出很高的灵敏度,最低检出浓度为1.0×10-10 g·L-1.由于其极高的灵敏度,只需0.2 μL的血样便可检测MMP-2的浓度,这对MMP-2相关的生物分析检测和临床诊断都具有重要的意义.
Yuan等[70]则通过类似的原理以MnO2纳米片作为能量供体构建UC-FRET传感器检测组织蛋白酶D (cathepsin D, Cat D).
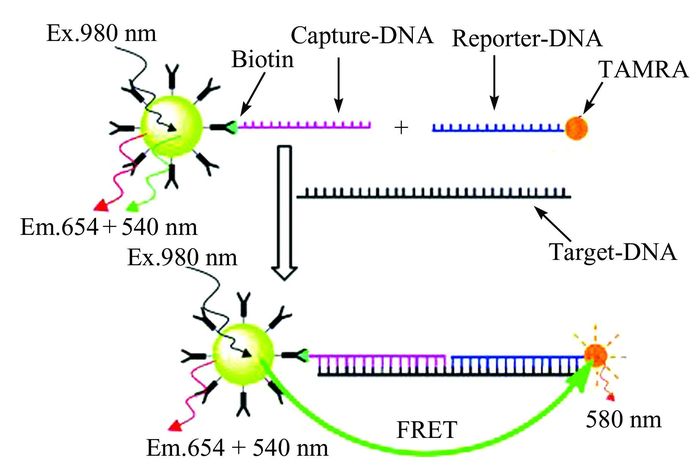
4.1.1.2 核酸较早拓展UC-FRET检测在核酸方面的应用的有Zhang[71~75]及李富友等课题组[76].Zhang等[71]以UCNPs为能量供体,四甲基罗丹明(tetramethyl-rhodamine,TAMRA)为受体,构建了高灵敏度检测单链核酸的UC-FRET传感器模型.其中,两条序列较短的核苷酸链分别修饰UCNPs和荧光染料TAMRA,互补目标链的存在使能量供受体接近,发生FRET.该传感器对目标DNA链的检出限可达1.3×10-9 mol·L-1,对单碱基错配的DNA也有很好的识别能力.此外,Zhang课题组[72~75]还建立了一系列以双链结合染料SYB Green Ⅰ为能量受体的体系来检测DNA.Chen等[76]则是利用生物素-亲和素桥联构建三明治夹心杂交模型用于单链核酸的传感分析.如图 4所示,他们将表面油酸配体氧化后得到的水溶性UCNPs共价偶联上亲和素,然后标记上生物素化的捕获单链核酸(capture-DNA),加入TAMRA修饰的另外一条信号单链核酸(reporter-DNA)后,当存在与前面两条单链核酸互补的目标核酸链(target-DNA)时,UCNPs与染料间的距离拉近,发生FRET,供体荧光猝灭,从而达到定量检测单链核酸的目的.
Rantanen等[77]则是利用UCNPs在980 nm近红外激发下能够发射出不同波长的可见光的特点进行多色检测.他们将UCNPs和有机分子分别标记与目标单链DNA互补的短链DNA,通过碱基互补配对原则拉近能量供受体间的距离,发生FRET,实现同时检测不同目标DNA链的目的.
为了进一步提高UC-FRET体系的能量转移效率,Yuan等[78]将分子信标引入UC-FRET模型中,用于核酸识别.他们利用分子信标特有的发卡型结构进一步拉近能量供受体间的距离,大大提高了有机染料对UCNPs的猝灭效率,进一步提高了检测灵敏度.为了增加FRET效率,也引入了不同的能量受体.如材料研究表明,氧化石墨烯(graphene oxide,GO)能与核酸碱基之间发生π—π堆积作用[79],由于双链核酸碱基更多地通过氢键形成双螺旋结构,因此GO对单链DNA的亲和性更高.Alonso-Cristobal等[80]基于此原理构建了超灵敏检测DNA的传感器,猝灭效率达到95%,检出限低至5.0×10-15 mol·L-1.其他常用的高猝灭能力的能量受体还有纳米金等.
4.1.1.3 生物小分子Kuningas课题组[81, 82]在构建UC-FRET模型后,将该模型应用于17-β-雌二醇(17-β-estradiol,E2)的检测.他们将表面修饰E2抗体的UCNPs作为能量供体,修饰在E2表面的有机荧光染料作为能量受体,当体系中存在游离的目标物E2时,会不断取代UCNPs表面的E2,从而可以通过UCNPs的荧光恢复程度对E2实现定量检测[81],在人血清中检出限可达9.0×10-10 mol·L-1.随后,他们将该模型用于人全血中检测[82],检出限可达2.1×10-10 mol·L-1.
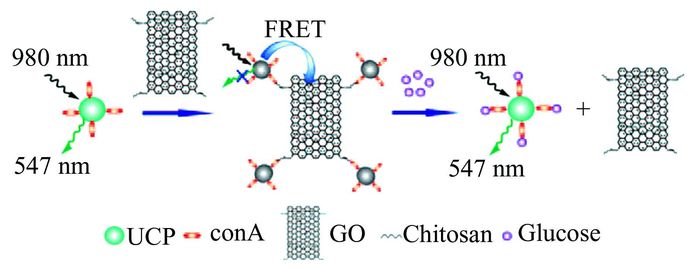
Zhang等[83]将氧化石墨烯作为能量受体引入UC-FRET体系构建了检测葡萄糖(glucose)的生物传感器(如图 5).他们分别在UCNPs和GO上修饰伴刀豆球蛋白(concanavalin A, Con A)和壳聚糖(chitosan),通过壳聚糖和Con A之间的亲和作用拉近UCNPs和GO的距离,形成FRET体系.加入目标物葡萄糖后,由于葡萄糖与Con A之间的作用力更强,因而会与结合的壳聚糖发生竞争,从而阻断FRET的发生,根据UCNPs的荧光恢复程度可对葡萄糖浓度进行定量检测.由于UCNPs具有较强的抗干扰能力,该传感器对血清中葡萄糖含量也可直接进行均相检测.同年,Peng等[84]也构建了以纳米金为能量受体的葡萄糖传感器.他们将CoA和巯基-β-环糊精(SH-β-CDs)分别偶联到UCNPs和纳米金表面,通过Con A与SH-β-CDs的分子识别作用使Au-SH-β-CDs组装到UCNPs-Con A表面发生能量转移,猝灭供体荧光.当加入目标物葡萄糖后,由于葡萄糖与Con A的亲和力更强,Au-SH-β-CDs会被竞争下来,UCNPs的荧光恢复.该传感器在人血清样本中对葡萄糖的测定结果,与临床上常用的标准己糖激酶法相符合,可望应用于临床分析.
Chu课题组[85]为了进一步减小能量供受体间的距离,则是通过磷酸根离子与稀土离子之间的螯合作用[86, 87],直接将以DNA为模板合成的银簇组装在去掉油酸配体的UCNPs表面,提高FRET效率.通过合理设计DNA序列,一段用于合成吸收光谱与UCNPs发射相匹配的银簇,一段用于与UCNPs配位的poly A序列;该UC-FRET体系猝灭效率可达93%.样品中的葡萄糖在葡萄糖氧化酶的作用下可被氧化,并释放出双氧水,可将银簇氧化成Ag+,从而破坏FRET过程,检出限可达1.4×10-6 mol·L-1.基于类似原理,他们还在UCNPs表面直接合成MnO2作为猝灭剂用于检测葡萄糖[88],通过目标物存在时产生的双氧水还原MnO2为Mn2+,从而使供体荧光恢复,实现对葡萄糖的检测.
4.1.2 金属离子重金属(如Hg2+,Pb2+,Ag+,Cr3+等)污染已日益成为环境治理的一大问题,发展灵敏、简单的检测重金属离子的方法显得极为重要.
Kumar等[89]利用双链DNA结合染料SYBR Green Ⅰ作为能量受体,基于T-Hg2+-T特异性结合的原理构建了Hg2+传感器.当存在目标物Hg2+时,UCNPs表面富含T碱基的单链DNA会与之特异性结合,并弯曲形成双链,从而拉近供受体之间的距离而发生FRET.在近红外光的激发下,UCNPs的紫外发射能激发染料发出荧光,从而实现对Hg2+高灵敏度、高选择性的检测,检出限可达6.0×10-11 mol·L-1.Huang等[90]则直接通过Hg2+对UCNPs的猝灭效应实现对其的检测.
Xu等[91]利用量子点作为能量受体实现对Pb2+的检测.聚乙烯亚胺(PEI)修饰的UCNPs与氢硫基乙酸修饰的量子点通过静电作用结合发生FRET,并激发出量子点的荧光;而当存在与氢硫基乙酸结合能力更强的Pb2+时,量子点由于表面配体的变化而无法发光,从而可通过量子点荧光变化的程度定量检测Pb2+.
Wu等[92]发展了同时检测多种金属离子的适配体传感器.他们使用两种不同颜色UCNPs分别修饰Hg2+和Pb2+的适配体,并在对应的纳米金上标记各自部分互补的单链DNA,通过碱基互补配对原则,UCNPs与纳米金发生FRET,荧光猝灭;当目标物存在时,会与各自的适配体结合,从而阻断FRET过程,通过各自通道内的颜色变化实现对Hg2+和Pb2+的同时定量检测.
4.1.3 危险物质随着人们对环境、食品安全的日益重视,许多课题组也设计了不同的传感器用于爆炸物、毒品、毒素等危险物质的检测.
Yuan课题组[93]非常巧妙地利用2, 4, 6-三硝基甲苯(TNT)与聚乙烯亚胺修饰的UCNPs形成复合物,且与掺铥的UCNPs光谱匹配从而发生FRET来灵敏检测TNT.由于3个拉电子硝基的存在,TNT具有一个极度缺电子的芳香环,因而能作为电子受体;而PEI修饰的UCNPs表面的氨基可以作为电子供体,从而二者之间可通过电子转移机制发生相互作用,形成Meisenheimer复合物.此外,该复合物在445 nm处有强烈吸收,从而可与掺铥的UCNPs发生FRET过程,实现对TNT的高灵敏检测.
Long等[94]则是利用有机磷农药调节UCNPs和AuNPs之间的FRET过程实现对其的检测.UCNPs和纳米金之间通过静电作用可发生FRET猝灭UCNPs的荧光;而硫代乙酰胆碱(ATC)能被乙酰胆碱酶(AChE)水解产生与纳米金结合能力更高的硫代胆碱,从而破坏UCNPs与纳米金之间的FRET过程;当目标物有机磷农药存在时,可抑制乙酰胆碱酶的活性,从而阻止硫代胆碱的产生,UCNPs的荧光猝灭.该传感器对久效磷、乐果、甲基对硫磷3种农药的检出限分别达到6.7×10-10 , 2.3×10-8 , 6.7×10-8 g·L-1.
Li等[95]则利用rGO(reduced graphene oxide)为猝灭剂构建了检测卡那霉素(Kanamycin)的适配体传感器.rGO一定程度上还原了GO的共轭结构,但水溶性有所降低,因此Li等选择磺化修饰rGO,既不破坏其大的共轭平面结构又保证其水溶性.通过适配体识别目标物卡那霉素前后构型的变化,UCNPs的荧光变化程度可以提示样品中卡那霉素的存在,并呈一定的线性关系.Wu等[96]则是利用GO同时猝灭两种不同颜色的UCNPs来同时检测两种真菌毒素.
4.2 非均相检测非均相实验通常是指在固相表面进行的实验,具有高特异性识别、高亲和性结合的特点,包括微阵列实验[97, 98]、横流层析实验[99~101]、微孔板实验[102]、磁分离实验[103]等.随着体外诊断市场需求日益增大,发展符合“ASSURED”标准[104](经济实惠、灵敏度高、选择性好、使用方便、检测速度快、无需设备、可直接交付最终用户使用)的检测装置显得尤为重要.其中,纸张因成本低、无需外力驱动、易化学改性等特点广受科研者的关注,以其作为基底材料的纸基分析装置也已广泛应用于疾病诊断、环境检测、食品质量控制等领域.
4.2.1 横流层析试纸条在纸基分析装置中,UCNPs最早是作为横流层析实验(LFAs)的荧光标志物使用.Hampl等[99]以UCNPs作为信号标记物构建LFAs,用于人绒毛促性腺激素(hCG)的检测.他们考察了UCNPs封闭条件、纤维素膜封闭条件及纤维素膜孔径等因素对UCNPs扩散的影响,发现UCNPs在合适条件下可以在多孔膜中扩散,对hCG的检出限可达1.0×10-97g·L-1,与胶体金、乳胶颗粒为标志物的LFAs相比,灵敏度提高10倍以上.
Niedbala等[100]则将UCNPs作为荧光标记物,构建夹心和竞争模型的LFAs.他们利用夹心模型实现了高背景干扰下大肠杆菌O157:H7的高灵敏检测.在该竞争模型下,传感器可检测药物滥用情况,实现唾液中苯丙胺、甲基苯丙胺、苯环利定和鸦片的同时、快速检测.
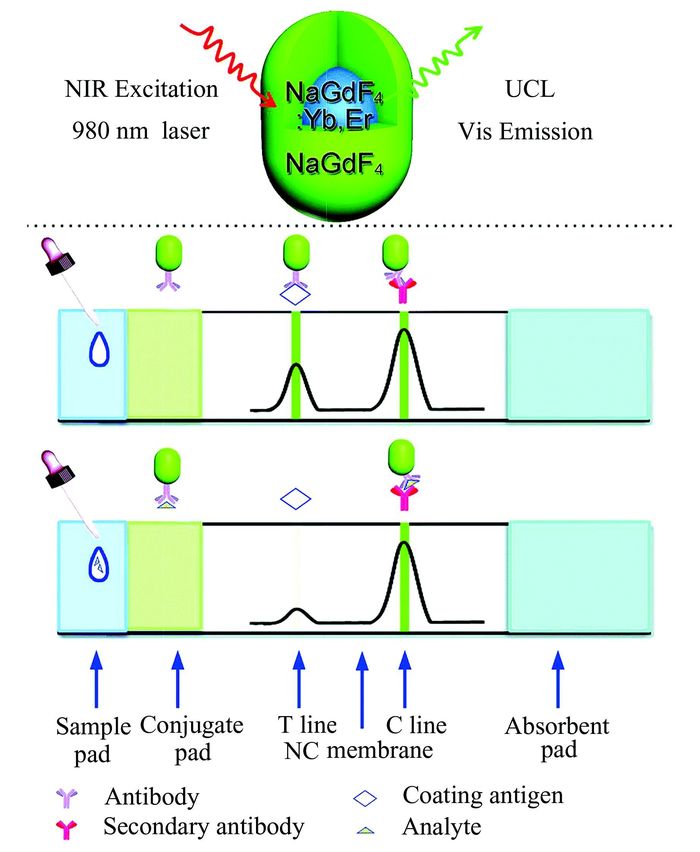
Liu等[101]则是利用核壳结构的UCNPs作为荧光标志物,对头孢氨苄实现可视化检测(如图 6),灵敏度可达10×10-6 g·L-1.基于夹心或者竞争免疫模型的LFAs也应用于病原体[105, 106]、核酸[107]等的检测.
纸芯片是纸基分析装置和微流控芯片结合的一种新的分析技术,它以纸基代替传统的微流控芯片基底材料(如玻璃、硅片等),通过微加工技术在纸张表面构建网络通道来实现目标物的分析检测.该技术自2008年由Whitesides课题组[108]提出以来,以其独特的优势引起科研工作者广泛关注.
Liu课题组[109]于2013年将UCNPs作为纸基FRET传感器的能量供体,用于癌症标志物——人基质金属蛋白酶2(MMP-2)的检测.作者首先利用UCNPs表面的氨基与多肽底物末端半胱氨酸侧链上的巯基偶联,将TAMRA修饰的MMP-2特异性多肽底物偶联至UCNPs表面,二者之间发生FRET过程,UCNPs的荧光猝灭.加入MMP-2后,MMP-2将选择性地从G-V结合位置切断多肽底物,使能量供受体之间发生分离,从而UCNPs荧光恢复,通过其变化程度可对MMP-2实现定量检测.该传感器只需4 μL极少量血样,检测线性范围可达5.0×10-8 ~5.0×10-6 g·L-1.
利用类似的原理,Jiang等[110]构建了纸基FRET传感器检测免疫球蛋白IgE.该传感器以碳纳米材料作为猝灭剂,通过偶联在UCNPs表面的IgE适配体与CNPs之间发生π—π堆积作用发生FRET作用,使UCNPs的荧光猝灭.而当IgE存在时,其适配体可以特异性地与之结合,使能量供受体间距离增大,能量转移过程被破坏,荧光恢复程度与目标物之间存在相关性,检测线性范围为5.0×10-7~8.0×10-5 g·L-1.
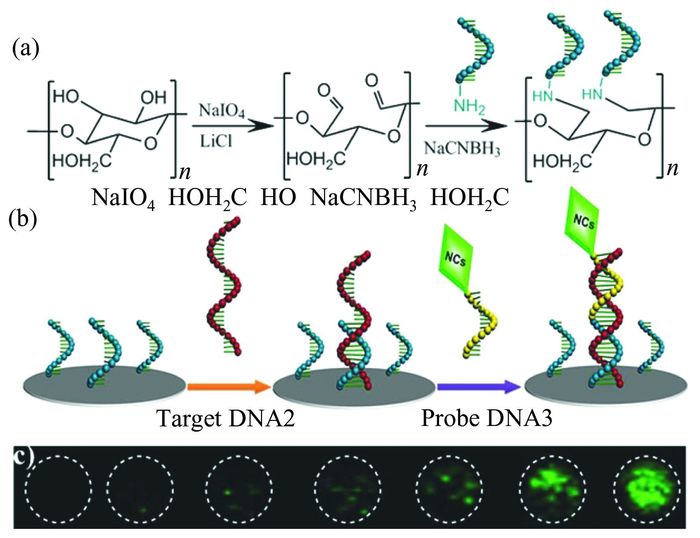
以UCNPs为荧光标记物的纸芯片则发展较晚.2014年,Ju等[111]将LiYF4上转换纳米材料作为荧光标记物应用于纸芯片检测单链核酸.如图 7所示,他们首先将捕获探针DNA 1共价固定在纤维素表面,捕获探针DNA 3修饰在UCNPs表面,利用目标DNA 2与DNA 1和DNA 3之间的杂交反应将UCNPs固定在纸张表面,因此检测区域中荧光强度与目标DNA的浓度相关.该传感器的检测灵敏度可达1.8×10-9 mol·L-1,且在复杂环境中也具有良好的抗干扰能力;与QDs-FRET纸基方法比较,灵敏度提高2个数量级.Wang等[112]利用类似的原理实现对端粒酶活性的检测,且通过裸眼即可清楚地分辨不同细胞株中低浓度的端粒酶.
为了进一步改善UCNPs在纸张表面的分布状况,提高检测灵敏度和检测范围,Krull课题组[113]将氨基修饰的UCNPs共价偶联在纸张表面,通过夹心杂交的方式用于检测单链核酸.磷酸乙醇胺(o-phosphorylethanolamine, PEA)修饰的UCNPs通过其表面的氨基在氰基硼氢化钠的作用下被还原,从而共价固定在纸张表面.该检测方法在缓冲中检出限可达4.3×10-9 mol·L-1,检测动态范围接近3个数量级;在90%的血清样品中,检出限也可达8.0×10-9 mol·L-1,动态检测范围也达两个数量级.
Liu课题组[114]也利用共价偶联UCNPs的方法,实现可视化纸基FRET传感器用于唾液中可卡因毒品的检测.作者将氨基修饰的UCNPs共价固定在纸张表面,并将可卡因适配体合理设计成两段,分别修饰在纸张和纳米金表面;只有在目标物可卡因存在的条件下,通过两段适配体同时识别可卡因才能拉近能量供受体间的距离,从而猝灭UCNPs的荧光,其猝灭程度与可卡因浓度之间存在相关性.此外,作者还将检测方式简化,只利用一部智能手机即可进行检测;且能用于大鼠血浆中可卡因含量的监测,具有较好的灵敏度和较快的分析速度.
与传统纸基传感器多用荧光仪、荧光显微镜等价格昂贵的精密仪器作为检测仪器相比,发展简单且灵敏度高的检测仪器更符合纸基分析装置的理念.因此,利用智能手机等移动设备作为检测仪器引起越来越多的关注[115, 116].这些移动设备具有存储、处理、传输数据和对原始颜色进行成像的能力,逐渐成为一类极具潜力的信号收集装置[117~119].Wang等[112]利用UCNPs检测端粒酶活性中,即以智能手机拍照,然后进行后续图像处理.He等[114]利用手机对大鼠血浆中可卡因的检测也取得了较好的效果.Zhang课题组[120]则是利用3D打印技术,自组装检测装置,并编程安卓手机程序,利用手机拍照实时检测杀虫剂,一定程度上简化了检测流程,且检出限可达1.0×10-7 mol·L-1.
5 结论与展望上转换纳米材料由于其近红外激发、反斯托克斯发射的特点,成为一类性质优良的FRET能量供体,而UC-FRET技术因能够避免紫外或者可见光激发下复杂样品中本底荧光、散射光的干扰,以及能量供受体同时激发的特点,被广泛用于在复杂样本(如血液、唾液、尿液等)中构建传感模型.
但是,与广泛使用的有机染料及量子点等材料相比,上转换纳米材料的应用范围仍不够广泛,需要进一步地拓展、改进和完善,以下是今后发展的几个方向:
1) 提高上转换纳米材料的发光效率.目前,上转换纳米材料的发光效率普遍偏低,这主要是由于稀土离子的吸收截面小,以及非辐射跃迁带来的能量损失导致的.因此,探索新的合成技术以及寻找新的基质材料,将是今后的研究热点.
2) 发展多种形式的检测机理.目前均相检测构建的原理比较单一,大多是基于UC-FRET体系,这在一定程度上限制了检测的灵活性.
3) 研究UCNPs在纸张表面分布规律.纳米材料在纸张表面的分布对检测结果有明显的影响,因此,发展稳定的纳米材料在纸张表面的固定方法,以及研究其在纸张表面的分布规律和扩散规律,提高检测的灵敏度和检测范围,是建立高性能的纸基分析装置的基础和发展前景,具有重要的价值.
4) 发展纸基UC-FRET配套的便携式检测仪器.目前基于纸基的UC-FRET检测方法还没有商业化的检测仪器,多是利用荧光显微镜或者自行组装的仪器进行检测,仪器检测价格昂贵,不适于即时检验(point-of-care testing, POCT)诊断市场的发展,而自行组装的仪器难以建立统一的标准,因此,研发商业化的统一标准的便携式检测仪器将是今后纸基UC-FRET发展的一个重要领域.
5) 研发纸基UC-FRET的体外诊断试剂盒.随着生活水平的提高,人们对自身健康越来越关注,因此集UC-FRET优势与纸基特点于一身的分析方法具有广阔的应用前景.目前研究大多集中于实验室水平,因此将实验成果转换为实用性产品还具有一定的挑战性.
| [1] |
WANG F, LIU X G. Recent advances in the chemistry of lanthanide-doped upconversion nanocrystals[J]. Chemical Society Reviews, 2009, 38(4): 976-989. DOI:10.1039/b809132n |
| [2] |
AUZEL F. Upconversion and anti-stokes processes with f and d ions in solids[J]. Chemical Reviews, 2004, 104(1): 139-174. DOI:10.1021/cr020357g |
| [3] |
BEER D, WEBER J. Photobleaching of organic laser dyes[J]. Optics Communications, 1972, 5(4): 307-309. DOI:10.1016/0030-4018(72)90105-8 |
| [4] |
KAMINOW I P, STULZ L W, CHANDROSS E A, et al. Photobleaching of organic laser dyes in solid matrices[J]. Applied Optics, 1972, 11(7): 1563-1567. DOI:10.1364/AO.11.001563 |
| [5] |
EGGELING C, WIDENGREN J, RIGLER R, et al. Photobleaching of fluorescent dyes under conditions used for single-molecule detection: Evidence of two-step photolysis[J]. Analytical Chemistry, 1998, 70(13): 2651-2659. DOI:10.1021/ac980027p |
| [6] |
YU W W, QU L H, GUO W Z, et al. Experimental determination of the extinction coefficient of CdTe, CdSe, and CdS nanocrystals[J]. Chemistry of Materials, 2003, 15(14): 2854-2860. DOI:10.1021/cm034081k |
| [7] |
RESCH-GENGER U, GRABOLLE M, CAVALIERE-JARICOT S, et al. Quantum dots versus organic dyes as fluorescent labels[J]. Nature Methods, 2008, 5(9): 763-775. DOI:10.1038/nmeth.1248 |
| [8] |
HARDMAN R. A toxicologic review of quantum dots: Toxicity depends on physicochemical and environmental factors[J]. Environmental Health Perspectives, 2006, 114(2): 165-172. DOI:10.1289/ehp.8284 |
| [9] |
SHIOHARA A, HOSHINO A, HANAKI K-I, et al. On the cyto-toxicity caused by quantum dots[J]. Microbiology and Immunology, 2004, 48(9): 669-675. DOI:10.1111/j.1348-0421.2004.tb03478.x |
| [10] |
TSOI K M, DAI Q, ALMAN B A, et al. Are quantum dots toxic? Exploring the discrepancy between cell culture and animal studies[J]. Accounts of Chemical Research, 2013, 46(3): 662-671. DOI:10.1021/ar300040z |
| [11] |
AUBIN J E. Autofluorescence of viable cultured mammalian cells[J]. Journal of Histochemistry & Cytochemistry, 1979, 27(1): 36-43. DOI:10.1177/27.1.220325 |
| [12] |
YANG Y L, YE Y M, LI F M, et al. Characteristic autofluorescence for cancer diagnosis and its origin[J]. Lasers in Surgery and Medicine, 1987, 7(6): 528-532. DOI:10.1002/lsm.1900070617 |
| [13] |
CHEN G Y, OHULCHANSKYY T Y, KUMAR R, et al. Ultrasmall monodisperse NaYF4:Yb3+/Tm3+ nanocrystals with enhanced near-infrared to near-infrared upconversion photoluminescence[J]. ACS Nano, 2010, 4(6): 3163-3168. DOI:10.1021/nn100457j |
| [14] |
CHEN G Y, OHULCHANSKYY T Y, LAW W C, et al. Monodisperse NaYbF4: Tm3+/NaGdF4 core/shell nanocrystals with near-infrared to near-infrared upconversion photoluminescence and magnetic resonance properties[J]. Nanoscale, 2011, 3(5): 2003-2008. DOI:10.1039/C0NR01018A |
| [15] |
CHEN G Y, SHEN J, OHULCHANSKYY T Y, et al. (α-NaYbF4:Tm3+)/CaF2 core/shell nanoparticles with efficient near-infrared to near-infrared upconversion for high-contrast deep tissue bioimaging[J]. ACS Nano, 2012, 6(9): 8280-8287. DOI:10.1021/nn302972r |
| [16] |
LI C X, LIN J. Rare earth fluoride nano-/microcrystals: Synthesis, surface modification and application[J]. Journal of Materials Chemistry, 2010, 20(33): 6831-6847. DOI:10.1039/C0JM00031K |
| [17] |
CHEN G Y, QIU H L, PRASAD P N, et al. Upconversion nanoparticles: Design, nanochemistry, and applications in theranostics[J]. Chemical Reviews, 2014, 114(10): 5161-5214. DOI:10.1021/cr400425h |
| [18] |
JUDD B R. Optical absorption intensities of rare-earth ions[J]. Physical Review, 1962, 127(3): 750. DOI:10.1103/PhysRev.127.750 |
| [19] |
OFELT G S. Intensities of crystal spectra of rare-earth ions[J]. The Journal of Chemical Physics, 1962, 37(3): 511-520. DOI:10.1063/1.1701366 |
| [20] |
DONG H, SUN L D, YAN C H. Energy transfer in lanthanide upconversion studies for extended optical applications[J]. Chemical Society Reviews, 2015, 44(6): 1608-1634. DOI:10.1039/C4CS00188E |
| [21] |
PELLE F, AUZEL F. Phonon bottleneck effect in multiphonon non-radiative transitions of rare-earth ions[J]. Journal of luminescence, 1998, 76: 623-627. DOI:10.1016/S0022-2313(97)00166-X |
| [22] |
AUZEL F E. Materials and devices using double-pumped-phosphors with energy transfer[J]. Proceedings of the IEEE, 1973, 61(6): 758-786. DOI:10.1109/PROC.1973.9155 |
| [23] |
WANG F, LIU X G. Upconversion multicolor fine-tuning: Visible to near-infrared emission from lanthanide-doped NaYF4 nanoparticles[J]. Journal of the American Chemical Society, 2008, 130(17): 5642-5643. DOI:10.1021/ja800868a |
| [24] |
WANG G F, PENG Q, LI Y D. Upconversion luminescence of monodisperse CaF2:Yb3+/Er3+ nanocrystals[J]. Journal of the American Chemical Society, 2009, 131(40): 14200-14201. DOI:10.1021/ja906732y |
| [25] |
JOUBERT M F. Photon avalanche upconversion in rare earth laser materials[J]. Optical Materials, 1999, 11(2): 181-203. DOI:10.1016/S0925-3467(98)00043-3 |
| [26] |
LAHOZ F, MARTIN I R, CALVILLA-QUINTERO J M. Ultraviolet and white photon avalanche upconversion in Ho3+-doped nanophase glass ceramics[J]. Applied Physics Letters, 2005, 86(5): 51106. DOI:10.1063/1.1861975 |
| [27] |
STREK W, DEREN P, BEDNARKIEWICZ A. Cooperative processes in KYb(WO4)2 crystal doped with Eu3+ and Tb3+ ions[J]. Journal of Luminescence, 2000, 87-89: 999-1001. DOI:10.1016/S0022-2313(99)00505-0 |
| [28] |
WANG F, DENG R R, WANG J, et al. Tuning upconversion through energy migration in core-shell nanoparticles[J]. Nature Materials, 2011, 10(12): 968-973. DOI:10.1038/nmat3149 |
| [29] |
SU Q Q, HAN S Y, XIE X J, et al. The effect of surface coating on energy migration-mediated upconversion[J]. Journal of the American Chemical Society, 2012, 134(51): 20849-20857. DOI:10.1021/ja3111048 |
| [30] |
ZHANG Y W, SUN X, SI R, et al. Single-crystalline and monodisperse LaF3 triangular nanoplates from a single-source precursor[J]. Journal of the American Chemical Society, 2005, 127(10): 3260-3261. DOI:10.1021/ja042801y |
| [31] |
SUN X, ZHANG Y W, DU Y P, et al. From trifluoroacetate complex precursors to monodisperse rare-earth fluoride and oxyfluoride nanocrystals with diverse shapes through controlled fluorination in solution phase[J]. Chemistry A European Journal, 2007, 13(8): 2320-2332. DOI:10.1002/chem.200601072 |
| [32] |
WANG X, ZHUANG J, PENG Q, et al. A general strategy for nanocrystal synthesis[J]. Nature, 2005, 437: 121-124. DOI:10.1038/nature03968 |
| [33] |
WANG X, ZHUANG J, PENG Q, et al. Hydrothermal synthesis of rare-earth fluoride nanocrystals[J]. Inorganic Chemistry, 2006, 45(17): 6661-6665. DOI:10.1021/ic051683s |
| [34] |
WANG L Y, LI Y D. Na(Y1.5Na0.5)F6 single-crystal nanorods as multicolor luminescent materials[J]. Nano Letters, 2006, 6(8): 1645-1649. DOI:10.1021/nl060684u |
| [35] |
STOUWDAM J W, FRANK C J M, van VEGGEL. Near-infrared emission of redispersible Er3+, Nd3+, and Ho3+ doped LaF3 nanoparticles[J]. Nano Letters, 2002, 2(7): 733-737. DOI:10.1021/nl025562q |
| [36] |
LI Z Q, ZHANG Y. An efficient and user-friendly method for the synthesis of hexagonal-phase NaYF4:Yb, Er/Tm nanocrystals with controllable shape and upconversion fluorescence[J]. Nanotechnology, 2008, 19(34): 345606. DOI:10.1088/0957-4484/19/34/345606 |
| [37] |
CHEN G Y, OHULCHANSKYY T Y, LAW W C, et al. Monodisperse NaYbF4:Tm3+/NaGdF4 core/shell nanocrystals with near-infrared to near-infrared upconversion photoluminescence and magnetic resonance properties[J]. Nanoscale, 2011, 3: 2003-2008. DOI:10.1039/C0NR01018A |
| [38] |
ZHANG Q B, SONG K, ZHAO J W, et al. Hexanedioic acid mediated surface-ligand-exchange process for transferring NaYF4:Yb/Er (or Yb/Tm) up-converting nanoparticles from hydrophobic to hydrophilic[J]. Journal of Colloid and Interface Science, 2009, 336(1): 171-175. DOI:10.1016/j.jcis.2009.04.024 |
| [39] |
CAO T Y, YANG T S, GAO Y, et al. Water-soluble NaYF4:Yb/Er upconversion nanophosphors: Synthesis, characteristics and application in bioimaging[J]. Inorganic Chemistry Communications, 2010, 13(3): 392-394. DOI:10.1016/j.inoche.2009.12.031 |
| [40] |
YI G S, PENG Y F, GAO Z Q. Strong red-emitting near-infrared-to-visible upconversion fluorescent nanoparticles[J]. Chemistry of Materials, 2011, 23(11): 2729-2734. DOI:10.1021/cm103175s |
| [41] |
WANG M, MI C C, WANG W X, et al. Immunolabeling and NIR-excited fluorescent imaging of HeLa cells by using NaYF4:Yb, Er upconversion nanoparticles[J]. ACS Nano, 2009, 3(6): 1580-1586. DOI:10.1021/nn900491j |
| [42] |
BOGDAN N, VETRONE F, OZIN G A, et al. Synthesis of ligand-free colloidally stable water dispersible brightly luminescent lanthanide-doped upconverting nanoparticles[J]. Nano Letters, 2011, 11(2): 835-840. DOI:10.1021/nl1041929 |
| [43] |
CHEN Z G, CHEN H L, HU H, et al. Versatile synthesis strategy for carboxylic acid-functionalized upconverting nanophosphors as biological labels[J]. Journal of the American Chemical Society, 2008, 130(10): 3023-3029. DOI:10.1021/ja076151k |
| [44] |
WANG L Y, YAN R X, HUO Z Y, et al. Fluorescence resonant energy transfer biosensor based on upconversion-luminescent nanoparticles[J]. Angewandte Chemie International Edition, 2005, 44(37): 6054-6057. DOI:10.1002/anie.200501907 |
| [45] |
SIVAKUMAR S, DIAMENTE P R, VAN VEGGEL F C J M. Silica-coated Ln3+-doped LaF3 nanoparticles as robust down-and upconverting biolabels[J]. Chemistry-A European Journal, 2006, 12(22): 5878-5884. DOI:10.1002/chem.200600224 |
| [46] |
LI Z Q, GUO H C, QIAN H S, et al. Facile microemulsion route to coat carbonized glucose on upconversion nanocrystals as high luminescence and biocompatible cell-imaging probes[J]. Nanotechnology, 2010, 21(31): 315105. DOI:10.1088/0957-4484/21/31/315105 |
| [47] |
LI Z Q, ZHANG Y, SHUTER B, et al. Hybrid lanthanide nanoparticles with paramagnetic shell coated on upconversion fluorescent nanocrystals[J]. Langmuir, 2009, 25(20): 12015-12018. DOI:10.1021/la903113u |
| [48] |
DAS G K, HENG B C, NG S C, et al. Gadolinium oxide ultranarrow nanorods as multimodal contrast agents for optical and magnetic resonance imaging[J]. Langmuir, 2010, 26(11): 8959-8965. DOI:10.1021/la904751q |
| [49] |
BAYLEY H, CREMER P S. Stochastic sensors inspired by biology[J]. Nature, 2001, 413(6852): 226-230. DOI:10.1038/35093038 |
| [50] |
TU D T, ZHENG W, LIU Y S, et al. Luminescent biodetection based on lanthanide-doped inorganic nanoprobes[J]. Coordination Chemistry Reviews, 2014, 273-274: 13-29. DOI:10.1016/j.ccr.2013.11.017 |
| [51] |
WEISS A, ABRAMOWSKI D, BIBEL M, et al. Single-step detection of mutant huntingtin in animal and human tissues: A bioassay for Huntington's disease[J]. Analytical Biochemistry, 2009, 395(1): 8-15. DOI:10.1016/j.ab.2009.08.001 |
| [52] |
SIITARI H, HEMMILA I, SOINI E, et al. Detection of hepatitis B surface antigen using time-resolved fluoroimmunoassay[J]. Nature, 1983, 301(5897): 258-260. DOI:10.1038/301258a0 |
| [53] |
WANG X D, STOLWIJK J A, LANG T, et al. Ultra-small, highly stable, and sensitive dual nanosensors for imaging intracellular oxygen and pH in cytosol[J]. Journal of the American Chemical Society, 2012, 134(41): 17011-17014. DOI:10.1021/ja308830e |
| [54] |
HONG H Y, LAM J W Y, TANG B Z. Aggregation-induced emission: Phenomenon, mechanism and applications[J]. Chemical Communications, 2009, 40(29): 4332-4353. DOI:10.1039/B904665H |
| [55] |
BORISOV S M, WOLFBEIS O S. Optical biosensors[J]. Chemical Reviews, 2008, 108(2): 423-461. DOI:10.1021/cr068105t |
| [56] |
BUNZLI J C G. Lanthanide luminescence for biomedical analyses and imaging[J]. Chemical Reviews, 2010, 110(5): 2729-2755. DOI:10.1021/cr900362e |
| [57] |
SAPSFORD K E, BERTI L, MEDINTZ I L. Materials for fluorescence resonance energy transfer analysis: Beyond traditional donor-acceptor combinations[J]. Angewandte Chemie International Edition, 2006, 45(28): 4562-4589. DOI:10.1002/anie.200503873 |
| [58] |
HUANG S H, WU W S, HUANG LY, et al. New continuous fluorometric assay for bacterial transglycosylase using förster resonance energy transfer[J]. Journal of the American Chemical Society, 2013, 135(45): 17078-17089. DOI:10.1021/ja407985m |
| [59] |
ZHAO C C, ZHANG X L, LI K B, et al. Förster resonance energy transfer switchable self-assembled micellar nanoprobe: Ratiometric fluorescent trapping of endogenous H2S generation via fluvastatin-stimulated upregulation[J]. Journal of the American Chemical Society, 2015, 137(26): 8490-8498. DOI:10.1021/jacs.5b03248 |
| [60] |
BRUIN G D, XIN B T, FLOREA B I, et al. Proteasome subunit selective activity-based probes report on proteasome core particle composition in a native polyacrylamide gel electrophoresis fluorescence-resonance energy transfer assay[J]. Journal of the American Chemical Society, 2016, 138(31): 9874-9880. DOI:10.1021/jacs.6b04207 |
| [61] |
WILLARD D M, CARILLO L L, JUNG J, et al. CdSe-ZnS quantum dots as resonance energy transfer donors in a model protein-protein binding assay[J]. Nano Letters, 2001, 1(9): 469-474. DOI:10.1021/nl015565n |
| [62] |
SCHMID J A, SCHOLZE P, KUDLACEK O, et al. Oligomerization of the human serotonin transporter and of the rat GABA transporter 1 visualized by fluorescence resonance energy transfer microscopy in living cells[J]. Journal of Biological Chemistry, 2001, 276(1): 3805-3810. DOI:10.1074/jbc.M007357200 |
| [63] |
KUNINGAS K, RANTANEN T, UKONAHO T, et al. Homogeneous assay technology based on upconverting phosphors[J]. Analytical Chemistry, 2005, 77(22): 7348-7355. DOI:10.1021/ac0510944 |
| [64] |
WANG M, HOU W, MI C C, et al. Immunoassay of goat antihuman immunoglobulin G antibody based on luminescence resonance energy transfer between near-infrared responsive NaYF4:Yb, Er upconversion fluorescent nanoparticles and gold nanoparticles[J]. Analytical Chemistry, 2009, 81(21): 8783-8789. DOI:10.1021/ac901808q |
| [65] |
JO E J, MUN H, KIM M G. Homogeneous immunosensor based on luminescence resonance energy transfer for glycated hemoglobin detection using upconversion nanoparticles[J]. Analytical Chemistry, 2016, 88(5): 2742-2746. DOI:10.1021/acs.analchem.5b04255 |
| [66] |
WANG Y H, WU Z J, LIU Z H. Upconversion fluorescence resonance energy transfer biosensor with aromatic polymer nanospheres as the lable-free energy acceptor[J]. Analytical Chemistry, 2012, 85(1): 258-264. DOI:10.1021/ac302659b |
| [67] |
WANG Z, LI X H, SONG Y C, et al. An upconversion luminescence nanoprobe for the ultrasensitive detection of hyaluronidase[J]. Analytical Chemistry, 2015, 87(11): 5816-5823. DOI:10.1021/acs.analchem.5b01131 |
| [68] |
WANG Y H, BAO L, LIU Z H, et al. Aptamer biosensor based on fluorescence resonance energy transfer from upconverting phosphors to carbon nanoparticles for thrombin detection in human plasma[J]. Analytical Chemistry, 2011, 83(21): 8130-8137. DOI:10.1021/ac201631b |
| [69] |
WANG Y H, SHEN P, LI C Y, et al. Upconversion fluorescence resonance energy transfer based biosensor for ultrasensitive detection of matrix metalloproteinase-2 in blood[J]. Analytical Chemistry, 2012, 84(3): 1466-1473. DOI:10.1021/ac202627b |
| [70] |
YUAN Y X, WU S F, SHU F, et al. An MnO2 nanosheet as a label-free nanoplatform for homogeneous biosensing[J]. Chemical Communications, 2014, 50(9): 1095-1097. DOI:10.1039/c3cc47755j |
| [71] |
ZHANG P, ROGEIJ S, NGUYEN K, et al. Design of a highly sensitive and specific nucleotide sensor based on photon upconverting particles[J]. Journal of the American Chemical Society, 2006, 128(38): 12410-12411. DOI:10.1021/ja0644024 |
| [72] |
KUMAR M, ZHANG P. Highly sensitive and selective label-free optical detection of DNA hybridization based on photon upconverting nanoparticles[J]. Langmuir, 2009, 25(11): 6024-6027. DOI:10.1021/la900936p |
| [73] |
WANG P, AHMADOV T O, LEE C, et al. Ligase-assisted signal-amplifiable DNA detection using upconversion nanoparticles[J]. RSC Advances, 2013, 3(37): 16326-16329. DOI:10.1039/c3ra42421a |
| [74] |
WANG P, ZHANG P. Ligase-assisted, upconversion luminescence resonance energy transfer-based method for specific and sensitive detection of V600E mutation in the BRAF gene[J]. RSC Advances, 2014, 4(99): 56235-56240. DOI:10.1039/c4ra10181b |
| [75] |
WANG P, JOSHI P, ALAZEMI A, et al. Upconversion nanoparticle-based ligase-assisted method for specific and sensitive detection of T790M mutation in epidermal growth factor receptor[J]. Biosensors and Bioelectronics, 2014, 62: 120-126. DOI:10.1016/j.bios.2014.06.037 |
| [76] |
CHEN Z G, CHEN H L, HU H, et al. Versatile synthesis strategy for carboxylic acid-functionalized upconverting nanophosphors as biological labels[J]. Journal of the American Chemical Society, 2008, 130(10): 3023-3029. DOI:10.1021/ja076151k |
| [77] |
RANTANEN T, JARVENPAA M L, VUOJOLA J, et al. Upconverting phosphors in a dual-parameter LRET-based hybridization assay[J]. Analyst, 2009, 134(8): 1713-1716. DOI:10.1039/b901299k |
| [78] |
YUAN Y X, LIU Z H. An effective approach to enhanced energy-transfer efficiency from up-converting phosphors and increased assay sensitivity[J]. Chemical Communications, 2012, 48(60): 7510-7512. DOI:10.1039/c2cc33289b |
| [79] |
LU C H, YANG H H, ZHU C L, et al. A graphene platform for sensing biomolecules[J]. Angewandte Chemie International Edition, 2009, 48(26): 4785-4787. DOI:10.1002/anie.200901479 |
| [80] |
ALONSO-CRISTOBAL P, VILELA P, EL-SAGHE- ER A, et al. Highly sensitive DNA sensor based on upconversion nanoparticles and graphene oxide[J]. ACS applied materials & interfaces, 2015, 7(23): 12422-12429. DOI:10.1021/am507591u |
| [81] |
KUNINGAS K, UKONAHO T, PAKKILA H, et al. Upconversion fluorescence resonance energy transfer in a homogeneous immunoassay for estradiol[J]. Analytical Chemistry, 2006, 78(13): 4690-4696. DOI:10.1021/ac0603983 |
| [82] |
KUNINGAS K, PAKKILA H, UKONAHO T, et al. Upconversion fluorescence enables homogeneous immunoassay in whole blood[J]. Clinical Chemistry, 2007, 53(1): 145-146. DOI:10.1373/clinchem.2006.076687 |
| [83] |
ZHANG C L, YUAN Y X, ZHANG S M, et al. Biosensing platform based on fluorescence resonance energy transfer from upconverting nanocrystals to graphene oxide[J]. Angewandte Chemie International Edition, 2011, 50(30): 6851-6854. DOI:10.1002/anie.201100769 |
| [84] |
PENG J H, WANG Y H, WANG J L, et al. A new biosensor for glucose determination in serum based on up-converting fluorescence resonance energy transfer[J]. Biosensors and Bioelectronics, 2011, 28(1): 414-420. DOI:10.1016/j.bios.2011.07.057 |
| [85] |
WU S, KONG X J, CEN Y, et al. Fabrication of a LRET-based upconverting hybrid nanocomposite for turn-on sensing of H2O2 and glucose[J]. Nanoscale, 2016, 8(16): 8939-8946. DOI:10.1039/c6nr00470a |
| [86] |
LI Z, LV S W, WANG Y L, et al. Construction of LRET-based nanoprobe using upconversion nanoparticles with confined emitters and bared surface as luminophore[J]. Journal of the American Chemical Society, 2015, 137(9): 3421-3427. DOI:10.1021/jacs.5b01504 |
| [87] |
LI Z, LIANG T, LÜ S W, et al. A rationally designed upconversion nanoprobe for in vivo detection of hydroxyl radical[J]. Journal of the American Chemical Society, 2015, 137(34): 11179-11185. DOI:10.1021/jacs.5b06972 |
| [88] |
YUAN J, CEN Y, KONG X J, et al. MnO2-nanosheet-modified upconversion nanosystem for sensitive turn-on fluorescence detection of H2O2 and glucose in blood[J]. ACS Applied Materials & Interfaces, 2015, 7(19): 10548-10555. DOI:10.1021/acsami.5b02188 |
| [89] |
KUMAR M, ZHANG P. Highly sensitive and selective label-free optical detection of mercuric ions using photon upconverting nanoparticles[J]. Biosensors and Bioelectronics, 2010, 25(11): 2431-2435. DOI:10.1016/j.bios.2010.03.038 |
| [90] |
HUANG L J, YU R Q, CHU X. DNA-functionalized upconversion nanoparticles as biosensors for rapid, sensitive, and selective detection of Hg2+ in complex matrices[J]. Analyst, 2015, 140(15): 4987-4990. DOI:10.1039/C5AN00635J |
| [91] |
XU S, XU S, ZHU Y, et al. A novel upconversion, fluorescence resonance energy transfer biosensor (FRET) for sensitive detection of lead ions in human serum[J]. Nanoscale, 2014, 6(21): 12573-12579. DOI:10.1039/C4NR03092C |
| [92] |
WU S J, DUAN N, SHI Z, et al. Dual fluorescence resonance energy transfer assay between tunable upconversion nanoparticles and controlled gold nanoparticles for the simultaneous detection of Pb2+ and Hg2+[J]. Talanta, 2014, 128(1): 327-336. DOI:10.1016/j.talanta.2014.04.056 |
| [93] |
HU X X, WEI T, WANG J, et al. Near-infrared-light mediated ratiometric luminescent sensor for multimode visualized assays of explosives[J]. Analytical Chemistry, 2014, 86(20): 10484-10491. DOI:10.1021/ac5032308 |
| [94] |
LONG Q, LI H T, ZHANG Y Y, et al. Upconversion nanoparticle-based fluorescence resonance energy transfer assay for organophosphorus pesticides[J]. Biosensors and Bioelectronics, 2015, 68(15): 168-174. DOI:10.1016/j.bios.2014.12.046 |
| [95] |
LI H, SUN D E, LIU Y J, et al. An ultrasensitive homogeneous aptasensor for kanamycin based on upconversion fluorescence resonance energy transfer[J]. Biosensors and Bioelectronics, 2014, 55(15): 149-156. DOI:10.1016/j.bios.2013.11.079 |
| [96] |
WU S J, DUAN N, MA X Y, et al. Multiplexed fluorescence resonance energy transfer aptasensor between upconversion nanoparticles and graphene oxide for the simultaneous determination of mycotoxins[J]. Analytical Chemistry, 2012, 84(14): 6263-6270. DOI:10.1021/ac301534w |
| [97] |
VAN DERIJKE F, ZIJLMANS H, SHANG L, et al. Up-converting phosphor reporters for nucleic acid microarrays[J]. Nature Biotechnology, 2001, 19(3): 273. DOI:10.1038/85734 |
| [98] |
KALE V, PAKKILA H, VAINIO J, et al. Spectrally and spatially multiplexed serological array-in-well assay utilizing two-color upconversion luminescence imaging[J]. Analytical Chemistry, 2016, 88(8): 4470-4477. DOI:10.1021/acs.analchem.6b00337 |
| [99] |
HAMPL J, HALL M, MUFTI N A, et al. Upconverting phosphor reporters in immunochromatographic assays[J]. Analytical Biochemistry, 2001, 288(2): 176-187. DOI:10.1006/abio.2000.4902 |
| [100] |
NIEDBALA R S, FEINDT H, KARDOS K, et al. Detection of analytes by immunoassay using up-converting phosphor technology[J]. Analytical Biochemistry, 2001, 293(1): 22-30. DOI:10.1006/abio.2001.5105 |
| [101] |
LIU C Y, MA W, GAO Z Y, et al. Upconversion luminescence nanoparticles-based lateral flow immunochromatographic assay for cephalexin detection[J]. Journal of Materials Chemistry C, 2014, 2(45): 9637-9642. DOI:10.1039/c4tc02034k |
| [102] |
MEI Q, LI Y, LI B N, et al. Oxidative cleavage-based upconversional nanosensor for visual evaluation of antioxidant activity of drugs[J]. Biosensors and Bioelectronics, 2015, 64: 88-93. DOI:10.1016/j.bios.2014.08.061 |
| [103] |
WU S J, DUAN N, MA X Y, et al. Simultaneous detection of enterovirus 71 and coxsackievirus A16 using dual-colour upconversion luminescent nanoparticles as labels[J]. Chemical Communications, 2012, 48(40): 4866-4868. DOI:10.1039/C2CC00092J |
| [104] |
MARTINEZA W, PHILLIPS S T, WHITESIDES G M, et al. Diagnostics for the developing world: microfluidic paper-based analytical devices[J]. Analytical Chemistry, 2010, 82(1): 3-10. DOI:10.1021/ac9013989 |
| [105] |
ZHAO P, WU Y Y, ZHU Y H, et al. Upconversion fluorescent strip sensor for rapid determination of Vibrio anguillarum.[J]. Nanoscale, 2014, 6(7): 3804-3809. DOI:10.1039/C3NR06549A |
| [106] |
MOKKAPATI V K, NIEDBALA R S, KARDOS K, et al. Evaluation of UPlink-RSV: Prototype rapid antigen test for detection of respiratory syncytial virus infection[J]. Annals of the New York Academy of Sciences, 2007, 1098(1): 476-485. DOI:10.1196/annals.1384.021 |
| [107] |
CORSTJENS P, ZUIDERWIJK M, BRINK A, et al. Use of up-converting phosphor reporters in lateral-flow assays to detect specific nucleic acid sequences: A rapid, sensitive DNA test to identify human papillomavirus type 16 infection[J]. Clinical Chemistry, 2001, 47(10): 1885-1893. |
| [108] |
MARTINEZ A W, PHILLIPS S T, BUTTE M J, et al. Patterned paper as a platform for inexpensive, low-volume, portable bioassays[J]. Angewandte Chemie International Edition, 2007, 46(8): 1318-1320. DOI:10.1002/anie.200603817 |
| [109] |
HE M Y, LIU Z H. Paper-based microfluidic device with upconversion fluorescence assay[J]. Analytical Chemistry, 2013, 85(24): 11691-11694. DOI:10.1021/ac403693g |
| [110] |
JIANG P, HE M Y, SHEN L, et al. A paper-supported aptasensor for total IgE based on luminescenceresonance energy transfer from upconversion nanoparticles to carbon nanoparticles[J]. Sensors and Actuators B: Chemical, 2017, 239: 319-324. DOI:10.1016/j.snb.2016.08.005 |
| [111] |
JU Q, UDDAYASANKAR U, KRULL U J. Paper-based DNA detection using lanthanide-doped LiYF4 upconversion nanocrystals as bioprobe[J]. Small, 2014, 10(19): 3912-3917. DOI:10.1002/smll.201400683 |
| [112] |
WANG F M, LI W, WANG J S, et al. Detection of telomerase on upconversion nanoparticle modified cellulose paper[J]. Chemical Communications, 2015, 51(58): 11630-11633. DOI:10.1039/C5CC03902A |
| [113] |
DOUGHAN S, UDDAYASANKAR U, KRULL U J. A paper-based resonance energy transfer nucleic acid hybridization assay using upconversion nanoparticles as donors and quantum dots as acceptors[J]. Analytica Chimica Acta, 2015, 878(9): 1-8. DOI:10.1016/j.aca.2015.04.036 |
| [114] |
HE M Y, LI Z, GE Y Y, et al. Portable upconversion nanoparticles-based paper device for field testing of drug abuse[J]. Analytical Chemistry, 2016, 88(3): 1530-1534. DOI:10.1021/acs.analchem.5b04863 |
| [115] |
ERICKSON D, O'DELL D, JIANG L, et al. Smartphone technology can be transformative to the deployment of lab-on-chip diagnostics[J]. Lab on a Chip, 2014, 14(17): 3159-3164. DOI:10.1039/c4lc00142g |
| [116] |
OZCANABC A. Mobile phones democratize and cultivate next-generation imaging, diagnostics and measurement tools[J]. Lab on a Chip, 2014, 14(17): 3187-3194. DOI:10.1039/c4lc00010b |
| [117] |
COSKUN A F, NAGI R, SADEGHI K, et al. Albumin testing in urine using a smart-phone[J]. Lab on a Chip, 2013, 13(21): 4231-4238. DOI:10.1039/c3lc50785h |
| [118] |
ONCESCU A, MANCUSOB M, ERICKSON D, et al. Cholesterol testing on a smartphone[J]. Lab on a Chip, 2014, 14(4): 759-763. DOI:10.1039/c3lc51194d |
| [119] |
ONCESCU V, O'DELL D, ERICKSON D. Smartphone based health accessory for colorimetric detection of biomarkers in sweat and saliva[J]. Lab on a Chip, 2013, 13(16): 3232-3238. DOI:10.1039/c3lc50431j |
| [120] |
MEI Q G, JING H R, LI Y, et al. Smartphone based visual and quantitative assays on upconversional paper sensor[J]. Biosensors and Bioelectronics, 2016, 75: 427-432. DOI:10.1016/j.bios.2015.08.054 |
 2018, Vol. 64
2018, Vol. 64