文章信息
- 王佐成 , 范志琳 , 程彦明 , 梅泽民 . 2016
- WANG Zuocheng, FAN Zhilin, CHENG Yanming, MEI Zemin . 2016
- 半胱氨酸分子手性转变及水分子的催化机理
- Chiral Transformation of Cysteine Molecules and Catalytic Mechanism of Water Molecules
- 武汉大学学报(理学版), 2016, 62(4): 368-374
- Journal of Wuhan University(Natural Science Edition), 2016, 62(4): 368-374
- http://dx.doi.org/10.14188/j.1671-8836.2016.04.011
-
文章历史
- 收稿日期:2015-10-28

2. 辽宁师范大学 化学与材料学院,辽宁 大连 116000 ;
3. 长春理工大学 光电信息学院,吉林 长春 130000 ;
4. 白城师范学院 化学学院,吉林 白城 137000
2. College of Chemistry and Materials, Liaoning Normal University, Dalian 116000, Liaoning, China ;
3. Optoelectronic Information College, Changchun University of Science and Engineering, Changchun 130000, Jilin, China ;
4. College of Chemistry, Baicheng Normal College, Baicheng 137000, Jilin, China
根据旋光性的不同,半胱氨酸(cysteine,Cys)可以分为左旋(S型)、右旋(R型)和外消旋(SR型)三种类型.左旋体在生命体内具有生理活性,是组成蛋白质的成分之一,同一条或不同多肽链两个左旋Cys残基间以二硫键(—S—S—)连接,使蛋白质具有稳定的空间立体结构[1, 2].S-Cys盐酸盐具有恢复肝功能的作用[3, 4],并可用于食品增香剂和保鲜剂[5, 6];R-Cys可作为大肠杆菌的强抑制剂、手性药物的重要中间体[7, 8]、头孢类抗生素的合成原料[[9,10],以及用于生产具有美白、润肤、消炎等功效的化妆品[11]. 其各种衍生物可用于抗HIV药物KNI-764的合成[12].人们对半胱氨酸进行了广泛研究.Gilline等[13]发现,S-Cys中的巯基(-SH)具有还原能力和化学反应活性,可调节黑色素的生成.李娟娟等[14]用S-Cys包覆ZnS纳米粒子为荧光探针测定药物制剂中诺氟沙星含量.李树白等[15]发现S-Cys对酪氨酸酶单酚酶和二酚酶活性的抑制效应.郝雅琼等[16]对Cys小分子在银基底表面的吸附方式、作用机理进行了详细的探讨和研究.Kambo等[17]研究了Cys向胱氨酸转变的反应机制.Cai 等[18]的研究揭示了S-苏氨酸和S-Cys与Ag纳米粒子之间的相互作用机制.
已有研究表明[19-22],单体α-丙氨酸和赖氨酸的手性转变主要有4个反应通道,手性碳上的H可以羰基、氨基,或羰基和氨基联合以及羟基作为桥梁转移至手性碳的另一侧实现手性转变.文献[20, 23-25]研究表明,水分子对α-丙氨酸、赖氨酸和布洛芬等分子手性转变过程中H的迁移反应具有较好的催化作用.基于此,本文系统研究了单体Cys分子的手性转变过程,同时,考虑到生命体内有大量的水分子存在,本文还考察了水分子对Cys分子手性转变过程中主要H迁移过程的催化作用,可望为Cys手性转变的实验研究提供积极的理论参考.
1 研究方法采用基于密度泛函理论的B3LYP方法[26, 27],选择6-31+g(d,p)基组,全参数优化S-Cys向R-Cys转变过程中稳定点和过渡态[28-30].通过对过渡态进行内禀反应坐标(IRC)[31, 32]计算,对过渡态进一步确认.采用微扰理论的MP2方法[33],选择6-311++g(2df,2pd)基组计算体系的单点能,进行零点振动能修正,利用Etotal=ESP+EZPV(ESP为单点能,EZPV为零点振动能)计算总能量,计算出相对高水平的反应过程势能面.文中计算均由Gaussian09程序包[34]完成.
2 结果与讨论 2.1 R-Cys向S-Cys手性转变的反应机理在B3LYP/6-31+g(d,p)理论水平,优化得到Cys分子手性对映体结构如图 1所示.
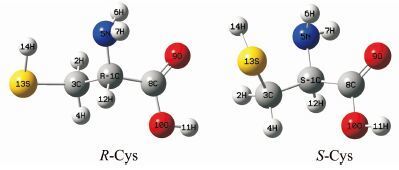
|
| 图 1 R型和S型Cys分子的几何构型 Figure 1 The geometries of R- and S- type cysteine molecules |
通过对图 1进行分析和计算可知,R-Cys向S-Cys转变有a,b,c和d 四个通道:在a通道,手性C上的H以氨基上的N为桥转移至手性C的另一侧;在b通道,手性C上的H顺次以羰基O和氨基N为桥转移至手性C的另一侧;在c通道,手性C上的H以羰基O为桥转移至手性C的另一侧;在d通道,手性C上的H以羟基O为桥转移至手性C的另一侧.各通道上的反应历程及计算的各个驻点结构见图 2~图 5.
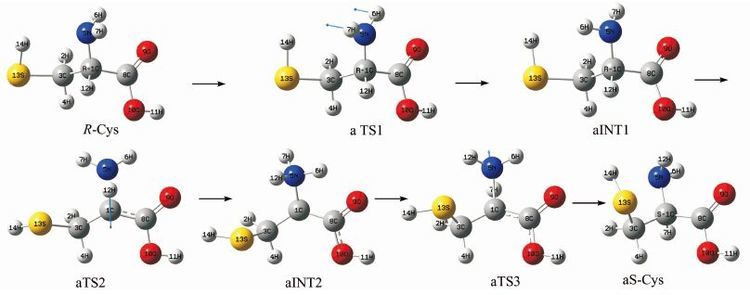
|
| 图 2 R-Cys向S-Cys转变反应通道a Figure 2 The first reaction channel a of R-Cys to S-Cys transformation |
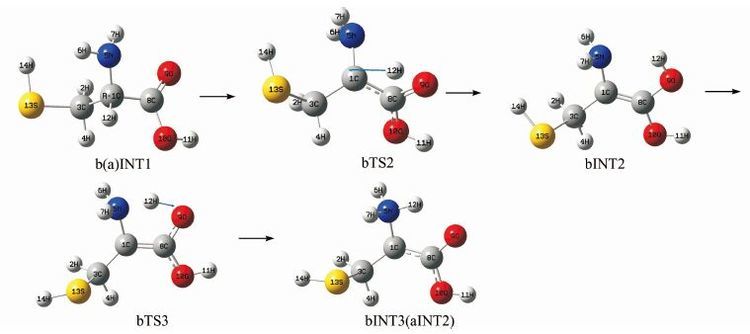
|
| 图 3 R-Cys向S-Cys转变反应通道b的部分过程 Figure 3 The partial processes of the second reaction channel b of R-Cys to S-Cys transformation |
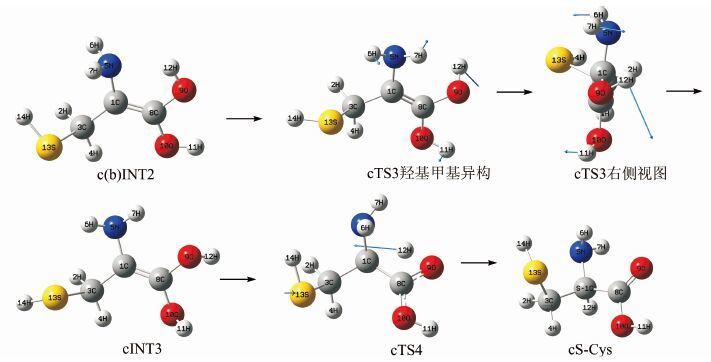
|
| 图 4 R-Cys向S-Cys转变反应通道c Figure 4 The third reaction channel c of R-Cys to S-Cys transformation |
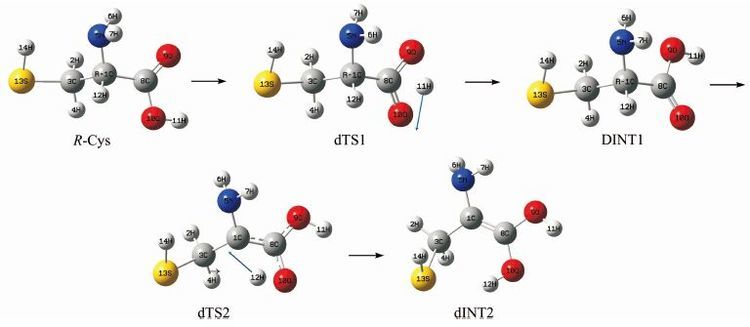
|
| 图 5 R-Cys向S-Cys转变反应通道d的部分过程 Figure 5 The partial processes of the forth reaction channel d of R-Cys to S-Cys transformation |
在a通道上,先是R-Cys的氨基5N上的6H和7H,经过在纸面内向外翻转的过渡态aTS1翻转至纸的内侧,异构成中间体aINT1;然后,12H经过渡态aTS2从手性C转移至氨基N上,异构成中间体aINT2;接着经过与aTS2对称的过渡态aTS3,氨基的纸面内侧的H从5N转移至手性碳1C,异构成为产物S-Cys,记为aS-Cys,从而完成手性转变.过渡态aTS2的1C-12H和1C-5N键均是断键,这预示着aTS2会产生较高的能垒.
在b通道上,第一步反应过程异构成中间体bINT1,同a通道的aINT1,记作b(a)INT1;接着手性C上的12H经过渡态bTS2转移至羰基氧9O上,异构成中间体bINT2;而后经过渡态bTS3,实现9O上的12H向氨基N的迁移,形成与a通道上的aINT2相同的中间体,记作bINT3(aINT2) ;之后的过程同a通道.过渡态bTS2的1C-12H断键,要克服1C-12H间较强的库仑力作用,且1C和9O的距离较远(大约0.323 57 nm),预示着aTS2可能产生更高的能垒.
在c通道,前2步反应过程同b通道,异构成的中间体cINT2,同bINT2,记作c(b)INT2;接着经过图 4所示的羧基氨基异构的过渡态cTS3,11H和12H分别翻转至纸面外和纸面内,6H和7H沿着cTS3虚频的正向旋转到纸面外,异构成有利于12H在纸面内向手性C迁移的中间体cINT3;cINT3经12H从9O向1C迁移的过渡态cTS4异构为产物cS-Cys,实现手性转变.
在d通道,首先羟基10O上11H经过渡态dTS1转移至羰基9O异构成中间体dINT1;然后,手性C上的12H经过渡态dTS2从手性C转移至羰基10O,形成中间体dINT2.以后是dINT2的羟基异构和12H在纸面内向手性碳1C迁移的过程,与c通道的cINT3之后的过程相似,不再赘述.
在MP2/6-311++g(2df,2pd)//B3LYP/6-31+g(d,p)理论水平上计算的各驻点零点振动能、单点能、过渡态的虚频以及零点能校正后的总能和相对总能量,绘制了单体R-Cys向S-Cys转变,不同的反应通道完整过程和部分过程的势能面示意图(图 6).从图 6可以看出,a通道上的最高能垒为254.6 kJ·mol-1,由手性C上的H向氨基N迁移的过渡态aTS2产生;b和c通道具有相同的最高能垒312.7 kJ·mol-1,由手性C上的H向羰基9O迁移的过渡态bTS2产生;d通道上的最高能垒为298.3 kJ·mol-1,由手性C上的H向羟基10O迁移的过渡态dTS3产生的.比较可知,a通道为优势通道.但254.6 kJ·mol-1的能垒在常温下难以逾越,说明通常情况下Cys分子具有稳定性,不会发生构象改变.
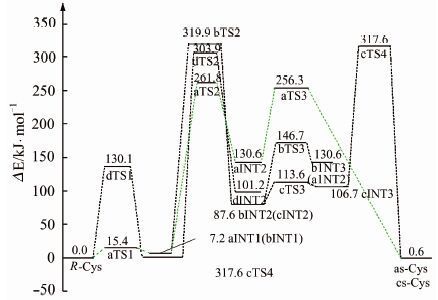
|
| 图 6 R-Cys向S-Cys转变过程的势能面示意图 Figure 6 Potential surfaces diagram of R-Cys to S-Cys transformation processes |
篇幅所限,本文只讨论水分子对优势通道a的决速步aINT1→aTS2→aINT2过程的催化.计算表明,3个水分子的联合催化作用与2个水分子链的催化作用相比增强不大,因此,本文只讨论1个水分子和2个水分子作H迁移媒介的情况.
水分子催化aINT1→aTS2→aINT2反应过程以及计算的各驻点结构见图 7.优化诸过渡态沿其虚频振动的两个方向调节得到的结构,分别得到每个过渡态对应的反应物和产物.对诸过渡态进行IRC路径探测,进一步验证了诸过渡态的可靠性.为了从结构特性上说明水分子个数的不同,对氢迁移反应具有不同的催化作用,列出aINT1·1H2O和aINT1·2H2O的主要结构参数,见表 1.
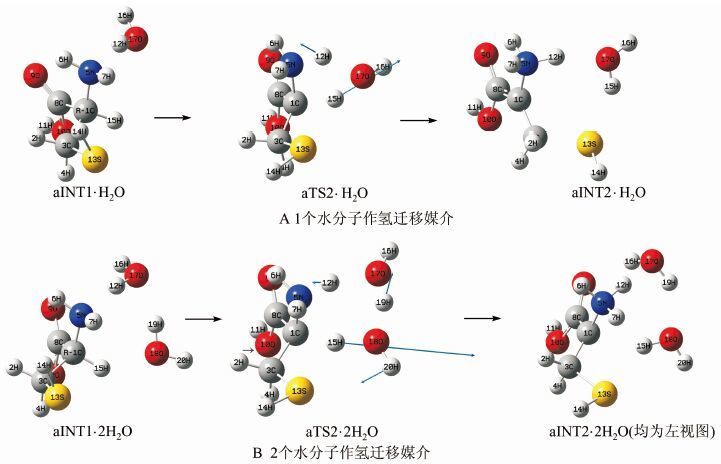
|
| 图 7 水分子作氢迁移媒介aINT1→aTS2→aINT2过程示意图 Figure 7 The processes A and B of aINT1→aTS2→aINT2 by using the water as hydrogen migration medium vector |
| nm | ||
| Structures | 主要键长 | 主要原子间距 |
| aINT1·1H2O | 0.109 36 (1C-15H) | 0.296 56 (15H-17O) |
| 0.190 74 (12H-5N) | ||
| aINT1·2H2O | 0.109 26 (1C-15H) | 0.233 08 (15H-18O) |
| 0.179 40 (19H-17O) | ||
| 0.184 74 (12H-5N) | ||
根据表 1可以看出:1) aINT1·1H2O和aINT1·2H2O中1C—15H键的键长基本相同,哪一个更易断裂取决于17O和18O与15H的距离;而由于15H-18O的键长较短,故aINT1·2H2O中的1C—15H键更易断裂.这是2H2O比1H2O作氢迁移媒介能垒较低的原因之一.2) aINT1·2H2O比aINT1·1H2O中的12H-5N的键长短,则其5N与12H之间的静电作用力较大,12H更易向5N迁移,而使得17O的电负性增加,增加了17O对即将向其迁移的19H的作用力,这是2H2O比1H2O作氢迁移媒介能垒较低的原因之二.3) aINT1·2H2O中的19H—17O键长0.179 40 nm,是强氢键,两者之间的静电作用力较大,19H-18O较容易断裂,这也增加了18O的电负性,进而增加18O对15H的引力,这是2H2O比1H2O作氢迁移媒介能垒较低的原因之三.
在MP2/6-311++g(2df,2pd)//B3LYP/6-31+g(d,p)理论水平上,计算各个驻点的零点振动能、单点能、过渡态的虚频、零点能校正后的总能及相对总能量. 势能面示意图见图 8.比较图 6和图 8可以看出,水分子对aINT1→aTS2→aINT2过程有较好的催化作用;2个水分子链具有极好的催化功能,使H迁移能垒从单体的254.6 kJ·mol-1降低至126.2 kJ·mol-1.但在体温下,此能垒仍然不能轻易地越过,要考虑温度的涨落、分子的碰撞以及体内某种酶的作用等多种因素.因此,生命体内不会有大量的Cys从左旋体转变到右旋体.
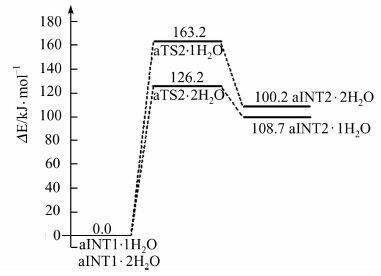
|
| 图 8 水分子为氢迁移媒介aINT1→aTS2→aINT2过程的势能面示意图 Figure 8 Potential surfaces diagram of aINT1→aTS2→ aINT2 processes using water as hydrogen migration medium vector |
在MP2/6-311++g(2df,2pd)//B3LYP/6-31+g(d,p)理论水平计算了Cys的手性转变及水分子的催化机理.研究发现:Cys分子手性转变反应有a,b,c,d四个通道;a通道为优势反应通道,最高能垒为254.6 kJ·mol-1;1个水分子以及2个水分子构成的链作为H迁移媒介,分别使最高能垒下降至163.2,126.2 kJ·mol-1.结果表明通常情况下Cys分子具有稳定性,不会发生异构,水分子对Cys手性转变有较好的催化作用,2个水分子对Cys分子的催化作用,加上温度涨落、分子碰撞和体内某种酶的作用,是生命体内Cys分子旋光异构的主要因素.
本工作发现了单体Cys手性转变反应的最优通道,对进一步研究Cys分子在纳米生物通道环境下的手性转变,更好地解释Cys分子在生命体内复杂环境的旋光异构,以及实验上利用左旋Cys获得右旋Cys提供一定的理论依据.
| [1] | 陈新谦. 新编药物学.[M] 北京: 人民卫生出版社, 1982 : 4831 . CHEN X Q. New Materia Medica.[M] Beijing: The People's Health Press, 1982 : 4831 . |
| [2] | 陈敏元. L-半胱氨酸药物及其合成[J]. 化学工程师, 1991 ,23 (5) : 39 –41. CHEN M Y. L-cysteine drugs and its synthesis[J]. Chemical Engineer, 1991, 23 (5) : 39 –41. |
| [3] | 雷绍青. 氨基酸在临床上的应用[J]. 氨基酸杂志, 1988 (4) : 26 –29. LEI S Q. Application of amino acids in the clinical[J]. Journal of Amino Acids, 1988 (4) : 26 –29. |
| [4] | 林文修, 陈丹, 王友泼. 电解合成L-半胱氨酸的研究[J]. 福建化工, 1991 ,2 (2) : 25 –28. LIN W X, CHEN D, WANG Y P, The study of electrolytic synthesis L-cysteine [J]. The study of electrolytic synthesis L-cysteine[J]. Fujian Chemical, 1991, 2 (2) : 25 –28. |
| [5] | 赵建国. 氨基酸在食品工业中的应用现状及进展[J]. 氨基酸杂志, 1984 (3) : 32 –37. ZHAO J G. Application status and progress of amino acids in the food industry[J]. Journal of Amino Acids, 1984 (3) : 32 –37. |
| [6] | 宋正选, 许晶, 郭继兴, 等. 维生素C注射液抗氧剂的选择[J]. 西北药学杂志, 2003 ,18 (2) : 75 –76. SONG Z X, XU J, GUO J X, et al. The choice of vitamin C injection antioxidants[J]. Pharmaceutical Journal of Northwest, 2003, 18 (2) : 75 –76. |
| [7] | JULIE S, SYLVAIN B, PIERRE P. Role of D-cysteine desulthydrase in the adaptation of escherichia colito D-cysteine[J]. J Biological Chemistry, 2001, 276 (44) : 40864 –40872. |
| [8] | 周锡梁, 梅亚红, 兰荣华, 等. D-半胱氨酸盐酸盐制备研究[J]. 氨基酸和生物资源, 2007 ,28 (1) : 39 –41. ZHOU X L, MEI Y H, LAN R H, et al. Research on preparation of D-cysteine hydrochloride[J]. Amino Acids & BioticResources, 2007, 28 (1) : 39 –41. |
| [9] | TSUKAMOTO S, KANEGAE T, NAGOYA T, et al. Effects of amino acids on acute alcohol intoxication in mice-concentra-tions of ethanol, acetaldehyde, acetate and acetone in blood and tissues[J]. Arukoru Kenkyuto Yakubutsu Ison, 1990, 25 (5) : 429 –440. |
| [10] | NAGASAWA T, HOSSONO H, OHKISHI H, et al. Synthesis of D-cysteine-related amino acids by 3-chloro-D-alanine chloride-lyase of pseudomonas putida CR1-1[J]. Applied Biochemistry and Biotechnology, 1983, 8 : 481 –489. |
| [11] | 刘军. (D)-半胱氨酸盐酸盐的研究和开发[D]. 大连:大连理工大学,2006: 15. LIU J. Research and Development of D-Cysteine Hydrochloride[D]. Dalian: Dalian University of Technology, 2006: 15(Ch). |
| [12] | AMI E, NAKAHARA K, SATO A, et al. Synthesis and antiviral property of allophenylnorstatine-based HIV protease inhibitors incorporating D-cysteine derivatives as P2/P3 moieties[J]. Bioorganic & Medicinal Chemistry Letters, 2007, 17 (5) : 4213 –4217. |
| [13] | GILLINE F D, DIAMOND L S. Attachment of entamoeba histolytica to glass in a defined maintenance medium: Specific requirement for cysteine and ascorbic acid[J]. Journal of Protozool, 1980, 27 (4) : 474 –478. |
| [14] | 李娟娟, 徐光明. L-半胱氨酸包覆ZnS纳米荧光探针测定诺氟沙星的研究[J]. 药物分析杂志, 2010 ,30 (3) : 361 –365. LI J J, XU G M. Study of L-cysteine-capped ZnS nanoparticles as fluorescence probe in the determination of norfloxacin[J]. Chinese Journal of Pharmaceutical Analysis, 2010, 30 (3) : 361 –365. |
| [15] | 李树白, 薛勇, 张海涛, 等. L-半胱氨酸对酪氨酸酶的抑制动力学研究[J]. 精细化工, 2009 ,26 (9) : 889 –893. LI S B, XUE Y, ZHANG H T, et al. Inhibitory kinetics of L-cysteine on tyrosinase activity[J]. Fine Chemicals, 2009, 26 (9) : 889 –893. |
| [16] | 郝雅琼, 吴玉清, 刘俊秋, 等. 半胱氨酸在银基底表面吸附机理的拉曼光谱研究[J]. 光散射学报, 2002 ,14 (3) : 172 –175. HE Y Q, WU Y Q, LIU J Q, et al. Surface enhanced raman spectroscopic studies of the monolayer of cysteine on silver mirror[J]. Chinese Journal of Light Scattering, 2002, 14 (3) : 172 –175. |
| [17] | KAMBO N, UPADHYAY S. Inhibition of {cysteine-surfactant} aggregation in cysteine-cystine transformation by alkaline hexacyanoferrate(Ⅲ): A kinetic study[J]. Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 296 (1) : 117 –122. |
| [18] | CAI P Y, ZHOU G H, YANG D C. FTIR FT-Raman and surface enhanced Raman study of S-thyminyl-L-cysteine[J]. Spectroscopy and Spectral Analysis, 2011, 31 (5) : 1274 –1278. |
| [19] | 王佐成, 刘凤阁, 吕洋, 等. 孤立条件下α-丙氨酸分子手性转变机制的DFT研究[J]. 吉林大学学报(理学版), 2014 ,52 (4) : 825 –830. WANG Z C, LIU F G, LV Y, et al. The DFT research on the chiral transformaition mechanism of alpha alanine under isolated condition[J]. Journal of Jilin University (Science Edition), 2014, 52 (4) : 825 –830. |
| [20] | 王佐成, 高峰, 赵衍辉, 等. α-丙氨酸分子手性转变反应通道及水分子作用的理论研究[J]. 浙江大学学报(理学版), 2015 ,42 (2) : 189 –197. WANG Z C, GAO F, ZHAO Y H, et al. Theoretical research on the chiral transformation pathway of α-alanine and effect of water molecules[J]. Journal of Zhejiang University(Science Edition), 2015, 42 (2) : 189 –197. |
| [21] | 刘凤阁, 辛春雨, 闫红彦, 等. 气相赖氨酸分子手性转变机制的理论研究[J]. 武汉大学学报(理学版), 2015 ,61 (1) : 93 –98. LIU F G, XIN C Y, YAN H Y, et al. Theoretical research on chiral change mechanism of gaseous lysine molecules[J]. Journal of Wuhan University(Natural Science Edition), 2015, 61 (1) : 93 –98. |
| [22] | 李忠, 佟华, 王佐成, 等. 基于氨基作H转移桥梁单体α-Ala的手性转变机理[J]. 复旦学报(自然科学版), 2015 ,54 (5) : 102 –108. LI Z, TONG H, WANG Z C, et al. The chiral transition mechanism of monomer α-alanine based on amino as H transfer bridge[J]. Journal of Zhejiang University(Natural Science), 2015, 54 (5) : 102 –108. |
| [23] | 王佐成, 佟华, 王丽萍, 等. 水环境下α-丙氨酸分子手性转变机制的理论研究[J]. 吉林大学学报(理学版), 2015 ,53 (1) : 134 –141. WANG Z C, TONG H, WANG L P, et al. Theoretical research of α-alanine molecule chiral shift mechanism under the water environment[J]. Journal of Jilin University (Science Edition), 2015, 53 (1) : 134 –141. |
| [24] | 梅泽民, 王佐成, 赵衍辉, 等. 水环境下布洛芬分子的手性转变机理[J]. 吉林大学学报(理学版), 2015 ,53 (2) : 331 –339. MEI Z M, WANG Z C, ZHAO Y H, et al. Theoretical research of chiral shift mechanism of ibuprofen molecule under water environment[J]. Journal of Jilin University (Science Edition), 2015, 53 (2) : 331 –339. |
| [25] | 刘凤阁, 王佐成, 梅泽民, 等. 水环境下赖氨酸分子的手性转变机理[J]. 武汉大学学报(理学版), 2015 ,61 (5) : 491 –496. LIU F G, WANG Z C, MEI Z M, et al. Theoretical research of chiral shift mechanism of ibuprofen molecule under water environment[J]. Journal of Wuhan University(Natural Science Edition), 2015, 61 (5) : 491 –496. |
| [26] | BECKE A D. Density-functional thermochemistry. Ⅲ. The role of exact exchange[J]. Chemical Physics, 1993, 98 (7) : 5648 –5652. |
| [27] | PARR R G, YANG W. Density-Functional Theory of Atoms and Molecules.[M] New York: Oxford University Press, 1994 . |
| [28] | EYRING H. The activated complex and the absolute rate of chemical reaction[J]. Chemical Reviews, 1935, 17 (1) : 65 –77. |
| [29] | GARRETT B C, TRUHLAR D G. Correction generalized transition state theory. Classical mechanical theory and applications to collinear reactions of hydrogen molecules[J]. Journal of Physical Chemistry, 1979, 83 (23) : 3058 . |
| [30] | GARRETT B C, TRUHLAR D G. Criterion of minimum state density in the transition state theory of bimolecular reactions[J]. The Journal of Chemical Physics, 1979, 70 (4) : 1593 –1598. |
| [31] | GONZALEZ C, SCHLEGEL H B. Reaction path following in mass-weighted internal coordinates[J]. Journal of Physical Chemistry, 1990, 94 (14) : 5523 –5527. |
| [32] | ISHIDA K, MOROKUMA K, KOMORNICKI A. The intrinsic reaction coordinate. An ab initio calculation for HNC?HCN and H-+ CH4 ?CH4+ H-[J]. The Journal of Chemical Physics, 1977, 66 (5) : 2153 –2156. |
| [33] | 徐光宪, 黎乐民, 王德民. 量子化学(中册).[M] 北京: 科学出版社, 1985 : 962 -986. XU G X, LI M L, WANG D M. Quantum Chemistry (middle).[M] Beijing: Science Press, 1985 : 962 -986. |
| [34] | FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09. Revision D.01 [CP]. Pittsburgh: Gaussian Inc, 2013. |
 2016, Vol. 62
2016, Vol. 62





