文章信息
- 齐自慧 , 杨梦歌 , 王美玉 , 王业富 . 2016
- QI Zihui, YANG Mengge, WANG Meiyu, WANG Yefu . 2016
- TaqMan实时荧光定量PCR检测外周血中survivin
- Detection of surivin in Peripheral Blood Using a TaqMan Real-Time Fluorescent Quantitative PCR
- 武汉大学学报(理学版), 2016, 62(4): 350-354
- Journal of Wuhan University(Natural Science Edition), 2016, 62(4): 350-354
- http://dx.doi.org/10.14188/j.1671-8836.2016.04.008
-
文章历史
- 收稿日期:2015-03-10

凋亡抑制蛋白survivin在正常成人组织中低表达或者不表达,但在肿瘤患者中会大量表达[1],不同癌症外周血循环肿瘤细胞(circulating tumor cell,CTC)中均具有较高的survivin基因检出率[2-5].因此,survivin基因已经成为一种新的肿瘤标志物[6-9],该基因的检测对于癌症的提前诊断、疗效评估和预后研究具有较高的临床价值.
survivin基因的检测方法多样,如放射免疫分析技术[10]、酶联免疫分析技术[11]以及化学发光免疫分析技术[12]等.这些技术都具有较高的灵敏度和特异性,但也存在不同程度的缺陷,如放射免疫分析技术需要放射性标记,不够安全,酶联免疫分析技术易出现假阳性,而化学发光免疫分析技术在研究和生产上难度较大等.PCR(聚合酶链式反应)技术具有取材量小,对病人造成的伤害小,且操作安全简便,检测快速等优点.目前,研究人员已通过PCR方法发现surivin基因能够在大多数的恶性肿瘤(如肝癌[13]、胰腺癌[14]、胃癌[15]等)中高表达.TaqMan实时荧光定量PCR技术是在普通PCR的基础上利用Taq酶5′→ 3′外切酶活性和荧光共振能量转移的原理,可对PCR反应进行实时监控,灵敏度和特异性高,检测用时短,且无需PCR后处理,避免了污染,检测样本用量少,能够实现精准定量[16].已有文献报道[17]利用SYBR Green染料法进行荧光定量PCR实验,染料法会出现非特异性结合.而TaqMan法因为探针具有特异性,不会出现非特异性扩增,特异性和敏感性也更高.目前,TaqMan荧光定量PCR法已被广泛应用于病毒、细菌的检测,如丙肝病毒[18]、轮状病毒[19]、革兰阴阳性细菌[20]等.
本实验旨在用TaqMan实时荧光定量PCR技术构建癌症患者外周血中survivin基因的检测方法.
1 材料与方法 1.1 材料、试剂及仪器材料:本实验所用样本由湖北省肿瘤医院、湖北省中医院、武汉大学附属中南医院、武汉大学校医院提供.
试剂:SanPrep柱式质粒DNA小量抽提试剂盒(生工生物工程(上海)股份有限公司);TRNzol-A+总RNA提取试剂盒(天根生化科技(北京)有限公司);UNIQ-10柱式PCR产物回收试剂盒(生工生物工程(上海)股份有限公司);限制性内切酶EcoR Ⅰ,BamH Ⅰ,Taq酶系列、RRI RNA酶抑制剂、OligodT(18) (TaKaRa 公司);M-MLV逆转录酶(Promega公司).
仪器:ABI7500型荧光定量PCR检测仪(美国应用生物系统公司);MJ-Mini TMPCR型扩增仪(Bio-Rad公司);5424R型高速冷冻离心机(艾本德中国有限公司);FR-980型凝胶成像仪(上海复日科技);Quawell TM型超微量紫外可见分光光度计(Q5000) (北京华大中生科技发展有限公司).
1.2 实验方法 1.2.1 样品处理所有样品均按照TRIzol-A+试剂盒的使用说明提取总RNA,然后将RNA反转为cDNA.
逆转录体系为25 μL,其中:5 μL反应缓冲液,1 μL 200 U/μL M-MLV逆转录酶,1.25 μL 10 mmol/L dNTPs,2 μL随机引物OligodT(18) ,0.5 μL 40 U/μL的RNase抑制剂,10 μL RNA模板,加无RNA酶水至总体积25 μL.以上体系的反应程序为42 ℃ 1 h,60 ℃ 10 min. -20 ℃保存逆转录产物.
1.2.2 引物与探针设计通过美国国家生物技术信息中心(NCBI)检索(http://www.ncbi.nlm.nih.gov),获得在多种肿瘤病人中均可检测到的野生型survivin基因(NCBI检索号:BC065497.1) 及其剪接变异体survivin-△Ex3(NM_001012270.1) ,survivin-2B(NM_001012271.1) ,survivin-2α(AY927772) 和survivin-3B(DQ227257.1) 等序列,用MEGA 4.0软件进行比对,找到保守序列.根据survivin基因保守序列进行引物探针的设计,用BeaconDesigner 7.0软件设计普通TaqMan探针及引物.所有引物探针均委托生工生物工程(上海)股份有限公司合成.
survivin保守序列(PCR产物共95 bp):
5′-CCTGGCAGCCCTTTCTCAAGGACCACCGCATCTCTACATTCAAGAACTGGCCCTTC-TTGGAGGGCTGCGCCTGCACCCCGGAGCGG-ATGGCCGAG-3′
引物及探针序列如下:
上游引物:5′-CCTGGCAGCCCTTTCTCA-3′
下游引物:5′-CTCGGCCATCCGCTCC-3′
探针:5′-(FAM)-CCGCATCTCTACATTCAAGAACTGGCCC-(BHQ-1) -3′
1.2.3 常规PCR产物回收克隆及鉴定PCR反应体系为50 μL,其中:PCR缓冲液5 μL,25 mmol/L Mg2+ 7 μL,10 mmol/L dNTPs 1 μL,10 μmol/L 上下游引物各1.5 μL,模板cDNA 5 μL,5 U/μL Taq DNA聚合酶0.4 μL,加灭菌双蒸水至总体积为50 μL.PCR 反应条件为:94 ℃ 5 min,94 ℃ 30 s,58 ℃ 20 s,72 ℃ 30 s,共35个循环,之后再于72 ℃反应5 min.其产物经2%琼脂糖凝胶电泳,DNA 胶回收试剂盒回收.将回收片段克隆至PES载体上,构建重组质粒,转化入DH5α感受态细菌,在含有氨苄青霉素(Amp+) 的LB平板上进行蓝白斑筛选,提取质粒并用PCR (反应体系和反应条件同上) 鉴定,然后送上海英骏生物技术公司测序.
1.2.4 TaqMan实时荧光定量PCR反应条件为提高反应的扩增效率与灵敏度,选择1×104,1×105,1×106,1×107copies/μL 4个浓度的重组质粒为检测样品,反应体系为50 μL.首先进行条件优化:Mg2+(25 mmol/L)的加入量(μL)分别为5.5,6.0,6.5,7.0,7.5,8.0;引物与探针(均为10 mmol/L)加入量(μL)分别为(1.3,0.6) ,(1.4,0.8) ,(1.5,1) ,(1.6,1.2) ,(1.7,1.4) 5个梯度.采用双因素混合水平正交实验设计实验.最后对Taq酶进行优化实验:Taq酶(5 U/μL)加入量(μL)分别为0.2,0.4,0.6,0.8,1.0.反应过程分两个阶段,第一阶段:37 ℃ 5 min,94 ℃ 5 min;第二阶段:94 ℃ 20 s,58 ℃ 30 s(收集荧光),72 ℃ 20 s,共40个循环.
通过以上优化实验确定反应体系中Mg2+、引物和探针以及Taq酶的最适用量.
1.2.5 标准曲线的建立选择1×107~1×104copies/μL 4个浓度的重组质粒为模板,在最佳反应条件下进行TaqMan实时荧光定量PCR实验,制作标准曲线.
1.2.6 重复性实验采用最优体系进行重复性实验,选择1×107~1×104 copies/μL 4个浓度梯度的重组质粒为模板,每个反应进行3次平行实验.通过扩增荧光曲线和循环阈值(Ct)计算来确定该反应重复性.
1.2.7 特异性和灵敏度实验选择1×104~1×101copies/μL的重组质粒为模板,每个质粒浓度进行3次平行实验,以出现较好的S型曲线、最大Ct值不超过35的最低浓度为检测灵敏度.
1.2.8 临床样本检测采集20例癌症患者新鲜血液和50例健康体检者的新鲜血液2 mL.所有癌症患者血液在术前采集并且未经过放化疗.其中,癌症患者包括7例肝癌患者,6例宫颈癌患者,5例胃癌患者和2例乳腺癌患者.50例无既往病史的健康者作为对照组.采血过程中为防止污染,外周血样品通过插入外围容器中的导管获得,并且丢弃最初的5 mL血液.这项研究经伦理委员会监控.
利用已优化的体系对外周血样品进行TaqMan实时荧光定量PCR实验.
2 结果与讨论 2.1 重组质粒筛选和鉴定重组质粒经常规PCR、2%琼脂糖凝胶电泳,得到95 bp的条带(图 1),经测序结果显示,序列与1.2.2 节中最终确定的保守序列相同.
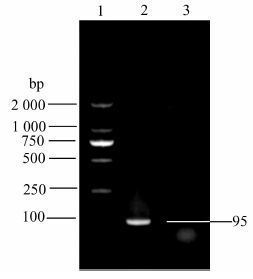
|
| 图 1 重组质粒PCR产物电泳图 1:Maker;2:重组质粒PCR产物;3:阴性对照 Figure 1 PCR product Electrophoresis of the recombinant plasimd 1:Maker;2:PCR product of the recombinant plasimd;3:Negative control |
通过优化实验,50 μL反应体系的最佳反应条件为:Mg2+(25 mmol/L)7 μL,终浓度3.5 mmol/L;上下游引物(10 mmol/L)1.3 μL,终浓度0.26 mmol/L;探针(10 mmol/L)1 μL,终浓度0.2 mmol/L;Taq酶(5 U/μL)0.4 μL,终浓度2U.
2.3 标准曲线根据最佳反应条件,以1×107,1×106,1×105,1×104 copies/μL 4个浓度的重组质粒为模板,进行TaqMan实时荧光定量PCR实验,扩增曲线如图 2(A)所示,标准曲线如图 2(B)所示.标准曲线y=-3.422x+36.56,相关系数0.998,线性范围1×107~1×104copies/μL.
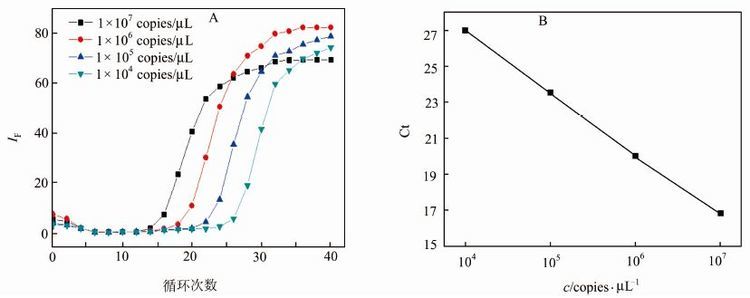
|
| 图 2 PCR扩增曲线(A)和标准曲线(B) Figure 2 Amplification lot (A) and standard curve (B) by PCR |
重复性实验采用变异系数CV(%)进行方法重现性评价(表 1).表 1中3次循环的Ct值较为接近,且CV值均在5%以下,表明本实验方法的实验结果稳定,重复性良好.
| c/copies·μL-1 | Ct | CV/% | ||
| 1 | 2 | 3 | ||
| 1×107 | 8.43 | 8.97 | 9.69 | 3.11 |
| 1×106 | 12.44 | 12.15 | 11.79 | 3.43 |
| 1×105 | 15.37 | 15.72 | 16.38 | 4.05 |
| 1×104 | 20.76 | 20.61 | 19.45 | 4.41 |
将重组质粒作为标准品进行普通PCR扩增,然后将扩增产物进行2%琼脂糖凝胶电泳,电泳图显示各泳道在95 bp的位置均有特异性条带出现,阴性对照无条带出现.将PCR产物测序,所测序列与靶序列完全一致,未出现非特异性扩增产物.
此外,选择浓度为1×104,1×103,1×102,1×101 copies/μL的标准品进行荧光定量PCR实验,结果如图 3所示,相对应的循环阈值如表 2所示.除1×101 copies/μL对应的曲线外,其余3条曲线的Ct值均小于35,且呈现出明显的S型.据此,本实验设定Ct值在35个循环之内,检测结果低于1×102 copies/μL的样品为阴性标本.
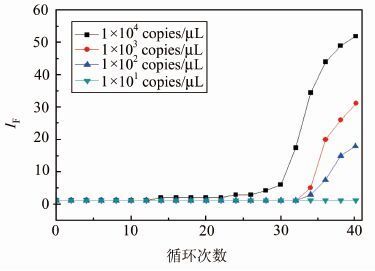
|
| 图 3 不同浓度样本的TaqMan荧光定量PCR扩增曲线 Figure 3 TaqMan real-time PCR amplification curve of different concentrations of sample |
| c/copies·μL-1 | Ct |
| 1×104 | 27.56 |
| 1×103 | 31.18 |
| 1×102 | 34.65 |
| 1×101 | 38.09 |
目前,大多数的荧光定量PCR用的是染料法,所测survivin的最高灵敏度也可以达到1×102 copies/μL[21].但是该文献方法是一种相对定量的方法,得到的结果是相对于内参的拷贝数量.而TaqMan实时荧光定量PCR是一种绝对定量的方法,故本实验的灵敏度好.
2.6 临床样品检验结果用已建立的TaqMan实时荧光定量PCR体系检测临床外周血样品,50例健康样本中survivin检测结果为3例为阳性(占6%),其中1例为强阳性,2例为弱阳性;20例癌症样本中survivin检测结果为15例为阳性(占75%),5例为阴性.其中15例阳性样本包括:肝癌样本5例(占71%),宫颈癌4例(占67%),胃癌4例(占80%),乳腺癌2例(占100%).
3 结论本研究运用TaqMan实时荧光定量PCR技术实现了对survivin基因的快速、灵敏地检测,且检测特异性高.在采集血液时弃去前5 mL血液,有效地解决了实验结果出现假阳性的问题.该方法操作简便,仅需抽取少量外周血,能在对病患最低伤害的情况下快速获得准确的检验结果,可望应用于临床上癌症的早期诊断、疗效评估等方面.但由于样本数量限制,本文结果还有待进一步大量临床样本进行验证.
| [1] | PAVOIDOU A, KROUPIS C, DIMAS K, et al. Association of survivin splice variants with prognosis and treatment of breast cancer[J]. World Journal of Clinical Oncology, 2014, 5 (5) : 883 –894. |
| [2] | YIE S M, LUO B, YE N Y, et al. Detection of Survivin-expressing circulating cancer cells in the peripheral blood of breast cancer patients by a RT-PCR ELISA[J]. Clinical & Experimental Metastasis, 2006, 23 (5-6) : 279 –289. |
| [3] | PATERLINI-BRECHOT P, BENALII N L. Circulating tumor cells (CTC) detection: Clinical impact and future directions[J]. Cancer Letters, 2007, 253 (2) : 180 –204. |
| [4] | SHEN C X, HU L H, XIA L, et al. The detection of circulating tumor cells of breast cancer patients by using multimarker (Survivin, hTERT and hMAM) quantitative real-time PCR[J]. Clinical Biochemistry, 2009, 42 (3) : 194 –200. |
| [5] | SHEN C X, HU L H, XIA L, et al. Quantitative real-time RT-PCR detection for survivin, CK20 and CEA in peripheral blood of colorectal cancer patients[J]. Japanese Journal of Clinical Oncology, 2008, 38 (11) : 770 –776. |
| [6] | WALIGORSKA-STACHRUIA J, JANKOWSKA A, WASKO R, et al. Survivin-prognostic tumor biomarker in human neoplasms—Review[J]. Ginekologia Polska, 2012, 83 (7) : 537 –540. |
| [7] | SANTA CRUZ GRUINDALINI R, MATHIAS MACHADO M C, GARICOCHEA B. Monitoring survivin expression in cancer: Implications for prognosis and therapy[J]. Molecular Diagnosis & Therapy, 2013, 17 (6) : 331 –342. |
| [8] | CHERENFANT J, TALAMONTI M S, HALL C R, et al. Comparison of tumor markers for predicting outcomes after resection of nonfunctioning pancreatic neuroendocrine tumors[J]. Surgery, 2014, 156 (6) : 1504 –1510. |
| [9] | SANGUEDOLCE F, BUFO P, CARRIERI G, et al. Predictive markers in bladder cancer: Do we have molecular markers ready for clinical use[J]. Critical Reviews in Clinical Laboratory Sciences, 2014, 51 (5) : 291 –304. |
| [10] | BIKOV A, BOCSKEI R, ESZES N, et al. Circulating survivin levels in healthy and asthmatic pregnancy[J]. Reproductive Biology and Endocrinology, 2014, 12 (1) : 93 . |
| [11] | THIHA A, OSAMURA Y, OISHI Y, et al. Differential expression of survivin in mammary gland diseases[J]. American Journals of Cancer Science, 2014, 3 (1) : 21 –29. |
| [12] | YIE S M, LOU B, YE S R, et al. Detection of survivin-expressing circulating cancer cells (CCCs) in peripheral blood of patients with gastric and colorectal cancer reveals high risks of relapse[J]. Annals of Surgical Oncology, 2008, 15 (11) : 3073 –3082. |
| [13] | LI J, CHEN P, LI X Q, et al. Elevated levels of survivin and livin mRNA in bronchial aspirates as markers to support the diagnosis of lung cancer[J]. International Journal of Cancer, 2013, 132 (5) : 1098 –1104. |
| [14] | GLIENKE W, MAUTE L, WICHT J, et al. The dual PI3K/mTOR inhibitor NVP-BGT226 induces cell cycle arrest and regulates survivin gene expression in human pancreatic cancer cell lines[J]. Tumour Biology, 2012, 33 (3) : 757 –765. |
| [15] | BERTAZZA L, MOCELLIN S, MARCHET A, et al. Survivin gene levels in the peripheral blood of patients with gastric cancer independently predict survival[J]. Journal of Translational Medicine, 2009, 7 (1) : 111 . |
| [16] | NIGAM J, CHANDRA A, KAZMI H R, et al. Prognostic significance of survivin in resected gallbladder cancer[J]. Journal of Surgical Research, 2015, 194 (1) : 57 –62. |
| [17] | 陈旭, 齐凤坤, 康立功, 等. 实时荧光定量PCR技术研究进展及其应用[J]. 东北农业大学学报, 2010 ,41 (8) : 148 –155. CHEN X, QI F K, KANG L G, et al. Advance and application of real-time fluorescent quantitative PCR[J]. Journal of Northeast Agricultural University, 2010, 41 (8) : 148 –155. |
| [18] | BASHIARDES S, RICHTER J, CHRISTODOULOU C G. An in-house method for the detection and quantification of HCV in serum samples using a TaqMan assay real time PCR approach[J]. Clinical Chemistry and Labortory Medicine, 2008, 46 (12) : 1729 –1731. |
| [19] | SMYTH V J, JEWHURST H L, WILKINSON D S, et al. Development and evaluation of real-time TaqMan (R) RT-PCR assays for the detection of avian nephritis virus and chicken astrovirus in chickens[J]. Avian Patholgy, 2010, 39 (6) : 467 –474. |
| [20] | 韩慧. 临床常见细菌和真菌快速检测方法的初步研究[D]. 广州: 南方医科大学, 2012. HAN H. Preliminary Studies on the Rapid Detection of Clinical Common Bacteria and Fungi[D]. Guangzhou: Southern Medical University, 2012(Ch). |
| [21] | 沈长新. 实时荧光定量PCR检测外周血循环肿瘤细胞的研究[D]. 武汉: 华中科技大学, 2009. |
 2016, Vol. 62
2016, Vol. 62





