文章信息
- 徐梦文, 韦秋曦, 胡晔, 周雪, 王星, 李春涯
- XU Mengwen, WEI Qiuxi, HU Ye, ZHOU Xue, WANG Xing, LI Chunya
- 基于离子液体的生物电化学传感器
- Electrochemical Biosensors Based on Ionic Liquids
- 武汉大学学报(理学版), 2018, 64(1): 17-27
- Journal of Wuhan University(Natural Science Edition), 2018, 64(1): 17-27
- http://dx.doi.org/10.14188/j.1671-8836.2018.01.002
-
文章历史
- 收稿日期:2017-10-10

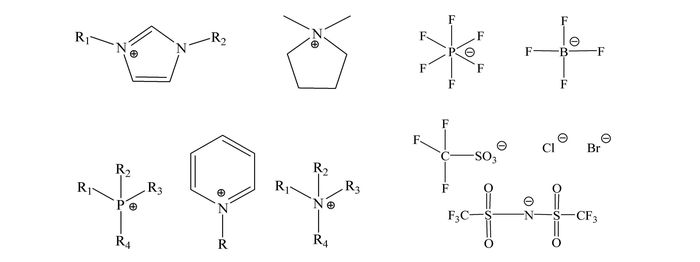
离子液体(ionic liquids, Ils)是由有机阳离子和无机或有机阴离子构成的、在100 ℃以下呈液体状态的盐类[1].离子液体的典型结构如图 1所示,主要由咪唑、吡啶、铵和鏻阳离子和PF6-、BF4-等有机及无机阴离子构成.与传统的有机溶剂相比,离子液体具有许多独特的性质,比如较强的溶解能力、较低的蒸汽压、较高的导电性,粘度可调性,较好的热稳定性以及较强的催化活性[2].这些特性使其常用于有机合成、催化反应、电化学和萃取分离等领域[3].离子液体由于具有良好的生物相容性和较宽的电化学窗口,能有效提升传感性能,故在电化学生物传感器制备过程中也备受关注[4].本文综述了离子液体在生物小分子电化学传感、生物催化及传感、生物免疫传感、直接电化学及生物传感、分子印迹电化学生物传感等领域的研究进展,并探讨了离子液体应用于生物电化学传感领域的优势与挑战.
|
| 图 1 离子液体合成中常用阳离子及阴离子结构示意图 Figure 1 Structure of cations and anions commonly employed in the synthesis of ILs |
电化学分析方法具有较高的灵敏度和良好的选择性,以及操作简单、成本低等优势[5].随着检测技术的发展,已经建立起多种基于离子液体检测生物小分子的电化学生物传感器,包括葡萄糖传感器、抗坏血酸传感器、多巴胺传感器和过氧化氢传感器等.
1.1 电化学葡萄糖生物传感器葡萄糖(glucose,Glu)是临床诊断、代谢调节和生化分析的重要指标,因此葡萄糖的检测尤为重要.1967年,Updik和Hicks [6]首次研制出以铂电极为基体的葡萄糖氧化酶(glucose oxidase,GOD)电极,并将其用于定量检测血清中的葡萄糖含量.该研究标志着第一代生物传感器的诞生.离子液体因具有良好的导电性、较强的溶解性、优异的催化性能等优点,已在检测葡萄糖方面占有一席之地.Jiang等[7]合成氨基封端的离子液体功能化的石墨烯纳米复合材料, 并通过离子交换获得了由离子液体桥接的石墨烯和葡萄糖氧化酶的复合材料.利用该复合材料构建的葡萄糖传感器检出限可达1.6×10-2 mol·L-1.该文认为离子液体的主要作用为:1)提高石墨烯的分散性;2)连接石墨烯与葡萄糖氧化酶;3)作为葡萄糖氧化酶与基底电极之间电子转移的媒介.Bai等[8]利用碳纳米管和离子液体的协同作用, 制备出1-丁基-3-甲基咪唑六氟磷酸盐[Bmim][PF6]与碳纳米管的复合材料,该复合材料可增强O2和NADH的电催化性能,故可用来构建无需介质的葡萄糖和O2生物传感平台.
Xiao等[9]在多壁碳纳米管(MWNT)/[P(C6)3C14][Tf2N]离子液体复合膜上直接电沉积高分散的PtM (M = Ru, Pd, Au)纳米颗粒,且对比得出,PtRu/MWNT/IL纳米复合材料对葡萄糖的氧化反应有更好的催化性能.Zhao等[10]以功能化的环糊精(CD)和[P(C6)3C14][Tf2N]离子液体形成的包合物薄膜作为支撑,在该薄膜上电沉积PtCo合金纳米粒子,形成的复合材料对葡萄糖的氧化显示出优异的催化活性.
1.2 电化学抗坏血酸生物传感器抗坏血酸(ascorbic acid,AA)对人类许多代谢过程至关重要,例如增强人肠细胞中的铁吸收,涉及免疫细胞功能和免疫应答并诱导细胞分化等作用[11].碳纳米管拥有许多独特的性质,如较大的比表面积、良好的机械稳定性和高的电导率,故可作为一种先进的碳材料用于抗坏血酸传感器的设计[12].Ping等[13]制备了正辛基吡啶六氟磷酸盐离子液体(IL)/单壁碳纳米管(SWCNT)复合电极材料,与其他电极材料相比,IL-SWCNT复合电极材料能显著提高电子转移速率,并降低抗坏血酸氧化反应的超电位.利用该复合材料构建用于测定抗坏血酸含量的高性能传感平台,线性范围为3.0×10-6~4.2×10-3 mol·L-1,检出限为1.0×10-6mol·L-1.
1.3 电化学多巴胺生物传感器多巴胺(dopamine,DA)是一种重要的神经递质,其浓度的变化通常与不同的疾病有关.干扰物尿酸(uric acid,UA)和抗坏血酸等物质的存在,使得实际样品中电化学检测多巴胺具有挑战性.化学修饰电极可用于解决检测多巴胺时面临的敏感性和选择性差的问题[14].Niu等[15]以[Bmim][BF4]作改性剂,设计出基于3, 4, 9, 10-苝四羧酸功能化石墨烯片/MWCNT/[Bmim][BF4]复合材料的多巴胺生物传感器.在AA和UA的存在下测定多巴胺, 线性范围为3.0×10-8~3.82×10-3 mol·L-1, 检出限为1.2×10-9 mol·L-1.
1.4 电化学H2O2生物传感器H2O2在环境、食品、医药和工业研究等领域都有着广泛的应用,故对H2O2的分析检测显得尤为重要.Liu等[16]制备出纳米金修饰的TiO2纳米管和1-癸基-3-甲基咪唑四氟硼酸盐离子液体[Demim][BF4]的复合材料,将该复合材料和辣根过氧化物酶(horseradish peroxidase,HRP)修饰在电极表面, 构建出用于检测H2O2含量的生物传感器.该传感器在1.5×10-5 ~7.5×10-4 mol·L-1范围内呈现线性响应,检出限为2.2×10-6 mol·L-1.Ping等[17]通过混合石墨、正辛基吡啶六氟磷酸盐离子液体和氧化铜纳米颗粒来制备电极材料,利用该复合材料构建的非酶H2O2电化学传感器具有高的稳定性及灵敏度、优良的选择性和重现性、制备的简易性等优点.
1.5 其他小分子电化学生物传感器除了上述的几种小分子以外,还有酚类化合物、药物小分子等传感器.本课题组的Chen等[18]将碳纳米管与1-[3′-(N-吡咯)丙基]-3-丁基咪唑溴离子液体经静电引力结合,制备出二者的纳米复合材料,并修饰至玻碳电极表面,通过研究双酚A在该电极上的电化学行为,建立了一种直接测定双酚A的电化学方法.
2 离子液体在生物催化及电化学传感中的应用近年来,基于室温离子液体电化学传感层的制备和应用得到迅猛发展,检测手段主要包括电位法、伏安法和安培法等[19].根据离子液体在生物催化及传感领域相关的文献报道,其在电化学生物传感器领域潜在的发展前景广阔.
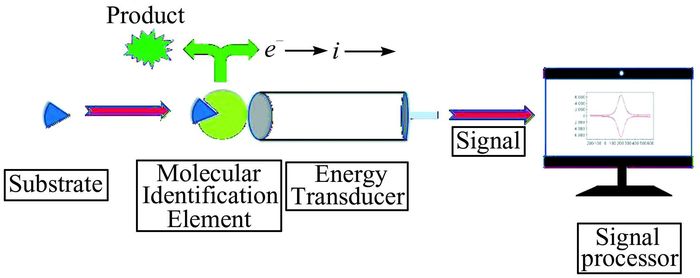
2.1 酶催化传感酶催化传感器是根据酶反应过程中电活性物质的变化产生的电信号进行检测的一类生物传感器,基本工作原理如图 2所示:底物与酶结合后,酶反应会催化产生或者消耗电活性物质,当反应达到稳态时,将电活性物质浓度的变化转变为电信号输出,从而进行检测[20].与其他有机溶剂相比,离子液体与生物分子及酶都具有更好的生物相容性,当酶被固定在离子液体溶胶-凝胶基质中时,可显著增强该酶的活性和热稳定性.
|
| 图 2 典型的酶修饰生物传感器示意图 Figure 2 A typical design of an enzyme modified electrochemical biosensor |
Liu等[21]首次将辣根过氧化物酶(HRP)作为模型包裹入离子液体内得到固定化的溶胶基质,通过简单的溶胶-凝胶法,以[Bmim][BF4]离子液体作为模板溶剂获得HRP固定化的溶胶-凝胶基质,并用于制备安培H2O2生物传感器,表现出优越的稳定性和灵敏度.Mundaca等[22]制备了MWCNT/辛基吡咯六氟磷酸盐离子液体(MWCNT/IL)复合材料.该复合电极材料具有较低的背景电流,且对还原型辅酶Ⅰ(nicotinamide adenine dinucleotide,NADH)氧化物有良好的稳定性.以MWCNT/IL复合材料作为平台固定3α-羟基类固醇脱氢酶(3α-HSD),构建用于男性酮检测的3α-神经甾体生物传感器,检出限达到1.5×10-7 mol·L-1.
2.2 血红蛋白和肌红蛋白Lu等[23]以新型壳聚糖/[Bmim][PF6]复合材料作为一种新的固定基质用于诱捕蛋白,进而研究血红蛋白(hemoglobin,Hb)在玻碳电极上的电化学行为.Sun等[24]基于Fe3O4介孔球修饰碳离子液体电极(CILE)构建了一种新的血红蛋白电化学生物传感器,该传感器具有极好的还原三氯乙酸的电催化能力.
肌红蛋白(myoglobin,Mb)是血红素蛋白之一,也是骨骼肌的主要蛋白.Wang等[25]以1-丁基吡啶六氟磷酸盐[BuPy] [PF6]基于的碳离子液体电极为基底电极,合成了核壳结构的Fe3O4@SiO2微球,肌红蛋白与Fe3O4@SiO2微球混合形成有机-无机复合物,通过壳聚糖固定到碳离子液体电极表面,用于研究Mb的直接电子转移.Lou等[26]应用羧基功能化离子液体1-羧甲基-3-甲基咪唑四氟硼酸盐[CMMIM][BF4]与Mg2Al层状双氢氧化物(LDH)反应用于将Mb固定到CILE电极表面,新构建的第三代无试剂电化学生物传感器具有高的灵敏度和可重现性.
2.3 非酶生物传感器葡萄糖生物传感器约占世界生物传感器市场的85%,但它们存在很多的缺陷,如酶的性质引起的化学不稳定性、高昂的价格及复杂的固定程序.因此,设计和制备非酶葡萄糖传感器用于替代具有上述缺点的酶生物传感器具有广阔的应用前景[27~29]. Haghighi等[30]制备了一种新型的用于葡萄糖检测的非酶传感器,该传感器通过使用离子液体衍生化介孔碳(IFMC)修饰钯纳米颗粒(PdNPs),制得的PdNPs均匀分布在IFMC表面形成纳米复合材料(Pd@IFMC),将该复合材料滴涂于玻碳电极表面制备出一种新颖的非酶葡萄糖传感器,该传感器能有效解决上述缺陷,具有易于制备、重现性好、稳定性良好等优点.
已经报道的非酶葡萄糖传感器常存在一些弊端,如价格昂贵、灵敏度低、线性范围窄和选择性差等.因此,制备价格低廉,选择性好和可靠的非酶葡萄糖传感器变得刻不容缓.
3 离子液体在电化学免疫传感中的应用免疫传感器是利用生物学中抗体分子能特异性识别抗原分子的原理,将灵敏的传感技术应用于生物分子检测中.近年来,离子液体作为一种优良的传感器修饰物被广泛应用于免疫传感器,这主要得益于离子液体高的离子导电性及生物相容性,可以提高电化学响应.
3.1 基于离子液体/贵金属复合材料的免疫传感器贵金属纳米粒子因具有大的比表面积、较强的导电性等优点常被用于生物传感器中来提高灵敏度.离子液体与贵金属纳米粒子结合不仅能显著提高传感体系的导电性,同时可提高固定生物材料的生物相容性及活性[31].
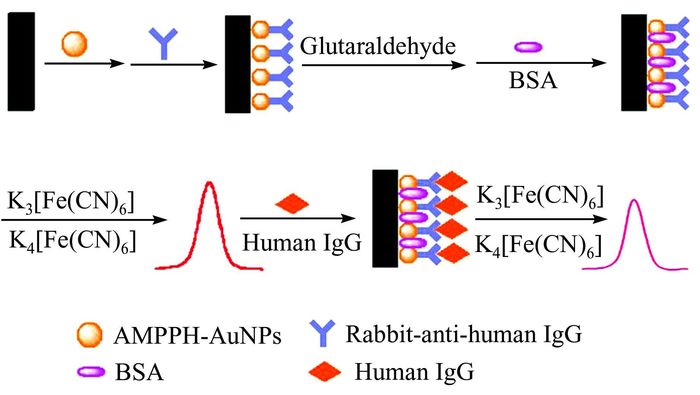
本课题组的Wu等[32]合成了3-氨丙基-N-[3-(N-吡咯)丙基]咪唑溴盐(APPIBr)离子液体及根状纳米金(AuNRs),将APPIBr电聚合至AuNRs/GCE表面,并用以固载鳞状细胞癌抗体(anti-SCCA)制备电化学免疫传感器,实现对鳞状细胞癌抗原(SCCA)的高选择性和高灵敏度检测.Li等[33]合成了一种新型的离子液体(如图 3所示)4-氨基-1-(3-巯基-丙基)-吡啶六氟磷酸盐(AMPPH),并以其为功能化单体制得AMPPH修饰的金纳米颗粒(AMPPH-AuNPs).通过AMPPH-AuNPs为载体,将人免疫球蛋白抗体(anti-HigG)负载到玻碳电极表面,成功构建了IgG免疫传感器.该传感器具有检出限低(3×10-13 g·L-1)、重现性好、抗干扰性强等优点.
3.2 基于离子液体/碳材料的免疫传感器碳纳米材料(CNMs)因其明显的结构特征及独特的物理化学性质,自诞生以来就受到广泛关注,在传感器方面的应用更是层出不穷.已报道的与离子液体结合并用于免疫传感器的碳材料主要有碳纳米管、石墨烯、富勒烯(C60)、介孔碳纳米微球等.
石墨烯因具有大的比表面积、高的电子迁移率及优良的导热性能,自2004年被发现以来便受到广泛关注,其在免疫传感领域的发展也是有增无减.Liu等[34]在1-氨丙基-3-甲基咪唑氯盐中电化学剥离石墨烯薄片成功制备IL-GS复合材料,负载纳米金形成IL/GS/AuNPs复合物,基于该复合材料的免疫传感器对癌胚抗原(CEA)的检出限可达1.0×10-13 g·L-1,线性范围为1.0×10-12 g·L-1到1.0×10-4 g·L-1.
碳纳米管因具有非凡的机械、电气和导热性能在电化学免疫传感领域得到广泛应用,但其缺点在于分散性较差.离子液体作为一种优良的分散剂能使碳纳米管分散,二者结合可使性能得到大大提升[35].Salimi等[36]基于[C4mpyr][NTf2]离子液体/MWCNTs复合材料制备用于检测前列腺特异性抗原(PSA)的夹心型免疫传感器,检出限可达2.0×10-11 g·L-1, 有望用于临床癌症标记物的筛选.Zhang等[37]利用MWCNTs/[Bmim][PF6]/硫堇复合材料修饰丝网印刷碳电极,将其用于阪崎肠杆菌(E.sakazakii)的含量测定,该传感器具有长时间储存稳定性,可用于E.sakazakii的临床免疫分析.
一些研究者另辟蹊径,寻找其他的碳材料作为石墨烯与碳纳米管的替代物.Wei[38]等制备了C60/二茂铁/离子液体复合材料,并利用壳聚糖和表氯醇的交联作用将该复合物固定在玻碳电极的表面,将该修饰电极用于测定食品中的脱氧萎镰菌醇(DON),具有良好的重现性、选择性及稳定性.Fan[39]等基于介孔碳纳米微球-甲苯胺蓝/[Bmim][BF4]构建了用于检测乳腺癌易感基因(BRCA1)的无标记型电化学免疫传感器,其中甲苯胺蓝作氧化还原介质,该检测平台表现出较佳的稳定性、灵敏度、选择性.
3.3 基于离子液体/量子点复合材料的免疫传感器光电免疫技术是近年来新兴起的一种免疫分析方法,因具有装置简易,花费小,易制备等优点在生物传感器领域得到快速发展[40].量子点也因自身独特的物理化学优势广泛应用于光电化学免疫研究[41].
本课题组的Yu等[42]首次合成了PDPIT(3-癸基-1-(3-吡咯丙基)咪唑四氟硼酸盐)聚离子液体,通过将PDPIT膜与ZnCdHgSe四元量子点层层组装到ITO电极表面成功制备出用于测定神经元特异性烯醇化酶抗原(NSE)的光电免疫传感器.Tan等[43]利用离子液体[Bmim]Br合成十二面体纳米金(AuNRs),并创新性地合成制备了N-乙酰-L-半胱氨酸(NAC)功能化的CdAgTe量子点,将NAC-CdAgTe量子点与AuNRs自组装,进一步负载cTnI抗体,构建出高灵敏的光电免疫传感器,并将其应用于cTnI测定.
3.4 基于其他材料与离子液体的免疫传感器Li等[44]基于1-戊基-2, 3-二甲基咪唑六氟磷酸盐离子液体(ADMIPF6)和硅胶形成的生物相容性膜制备了一种无标记的电化学阻抗型免疫传感器,并将其应用于蜂花中黄曲霉素B1的含量测定,检出限为1.0×10-8 g·L-1.Chen等[45]在[Bmim][BF4]存在下,基于高度有序大孔的金膜构建用于测定人体中载脂蛋白B-100 (ApoB-100)含量的电化学阻抗型免疫传感器.
4 离子液体在生物分子直接电化学及传感中的应用近年来,利用离子液体修饰电极来研究生物大分子(酶、蛋白质等)的直接电化学行为引起了人们的广泛兴趣[46~48].这些研究深化了对离子液体修饰电极内在热力学和动力学性能的认识,对于了解生命体的作用机制以及开发新型的生物传感器都有重要的意义[49, 50].离子液体在生物大分子直接电化学检测中主要有两个作用:一是作为粘合剂与石墨粉粘结,制备新型的碳离子液体电极(CILE);二是作为修饰剂,将被研究的生物大分子固定在修饰电极的表面[51].
4.1 离子液体作为粘合剂与传统的粘合剂石蜡相比,离子液体具有更高的导电率,与石墨粘结后,使得碳离子液体电极的导电率和电子转移效率显著提高[52].Sun等[53]以[Bmim][PF6]离子液体为粘合剂与石墨混合制备修饰的碳离子液体电极(carbon ionic liquid electrode,CILE),然后使用海藻酸钠水凝胶膜(sodium alginate,SA)将血红蛋白包埋在碳离子液体电极表面制备出SA/Hb/CILE复合电极.利用光谱和电化学实验考察了固定在膜内的血红蛋白(Hb)的性质,结果表明Hb不仅在膜内能够很好的保持原始构象,而且在pH 7.0的伯瑞坦-罗宾森缓冲溶液(B-R)中,出现了一对良好的准可逆氧化还原峰.
随后,该课题组运用层层涂布法将Hb、纳米碳酸钙和Nafion修饰到正丁基吡啶六氟磷酸盐[BPPF6]修饰的CILE电极表面,使用相同的方法对Hb在离子液体修饰电极上的电化学行为进行了考察,结果表明该修饰电极对H2O2同样表现出良好的催化作用[54].
Chen等[55]首次使用电沉积法将肌红蛋白(Mb)、海藻酸钠(sodium alginate,SA)、四氧化三铁(Fe3O4)、石墨烯(graphene,GR)复合材料滴涂在正己基吡啶六氟磷酸盐[HPPF6]修饰的CILE电极表面,研究了Mb在该修饰电极上的直接电化学行为,电化学表征Mb在该修饰电极上有良好的电流响应,能够很好的用于三氯乙酸(trichloroacetic acid,TCA),检出限为1.74×10-2 mol·L-1.Sun等[56]以1-乙基-3-甲基咪唑四氟硼酸盐[Emim][BF4]为粘合剂制得碳离子液体电极,并在该电极表面电沉积Co纳米粒子,再依次滴涂肌红蛋白和Nafion溶液,制得Nafion/Mb/Co/CILE复合物膜.利用电极表面离子液体与Co纳米粒子的协同作用,该修饰电极可以检测膜内Mb的直接电化学行为,且具有良好的重现性和稳定性.
4.2 离子液体作为修饰剂近10年来,第三代生物传感器得到了迅速的发展,如何促进生物大分子活性中心与电极之间直接电子的转移是目前的研究热点[57, 58].将离子液体修饰的纳米材料掺杂到传感器膜内,在这一独特而有利的微环境中,生物大分子与电极之间能够直接进行电子交换,表现出良好的电化学活性,有效地避免了外部环境对电化学反应带来的不利影响,极大的促进了生物大分子的直接电化学研究[59, 60].
Zhang等[61]将单壁碳纳米管(SWCNT)溶解在[Bmim][PF6]中,然后将葡萄糖氧化酶包埋在[Bmim][PF6]与SWCNT形成的复合材料中,利用三者形成的复合物修饰电极.在pH 7.4的PBS缓冲溶液中该修饰电极能够发生直接的电子传输,并且能够用于溶液中葡萄糖含量的检测.
此外,多壁碳纳米管(MWCNTs)与离子液体的复合材料,也是生物传感器的主要研究对象[62, 63].Xiang等[64]在玻碳电极上依次自组装上MWCNTs,离子液体[Bmim][BF4],纳米金(GNPs),细胞色素C(Cyt C)成功制备出了CytC/GNPs/[Bmim][BF4]/MWCNTs/GC电极,同时考察了Cyt C的直接电化学,结果表明:该修饰电极对浓度在5.0×10-5~1.15×10-3 mol·L-1范围内的H2O2有良好的电催化作用.同时,Zhang等[65]利用[Emim][BF4]/MWCNTs复合材料修饰电极,对H2O2的检出限可达8.0×10-7 mol·L-1.这些研究都为第三代生物传感器的研究奠定了良好的基础.
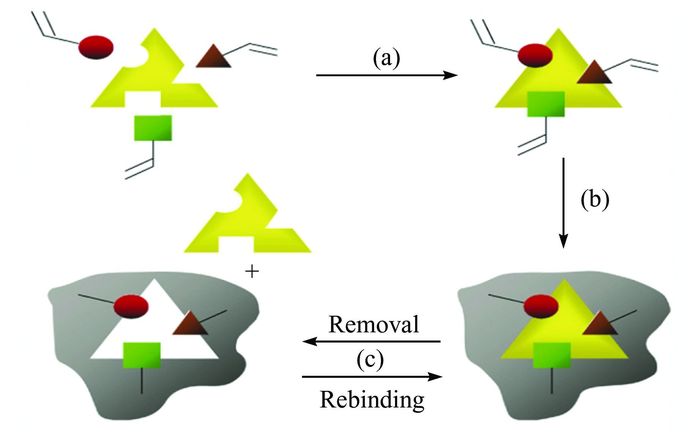
5 离子液体在生物分子印迹及电化学传感中的应用分子印迹技术(molecularly imprinted technology, MIT)是一种以目标分子为模板,合成对该分子具有特异性识别功能的聚合物的技术.根据模板分子的空间构型,选取与之具有相互作用的功能单体,引发聚合形成聚合物.将聚合物中的模板分子去除后,产生与模板分子在空间构型和化学键上相匹配的孔穴或者孔隙结构.当印迹材料再次与模板分子结合时,模板分子可以重新回到空穴,从而达到专一性识别[66].分子印迹聚合物的制备如图 4所示.分子印迹技术最初是Pauling在以抗原为模板合成抗体时提出的[67].近年来,由于分子印迹传感器具有对目标分子高度专一的识别性和稳定性,在药物分析、环境监测、色谱分离、化学生物传感等多个领域发展迅速.
|
| 图 4 分子印迹聚合物制备示意图 Figure 4 Schematic of MIP preparation |
21世纪初,涌现出大量关于小分子印迹聚合物的报道,但大分子印迹聚合物的研究却相对较少.离子液体作为一种可设计的材料[68],可以有效解决生物分子在制备印迹聚合物膜时,生物相容性差和印迹效率低等问题.
Wang等[69]制备了石墨烯与[Bmim][BF4]离子液体的复合材料用于修饰玻碳电极,通过[Bmim][BF4]中的氮原子与牛血红蛋白(bovine hemoglobin,BHb)中的Fe2+离子形成配位键来固定BHb,然后使用电化学聚合吡咯功能单体成功制备BHb分子印迹聚合物膜,实现了对BHb的特异性检测,检出限可达3.09×10-11 g·L-1.
Liu等[70]制备了pH响应的分子印迹传感器,可实现对牛血清白蛋白(bovine serum albumin,BSA)的特异性检测.该传感器利用3-氨丙基三乙氧基硅烷修饰的多壁碳纳米管(MWCNT-APTES)作为基底材料,BSA为模板,烷氧基功能化的1-(3-丙基三甲氧基硅烷)-3-甲基咪唑溴盐([TMSPMIM]Cl)离子液体作为功能单体,四乙氧基硅烷(TEOS)作为交联剂,利用溶胶-凝胶技术在多壁碳纳米管的表面成功制备了分子印迹聚离子液体膜,实现了对BSA的选择性识别.Wang等[71]制备了1-乙烯基-3-氨丙基四氟硼酸盐(APVIMBF4)离子液体,并以其作为功能单体,通过自由基聚合在羧基化碳纳米管修饰的玻碳电极表面成功制备BSA分子印迹传感器,实现对BSA的选择性识别,检出限达到3.91×10-10 mol·L-1.
Xia等[72]基于[Bmim][PF6]离子液体/壳聚糖/石墨烯的复合材料成功制备了CS/IL-GR/GCE,该修饰电极可以有效固定目标蛋白.使用表面印迹法,利用吡咯电化学聚合在电极表面成功制备BSA表面分子印迹聚合物膜,大大提高了印迹效率,缩短了识别时间,实现了对目标分子的特异性识别,检出限达到2.0×10-11g·L-1.
Duan等[73]利用离子液体修饰的Fe3O4@多巴胺/氧化石墨烯/β-环糊精(ILs-Fe3O4@DA/GO /β-CD)作为基底材料来合成表面分子印迹聚合物,利用化学发光的方法,实现了对溶解酵素(Lys)的特异性检测,检出限达到3.0×10-10 g· L-1.
Wang等[74]合成了巯基功能化的1-(3-巯基丙基)-3-乙烯基咪唑四氟硼酸盐(MVIMBF4)离子液体,并将其自组装到金纳米阵列的表面用来固定神经元特异性烯醇化酶(NSE)目标分子.吡咯功能化的1, 3-二(N-吡咯丙基)咪唑溴盐(DPIMBr)离子液体作为功能单体,通过电化学聚合成功制备了聚离子液体分子印迹聚合物膜,可以选择性识别目标蛋白,并成功用于人血清中NSE含量的测定.
Qian等[75]利用离子液体作为热稳定剂,在较高温度下聚合制备分子印迹聚合物膜时能够很好的保持目标蛋白质的性质不发生改变,极大地推动了大分子分子印迹技术的发展.Wang等[76]以氨基功能化的离子液体1-乙烯基-3-(2-亚氨基)氨己基咪唑溴盐(1-{3-[(2-aminoethyl)amino]propyl}-3-vinylimidazole bromide,IAHVIMBr)作为功能单体,制备出了肌红蛋白分子印迹聚合物水凝胶,并将其修饰在碳纳米管膜修饰的玻碳电极表面,成功制备出Mb分子印迹电化学传感器.
6 结论与展望本文根据离子液体在电化学生物传感领域的最新文献报道,探讨了离子液体在生物小分子传感器、生物催化传感器、免疫传感器、直接电化学生物传感器、分子印迹电化学生物传感器等领域的应用研究.离子液体因自身独特的物理化学性质,在电化学传感领域扮演着愈加重要的角色,然而目前的研究也面临着一些挑战,如传感器的种类有限、在复杂体系中对某一特定分析物选择性较差,理论研究不够充分等,因此,基于离子液体的生物传感器未来需要做进一步的系统性研究:
1) 依据拟拓展的生物传感器性能,设计合成具有特定结构及功能的新型离子液体;
2) 深入开展离子液体增敏生物电化学传感的机理研究,探索电化学及动力学过程中的物理参数,建立相关理论模型;
3) 离子液体耦合纳米材料构建新型复合传感界面,提升生物传感器响应性能;
4) 优化基于离子液体的生物传感器的结构及性能,促进其微型化、实用化、商品化.
| [1] |
HALLETT J P, WELTON T. Room-temperature ionic liquids: Solvents for synthesis and catalysis[J]. Chemical Reviews, 2011, 111(5): 3508-3576. DOI:10.1021/cr1003248 |
| [2] |
ZHANG D, CHEN J, LIANG Y, et al. Facile synthesis of novel ionic liquids containing dithiocarbamate[J]. Synthetic Communications, 2005, 35(4): 521-526. DOI:10.1081/SCC-200049773 |
| [3] |
PATEL D D, LEE J M. Applications of ionic liquids[J]. The Chemical Record, 2012, 12(3): 329-355. DOI:10.1002/tcr.201100036 |
| [4] |
WEI D, IVASKA A. Applications of ionic liquids in electrochemical sensors[J]. Analytica Chimica Acta, 2008, 607(2): 126-135. DOI:10.1016/j.aca.2007.12.011 |
| [5] |
PEREZ-LOPEZ B, MERKOCI A. Nanomaterials based biosensors for food analysis applications[J]. Trends in Food Science & Technology, 2011, 22(11): 625-639. DOI:10.1016/j.tifs.2011.04.001 |
| [6] |
UPDIKE S J, HICKS G P. The enzyme electrode[J]. Nature, 1967, 214: 986-988. DOI:10.1038/214986a0 |
| [7] |
JIANG Y Y, ZHANG Q X, LI F H, et al. Glucose oxidase and graphene bionanocomposite bridged by ionic liquid unit for glucose biosensing application[J]. Sensors and Actuators B: Chemical, 2012, 161(1): 728-733. DOI:10.1016/j.snb.2011.11.023 |
| [8] |
BAI L, WEN D, YIN J Y, et al. Carbon nanotubes-ionic liquid nanocomposites sensing platform for NADH oxidation and oxygen, glucose detection in blood[J]. Talanta, 2012, 91: 110-115. DOI:10.1016/j.talanta.2012.01.027 |
| [9] |
XIAO F, ZHAO F, MEI D, et al. Nonenzymatic glucose sensor based on ultrasonic-electrodeposition of bimetallic PtM (M=Ru, Pd and Au) nanoparticles on carbon nanotubes-ionic liquid composite film[J]. Biosensors & Bioelectronics, 2009, 24(12): 3481-3486. DOI:10.1016/j.bios.2009.04.045 |
| [10] |
ZHAO F Q, XIAO F, ZENG B Z. Electrodeposition of PtCo alloy nanoparticles on inclusion complex film of functionalized cyclodextrin-ionic liquid and their application in glucose sensing[J]. Electrochemistry Communications, 2010, 12(1): 168-171. DOI:10.1016/j.elecom.2009.11.016 |
| [11] |
MA Y, ZHAO M G, CAI B, et al. 3D graphene foams decorated by CuO nanoflowers for ultrasensitive ascorbic acid detection[J]. Biosensors & Bioelectronics, 2014, 59: 384-388. |
| [12] |
AGUI L, YANEZ-SEDENO P, PINGARRON J M. Role of carbon nanotubes in electroanalytical chemistry: A review[J]. Analytica Chimica Acta, 2008, 622(1-2): 11-47. DOI:10.1016/j.aca.2008.05.070 |
| [13] |
PING J F, WANG Y X, WU J, et al. Determination of ascorbic acid levels in food samples by using an ionic liquid-carbon nanotube composite electrode[J]. Food Chemistry, 2012, 135(2): 362-367. DOI:10.1016/j.foodchem.2012.05.013 |
| [14] |
SAJID M, NAZAL M K, Mansha M, et al. Chemically modified electrodes for electrochemical detection of dopamine in the presence of uric acid and ascorbic acid: A review[J]. TrAC Trends in Analytical Chemistry, 2016, 76: 15-29. DOI:10.1016/j.trac.2015.09.006 |
| [15] |
NIU X L, YANG W, GUO H, et al. Highly sensitive and selective dopamine biosensor based on 3, 4, 9, 10-perylene tetracarboxylic acid functionalized graphene sheets/multi-wall carbon nanotubes/ionic liquid composite film modified electrode[J]. Biosensors & Bioelectronics, 2013, 41: 225-231. DOI:10.1016/j.bios.2012.08.025 |
| [16] |
LIU X Q, FENG H Q, ZHANG J M, et al. Hydrogen peroxide detection at a horseradish peroxidase biosensor with a Au nanoparticle-dotted titanate nanotube|hydrophobic ionic liquid scaffold[J]. Biosensors & Bioelectronics, 2012, 32(1): 188-194. DOI:10.1016/j.bios.2011.12.002 |
| [17] |
PING J F, RU S P, FAN K, et al. Copper oxide nanoparticles and ionic liquid modified carbon electrode for the non-enzymatic electrochemical sensing of hydrogen peroxide[J]. Microchimica Acta, 2010, 171(1-2): 117-123. DOI:10.1007/s00604-010-0420-3 |
| [18] |
CHEN X M, REN T Q, MA M, et al. Voltammetric sensing of bisphenol A based on a single-walled carbon nanotubes/poly{3-butyl-1-[3-(N-pyrrolyl)propyl] imidazolium ionic liquid} composite film modified electrode[J]. Electrochimica Acta, 2013, 111: 49-56. DOI:10.1016/j.electacta.2013.07.211 |
| [19] |
SINGH V V, NIGAM A K, BATRA A, et al. Applications of ionic liquids in electrochemical sensors and biosensors[J]. International Journal of Electrochemistry, 2012, 2012: 2090-3529. DOI:10.1155/2012/165683 |
| [20] |
PUTZBACH W, RONKAINEN N J. Immobilization techniques in the fabrication of nanomaterial-based electrochemical biosensors: A review[J]. Sensors, 2013, 13(4): 4811-4840. DOI:10.3390/s130404811 |
| [21] |
LIU Y, WANG M, LI J, et al. Highly active horseradish peroxidase immobilized in 1-butyl-3-methylimidazolium tetrafluoroborate room-temperature ionic liquid based sol-gel host materials[J]. Chemical Communications, 2005, 13(13): 1778-1780. DOI:10.1039/B417680D |
| [22] |
MUNDACA R A, MORENO-GUZMAN M, EGUILAZ M, et al. Enzyme biosensor for androsterone based on 3α-hydroxysteroid dehydrogenase immobilized onto a carbon nanotubes/ionic liquid/NAD+ composite electrode[J]. Talanta, 2012, 99: 697-702. DOI:10.1016/j.talanta.2012.07.008 |
| [23] |
LU X, HU J, YAO X, et al. Composite system based on chitosan and room-temperature ionic liquid: direct electrochemistry and electrocatalysis of hemoglobin[J]. Biomacromolecules, 2006, 7(3): 975-980. DOI:10.1021/bm050933t |
| [24] |
SUN W, SUN Z, ZHANG L, et al. Application of Fe3O4 mesoporous sphere modified carbon ionic liquid electrode as electrochemical hemoglobin biosensor[J]. Colloids and Surfaces B: Biointerfaces, 2013, 101: 177-182. DOI:10.1016/j.colsurfb.2012.06.010 |
| [25] |
WANG X, YOU Z, SHA H, et al. Electrochemical myoglobin biosensor based on carbon ionic liquid electrode modified with Fe3O4@SiO2 microsphere[J]. Journal of Solid State Electrochemistry, 2014, 18(1): 207-213. DOI:10.1007/s10008-013-2259-0 |
| [26] |
LOU J, LU Y, ZHAN T, et al. Application of an ionic liquid-functionalized Mg2Al layered double hydroxide for the electrochemical myoglobin biosensor[J]. Ionics, 2014, 20(10): 1471-1479. DOI:10.1007/s11581-014-1088-1 |
| [27] |
WANG G, HE X, WANG L, et al. Non-enzymatic electrochemical sensing of glucose[J]. Microchimica Acta, 2013, 180(3-4): 161-186. DOI:10.1007/s00604-012-0923-1 |
| [28] |
CHEN C, XIE Q, YANG D, et al. Recent advances in electrochemical glucose biosensors: A review[J]. Rsc Advances, 2013, 3(14): 4473-4491. DOI:10.1039/C2RA22351A |
| [29] |
WANG J. Electrochemical glucose biosensors[J]. Chemical Reviews, 2008, 108(2): 814-825. DOI:10.1021/cr068123a |
| [30] |
HAGHIGHI B, KARIMI B, TAVAHODI M, et al. Fabrication of a nonenzymatic glucose sensor using Pd-nanoparticles decorated ionic liquid derived fibrillated mesoporous carbon[J]. Materials Science and Engineering: C, 2015, 52: 219-224. DOI:10.1016/j.msec.2015.03.045 |
| [31] |
WANG X L, HAO J C. Recent advances in ionic liquid-based electrochemical biosensors[J]. Science Bulletin, 2016, 61(16): 1281-1295. DOI:10.1007/s11434-016-1151-6 |
| [32] |
WU Y Y, ZHAO Y, WANG Y Y, et al. Sensitive immunosensing of squamous cell carcinoma antigen based on a nanocomposite of poly{3-amine-N-[3-(N-pyrrole)propyl]imidazole bromide} ionic liquid and gold nanoroots[J]. Biosensors and Bioelectronics, 2017, 96: 140-145. DOI:10.1016/j.bios.2017.04.028 |
| [33] |
LI R, WU K B, LIU C X, et al. 4Amino-1-(3-mercapto-propyl)-pyridine hexafluorophosphate ionic liquid functionalized gold nanoparticles for IgG immunosensing enhancement[J]. Analytical Chemistry, 2014, 86: 5300-5307. DOI:10.1021/ac500024n |
| [34] |
LIU N, CHEN X, MA Z F, et al. Ionic liquid functionalized graphene/Au nanocomposites and its application for electrochemical immunosensor[J]. Biosensors & Bioelectronics, 2013, 48: 33-38. DOI:10.1016/j.bios.2013.03.080 |
| [35] |
FUKUSHIMA T, AIDA T. Ionic liquids for soft functional materials with carbon nanotubes[J]. Chemistry, 2007, 13(18): 5048-5058. DOI:10.1002/chem.200700554 |
| [36] |
SALIMI A, KAVOSI B, HALLAJ R, et al. Highly sensitive immunosensing of prostate specific antigen based on ionic liquid carbon nanotubes modified electrode: Application as cancer biomarker for prostate biopsies[J]. Biosensors & Bioelectronics, 2013, 42: 439-446. DOI:10.1016/j.bios.2012.10.053 |
| [37] |
ZHANG X, DOU W C, ZHANG X J, et al. A novel immunosensor for Enterobacter sakazakii based on multiwalled carbon nanotube/ionic liquid/thionine modified electrode[J]. Electrochimica Acta, 2012, 61: 73-77. DOI:10.1016/j.electacta.2011.11.092 |
| [38] |
WEI Z L, SUN X l, LI Z J, et al. Highly sensitive deoxynivalenol immunosensor based on a glassy carbon electrode modified with a fullerene/ferrocene/ionic liquid composite[J]. Microchim Acta, 2011, 172: 365-371. DOI:10.1007/s00604-010-0495-x |
| [39] |
FAN H X, ZHANG Y, WU D, et al. Construction of label-free electrochemical immunosensor on mesoporous carbon nanospheres for breast cancer susceptibility gene[J]. Analytica Chimica Acta, 2013, 770: 62-67. DOI:10.1016/j.aca.2013.01.066 |
| [40] |
ZHAO W W, XU J J, CHEN H Y. Photoelectrochemical bioanalysis: The state of the art[J]. Chemical Society Reviews, 2015, 44: 729-741. DOI:10.1039/C4CS00228H |
| [41] |
KHALID W, HELOU M, MURBOCK T, et al. Immobilization of quantum dots via conjugated self-Assembled monolayers and their application as a light-controlled sensor for the detection of hydrogen peroxide[J]. ACS Nano, 2011, 5: 9870-9876. DOI:10.1021/nn2035582 |
| [42] |
YU X Y, WANG Y Y, CHEN X M, et al. White-light-exciting, layer-by-layer-assembled ZnCdHgSe qua-ntum dots/polymerized ionic liquid hybrid film for highly sensitive photoelectrochemical immunosensing of neuron specific enolase[J]. Analytical Chemistry, 2015, 87: 4237-4244. DOI:10.1021/ac504456w |
| [43] |
TAN Y, WANG Y Y, LI M S, et al. Enhanced photoelectrochemical immunosensing of cardiac troponin Ⅰ based on energy transfer between N-acetyl-L-cysteine capped CdAgTe quantum dots and dodecahedral Au nanoparticles[J]. Biosensors & Bioelectronics, 2017, 91: 741-746. DOI:10.1016/j.bios.2017.01.040 |
| [44] |
LI Z J, WANG Z Y, SUN X L. A sensitive and highly stable electrochemical impedance immunosensor based on the formation of silica gel-ionic liquid biocompatible film on the glassy carbon electrode for the determination of aflatoxin B1 in bee pollen[J]. Talanta, 2010, 80: 1632-1637. DOI:10.1016/j.talanta.2009.09.058 |
| [45] |
CHEN X J, ZHOU J J, XUAN J. Room-temperature ionic liquid assisted fabrication of sensitive electrochemical immunosensor based on ordered macroporous gold film[J]. Analyst, 2010, 135: 2629-2636. DOI:10.1039/C0AN00264J |
| [46] |
LIU K P, ZHANG J J, YANG G H, et al. Direct electrochemistry and electrocatalysis of hemoglobin based on poly (diallyldimethylammonium chloride) functionalized graphene sheets/room temperature ionic liquid composite film[J]. Electrochemistry Communications, 2010, 12(3): 402-405. DOI:10.1016/j.elecom.2010.01.004 |
| [47] |
LI J W, LIU L H, XIAO F. Direct electron transfer and electrocatalysis of horseradish peroxidase immobilized in gemini surfactant-ionic liquid composite film on glassy carbon electrode[J]. Journal of Electroanalytical Chemistry, 2008, 613(1): 51-57. DOI:10.1016/j.jelechem.2007.10.008 |
| [48] |
WANG W C, LI X Q, YU X H, et al. Electrochemistry and electrocatalysis of myoglobin on electrodeposited ZrO2 and graphene-modified carbon ionic liquid electrode[J]. Journal of the Iranian Chemical Society, 2016, 13(2): 323-330. DOI:10.1007/s13738-015-0740-7 |
| [49] |
XI F N, LIU L J, WU Q, et al. One-step construction of biosensor based on chitosan-ionic liquid-horseradish peroxidase biocomposite formed by electrodeposition[J]. Biosensors & Bioelectronics, 2008, 24(1): 29-34. DOI:10.1016/j.bios.2008.03.023 |
| [50] |
LONG J S, SILVESTER D S, WILDGOOSE G G, et al. Direct electrochemistry of horseradish peroxidase immobilized in a chitosan-[C4mim][BF4] film: Determination of electrode kinetic parameters[J]. Bioelectrochemistry, 2008, 74(1): 183-187. DOI:10.1016/j.bioelechem.2008.07.008 |
| [51] |
KANG S, ZHAO W S, LI X Y, et al. Electrochemical behaviors of myoglobin on ionic liquid-graphene-cobalt oxide nanoflower composite modified electrode and its electrocatalytic activity[J]. International Journal of Electrochemical Science, 2017, 12(3): 2184-2193. DOI:10.20964/2017.03.64 |
| [52] |
LOU J, LU Y X, ZHAN T R, et al. Application of an ionic liquid-functionalized Mg2Al layered double hydroxide for the electrochemical myoglobin biosensor[J]. Ionics, 2014, 20(10): 1471-1479. DOI:10.1007/s11581-014-1088-1 |
| [53] |
SUN W, WANG D D, GAO R F, et al. Direct electrochemistry and electrocatalysis of hemoglobin in sodium alginate film on a BMIMPF6 modified carbon paste electrode[J]. Electrochemistry Communications, 2007, 9(5): 1159-1164. DOI:10.1016/j.elecom.2007.01.003 |
| [54] |
SUN W, GAO R F, JIAO K. Electrochemistry and electrocatalysis of hemoglobin in nafion/nano-CaCO3 film on a new ionic liquid BPPF6 modified carbon paste electrode[J]. The Journal of Physical Chemistry B, 2007, 111(17): 4560-4567. DOI:10.1021/jp067933n |
| [55] |
CHEN X Q, YAN H Q, SHI Z F, et al. A novel biosensor based on electro-co-deposition of sodium alginate-Fe3O4-graphene composite on the carbon ionic liquid electrode for the direct electrochemistry and electrocatalysis of myoglobin[J]. Polymer Bulletin, 2017, 74(1): 75-90. DOI:10.1007/s00289-016-1698-z |
| [56] |
SUN W, LI X Q, QIN P, et al. Electrodeposition of Co nanoparticles on the carbon ionic liquid electrode as a platform for myoglobin electrochemical biosensor[J]. The Journal of Physical Chemistry C, 2009, 113(26): 11294-11300. DOI:10.1021/jp8114594 |
| [57] |
RAHIMI P, RAFIEE-POUR H A, GHOURCHIAN H, et al. Ionic-liquid/NH2-MWCNTs as a highly sensitive nano-composite for catalase direct electrochemistry[J]. Biosensors & Bioelectronics, 2010, 25(6): 1301-1306. DOI:10.1016/j.bios.2009.10.020 |
| [58] |
GHOLIVAND M B, KHODADADIAN M. Amperometric cholesterol biosensor based on the direct electrochemistry of cholesterol oxidase and catalase on a graphene/ionic liquid-modified glassy carbon electrode[J]. Biosensors & Bioelectronics, 2014, 53: 472-478. DOI:10.1016/j.bios.2013.09.074 |
| [59] |
ZHANG Q, WU S Y, ZHANG L, et al. Fabrication of polymeric ionic liquid/graphene nanocomposite for glucose oxidase immobilization and direct electrochemistry[J]. Biosensors & Bioelectronics, 2011, 26(5): 2632-2637. DOI:10.1016/j.bios.2010.11.024 |
| [60] |
WU X M, ZHAO B, WU P, et al. Effects of ionic liquids on enzymatic catalysis of the glucose oxidase toward the oxidation of glucose[J]. The Journal of Physical Chemistry B, 2009, 113(40): 13365-13373. DOI:10.1021/jp905632k |
| [61] |
ZHANG Y J, SHEN Y F, LI J H, et al. Electrochemical functionalization of single-walled carbon nanotubes in large quantities at a room-temperature ionic liquid supported three-dimensional network electrode[J]. Langmuir, 2005, 21(11): 4797-4800. DOI:10.1021/la050026+ |
| [62] |
TAO W Y, PAN D W, LIU Q, et al. Optical and bioelectrochemical characterization of water-miscible ionic liquids based composites of multiwalled carbon nanotubes[J]. Electroanalysis, 2006, 18(17): 1681-1688. DOI:10.1002/elan.200603560 |
| [63] |
ZHAO Q, ZHAN D P, MA H Y, et al. Direct proteins electrochemistry based on ionic liquid mediated carbon nanotube modified glassy carbon electrode[J]. Frontiers Bioscience, 2005, 10: 326-334. DOI:10.2741/1530 |
| [64] |
XIANG C L, ZOU Y J, SUN L X, et al. Direct electron transfer of cytochrome C and its biosensor based on gold nanoparticles/room temperature ionic liquid/carbon nanotubes composite film[J]. Electrochemistry Communications, 2008, 10(1): 38-41. DOI:10.1016/j.elecom.2007.10.030 |
| [65] |
ZHANG Y, ZHENG J B. Direct electrochemistry and electrocatalysis of cytochrome C based on chitosan-room temperature ionic liquid-carbon nanotubes composite[J]. Electrochimica Acta, 2008, 54(2): 749-754. DOI:10.1016/j.electacta.2008.06.066 |
| [66] |
SPEGEL P, SCHWEITZ L, NILSSON S. Molecularly imprinted polymers[J]. Analytical and Bioanalytical Chemistry, 2002, 372(1): 37-38. DOI:10.1007/s00216-001-1155-0 |
| [67] |
PAULING L. A theory of the structure and process of formation of antibodies[J]. Journal of the American Chemical Society, 1940, 62(10): 2643-2657. DOI:10.1021/ja01867a018 |
| [68] |
FREEMANTLE M. Designer solvents: Ionic liquids may boost clean technology development[J]. Chemical & Engineering News, 1998, 76(13): 32-37. |
| [69] |
WANG Z H, LI F, XIA J F, et al. An ionic liquid-modified graphene based molecular imprinting electrochemical sensor for sensitive detection of bovine hemoglobin[J]. Biosensors & Bioelectronics, 2014, 61: 391-396. DOI:10.1016/j.bios.2014.05.043 |
| [70] |
LIU M M, PI J Y, WANG X J, et al. A sol-gel derived pH-responsive bovine serum albumin molecularly imprinted poly (ionic liquids) on the surface of multiwall carbon nanotubes[J]. Analytica Chimica Acta, 2016, 932: 29-40. DOI:10.1016/j.aca.2016.05.020 |
| [71] |
WANG Y Y, HAN M, LIU G S, et al. Molecularly imprinted electrochemical sensing interface based on in-situ-polymerization of amino-functionalized ionic liquid for specific recognition of bovine serum albumin[J]. Biosensors & Bioelectronics, 2015, 74: 792-798. DOI:10.1016/j.bios.2015.07.046 |
| [72] |
XIA J F, CAO X Y, WANG Z H, et al. Molecularly imprinted electrochemical biosensor based on chitosan/ionic liquid-graphene composites modified electrode for determination of bovine serum albumin[J]. Sensors and Actuators B: Chemical, 2016, 225: 305-311. DOI:10.1016/j.snb.2015.11.060 |
| [73] |
DUAN H M, WANG X J, WANG Y H, et al. An ultrasensitive lysozyme chemiluminescence biosensor based on surface molecular imprinting using ionic liquid modified magnetic graphene oxide/β-cyclodextrin as supporting material[J]. Analytica Chimica Acta, 2016, 918: 89-96. DOI:10.1016/j.aca.2016.03.008 |
| [74] |
WANG X, WANG Y Y, YE X X, et al. Sensing platform for neuron specific enolase based on molecularly imprinted polymerized ionic liquids in between gold nanoarrays[J]. Biosensors & Bioelectronics, 2018, 99: 34-39. DOI:10.1016/j.bios.2017.07.037 |
| [75] |
QIAN L W, HU X L, GUAN P, et al. Thermal preparation of lysozyme-imprinted microspheres by using ionic liquid as a stabilizer[J]. Analytical and Bioanalytical Chemistry, 2014, 406(28): 7221-7231. DOI:10.1007/s00216-014-8133-9 |
| [76] |
WANG Y Y, HAN M, YE X X, et al. Voltammetric myoglobin sensor based on a glassy carbon electrode modified with a composite film consisting of carbon nanotubes and a molecularly imprinted polymerized ionic liquid[J]. Microchimica Acta, 2017, 184(1): 195-202. DOI:10.1007/s00604-016-2005-2 |
 2018, Vol. 64
2018, Vol. 64