文章信息
- 温辉高, 易嘉琰, 肖瑶, 李亚, 葛红瑜, 邹胜琼, 冯翰, 樊李红
- WEN Huigao, YI Jiayan, XIAO Yao, LI Ya, GE Hongyu, ZOU Shengqiong, FENG Han, FAN Lihong
- 壳聚糖季铵盐/氧化魔芋葡甘露聚糖水凝胶的制备及性能
- Preparation and Properties of 2-Hydroxypropyltrimethyl Ammonium Chloride Chitosan/Oxidized Konjac Glucomannan Hydrogel
- 武汉大学学报(理学版), 2017, 63(4): 305-311
- Journal of Wuhan University(Natural Science Edition), 2017, 63(4): 305-311
- http://dx.doi.org/10.14188/j.1671-8836.2017.04.004
-
文章历史
- 收稿日期:2017-02-16

水凝胶是一种具有三维大分子网络结构的亲水性聚合物[1, 2],具有良好的溶胀性能,能封存一定的水分,且具有抗菌活性,可作为新型的伤口敷料加快伤口愈合[3~6].壳聚糖(chitosan, CS)是天然的阳离子聚合物,具有良好的生物相容性、生物可降解性、抗菌性和抗氧化活性,广泛应用于生物学、化学和医学等领域[7].但壳聚糖只能溶于酸性介质,且在pH值大于6.5时失去抗菌活性[8],限制了其应用.壳聚糖季铵盐则是一种在中性和碱性条件下都水溶的壳聚糖衍生物,相比于壳聚糖,其抗菌性能得到显著提升[9, 10].魔芋葡甘露聚糖(konjac glucomannan, KGM)是一种水溶性非离子型天然高分子多糖,具有优良的亲水性、凝胶性、成膜性和增稠性等理化性质[11~13].魔芋葡甘露聚糖与高碘酸钠发生氧化反应,分子链上的顺式二糖醇基团的C—C键开裂生成醛基结构[14, 15],得到的氧化魔芋葡甘露聚糖(OKGM)可代替常用的甲醛、乙二醛、戊二醛等有毒害的化学交联剂制备水凝胶,从而提升水凝胶的生物性能.
本文以壳聚糖与3-氯-2-羟丙基三甲基氯化铵合成羟丙基三甲基氯化铵壳聚糖,以NaIO4作为氧化剂与魔芋胶制得OKGM与壳聚糖季铵盐交联,得到一种具有医用潜力的新型抗菌水凝胶敷料.检测了该水凝胶敷料吸水和保水能力,与伤口接触时的溶血反应以及对伤口部位的细菌的杀伤能力,探讨了不同的OKGM含量对水凝胶的凝胶时间、溶胀性能、失水率、溶血性能等的影响.
1 实验部分 1.1 材料及仪器材料:魔芋胶(葡甘露聚糖含量95%以上,湖北强森魔芋科技有限公司);3-氯-2-羟丙基三甲基氯化铵(活性物含量69%以上,山东国丰君达化工科技股份有限公司);壳聚糖(脱乙酰度92%,浙江金壳药业有限公司).其他试剂均为分析纯,实验用水为去离子水.
仪器:170SX型傅立叶变换红外光谱仪(Nicolet公司);VEGA 3型扫描电镜(TESCAN公司);UV1700PC型紫外可见分光光度计(上海精密科学仪器有限公司);SW-CJ-2FD型超净工作台(上海博讯实业有限公司)等.
1.2 实验方法 1.2.1 壳聚糖季铵盐的制备参考文献方法[16]优化实验方案制备羟丙基三甲基氯化铵壳聚糖(HACC),反应式如图 1.取60 mL 3-氯-2-羟丙基三甲基氯化铵于烧杯中,加入适量的水稀释,用NaOH溶液调节pH至8.0后转移至三口烧瓶中,再加入4.0 g壳聚糖,85 ℃机械搅拌72 h.反应完成后加水溶解,调节pH值至中性,透析72 h.所得样品经旋转蒸发浓缩,得到糊状的初产品恒温干燥备用.
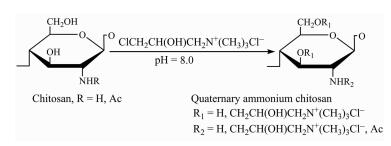
|
| 图 1 HACC的制备 Figure 1 The synthesis of HACC |
氧化魔芋葡甘露聚糖(oxidized konjac glucomannan, OKGM)的制备参照文献[15, 17],反应式如图 2所示.5.0 g魔芋加入500 mL水中,搅拌得到均一的水分散体系后加入5.0 g高碘酸钠,控制温度30 ℃,在黑暗环境中反应12 h,然后加入适量的乙二醇继续反应2 h以除去未反应的氧化剂,透析72 h,离心后收集上清液,恒温干燥备用.
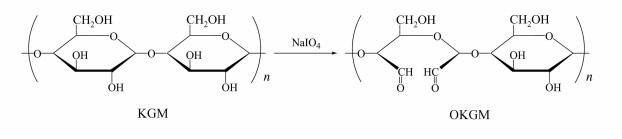
|
| 图 2 OKGM的制备 Figure 2 The synthesis of OKGM |
取10 mL 6%(m/V)HACC溶液,按实验设计量加入6%(m/V)OKGM水溶液,充分搅拌后静置得到壳聚糖季铵盐/OKGM水凝胶(OKHC),根据OKGM含量(2, 4, 6, 8, 10 mL)的不同,将水凝胶分别标记为OKHC-2,OKHC-4,OKHC-6,OKHC-8,OKHC-10.
1.2.4 水凝胶的表征红外光谱(FT-IR):采用170SX型傅立叶变换红外光谱仪,将壳聚糖、魔芋原料, 制得的壳聚糖季铵盐、OKGM和OKHC-6水凝胶样品研磨成粉末,以KBr压片法进行红外吸收光谱测试.
扫描电镜(SEM):将水凝胶样品液氮脆断,置于-20℃冰箱中预冻完全,冷冻干燥24h,真空喷金处理,观测水凝胶的断面形貌.
1.2.5 凝胶时间的测试采用试管倾倒法测定水凝胶的凝胶时间.取3 mL已混合均匀的样品加入到10 mm的玻璃试管中,注射后开始计时,并不停地倾斜或翻转试管直到液体体系停止流动,记录体系的流动时间即为水凝胶的凝胶时间.
1.2.6 溶胀性能测试称取一定质量水凝胶冻干样品,室温下浸泡于pH 7.4 PBS缓冲溶液中至溶胀平衡,用滤纸片将水凝胶样品表面的水分完全吸收移除后,称其质量,按(1) 式计算水凝胶的溶胀率:
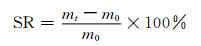
|
(1) |
其中:mt为水凝胶溶胀后的质量,m0为水凝胶初始质量.
1.2.7 失水率测试将形状相似的水凝胶冻干样品置于水中浸泡至溶胀平衡,取出后去除表面水分并称其质量m1,将样品放置于温度为50 ℃,湿度为50%的恒温烘箱中,定期取出测其质量m2,直至水凝胶干燥至恒重后称其质量m3.按(2) 式计算水凝胶的失水率:
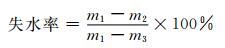
|
(2) |
其中,m1为水凝胶初始重量,m2为定期测量的水凝胶重量,m3为水凝胶完全干燥后的重量.
1.2.8 溶血性能测试通过对水凝胶与血红细胞在体外接触过程中导致红细胞破坏和血红蛋白游离程度的测定,评价材料的血液兼容性.取新鲜抗凝全血2 mL加入2.5 mL生理盐水稀释备用.称取一定质量的水凝胶样品粉末于试管中,加入10 mL生理盐水,同时取10 mL去离子水作阳性对照,10 mL生理盐水作阴性对照.将全部试管置于37 ℃恒温水浴槽中保温30 min,取出后分别加入稀释全血0.1 mL,混匀后再于37 ℃保温60 min.取出试管,将温浴后的血红细胞在1 500 r/min的转速下离心10 min,测上清液545 nm波长处的吸光度值,每组样品平行重复测3次,取平均值,按(3) 式计算溶血率:
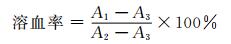
|
(3) |
其中,A1为样品组的吸光度,A2为阳性对照组的吸光度,A3为阴性对照组的吸光度.
1.2.9 抑菌性能测试采用吸光度法测定HACC/OKGM水凝胶对金黄色葡萄球菌(E. coli)和大肠杆菌(S. aureus)的抑菌效果.配制牛肉浸膏蛋白胨细菌培养基:将牛肉浸膏、鱼粉蛋白粉、NaCl溶于水,配制成含0.5%牛肉浸膏、1.0%鱼粉蛋白粉、1.0%NaCl的液体培养基,用NaOH溶液调节pH值至7.2.将培养基分装入锥形瓶中并加入质量相同的水凝胶冻干样品,以不加水凝胶的液体培养基作为空白对照,充分溶胀后密封置于高压灭菌器中于121 ℃,1 216 kPa下灭菌15 min,冷却至室温.取200 μL稀释后的菌悬液接种至液体培养基中,将所有的锥形瓶于37 ℃,120 r/min恒温振荡24 h,然后取适量浑浊菌液测试600 nm处吸光度,每组样品重复测3次,计算抑菌率:
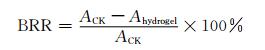
|
(4) |
其中:Ahydrogel为加入水凝胶样品的吸光度,ACK为空白对照组的吸光度.
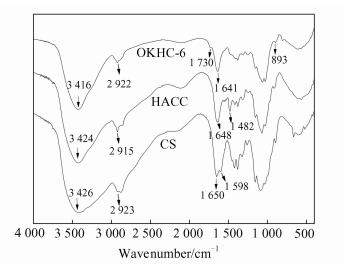
2 结果与讨论 2.1 红外光谱图 3为壳聚糖、壳聚糖季铵盐和壳聚糖季铵盐/OKGM水凝胶(OKHC-6) 的FT-IR光谱.壳聚糖3 426 cm-1处较宽的吸收峰为—OH和—NH2的伸缩振动吸收峰,2 923 cm-1处为残糖基上的甲基或次甲基的C—H的伸缩振动吸收峰,1 650 cm-1处为吸收酰氨Ⅰ谱带,1 598 cm-1处为氨基的弯曲振动峰.壳聚糖季铵盐1 598 cm-1处的强吸收峰消失,并于1 482 cm-1处出现一新的强吸收峰,对应为三甲基季铵离子中—CH3的C—H弯曲振动吸收峰,说明该季铵化反应是以N为位点接入了季铵盐侧链,从而将羟丙基三甲基氯化胺成功引入到壳聚糖的分子链中.OKHC-6水凝胶在1 641 cm-1处出现新的吸收峰,归属为—N=C—的伸缩振动吸收峰,证明壳聚糖季铵盐上的氨基与OKGM上的醛基发生了交联反应.
|
| 图 3 壳聚糖、壳聚糖季铵盐和OKHC-6水凝胶的FT-IR光谱 Figure 3 FT-IR spectra of CS, HACC and OKHC-6 hydrogel |
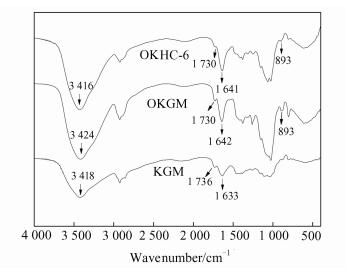
图 4为魔芋、OKGM和OKHC-6水凝胶的红外图谱.魔芋图谱中,在3 418 cm-1出现的强而宽的吸收峰为KGM葡聚糖结构上—OH伸缩振动吸收峰,1 736 cm-1处为乙酰基的C=O的伸缩振动吸收峰,1 633 cm-1处为水分子的面内弯曲振动吸收峰.OKGM的红外图谱中可以发现在1 730 cm-1和893 cm-1处出现两个新的吸收峰,其中,1 730 cm-1处为醛基的伸缩振动吸收峰,893 cm-1处为醛基和邻位羟基之间形成的半缩醛结构特征吸收峰[14, 15, 17],证明了氧化反应的发生.而这两个强吸收峰在OKHC-6水凝胶的红外图谱中变弱甚至消失,同时在1 641 cm-1处出现了C=N的伸缩振动吸收峰,说明OKGM的醛基和壳聚糖季铵盐的氨基发生了交联反应.
|
| 图 4 KGM、OKGM和OKHC-6水凝胶的FT-IR光谱 Figure 4 FT-IR spectra of KGM, OKGM and OKHC-6 hydrogel |
图 5为不同OKGM含量的OKHC水凝胶干样品断面在不同放大倍率下的扫描电镜图片.观察水凝胶的超微结构可以发现,所有水凝胶样品都具有平整而光滑的骨架结构,并有大量的孔隙遍布其中,在水凝胶内部形成牢固、连续且均匀分布的三维网络结构.对比OKHC-2(A)、OKHC-4(B)、OKHC-6(C)、OKHC-8(D)和OKHC-10(E)可以发现,水凝胶结构骨架的表面很光滑平整,随着OKGM含量的增大,水凝胶的孔径结构呈现出减小的趋势.这可能是因为随着OKGM含量的增大,与壳聚糖季铵盐发生Schiff碱反应程度越高,导致形成的凝胶结构越致密.

|
| 图 5 不同OKGM含量OKHC水凝胶断面的SEM照片 Figure 5 SEM images of the cross-section of OKHC hydrogels with different OKGM loadings A: OKHC-2, B: OKHC-4; C: OKHC-6; D: OKHC-8; E: OKHC-10 |
表 1为不同OKGM加入量的OKHC水凝胶的凝胶时间(Δt)测试结果.从表 1中可以看出,随着OKGM加入量的增加,水凝胶的凝胶时间先减少后增加,在OKGM加入量为6 mL的OKHC-6水凝胶有最短的凝胶时间91.3 s.这可能是因为当OKGM加入量低于6 mL时,随着OKGM加入量的加大使体系中的醛基含量增加,加快了氨基与醛基的交联反应,使凝胶所需时间变短;但当OKGM加入量大于6 mL时,体系中的醛基含量已经达到饱和,过多的OKGM溶液使得混合体系中组分的整体浓度下降,交联反应的反应速率降低,凝胶时间延长.
| Hydrogel | Δt/s |
| OKHC-2 | 110.4 |
| OKHC-4 | 97.1 |
| OKHC-6 | 91.3 |
| OKHC-8 | 98.4 |
| OKHC-10 | 106.5 |
室温下,不同OKGM含量所制备的水凝胶在PBS溶液(pH 7.4) 中的溶胀率如图 6所示.由于壳聚糖季铵盐、OKGM含有大量亲水性基团并且水凝胶具有高度多孔网络结构,自由水可以进入多孔网络结构,显示出良好的溶胀性能.从图 6中可以看出,OKGM加入量为2 mL的OKGM-2水凝胶的溶胀率达到最大值508%.之后,随OKGM含量的增大,水凝胶的溶胀率变化不大但依然呈现减小的趋势,这是因为OKGM的含量越大,与壳聚糖季铵盐发生Schiff碱反应程度越高,形成的凝胶结构越致密,孔径变小,吸水率随之降低,凝胶的溶胀性能就变差.此结果与扫描电镜得到的结果相一致.
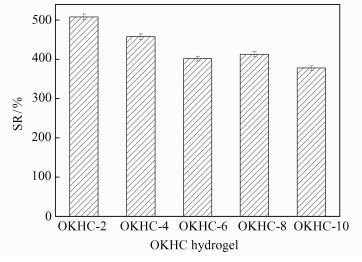
|
| 图 6 不同OKGM含量OKHC水凝胶的溶胀率 Figure 6 Swelling ratio of OKHC hydrogels with different OKGM loadings |
大量临床研究和实践已经证实,处在良好湿润性的环境下创面可以加速和改善自身愈合的状况.适宜的失水率可以封存一定的水分于伤口敷料下,为伤口愈合提供一个良好的、润湿的环境,故通过失水率的测定评价水凝胶敷料保水能力有重大意义.图 7为不同OKGM含量的OKHC水凝胶的失水率.可以看出,不同水凝胶的失水率变化趋势大体相似,初始时水凝胶失水率较低,随着时间的延长水凝胶失去了大量的水分,18h后水凝胶的失水率变化明显减缓,24 h后达到基本稳定.随着OKGM含量增加,不同OKGM含量的水凝胶失水率逐步下降.这主要是因为OKGM含量的升高增加了水凝胶的交联度,凝胶内部孔径变小且孔结构变密集,减少了水凝胶与空气对流接触的比表面积,使水凝胶的失水率下降.此外,水凝胶在24 h之后仍然保有一定量的水分,使其可以在较长的时间内为伤口的愈合提供理想的润湿环境[18~20].
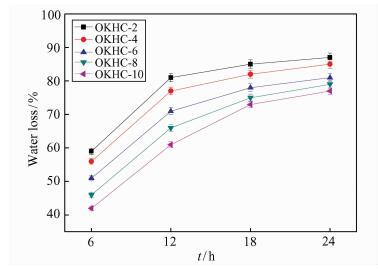
|
| 图 7 不同OKGM含量OKHC水凝胶的失水率 Figure 7 Water loss of OKHC hydrogels with different OKGM loadings |
伤口敷料在临床应用中通常直接与血液相接触,故水凝胶医用材料的溶血率必须达到可接受的范围.图 8分别为阴性对照组、实验组(OKHC-6水凝胶)和阳性对照组的溶血实验.实验组的试管底部有部分血红细胞沉积,水凝胶材料吸附了大量的血红细胞,且上清液基本为无色透明状,说明该水凝胶材料具有良好的抗溶血性能.

|
| 图 8 阴性组、OKHC-6水凝胶和阳性组的溶血现象 Figure 8 Hemolysis of the negative control sample, OKHC-6 hydrogel and the positive control sample |
表 2为37℃下不同样品与血液相接触60 min后的溶血率.由表中数据可知,OKHC水凝胶材料的溶血率在0.57% ~ 3.32%之间,均低于5%,符合生物材料溶血率小于5%的国际标准,说明OKHC水凝胶几乎不引起体外溶血反应,基本保持了血液中红细胞的完整性,具有良好的血液相容性.
| Hydrogel | Haemolysis/% |
| OKHC-2 | 0.57 |
| OKHC-4 | 0.95 |
| OKHC-6 | 1.27 |
| OKHC-8 | 3.32 |
| OKHC-10 | 3.16 |
伤口暴露在空气中极易感染细菌从而延迟伤口的愈合,具有抗菌活性的伤口敷料可以加快伤口的愈合.图 9为不同OKGM含量OKHC水凝胶对金黄色葡萄球菌和大肠杆菌的抑制率.可以发现水凝胶对两种细菌均表现出良好的抗菌性,抑菌率随着OKGM含量的增加呈现出先增大后减小的趋势.这是因为当OKGM含量增加,更多的壳聚糖季铵盐可以与OKGM发生交联形成具有网络结构的水凝胶从而抗菌活性增强.随着OKGM含量的继续加大,水凝胶的孔结构变密集孔径变小,季铵盐基团很难和细菌接触,从而抗菌活性无增强反而稍有减弱.OKHC水凝胶的良好抗菌活性主要是因为在壳聚糖分子链上引入了季铵阳离子基团,提高了聚合物的正电性和正电荷密度,增强其对细菌细胞表面负电荷的静电吸引作用,导致细菌裂解死亡.
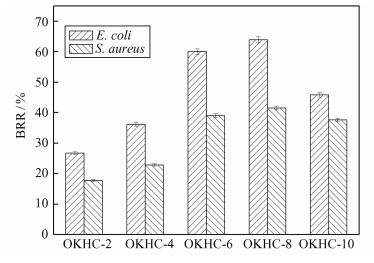
|
| 图 9 不同OKGM含量OKHC水凝胶的抑菌率 Figure 9 Inhibitory ratio of OKHC hydrogels with different OKGM loadings against S. aureus and E. coli |
本文以壳聚糖与3-氯-2-羟丙基三甲基氯化铵反应,在碱性条件下合成了羟丙基三甲基氯化铵壳聚糖,以NaIO4作为氧化剂与魔芋胶反应得到OKGM作为交联剂与壳聚糖季铵盐交联制得一种可用作伤口敷料的OKHC水凝胶材料.在保持壳聚糖季铵盐溶液的体积为10 mL的条件下探讨了不同的OKGM含量对水凝胶结构及性能的影响.通过这一方法制备的水凝胶保留了魔芋和壳聚糖季铵盐的优良性质且避免了有毒交联剂的引用.通过一系列表征和测试发现:水凝胶样品均具有清晰稳定的三维网络结构,在OKGM含量为6 mL时具备最短凝胶时间91.3 s;溶胀性能和失水率测试表明,水凝胶具有良好的溶胀性能和适当的保水能力,最大溶胀率为508%,且随OKGM含量的增大,溶胀率减小,失水率逐步下降;溶血实验显示所有OKHC水凝胶材料具有良好的抗溶血性能,溶血率在0.57%~3.32%之间,几乎不破坏人体的血细胞.此外,抑菌性能测试结果表明OKHC水凝胶对金黄色葡萄球菌和大肠杆菌具有良好的抑菌性,能够防止由细菌侵入造成的伤口感染.本文研究结果表明,OKHC水凝胶在伤口敷料领域具有潜在的应用价值.
| [1] | KONG W, HUANG D, XU G, et al. Graphene oxide/polyacrylamide/aluminum ion cross-linked carboxymethyl hemicellulose nanocomposite hydrogels with very tough and elastic properties[J]. Chemistry-An Asian Journal, 2016, 11(11) : 1697–1704. DOI:10.1002/asia.201600138 |
| [2] | I SWARIYA S, BHANUKEERTHI A V, VELSWAMY P, et al. Design and development of a piscine collagen blended pullulan hydrogel for skin tissue engineering[J]. Rsc Advances, 2016, 6(63) : 57863–57871. DOI:10.1039/C6RA03578G |
| [3] | KIM Y M, POTTA T, PARK K H, et al. Temperature responsive chemical crosslinkable UV pretreated hydrogel for application to injectable tissue regeneration system via differentiations of encapsulated hMSCs[J]. Biomaterials, 2016, 112 : 248–256. DOI:10.1016/j.biomaterials.2016.10.025 |
| [4] | ZHAO X, WU H, GUO B, et al. Antibacterial anti-oxidant electroactive injectable hydrogel as self-healing wound dressing with hemostasis and adhesiveness for cutaneous wound healing[J]. Biomaterials, 2017, 122 : 34–37. DOI:10.1016/j.biomaterials.2017.01.011 |
| [5] | ZHANG Y, DANG Q, LIU C, et al. Synthesis, characterization, and evaluation of poly(aminoethyl) modified chitosan and its hydrogel used as antibacterial wound dressing[J]. International Journal of Biological Macromolecules, 2017, 102 : 457–467. DOI:10.1016/j.ijbiomac.2017.04.049 |
| [6] | CHEN H, XING X, TAN H, et al. Covalently antibacterial alginate-chitosan hydrogel dressing integrated gelatin microspheres containing tetracycline hydrochloride for wound healing[J]. Materials Science and Engineering C, 2017, 70(Pt 1) : 287–295. DOI:10.1016/j.msec.2016.08.086 |
| [7] | HE G, CHAO Z, YE S, et al. Preparation and properties of novel hydrogel based on chitosan modified by poly(amidoamine) dendrimer[J]. International Journal of Biological Macromolecules, 2016, 91 : 828–837. DOI:10.1016/j.ijbiomac.2016.05.091 |
| [8] | HU D, WANG H, WANG L. Physical properties and antibacterial activity of quaternized chitosan/carboxymethyl cellulose blend films[J]. LWT-Food Science and Technology, 2016, 65 : 398–405. DOI:10.1016/j.lwt.2015.08.033 |
| [9] | LI S D, ZHANG C H, DONG J J, et al. Effect of cupric ion on thermal degradation of quaternized chitosan[J]. Carbohydrate Polymers, 2010, 81(2) : 182–187. DOI:10.1016/j.carbpol.2010.02.049 |
| [10] | WU H, ZHANG J, XIAO B, et al. N-(2-hydroxypropyl)-3-trimethylammonium chitosan-poly(ε-caprolactone) copolymers and their antibacterial activity[J]. Carbohydrate Polymers, 2011, 83(2) : 824–830. DOI:10.1016/j.carbpol.2010.08.062 |
| [11] | GAN L, SHANG S, HU E, et al. Konjac glucomannan/graphene oxide hydrogel with enhanced dyes adsorption capability for methyl blue and methyl orange[J]. Applied Surface Science, 2015, 357 : 866–872. DOI:10.1016/j.apsusc.2015.09.106 |
| [12] | LU M, LI Z, LIANG H, et al. Controlled release of anthocyanins from oxidized konjac glucomannan microspheres stabilized by chitosan oligosaccharides[J]. Food Hydrocolloids, 2015, 51 : 476–485. DOI:10.1016/j.foodhyd.2015.05.036 |
| [13] | CHEN Y, ZHAO H, LIU X, et al. TEMPO-oxidized konjac glucomannan as appliance for the preparation of hard capsules[J]. Carbohydrate Polymers, 2016, 143 : 262–269. DOI:10.1016/j.carbpol.2016.01.072 |
| [14] | YU H, LU J, XIAO C. Preparation and properties of novel hydrogels from oxidized konjac glucomannan cross-linked chitosan for in vitro drug delivery[J]. Macromolecular Bioscience, 2007, 7(9-10) : 1100–1111. DOI:10.1002/mabi.200700035 |
| [15] | KORKIATITHAWEECHAI S, UMSARIKA P, PRAPHAIRAKSIT N, et al. Controlled release of diclofenac from matrix polymer of chitosan and oxidized konjac glucomannan[J]. Marine Drugs, 2011, 9(9) : 1649–1663. DOI:10.3390/md9091649 |
| [16] | FAN L, YANG J, WU H, et al. Preparation and characterization of quaternary ammonium chitosan hydrogel with significant antibacterial activity[J]. International Journal of Biological Macromolecules, 2015, 79 : 830–836. DOI:10.1016/j.ijbiomac.2015.04.013 |
| [17] | YU H, XIAO C. Synthesis and properties of novel hydrogels from oxidized konjac glucomannan crosslinked gelatin for in vitro drug delivery[J]. Carbohydrate polymers, 2008, 72(3) : 479–489. DOI:10.1016/j.carbpol.2007.09.023 |
| [18] | KUS H, MISTERKA S, PIELKA S, et al. Local treatment of burn injuries and traumatic wounds with a hydrogel Geliperm dressing[J]. Polimery w medycynie, 1987, 18(4) : 211–219. |
| [19] | KICKHOFEN B, WOKALEK H, SCHEEL D, et al. Chemical and physical properties of a hydrogel wound dressing[J]. Biomaterials, 1986, 7(1) : 67–72. DOI:10.1016/0142-9612(86)90092-X |
| [20] | DAWLEE S, SUGANDHI A, BALAKRISHNAN B, et al. Oxidized chondroitin sulfate-cross-linked gelatin matrixes: A new class of hydrogels[J]. Biomacromolecules, 2005, 6(4) : 2040–2048. DOI:10.1021/bm050013a |
 2017, Vol. 63
2017, Vol. 63





