文章信息
- 刘霞, 邓德明, 熊丽丽
- LIU Xia, DENG Deming, XIONG Lili
- BiOBr/TiO2异质结催化剂的制备及其可见光催化活性
- Preparation of BiOBr/TiO2 Heterojunction Catalyst and Its Visible Light Photocatalytic Activity
- 武汉大学学报(理学版), 2019, 65(1): 57-65
- Journal of Wuhan University(Natural Science Edition), 2019, 65(1): 57-65
- http://dx.doi.org/10.14188/j.1671-8836.2019.01.008
-
文章历史
- 收稿日期:2018-04-09

光催化技术因降解污染物速度快、成本低、清洁环保,可光解水产氢等优点而受到越来越多的关注[1~4]。TiO2稳定性好、无毒、无二次污染、价廉易得,是研究最为广泛的半导体光催化剂之一,但因其带隙宽度较宽,只能利用波长小于387 nm的太阳光(约只占太阳光谱的4%),以及光生空穴-电子对较易复合,在一定程度上限制了其应用[5~8]。
许多研究者使用金属掺杂[9, 10]、非金属掺杂[11, 12]、半导体复合[13~18]等手段对TiO2进行改性,以改善其光催化效果。其中,将TiO2与其他窄带隙半导体或金属复合,形成具有p-n异质结、肖特基结或带结构匹配的复合催化剂能够窄化TiO2的带隙宽度,同时提高其空穴-电子对的分离效率[19~21]。BiOX(X=Cl、Br、I)具有由[Bi2O2]2+层和双X-离子层沿着[001]方向交替排列形成的特殊层状结构,能够产生内部静电场,有效分离电子-空穴对[22, 23]。Li等[24]采用溶剂热法制得BiOI/TiO2异质结催化剂,可见光照射120 min后,甲基橙的脱色率达90%以上;Sánchez-Rodríguez等[25]采用溶胶-凝胶法制得BiOCl-TiO2复合催化剂,可见光下照射6 h后,50 mg·L-1苯酚溶液的降解率达到43%;Zhao等[21]采用共沉淀法制得BiOBr@TiO2 p-n异质结催化剂,明显改善了光催化水解产氢和RhB脱色能力。BiOX中,BiOCl的带隙宽度为3.2~3.4 eV,只能吸收紫外光[25];BiOI的带隙宽度较窄(约1.7 eV),但光生空穴氧化能力较差[21];而BiOBr带隙宽度适中(约2.9 eV),具有相对高的可见光催化活性和稳定性[4, 26]。BiOBr/TiO2复合光催化剂的制备方法主要有共沉淀法[4, 21]和一步溶剂热法[27, 28],但共沉淀法不易控制晶粒的尺寸和形貌,分散性也较差,一步溶剂热法只能得到无定形态的TiO2和BiOBr的复合物。
鉴于此,本文拟结合碱热法和溶剂热法对上述方法进行改进,制备具有特定晶型的BiOBr/TiO2异质结催化剂,并以罗丹明B(RhB)为模式污染物,考察在可见光照射下BiOBr和TiO2的配比对光催化效果的影响,探索BiOBr/TiO2异质结催化剂的光催化机理和RhB的脱色机理。
1 实验部分 1.1 试剂及仪器试剂:P25 TiO2(70%锐钛矿、30%金红石TiO2);KBr、Bi(NO3)3·5H2O、RhB、KI、乙二醇、KOH等均为国产分析纯试剂;叔丁醇(TBA)为国产化学纯试剂;对苯醌(BQ,97%)购自阿拉丁试剂公司;实验用水为去离子水。
仪器:双端卤钨灯(功率500 W,照度1.987×105 lx,飞利浦照明有限公司);D8型X射线衍射仪(XRD,Bruker公司);Zeiss SIGMA型场发射扫描电子显微镜(FESEM, Zeiss公司);JEM-2100型透射式电子显微镜(TEM,日本电子株式会社);ESCALAB250Xi型光电子能谱仪(XPS,ThermoFisher公司);Nicolet is50型在线原位傅立叶变换红外光谱仪(FT-IR,Thermo Fisher公司);UV-2550型紫外分光光度计(岛津公司);LS55型荧光分光光度计(Perkin Elmer公司);UV-5900PC型紫外可见分光光度计(上海元析仪器有限公司);CHI660E型电化学工作站(上海辰华仪器有限公司)。
1.2 材料制备 1.2.1 TiO2的制备参照文献方法[4, 5],称取一定量P25加入到70 mL 10 mol·L-1 KOH溶液中超声分散10 min,搅拌40 min,转移至100 mL反应釜中,密封后置于烘箱中180 ℃反应48 h,自然冷却至室温。弃上清液,取下层白色沉淀物转移至抽滤瓶中,用0.1 mol·L-1 HCl溶液洗涤、抽滤至滤液呈酸性,再用0.1 mol·L-1 HCl溶液浸泡15 h进行离子交换,过滤,用水洗涤、抽滤至滤液呈中性,将产物置于烘箱中80 ℃干燥。称取1.0 g干燥样品加入到70 mL 0.02 mol·L-1 H2SO4溶液中,超声分散10 min,搅拌30 min,转移至100 mL反应釜中,密封后置于烘箱中100 ℃反应12 h,自然冷却至室温,取出过滤,用水洗涤、抽滤至中性。将产物置于烘箱中80 ℃干燥,研磨,置于马弗炉中,600 ℃煅烧4 h,再研磨得到TiO2。
1.2.2 BiOBr/TiO2异质结催化剂的制备参照文献方法[24],称取0.485 g的Bi(NO3)3·5H2O和0.119 g的KBr,分别加入到35 mL乙二醇中,搅拌溶解,逐滴加入KBr溶液,再加入0.160 g的TiO2,搅拌30 min,超声分散10 min,转移至100 mL反应釜中,密封后置于烘箱中160 ℃反应6 h,自然冷却至室温,过滤,用水和无水乙醇反复洗涤、抽滤,置于烘箱中80 ℃干燥,研磨,得到BiOBr和TiO2摩尔比为1:2的BiOBr/TiO2异质结催化剂。BiOBr和TiO2的摩尔比为1:1、1:2、1:3、2:1、3:1时,分别记为B1T1、B1T2、B1T3、B2T1、B3T1。作为对照,不加TiO2,用同样的方法制得纯BiOBr。
1.3 光催化实验以RhB作为模式污染物进行可见光催化脱色实验,以评价BiOBr/TiO2复合催化剂在可见光下的活性。于250 mL 20 mg·L-1 RhB溶液中,加入0.2 g复合催化剂,避光搅拌30 min以达到吸附-解吸平衡。以500 W卤钨灯作为可见光光源,光源距离烧杯底部16 cm,对RhB进行脱色实验,每隔5 min取样5 mL,经0.45 μm有机滤膜过滤,于554 nm处测定滤液的吸光度。RhB的脱色率D(%)用(1)式计算:
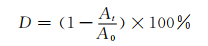
|
(1) |
(1) 式中:A0为RhB溶液的初始吸光度,At为反应时间t时刻RhB溶液的吸光度。
1.4 Mott-Schottky曲线测试利用电化学工作站测试催化剂的电化学性能,得到Mott-Schottky曲线。按质量比8:1:1,分别称取催化剂样品、乙炔黑和聚四氟乙烯(35%)于制样瓶中,加入一定量的无水乙醇,超声分散10 min,置于烘箱中80 ℃下干燥8 h,取出擀膜,用刀片裁成1 cm×1 cm正方形膜压在钛网上,制成工作电极。饱和甘汞电极和铂片分别作为参比电极和对电极,中间用盐桥连接,电解质溶液为1 mol·L-1 Na2SO4溶液,测试频率为1 kHz。
2 结果与讨论 2.1 结构表征 2.1.1 XRD谱图图 1为TiO2、BiOBr、B1T2催化剂的XRD谱图。TiO2样品谱线中未发现杂峰,位于25.40°、37.06°、37.92°、38.66°、48.15°、54.00°、55.16°、62.81°、69.00°、70.42°、75.17°处的衍射峰分别对应于锐钛矿型TiO2(JCPDS 21-1272)的(101)、(103)、(004)、(112)、(200)、(105)、(211)、(204)、(116)、(220)、(215)晶面,表明合成的TiO2是纯的锐钛矿相TiO2[5]。BiOBr样品谱线中,位于11.08°、22.09°、25.46°、31.97°、32.45°、39.64°、46.51°、50.91°、53.64°、57.48°、67.88°、77.23°处的衍射峰分别对应于四方晶系BiOBr(JCPDS 73-2061)的(001)、(002)、(011)、(012)、(110)、(112)、(020)、(014)、(211)、(212)、(220)、(223)晶面,衍射峰强度也较明显,表明合成了结晶度较好的四方晶系BiOBr[22]。从B1T2曲线可以看出,其在TiO2和BiOBr衍射峰的位置均有与之对应的峰出现,且未观察到其他杂峰,说明B1T2催化剂含有锐钛矿相TiO2和BiOBr,且这两种成分能在复合样品中保持各自的化学性质。
|
| 图 1 各催化剂的XRD图 Figure 1 XRD patterns of the catalysts |
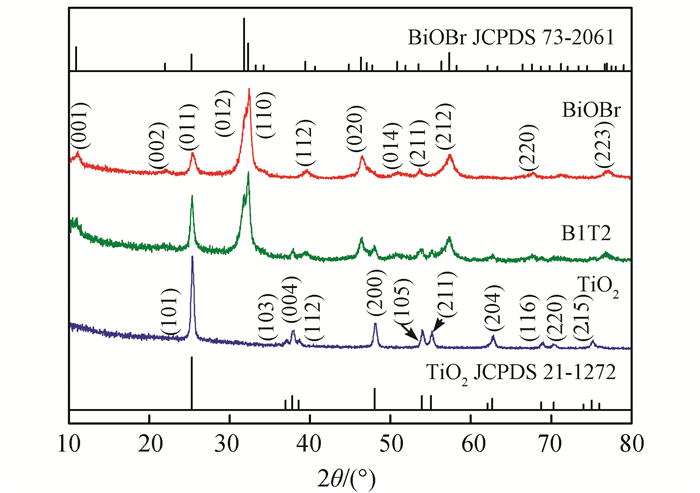
图 2为TiO2、BiOBr、B1T2催化剂的FESEM图以及B1T2催化剂的TEM图,从图 2A中可以看出,以KOH为碱溶剂制备的TiO2样品呈颗粒状,有沿径向生长的趋势,直径15~30 nm。图 2B显示,合成的BiOBr呈现花状球形貌,由大量片状的BiOBr围绕球形中心聚集生长而成,直径2~4 μm。将图 2C与图 2B中插图比较,可看出复合样品B1T2催化剂中TiO2颗粒附着生长在BiOBr花状球表面。与纯BiOBr相比,B1T2复合催化剂表面更为粗糙,有利于吸附更多的染料分子。图 2D显示,B1T2催化剂表面的TiO2和BiOBr分布均匀,接触紧密,有利于载流子在两个半导体之间的传递,进而提高光催化剂的量子效率。
|
| 图 2 TiO2(A)、BiOBr(B)、B1T2(C)的FESEM图及B1T2(D)的TEM图 Figure 2 FESEM images of TiO2(A), BiOBr(B), B1T2(C) and TEM image of B1T2(D) |
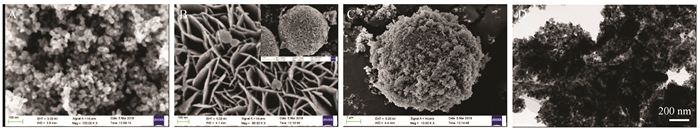
图 3为TiO2、BiOBr、B1T2在4 000~400 cm-1的范围内的FT-IR光谱。3 451 cm-1和1 630 cm-1处的吸收峰在TiO2、BiOBr、B1T2催化剂中均有出现,主要是由吸附水的O—H的伸缩振动和弯曲振动造成[29];TiO2谱图中,400~800 cm-1处宽峰为Ti—O—Ti的桥连拉伸峰和Ti—O的伸缩振动峰[30];BiOBr谱图中,510 cm-1处的吸收峰归因于Bi—O的伸缩振动[30];B1T2谱图中,合成的异质结催化剂包含TiO2和BiOBr催化剂的官能团,且未出现其他杂质官能团,进一步证实B1T2催化剂是由TiO2和BiOBr组成,与XRD图的结论一致。
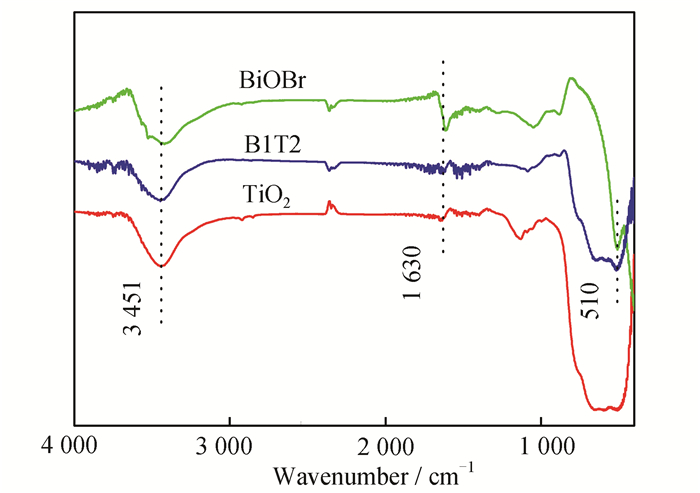
|
| 图 3 各催化剂的FT-IR光谱 Figure 3 FT-IR spectra of the catalysts |
XPS光谱是分析催化剂元素组成及元素价态的重要方法。图 4为B1T2样品的XPS全谱图及相应元素的分峰谱图。由图 4A可知,B1T2催化剂中存在Bi、Ti、Br、O、C五种元素。其中,284.8 eV处特征峰对应于样品中的C 1s,是由测量仪器偶然带入[21]。图 4B中,158.9 eV和164.3 eV处的特征峰分别归属于Bi 4f7/2和Bi 4f5/2,表明Bi以Bi3+的形式存在[31, 32]。图 4C中,458.5 eV和464.4 eV处的特征峰分别对应于Ti 2p3/2和Ti 2p1/2,表明Ti元素以Ti4+的形式存在。其中,Ti 2p1/2处宽峰主要是由于464.4 eV处Ti 2p1/2和466.5 eV处Bi 4d3/2的特征峰部分重叠所致[21]。图 4D中,68.0 eV和69.0 eV处的特征峰分别归属于Br 3d5/2和Br 3d3/2,表明Br元素以Br-的形式存在[31]。图 4E中,529.7、530.4、532.2 eV处的特征峰分别对应于Bi—O、Ti—O以及O—H键[23, 31, 33]。XPS光谱图的结果与XRD和FT-IR的结果相一致,进一步证实了B1T2是由TiO2和BiOBr两种成分组成的复合催化剂。
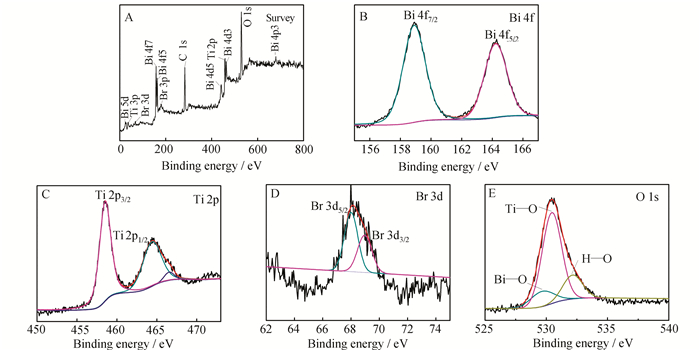
|
| 图 4 B1T2样品的XPS全谱图(A)以及Bi 4f(B),Ti 2p(C),(d) Br 3d(D),O 1s(E)的XPS分峰拟合图 Figure 4 The XPS spectra of survey spectrum(A) of B1T2 sample and the fitting peaks for Bi 4f(B), Ti 2p(C), Br 3d(D), O 1s(E) XPS spectra |
图 5为TiO2、BiOBr、B1T2催化剂的Mott-Schottky曲线。当曲线的切线斜率为正值时,对应的半导体属于n型半导体,斜率为负值时,为p型半导体[24]。图 5A表明TiO2催化剂为n型半导体,图 5B表明BiOBr催化剂为p型半导体,图 5C中曲线为倒“V”型,切线斜率有正有负,表明B1T2催化剂为p-n异质结催化剂[21]。
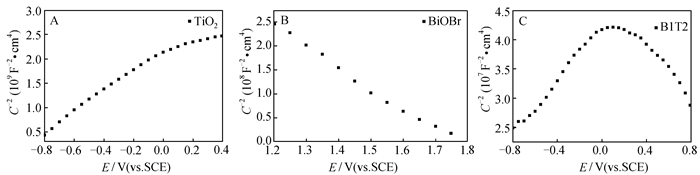
|
| 图 5 TiO2(A)、BiOBr(B)、B1T2(C)催化剂的Mott-Schottky曲线 Figure 5 Mott-Schottky plots of TiO2(A), BiOBr(B), and B1T2(C) catalys |
图 6A为各催化剂的紫外-可见漫反射光谱图,可以看出,B1T2复合样品在紫外光区有较强的吸收,在可见光区的吸收波长为400~426 nm,较TiO2样品的吸收边缘(392 nm)有一定红移,表明B1T2复合型催化剂在可见光下有一定的催化能力。图 6B是由图 6A计算得到的[F(R∞)hν]1/2-hν图[5]。其中,R∞为无限厚样品的反射率,F(R∞)为Kubelka-Munk函数,h是普朗克常数(~4.14×10-15 eV·s),ν(s-1)为频率。推算得到TiO2、B1T2、BiOBr样品的带隙宽度分别为3.16、2.91、2.87 eV。B1T2催化剂的带隙宽度介于TiO2和BiOBr之间,比较接近BiOBr的带隙宽度。和TiO2相比,B1T2复合样品带隙宽度减小,吸收边缘红移,主要是因为BiOBr和TiO2耦合形成异质结,有效抑制了光生电子和空穴的复合,进而提高光响应范围[24]。图 6C为激发波长260 nm时各催化剂的光致发光(PL)光谱,PL峰强度越大,光生电子-空穴越易复合[21]。可以看出,B1T2催化剂的峰强度最小,其次是BiOBr,最高的是TiO2,说明制备的B1T2复合样品能够有效转移载流子,降低光生电子和空穴的复合率。
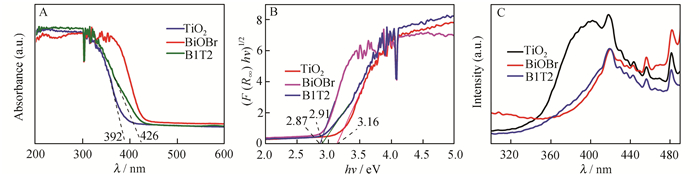
|
| 图 6 催化剂的紫外可见漫反射光谱(A),[F(R∞)hν]1/2-hν(B),催化剂的光致发光光谱图(C) Figure 6 UV-Vis diffuse reflectance spectra of the catalysts(A), [F(R∞)hν]1/2-hν(B), PL spectra(C) of the catalysts |
图 7A显示了复合样品中BiOBr和TiO2的摩尔比对RhB脱色率的影响,当BiOBr和TiO2的摩尔比为1:2时,RhB脱色率最高,继续增加TiO2的比例,RhB脱色率反而下降。这是由于,在BiOBr花状球上覆盖一定量的TiO2有利于形成异质结,促进光生载流子的分离,提高复合材料在可见光范围内的吸收,而添加过量的TiO2会覆盖在BiOBr花状球表面,阻碍BiOBr对可见光的吸收,进而降低光催化效果。
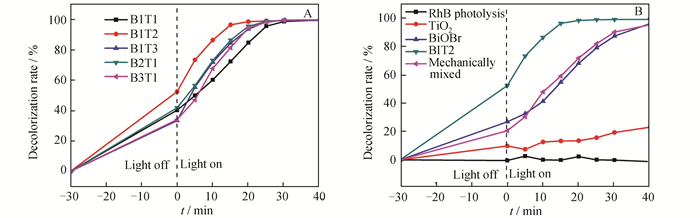
|
| 图 7 BiOBr和TiO2的摩尔比对RhB脱色率的影响(A),不同催化剂对RhB脱色率的影响(B) Figure 7 Effect of the mole ratio of BiOBr and TiO2 on the decolorization rate of RhB(A), and effect of different catalysts on the decolorization rate of RhB(B) |
图 7B显示了TiO2、BiOBr、B1T2以及机械混合催化剂(BiOBr和TiO2按摩尔比为1:2的量在玛瑙研钵中混合研磨20 min)对RhB脱色率的影响。由图 7B可知,RhB的自光解可忽略不计;可见光照射40 min,TiO2对RhB的脱色率仅为23.2%;BiOBr和机械混合制得的样品催化效果相当,可见光照射15 min,RhB的脱色率约59.2%;而B1T2复合样品催化效果最好,可见光照射15 min,RhB的脱色率达96.5%。这主要是因为:
1) B1T2复合催化剂是由TiO2颗粒附着生长在BiOBr花状球表面构成,与BiOBr相比,其表面更为粗糙,能吸附更多的RhB分子;
2) 与TiO2相比,复合催化剂对可见光的利用率更高;
3) B1T2复合催化剂内部的TiO2和BiOBr耦合形成异质结,更有利于光生电子和空穴的分离。
催化剂的稳定性是影响其实际应用的重要因素之一。图 8考察了B1T2催化剂的循环使用次数对其催化RhB脱色效率的影响。由图 8可知,重复使用4次后B1T2催化剂对RhB的脱色率仍高达91.79%,较第1次使用仅下降7.94%,表明B1T2催化剂稳定性较好,循环利用率高。
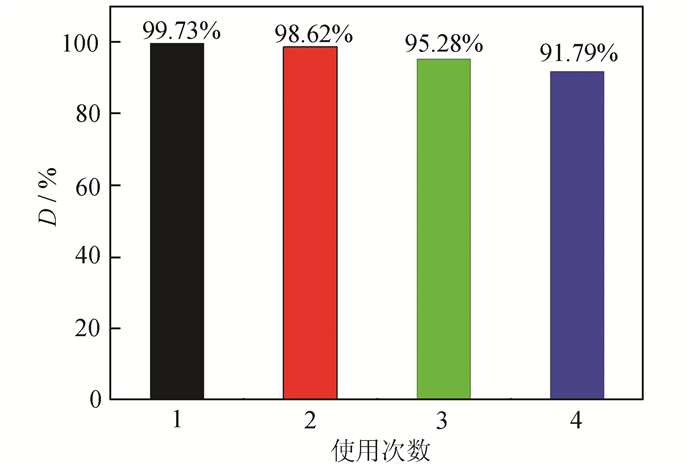
|
| 图 8 B1T2循环使用对RhB脱色率的影响 Figure 8 Effect of B1T2 cycles on RhB decolorization rate |
光催化活性的提高主要取决于光催化剂的能带结构以及光生电子和空穴的分离效率。催化剂能带位置根据(2)式和(3)式计算[24, 34]:
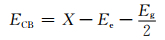
|
(2) |
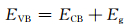
|
(3) |
ECB为导带电势,EVB为价带电势,X为半导体的绝对电负性,Ee为自由电子在标准氢电极的势能(~4.5 eV),Eg为半导体的带隙宽度。计算得到TiO2催化剂的导带电势和价带电势分别为-0.24 eV和2.92 eV,BiOBr催化剂的导带电势和价带电势分别为0.24 eV和3.11 eV。
B1T2复合催化剂形成的p-n结有效分离光生电子-空穴对的机理如下:n型半导体的费米能级靠近导带,p型半导体的费米能级靠近价带,两种半导体相接触时,会发生电子转移,直至费米能级趋于平衡,因此在复合材料中,TiO2的费米能级发生下移,BiOBr的费米能级发生上移,从而建立从n-TiO2到p-BiOBr的内部电场[21]。当可见光照射材料表面时,BiOBr价带中的电子会跃迁至导带,在内部电场的驱动下,p-BiOBr导带中的光生电子会传递到n-TiO2的导带中,而带正电的空穴仍然留在p-BiOBr的价带中,从而达到光生电子和空穴分离的目的,进而提高光催化脱色效果。
为了进一步研究B1T2对RhB的可见光催化脱色机理,向反应体系中分别添加KI[35]、TBA[3]、BQ[21]作为h+、OH·、O2·-的捕获剂,验证可能存在的活性自由基种类。由图 9可知,与不添加捕获剂相比,加入KI和TBA后,RhB的脱色率基本无变化,但加入BQ后RhB的脱色率显著下降。由此可见,O2·-是参与光催化反应的主要活性物种,而h+和OH·基本不参与反应。
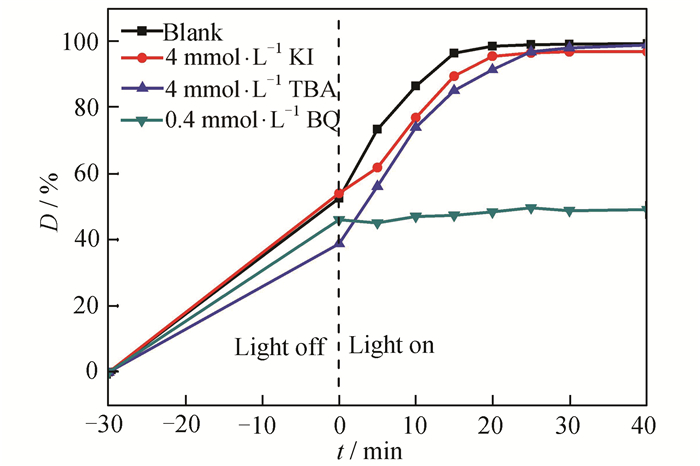
|
| 图 9 不同捕获剂对RhB脱色率的影响 Figure 9 Effect of various scavengers on decolorization rate of RhB |
可能的机理如下:首先在可见光的照射下,B1T2催化剂中的p-BiOBr光生电子转移至n-TiO2导带上,由于n-TiO2的导带电势比O2/O2·-的标准氧化电极电势(-0.046 eV)更负,故能将O2还原为O2·-,而带正电的空穴仍然留在p-BiOBr的价带中;p-BiOBr价带上空穴的氧化电位为Bi5+/Bi3+的标准氧化还原电势(1.59 eV),比OH·/OH-的标准还原电极电势(1.99 eV)更负,故p-BiOBr价带上的空穴不能将OH-氧化为OH·;此外,RhB分子最高已占轨道(HOMO)电势为0.8 eV,而O2/H2O的标准氧化还原电势约为1.23 eV,故p-BiOBr价带上的空穴可能优先氧化水分子,因而,h+不参与RhB脱色反应[3]。因此,该体系中导致RhB脱色的自由基主要为O2·-。B1T2可能的光催化反应步骤如下:
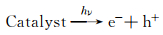
|
(4) |
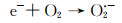
|
(5) |
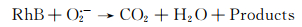
|
(6) |
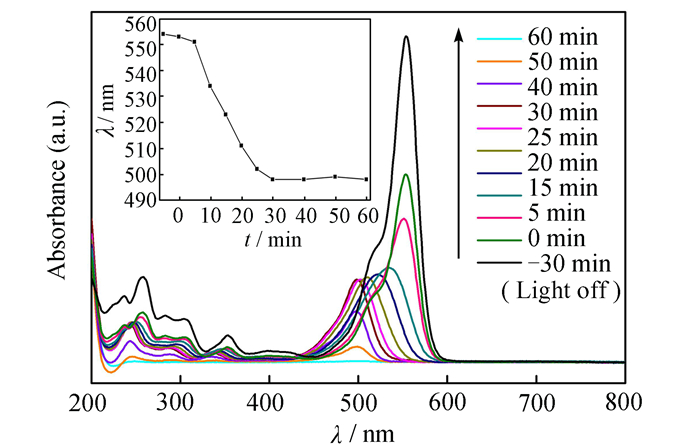
光催化脱色过程中RhB溶液的UV-Vis光谱如图 10所示。随着反应的进行,RhB溶液的最大吸收波长逐渐蓝移,由最初的554 nm蓝移至498 nm。这主要是由于RhB分子脱乙基造成的[3]。而且,随着反应时间的延长,RhB溶液在紫外光区及可见光区的吸光度逐渐降低,说明在RhB的光催化脱色过程中,存在苯环的开环氧化反应[36]。
|
| 图 10 光催化脱色过程中RhB溶液的UV-Vis光谱 Figure 10 UV-Vis spectra of RhB solution during photocatalytic decolorization |
本研究将碱热法和溶剂热法相结合制备了不同配比的BiOBr/TiO2异质结催化剂。该催化剂由锐钛矿相TiO2纳米颗粒附着生长在BiOBr花状球表面构成。BiOBr和TiO2摩尔比为1:2的复合材料对RhB的催化脱色效果最好,在可见光照射下催化反应15 min,RhB的脱色率达96.5%,循环使用4次后,RhB脱色率仅降低7.94%,稳定性较好。该复合材料光催化活性的提升主要原因如下:1)表面结构更粗糙,有利于吸附更多的RhB分子;2)光响应范围得到拓宽,对可见光利用率更高;3)在BiOBr和TiO2界面上形成了p-n结,使光生电子和空穴得到有效分离。O2·-是光催化反应过程中的主要活性物种;RhB的脱色主要是由脱乙基和苯环开环氧化导致。本研究对BiOBr/TiO2异质结催化剂的光催化机理和RhB溶液的脱色机理进行分析,对于新型光催化剂的制备和机理探索具有一定的参考意义,但其实际应用还有待进一步拓展。
| [1] |
CHEN X B, SHEN S H, GUO L J, et al. Semiconductor-based photocatalytic hydrogen generation[J]. Chemical Review, 2010, 110(11): 6503-6570. DOI:10.1021/cr1001645 |
| [2] |
TONG H, OUYANG S X, BI Y P, et al. Nano-photocatalytic materials: Possibilities and challenges[J]. Advanced Materials, 2012, 24(2): 229-251. DOI:10.1002/adma.201102752 |
| [3] |
FU J, TIAN Y L, CHANG B B, et al. BiOBr-carbon nitride heterojunctions: Synthesis, enhanced activity and photocatalytic mechanism[J]. Journal of Materials Chemistry, 2012, 22(39): 21159-21166. DOI:10.1039/c2jm34778d |
| [4] |
TAN X, LI X L, YU T, et al. Preparation and photocatalytic activity of BiOBr/TiO2 heterojunction nanocomposites[J]. Transactions of Tianjin University, 2016, 22(3): 211-217. DOI:10.1007/s12209-016-2778-8 |
| [5] |
LIU C, ZHANG L Q, LIU R, et al. Hydrothermal synthesis of N-doped TiO2 nanowires and N-doped graphene heterostructures with enhanced photocatalytic properties[J]. Journal of Alloys and Compounds, 2016, 656: 24-32. DOI:10.1016/j.jallcom.2015.09.211 |
| [6] |
WENG X L, ZENG Q S, ZHANG Y L, et al. Facile approach for the syntheses of ultrafine TiO2 nanocrystallites with defects and C heterojunction for photoca- talytic water splitting[J]. ACS Sustainable Chemistry & Engineering, 2016, 4(8): 4314-4320. DOI:10.1021/acssuschemeng.6b00828 |
| [7] |
XIE G H, CHANG X, ADHIKARI B R, et al. Photoelectrochemical degradation of acetaminophen and valacyclovir using nanoporous titanium dioxide[J]. Chinese Journal of Catalysis, 2016, 37(7): 1062-1069. DOI:10.1016/s1872-2067(15)61101-9 |
| [8] |
HEZAM A, NAMRATHA K, DRMOSH Q A, et al. Synthesis of heterostructured Bi2O3-CeO2-ZnO photocatalyst with enhanced sunlight photocatalytic activity[J]. Ceramics International, 2017, 43(6): 5292-5301. DOI:10.1016/j.ceramint.2017.01.059 |
| [9] |
KHAN M, WOO S I, YANG O. Hydrothermally stabilized Fe(Ⅲ) doped titania active under visible light for water splitting reaction[J]. International Journal of Hydrogen Energy, 2008, 33(20): 5345-5351. DOI:10.1016/j.ijhydene.2008.07.119 |
| [10] |
KERKEZ Ö, BOZ Í. Photo(electro)catalytic activity of Cu2+-modified TiO2 nanorod array thin films under visible light irradiation[J]. Journal of Physics and Chemistry of Solids, 2014, 75(5): 611-618. DOI:10.1016/j.jpcs.2013.12.019 |
| [11] |
WU X Y, YIN S, DONG Q, et al. Synthesis of high visible light active carbon doped TiO2 photocatalyst by a facile calcination assisted solvothermal method[J]. Applied Catalysis B: Environmental, 2013, 142: 450-457. DOI:10.1016/j.apcatb.2013.05.052 |
| [12] |
LIU W X, JIANG P, SHAO W N, et al. A novel approach for the synthesis of visible-light-active nanocrystalline N-doped TiO2 photocatalytic hydrosol[J]. Solid State Sciences, 2014(33): 45-48. DOI:10.1016/j.solidstatesciences.2014.04.012 |
| [13] |
TENG W, LI X Y, ZHAO Q D, et al. Fabrication of Ag/Ag3PO4/TiO2 heterostructure photoelectrodes for efficient decomposition of 2-chlorophenol under visible light irradiation[J]. Journal of Materials Chemistry A, 2013, 1(32): 9060. DOI:10.1039/c3ta11254c |
| [14] |
LI Z J, HUANG Z W, GUO W L, et al. Enhanced photocatalytic removal of uranium (Ⅵ) from aqueous solution by magnetic TiO2/Fe3O4 and its graphene composite[J]. Environmental Science & Technology, 2017, 51(10): 5666-5674. DOI:10.1021/acs.est.6b05313 |
| [15] |
DAOUS M, ILIEV V, PETROV L. Gold-modified N-doped TiO2 and N-doped WO3/TiO2 semiconductors as photocatalysts for UV-visible light destruction of aqueous 2, 4, 6-trinitrotoluene solution[J]. Journal of Molecular Catalysis A: Chemical, 2014(392): 194-201. DOI:10.1016/j.molcata.2014.05.020 |
| [16] |
XIAO M W, WANG L S, WU Y D, et al. Preparation and characterization of CdS nanoparticles decorated into titanate nanotubes and their photocatalytic properties[J]. Nanotechnology, 2008, 19(1): 015706. DOI:10.1088/0957-4484/19/01/015706 |
| [17] |
KWIATKOWSKI M, CHASSAGNON R, HEINTZ O, et al. Improvement of photocatalytic and photoelectrochemical activity of ZnO/TiO2 core/shell system through additional calcination: Insight into the mechanism[J]. Applied Catalysis B: Environmental, 2017(204): 200-208. DOI:10.1016/j.apcatb.2016.11.030 |
| [18] |
ZHAO S S, CHEN S, YU H T, et al. g-C3N4/TiO2 hybrid photocatalyst with wide absorption wavelength range and effective photogenerated charge separation[J]. Separation and Purification Technology, 2012(99): 50-54. DOI:10.1016/j.seppur.2012.08.024 |
| [19] |
QU Y Q, DUAN X F. Progress, challenge and perspective of heterogeneous photocatalysts[J]. Chemical Society reviews, 2013, 42(7): 2568-2580. DOI:10.1039/c2cs35355e |
| [20] |
TIAN J, ZHAO Z H, KUMAR A, et al. Recent progress in design, synthesis, and applications of one-dimensional TiO2 nanostructured surface heterostructures: A review[J]. Chemical Society Reviews, 2014, 43(20): 6920-6937. DOI:10.1039/c4cs00180j |
| [21] |
ZHAO Y, HUANG X, TAN X, et al. Fabrication of BiOBr nanosheets@TiO2 nanobelts p-n junction photocatalysts for enhanced visible-light activity[J]. Applied Surface Science, 2016(365): 209-217. DOI:10.1016/j.apsusc.2015.12.249 |
| [22] |
WANG Y, SUNARSO J, ZHAO B, et al. One-dimensional BiOBr nanosheets/TiO2 nanofibers composite: Controllable synthesis and enhanced visible photocatalytic activity[J]. Ceramics International, 2017, 43(17): 15769-15776. DOI:10.1016/j.ceramint.2017.08.140 |
| [23] |
LIU J Q, DAI M J, RUAN L L, et al. Novel multi-heterostructured Pt-BiOBr/TiO2 nanotube arrays with remarkable visible-light photocatalytic performance and stability[J]. Optoelectronics Letters, 2017, 13(3): 165-171. DOI:10.1007/s11801-017-7023-8 |
| [24] |
LI Z J, WANG M T, SHEN J X, et al. Synthesis of BiOI nanosheet/coarsened TiO2 nanobelt heterostructures for enhancing visible light photocatalytic activity[J]. RSC Advances, 2016, 6(36): 30037-30047. DOI:10.1039/c6ra01426g |
| [25] |
SÁNCHEZ-RODRÍGUEZ D, MEDRANO M G M, REMITA H, et al. Photocatalytic properties of BiOCl-TiO2 composites for phenol photodegradation[J]. Journal of Environmental Chemical Engineering, 2018, 6(2): 1601-1612. DOI:10.1016/j.jece.2018.01.061 |
| [26] |
XUE C, XU X, YANG G D, et al. Comprehensive investigation of the reciprocity of structure and enhanced photocatalytic performance in finned-tube structured TiO2/BiOBr heterojunctions[J]. RSC Advances, 2015, 5(124): 102228-102237. DOI:10.1039/c5ra20510g |
| [27] |
李丹, 杨健, 凤维勇, 等. BiOBr-TiO2的醇热法合成及光催化活性的研究[J]. 应用化工, 2015, 44(12): 2202-2206. LI D, YANG J, FENG W Y, et al. Synthesis of BiOBr-TiO2 by solvothermal method and research of its photocatalytic activity[J]. Applied Chemical Industry, 2015, 44(12): 2202-2206 (Ch). DOI:10.16581/j.cnki.issn1671-3206.2015.12.011 |
| [28] |
WEI X X, CUI H T, GUO S Q, et al. Hybrid BiOBr-TiO2 nanocomposites with high visible light photocatalytic activity for water treatment[J]. Journal of Hazardous Materials, 2013(263): 650-658. DOI:10.1016/j.jhazmat.2013.10.027 |
| [29] |
LIU Z S, LIU J L, WANG H Y, et al. Boron-doped bismuth oxybromide microspheres with enhanced surface hydroxyl groups: Synthesis, characterization and dramatic photocatalytic activity[J]. Journal of Colloid and Interface Science, 2016(463): 324-331. DOI:10.1016/j.jcis.2015.10.028 |
| [30] |
ZHU S R, WU M K, ZHAO W N, et al. Fabrication of heterostructured BiOBr/Bi24O31Br10/TiO2 photocatalyst by pyrolysis of MOF composite for dye degradation[J]. Journal of Solid State Chemistry, 2017(255): 17-26. DOI:10.1016/j.jssc.2017.07.038 |
| [31] |
RUAN L L, LIU J Q, ZHOU Q, et al. A flake-tube structured BiOBr-TiO2 nanotube array heterojunction with enhanced visible light photocatalytic activity[J]. New Journal of Chemistry, 2014, 38(7): 3022-3028. DOI:10.1039/c4nj00024b |
| [32] |
WEI X X, CUI H T, GUO S Q, et al. Hybrid BiOBr-TiO2 nanocomposites with high visible light photocatalytic activity for water treatment[J]. Journal of Hazardous Materials, 2013(263): 650-658. DOI:10.1016/j.jhazmat.2013.10.027 |
| [33] |
XUE C, ZHANG T X, DING S J, et al. Anchoring tailored low-index faceted BiOBr nanoplates onto TiO2 nanorods to enhance the stability and visible-light-driven catalytic activity[J]. ACS Applied Materials & Interfaces, 2017, 9(19): 16091-16102. DOI:10.1021/acsami.7b00433 |
| [34] |
WANG J, GUO P, DOU M F, et al. Visible light-driven g-C3N4/m-Ag2Mo2O7 composite photocatalysts: synthesis, enhanced activity and photocatalytic mechanism[J]. Rsc Advances, 2014, 4(92): 51008-51015. DOI:10.1039/c4ra09224d |
| [35] |
LIU G S, YOU S J, TAN Y, et al. In situ photochemical activation of sulfate for enhanced degradation of organic pollutants in water[J]. Environmental Science & Technology, 2017, 51(4): 2339-2346. DOI:10.1021/acs.est.6b05090 |
| [36] |
刘华俊, 彭天右, 彭正合, 等. Dy/WO3光催化降解罗丹明B的反应机理[J]. 武汉大学学报(理学版), 2007, 53(2): 127-132. LIU H J, PENG T Y, PENG Z H, et al. Photocatalytic degradation mechanism of RB over Dy-Doped WO3 photocatalysts[J]. Journal of Wuhan University (Natural Science Edition), 2007, 53(2): 127-132 (Ch). DOI:10.3321/j.issn:1671-8836.2007.02.001 |
 2019, Vol. 65
2019, Vol. 65





