文章信息
- 樊李红 , 易嘉琰 , 童骏 , 葛红瑜 , 邹胜琼 , 温辉高 . 2016
- FAN Lihong, YI Jiayan, TONG Jun, GE Hongyu, ZOU Shengqiong, WEN Huigao . 2016
- 羟丙基壳聚糖/氧化魔芋/氧化石墨烯水凝胶的制备及表征
- Preparation and Characterization of Hydroxypropyl Chitosan/Oxidized Konjac Glucomannan/Graphene Oxide Hydrogel
- 武汉大学学报(理学版), 2016, 62(4): 361-367
- Journal of Wuhan University(Natural Science Edition), 2016, 62(4): 361-367
- http://dx.doi.org/10.14188/j.1671-8836.2016.04.010
-
文章历史
- 收稿日期:2016-03-31

水凝胶(hydrogel)是一种具有三维结构的高分子聚合物,能在水和生理介质中溶胀并保持大量水分而不溶解[1].近年来,由于水凝胶具有良好的生物相容性、生物可降解性、无毒、刺激响应性等特性,被广泛的应用在生物医药领域中[2, 3].
壳聚糖(chitosan,CS)是甲壳素脱N-乙酰基的产物,具有良好的生物相容性、生物可降解性和抗菌性等性能,在生物医药、食品及化工等诸多领域中的应用受到广泛关注[4].壳聚糖只能溶解于弱酸,这一特性限制了壳聚糖的应用.因此,将壳聚糖进行化学改性,制备水溶性壳聚糖衍生物,从而拓宽其应用范围,已成了近年来壳聚糖的研究热点之一.羟丙基壳聚糖是由壳聚糖与环氧丙烷发生醚化反应制得的一种水溶性壳聚糖衍生物.
魔芋葡甘聚糖(konjac glucomannan,KGM)是一种较为丰富的可再生天然高分子多糖,由β-1,4吡喃糖甘键连接的D-甘露糖和D-葡萄糖组成,可与高碘酸钠反应生成一种具有醛基结构的氧化魔芋[5],可代替甲醛、戊二醛等对人体有害的交联剂与羟丙基壳聚糖交联制备水凝胶.
传统的水凝胶机械性能较差,限制了其在生物医药领域的应用.氧化石墨烯(GO)是石墨烯的前体,其2D片层上富含羧基、羟基等含氧基团,这些基团使其可以与聚合物分子之间产生强烈的相互作用,能够用来提高水凝胶的机械性能[6].同时,氧化石墨烯还显示出良好的生物相容性[7, 8]和一定程度的抗菌性[9].这些特性使氧化石墨烯可以作为一种提升水凝胶的性能的添加物.
本文用氧化魔芋作为交联剂,氧化石墨烯作为添加剂制备出一种新型的具有医用潜力的羟丙基壳聚糖/氧化魔芋/氧化石墨烯水凝胶,并考察了不同氧化石墨烯加入量对水凝胶结构及性能的影响.
1 实验部分 1.1 材料及仪器材料:壳聚糖(脱乙酰度92%,浙江金壳药业有限公司);魔芋胶(葡甘露聚糖含量85%以上,湖北强森魔芋科技有限公司);纳米石墨粉(阿拉丁试剂).其他试剂均为分析纯,实验用水为去离子水.
仪器:170SX 型傅立叶变换红外光谱仪(Nicolet公司);VEGA 3型扫描电镜(TESCAN公司);DNM-9602型酶标仪(北京普拉公司);CMT8502型微机控制电子万能试验机(深圳新三思材料检测有限公司);Eclipse TE300型倒置显微镜(Nikon公司);SW-CJ-2FD型超净工作台(上海博讯实业有限公司)等.
1.2 实验方法 1.2.1 羟丙基壳聚糖的制备在文献[10]的基础上加以改进,制备羟丙基壳聚糖(HPCS).称取20.00 g的NaOH溶于20 mL蒸馏水中,待冷却后,加入20.00 g的壳聚糖,充分搅拌至膨松状态,放入冰箱冷冻24 h.取出一定量上述碱化后的壳聚糖放入三口烧瓶中,加入200 mL异丙醇和4 mL 25%(wt)四甲基氢氧化铵,常温下搅拌1 h,升温至45℃,加入200 mL环氧丙烷,搅拌反应6 h,纯化后得到羟丙基壳聚糖.
1.2.2 氧化魔芋的制备参照文献[5]制备氧化魔芋(OKGM):6.00 g魔芋溶于600 mL蒸馏水中,加入一定量高碘酸钠,30 ℃避光反应12 h,加入一定量乙二醇搅拌2 h终止反应,产物透析72 h,离心,上清液烘干后得到氧化魔芋.
1.2.3 氧化石墨烯的制备氧化石墨烯(GO)的制备采用改进的Hummers方法[11, 12].2 g石墨粉,1 g K2S2O8,1 g P2O5加入三口烧瓶中,加入20 mL浓硫酸,80 ℃反应5 h,缓慢降至室温,产物过滤、洗涤、烘干得到预氧化的石墨粉.2 g预氧化的石墨粉加入三口烧瓶,加入100 mL浓硫酸,在冰水浴中搅拌,同时,分批缓慢加入6 g高锰酸钾,保持温度低于10 ℃,搅拌30 min后转移至油浴锅内,35 ℃反应5 h,混合物用500 mL蒸馏水稀释后,加入15 mL 30%(wt)H2O2终止反应,过滤,洗涤,直到滤液呈中性.产物分散在蒸馏水中,超声3 h,透析3 d,冷冻干燥获得氧化石墨烯.
1.2.4 水凝胶的制备HPCS溶于蒸馏水配置成5%(wt)的水溶液.不同量的GO加入蒸馏水中得到0,1,3,5 g/L的分散液,取一定量的OKGM溶于上述氧化石墨烯水溶液配制成OKGM质量分数为5%的混合液.HPCS溶液和OKGM/GO混合液按一定比例混合,充分搅拌后静置得到羟丙基壳聚糖/氧化魔芋/氧化石墨烯(HPCS/OKGM/GO)水凝胶(制备过程见图 1),根据GO加入量的不同,将水凝胶分别标记为HOG-0,HOG-1,HOG-3,HOG-5.
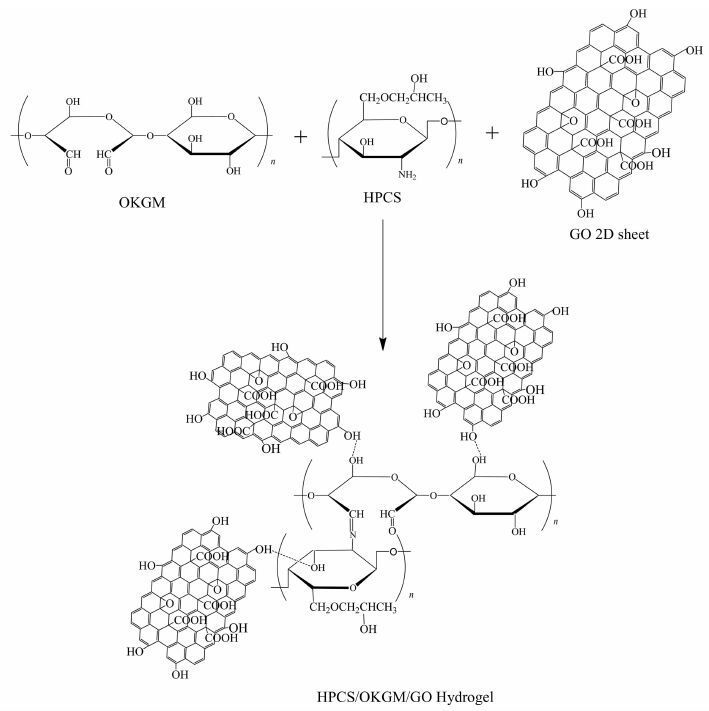
|
| 图 1 HPCS/OKGM/GO水凝胶的合成路线示意图 Figure 1 Schematic illustration of the synthesis route of HPCS/OKGM/GO hydrogel |
红外光谱(FT-IR):壳聚糖、羟丙基壳聚糖、魔芋、氧化魔芋、氧化石墨烯和不同水凝胶样品研磨成粉末,以KBr压片法分别在4 000~400 cm-1范围内扫描红外光谱.
扫描电镜(SEM):将制得的水凝胶置于冷冻干燥机中进行冷冻干燥,选取样品断面进行观察.
1.2.6 凝胶时间的检测凝胶时间采用试管倾倒法[13],将1.5 mL HPCS溶液和1.5 mL OKGM/GO混合液同时注入到直径10 mm的玻璃试管内开始计时,倾斜或倒转试管进行观察,将体系停止流动的时间作为凝胶化时间.
1.2.7 溶胀性能测试称取一定量的水凝胶,室温下浸泡于0.1 mol/L pH7.4的PBS缓冲液中48 h达到溶胀平衡,用滤纸片吸干水凝胶表面残留水分,称其质量,按下式计算水凝胶溶胀度:
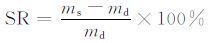
|
(1) |
其中:ms为水凝胶溶胀后的质量,md为水凝胶初始质量.
1.2.8 水蒸发率测试水凝胶样品置于蒸馏水中浸泡至溶胀平衡,称其质量,然后将样品置于50 ℃,50%湿度的烘箱中,定期测量水凝胶质量,直到水凝胶完全干燥,按下式计算水凝胶的水蒸发率:
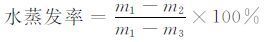
|
(2) |
其中,m1为水凝胶初始质量,m2为定期测量的水凝胶的质量,m3为水凝胶最终的质量.
1.2.9 机械性能的测定水凝胶的抗压强度和压缩模量通过万能试验机来测定.制备直径20 mm厚度10 mm的圆柱状水凝胶样品,以10 mm/min的应变速率对样品进行单轴压缩实验,直至样品完全破碎,得到样品的抗压强度和压缩模量.
1.2.10 细胞毒性测试将小鼠胚胎细胞(NIH-3T3) 置入培养瓶中,使用添加了10%胎牛血清(FBS),100 U/mL青霉素,100 μg/mL链霉素的DMEM培养基于37 ℃、5%CO2的培养箱中培养,2~3 d换液,取对数生长期的细胞用0.25%的胰蛋白酶消化后接种到96孔细胞培养板中(5 000 细胞/孔),培养24 h使细胞贴壁.称取一定量的不同水凝胶样品,紫外线照射4 h消毒,置于24孔细胞培养板中,每孔加入一定量新鲜细胞培养基,于37 ℃、5% CO2的培养箱中放置24 h,收集不同水凝胶浸提液,0.22 μm滤膜过滤.将96孔板中培养基移出,用PBS缓冲溶液冲洗2次,每孔加入200 μL水凝胶浸提液,分别培养1,3,5 d后每孔加入20 μL的3-(4,5-二甲基噻唑-2) -2,5-二苯基四氮唑溴盐(MTT)溶液,避光反应4 h,吸去培养基后加入150 μL的二甲基亚砜(DMSO),摇床低速震荡10 min,使结晶充分溶解,用酶标仪测其在490 nm处的吸光度,计算细胞的存活率:
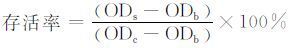
|
(3) |
其中:ODs为实验组吸光度,ODb为空白组吸光度,ODc为阳性对照组吸光度.
2 结果与讨论 2.1 红外光谱图 2为壳聚糖、羟丙基壳聚糖的红外图谱,从图中可看出壳聚糖在3 419 cm-1处有一宽峰,其归属于O—H的伸缩振动吸收峰和N—H伸缩振动峰的叠加,1 651 cm-1处为CO伸缩振动吸收峰,1 598 cm-1处为伯胺基的N—H弯曲振动峰,1 155 cm-1处为C6位—OH的吸收峰.羟丙基壳聚糖在2 970 cm-1和1 462 cm-1处出现新的吸收峰,分别为—CH3的伸缩振动和不对称振动吸收峰,说明在壳聚糖上成功引入了羟丙基基团[10];1 155 cm-1的峰基本消失,说明羟丙基化反应大部分发生在C6位的羟基上.
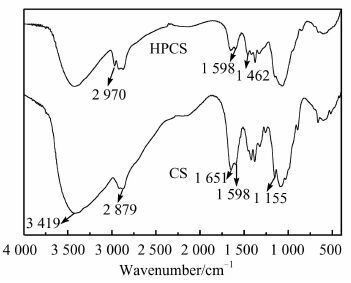
|
| 图 2 壳聚糖、羟丙基壳聚糖的红外光谱 Figure 2 IR spectra of chitosan,hydroxypropyl chitosan |
图 3为魔芋、氧化魔芋和HOG-0水凝胶的红外图谱.魔芋在3 419 cm-1和1 734 cm-1处有两个吸收峰,分别为O-H的伸缩振动吸收峰和CO的伸缩振动吸收峰.氧化魔芋在1 730 cm-1和895 cm-1处出现两个新的吸收峰,分别属于醛基的对称振动吸收峰和半缩醛结构的特征吸收峰[5],证明了氧化反应的发生.HOG-0水凝胶在1 640 cm-1处出现新的吸收峰,为CN的伸缩振动吸收峰,同时1 730 cm-1和895 cm-1处的吸收峰变弱甚至消失,说明羟丙基壳聚糖的氨基和氧化魔芋的醛基发生了交联反应.
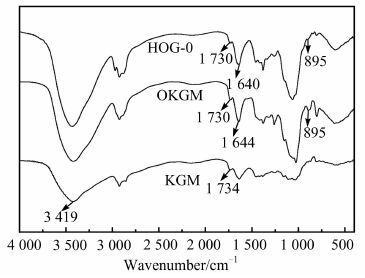
|
| 图 3 魔芋、氧化魔芋和HOG-0水凝胶的红外光谱 Figure 3 IR spectra of konjac glucomannan,oxidized konjac glucomannan and HOG-0 hydrogel |
图 4为氧化石墨烯、HOG-0、HOG-1、HOG-3、HOG-5水凝胶的红外图谱.氧化石墨烯在3 399,1 731,1 400和1 052 cm-1处出现了吸收峰,分别归属于O—H的伸缩振动吸收峰、CO的伸缩振动吸收峰、O—H的变形振动吸收峰和C—O—C的伸缩振动吸收峰[14],说明含氧基团成功引入到氧化石墨烯中.对比HOG-0、HOG-1、HOG-3、HOG-5的红外图谱,没有新的吸收峰出现且仅有部分吸收峰发生了偏移和增强,说明氧化石墨烯的加入并未与羟丙基壳聚糖和氧化魔芋之间产生新的化学键,而是通过氢键与羧丙基壳聚糖和氧化魔芋分子链结合.
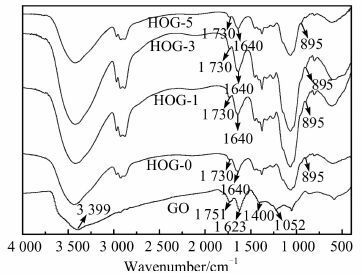
|
| 图 4 GO粉末、HOG-0、HOG-1、HOG-3和HOG-5水凝胶的红外光谱 Figure 4 IR spectra of GO powder,HOG-0,HOG-1,HOG-3 and HOG-5 hydrogels |
为了获得水凝胶的微观形貌,通过扫描电子显微镜对水凝胶进行了观察.图 5为水凝胶的SEM图片,(a),(b),(c),(d)分别为HOG-0,HOG-1,HOG-3,HOG-5水凝胶在不同放大倍数下的SEM图片.从图中可以看出,所有水凝胶样品均有一个连续而稳定的三维网络结构,同时所有样品均有许多微孔结构且较均匀地分布在水凝胶内部.对比HOG-0、HOG-1、HOG-3和HOG-5的结构可以发现,各个样品的孔径没有明显变化,但是HOG-0水凝胶的孔壁在冻干过程中发生了坍塌,而HOG-1、HOG-3、HOG-5水凝胶在冻干过程中能够更好的维持结构的稳定,说明加入氧化石墨烯的水凝胶拥有更稳定的结构,氧化石墨烯可以增强水凝胶的结构.

|
| 图 5 HOG-0(a)、HOG-1(b)、HOG-3(c)、HOG-5(d)水凝胶断面在不同放大倍率下的扫描电镜图片 Figure 5 SEM images of the cross-section of the HOG-0 hydrogel (a),HOG-1 (b),HOG-3 hydrogel (c) and HOG-5 hydrogel (d) at different magnifications |
图 6为HOG-0,HOG-1,HOG-3,HOG-5水凝胶的凝胶时间测试结果.可以看出水凝胶的凝胶时间随着氧化石墨烯含量的增加而减少,随着氧化石墨烯的含量从0 g/L增加到5 g/L,水凝胶的凝胶时间从45.6 s减少到24.3 s.此现象可以解释为:氧化石墨烯含有大量含氧基团,可与羟丙基壳聚糖和氧化魔芋分子链之间产生大量氢键,从而约束了分子链的移动,有利于交联反应的进行,从而缩短凝胶时间.极快的凝胶化过程为其作为原位可注射水凝胶的应用提供了较好的条件.
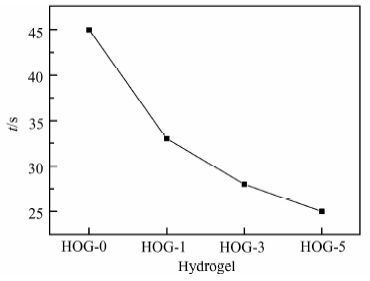
|
| 图 6 不同氧化石墨烯含量的水凝胶的凝胶时间 Figure 6 Gelation time of hydrogels with different GO loadings |
不同水凝胶室温下在PBS溶液中的溶胀率测试结果如图 7所示.所有水凝胶均显示出一定的溶胀性能,这是因为羟丙基壳聚糖、氧化魔芋和氧化石墨烯含有大量亲水性基团如—OH、—COOH和—NH2,故自由水可以进入水凝胶网络中.此外,氧化石墨烯加入量的不同会明显影响水凝胶的溶胀率,随着氧化石墨烯加入量从0 g/L增加到5 g/L,水凝胶的溶胀率从132.3%减少到76.5%,这是因为氧化石墨烯可以和聚合物分子链间产生氢键,而且氧化石墨烯加入量越多产生的氢键也越多,使水凝胶与水分子间产生氢键的能力减弱从而导致溶胀性能的降低.
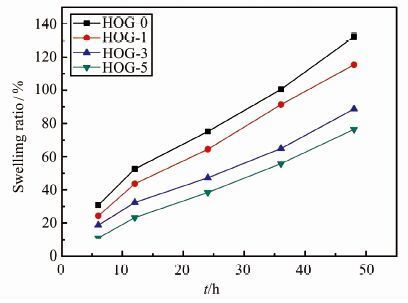
|
| 图 7 HOG-0、HOG-1、HOG-3和HOG-5水凝胶的溶胀率 Figure 7 Swelling percentage of HOG-0,HOG-1,HOG-3,HOG-5 hydrogels |
大量研究和临床实践已经证明一个湿润的环境有利于伤口愈合,故研究水凝胶敷料保水能力很有意义.不同水凝胶的水分蒸发率如图 8所示,不同水凝胶的失水趋势逐步上升且随着氧化石墨烯含量增加而增加,在最初的8 h内水蒸发率急剧上升并在24 h时达到稳定,此外,在实验结束时,水凝胶中仍存在一定水分,这可为长时间伤口愈合提供一定的湿润环境.
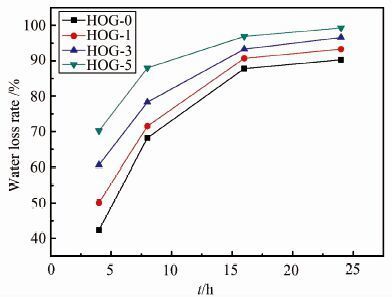
|
| 图 8 HOG-0、HOG-1、HOG-3和HOG-5水凝胶的失水率 Figure 8 Water loss of HOG-0,HOG-1,HOG-3,HOG-5 hydrogels |
作为伤口敷料,水凝胶必须要有一定的机械强度,从图 9可以看出,氧化石墨烯的加入明显增强了水凝胶的机械性能,且水凝胶的压缩强度和压缩模量随着氧化石墨烯加入量的增加而增加.随着氧化石墨烯加入量从0 g/L增加到5 g/L,水凝胶的压缩强度从49.8 kPa增加到202.1 kPa,同时压缩模量从0.05 MPa增加到0.34 MPa.这可以归因于氧化石墨烯能够均匀地分散在聚合物基质中同时可与聚合物分子之间产生强烈的氢键作用从而增强水凝胶的机械性能.此外,我们还发现水凝胶机械性能增加趋势变缓的现象,这是由于氧化石墨烯浓度较高时,在分子间作用力的影响下会产生不可逆的团聚,从而影响其在聚合物基质内的分散.
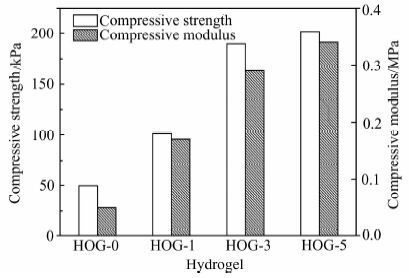
|
| 图 9 不同氧化石墨烯含量的水凝胶的抗压强度和压缩模量 Figure 9 Compressive strength and modulus of composite hydrogels with different GO loadings |
伤口敷料会与伤口直接接触,因此需要具备无毒和生物相容性好的特性,体外细胞毒性实验具有简单、重复性好、性价比高等优点,较适合用于生物相容性的评价.图 10为HOG-0,HOG-1,HOG-3,HOG-5水凝胶的细胞存活率,可以发现在整个培养时期所有样品的细胞存活率均大于80%,属于细胞毒性0级(无毒),同时可发现细胞存活率随着培养时间的增加和氧化石墨烯加入量的增加而增加,说明氧化石墨烯加入水凝胶中可以促进细胞的生长,提高水凝胶的生物相容性.这一结果与之前的报道[15]一致,显示氧化石墨烯有促进细胞粘附、增殖和分化的能力.
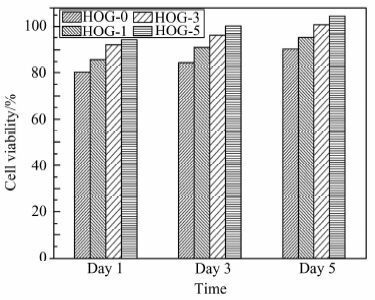
|
| 图 10 细胞与HOG-0、HOG-1、HOG-3和HOG-5水凝胶浸提液培养1,3,5 d后的存活率 Figure 10 The cell viabilities of NIH-3T3 cells after incubation for 1,3,5 days with extracts from HOG-0,HOG-1,HOG-3,HOG-5 hydrogels |
本文采用高碘酸钠氧化法制备出氧化魔芋,将其与羟丙基壳聚糖交联,同时将氧化石墨烯作为添加剂加入制得HPCS/OKGM/GO复合水凝胶,并对水凝胶进行了一系列表征和性能测试.结果发现,该水凝胶具备较短凝胶时间,合适的溶胀性能,一定的水分保持能力以及稳定的三维结构,加入一定量的氧化石墨烯大大提升了水凝胶的抗压强度和压缩模量.此外,体外细胞实验显示加入氧化石墨烯的水凝胶显示出更好的生物相容性.本研究表明,羟丙基壳聚糖/氧化魔芋/氧化石墨烯水凝胶在伤口敷料领域具有潜在的应用价值.
| [1] | HE C, SHI Z Q, MA L, et al. Graphene oxide based heparin-mimicking and hemocompatible polymeric hydrogels for versatile biomedical applications[J]. Journal of Materials Chemistry B , 2014, 3 (4) : 592–602 |
| [2] | DRURY J L, MOONEY D J. Hydrogels for tissue engineering: Scaffold design variables and applications[J]. Biomaterials , 2003, 24 (24) : 4337–4351 |
| [3] | LIU X Y, ZHOU Y F, NIE W Y, et al. Fabrication of hydrogel of hydroxypropyl cellulose (HPC) composited with graphene oxide and its application for methylene blue removal[J]. Journal of Materials Science , 2015, 50 (18) : 6113–6123 |
| [4] | MIAO J, CHENG H, GAO C J, et al. Preparation and characterization of N,O-carboxymethyl chitosan (NOCC)/polysulfone (PS) composite nanofiltration membranes[J]. Journal of Membrane Science , 2006, 280 (1-2) : 478–484 |
| [5] | YU H Q, XIAO C B. Synthesis and properties of novel hydrogels from oxidized konjac glucomannan crosslinked gelatin for in vitro drug delivery[J]. Carbohydrate Polymers , 2008, 72 (3) : 479–489 |
| [6] | XU Y X, HONG W J, BAI H, et al. Strong and ductile poly(vinyl alcohol)/graphene oxide composite films with a layered structure[J]. Carbon , 2009, 47 (15) : 3538–3543 |
| [7] | NAYAK T R, HENRIK A, MAKAM V S, et al. Graphene for controlled and accelerated osteogenic differentiation of human mesenchymal stem cells[J]. ACS Nano , 2011, 5 (6) : 4670–4678 |
| [8] | SHIN S R, AGHAEI-GHAREH-BOLAGHB, DANG T T, et al. Cell-laden microengineered and mechanically tunablehybrid hydrogels of gelatin and grapheneoxide[J]. Advanced Materials , 2013, 25 (44) : 6385–6391 |
| [9] | HE J L, ZHU X D, QI Z G, et al. Killing dental pathogens using antibacterial graphene oxide[J]. ACS Applied Materials and Interfaces , 2015, 7 (9) : 5605–5611 |
| [10] | FAN L H, LI M J, GAO S, et al. Preparation and characterization of alginate/hydroxypropylchitosan blend fibers[J]. Journal of Applied Polymer Science , 2012, 125 (2) : 892–835 |
| [11] | MARCANO D V, KOSYNKIN J M, BERLIN A, et al. Improved synthesis of graphene oxide[J]. ACS Nano , 2010, 4 (8) : 4806–4814 |
| [12] | HUMMERS W S, OFFEMAN R E. Preparation of Graphitic Oxide[J]. Journal of the American Chemical Society , 1958, 80 (6) : 1339 |
| [13] | 鲁路, 桑守山, 周长忍, 等. 可注射型海藻酸/磷酸化壳聚糖复合水凝胶的制备及其生物相容性[J]. 暨南大学学报(自然科学版) , 2008, 29 (1) : 81–84 LU L, SANG S S, ZHOU C R, et al. Preparation and bicompatibility of injectable alginate/N-methylene phosphonic chitosan composite hydrogel[J]. Journal of Jinan University (Natural Science & Medicine Edition) , 2008, 29 (1) : 81–84 |
| [14] | SHUAI C J, FENG P, GAO C D, et al. Graphene oxide reinforced poly(vinyl alcohol): Nanocomposite scaffolds for tissue engineering applications[J]. RSC Advances , 2015, 5 (32) : 25316–25423 |
| [15] | LU J Y, HE Y H, CHENG C, et al. Self-supporting graphene hydrogel film as an experimental platform to evaluate the potential of graphene for bone regeneration[J]. Advanced Functional Materials , 2013, 23 (28) : 3494–3502 |
 2016, Vol. 62
2016, Vol. 62





