文章信息
- 王佐成, 喻小继, 闫红彦, 梅泽民
- WANG Zuocheng, YU Xiaoji, YAN Hongyan, MEI Zemin
- 脯氨酸分子的手性转变机理及水的作用
- Chiral Enantiomers Transformation of Proline Molecule and Effect of Water
- 武汉大学学报(理学版), 2017, 63(4): 317-324
- Journal of Wuhan University(Natural Science Edition), 2017, 63(4): 317-324
- http://dx.doi.org/10.14188/j.1671-8836.2017.04.006
-
文章历史
- 收稿日期:2016-12-02

2. 长春师范大学 外语学院,吉林 长春 131000;
3. 白城师范学院 计算机科学学院,吉林 白城 137000;
4. 白城师范学院 化学学院,吉林 白城 137000
2. Foreign Languages School, Changchun Normal University, Changchun 131000, Jilin, China;
3. Computer Science College, Baicheng Normal University, Baicheng 137000, Jilin, China;
4. College of Chemistry, Baicheng Normal College, Baicheng 137000, Jilin, China
脯氨酸(proline, Pro)是构成蛋白质的一种重要氨基酸,根据旋光性和构型的不同分为左旋体(S-Pro)和右旋体(R-Pro).人们一直认为高等动物体内只存在S-Pro,而R-Pro只在低等动物体内存在.随着分析技术和方法的提高与发展,目前已在动物体内发现R-Pro[1~4].Pro具有重要的生理作用和广泛的应用[5],S-Pro能增加胶原蛋白的合成, 可用于合成抗高血压药物等.R-Pro具有甜味,可用于食品添加剂或生化研究.Pro还是廉价且环境友好的有机小分子催化剂,S-Pro可以催化分子内不对称羟醛缩合反应[6].
基于Pro的重要作用,学者们对它进行了广泛的研究.王朝杰等[7]研究了15种构象的Pro的结构特性和红外光谱,得到了能量最低的4种构象,不同构象中存在着强弱不同的氢键, 其中以亚氨基氮和羧基的分子内单氢键最强.Mary等[8]通过对S-Pro的红外和拉曼光谱以及表面增强拉曼散射光谱进行分析,得到了S-Pro分子的构象和振动频率等信息.
然而,关于Pro的旋光异构、生命体内右旋Pro存在原因的解释等尚未见报道.Pro的左旋体来源广泛、价格低廉,但其右旋体很难从天然产物中大量获得,且合成路线复杂、价格昂贵.研究Pro的手性转变机理,对于解释生命体内右旋Pro的存在,进一步研究Pro在不同环境条件下的旋光异构,为实验上实现S-Pro的手性转变,都会起到积极的作用.
已有研究[9~11]表明,赖氨酸手性转变裸反应有4个通道,手性C上的质子以氨基N为桥梁迁移是主反应通道,水分子对手性转变过程中的H迁移反应具有较好的催化作用.基于此,并考虑到生命体是富水环境,本工作系统地研究了Pro分子手性转变的裸反应、水分子对主反应通道决速步骤H迁移过程的催化作用以及水分子的催化和水溶剂化效应对主反应通道主要过程的共同作用.
1 研究与计算方法采用密度泛函理论的B3LYP[12, 13]方法,选用6-31+G(d, p)基组,全优化S型Pro向R型Pro转变过程中的各个驻点.通过对过渡态[14, 15]虚频振动模式的分析和内禀反应坐标(IRC)[16, 17]计算,对过渡态进行确认.为获得高水平的势能面,采用微扰理论的MP2方法[18, 19],选用6-311++G(2df, pd)基组,计算体系的单点能,进行吉普斯自由能热校正,利用Gtotal=ESP+Gtc(Gtotal为总自由能,ESP为单点能,Gtc为吉布斯自由能热校正)计算总自由能.水溶剂效应采用自洽反应场(SCRF)理论的smd模型方法[20]计算.a通道的第一个S型中间体INT1与1个水分子的氢键络合物aSINT1·1H2O在水溶剂环境下记作aSINT1·1H2O@water,水环境下其他分子的表示法相似.文中计算均由Gaussian 09程序包[21]完成.
2 结果与讨论 2.1 S-Pro向R-Pro异构的裸反应机理在B3LYP/6-31+G(d, p)理论水平,优化得到Pro分子手性对映体结构如图 1.
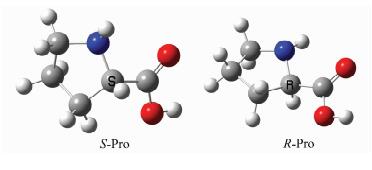
|
| 图 1 S-Pro和R-Pro的几何构型 Figure 1 The geometrical configuration of S-Pro and R-Pro molecules |
分析图 1发现,S-Pro旋光异构可能在4个通道a、b、c和d实现.a,b和c分别为手性C上的质子以亚氨基为桥、依次以羰基和亚氨基N为桥和只以羰基为桥迁移;d为羧基内质子迁移后,手性C上的质子再以羰基为桥迁移.在MP2/6-311++G(2df, pd)//B3LYP/6-31+G(d, p)双理论水平计算的各个反应通道的驻点结构,如图 2所示;势能面剖面,如图 3所示.
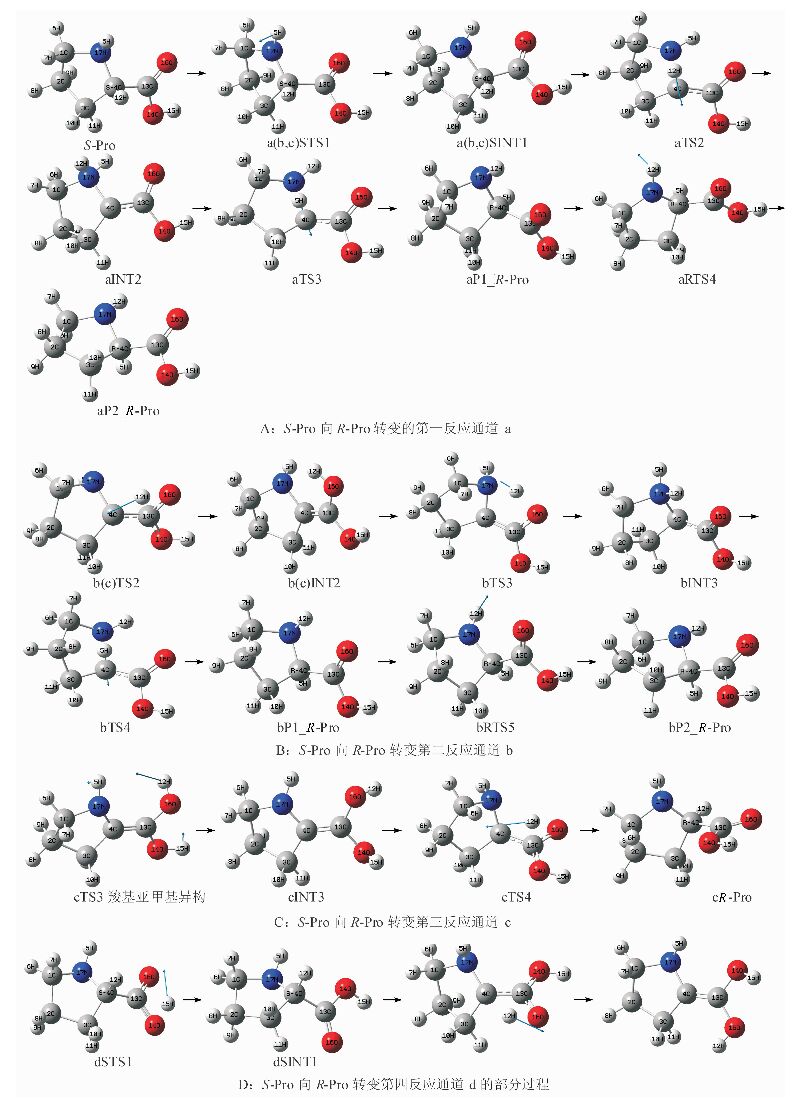
|
| 图 2 S-Pro向R-Pro的异构反应历程、驻点结构和过渡态的虚频振动模式 Figure 2 The reaction processes from S-Pro to R-Pro chiral conversion, stagnation point structures and virtual frequency vibration modes of the transition state |
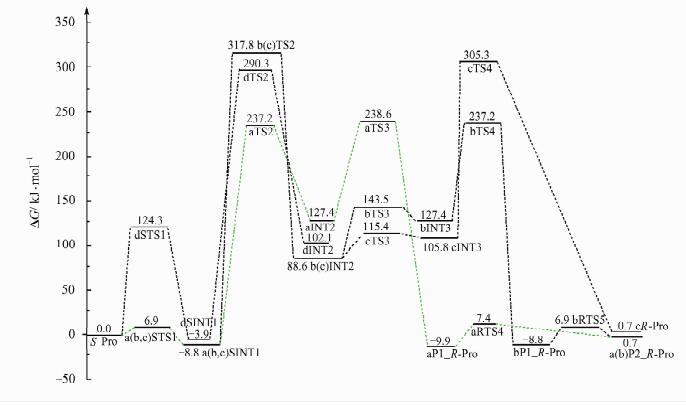
|
| 图 3 S-Pro向R-Pro转变过程的自由能势能面示意图 Figure 3 Potential free energy profile of S-Pro to R-Pro transformation processes |
S-Pro在a通道的旋光异构历程见图 2A.首先,S-Pro的亚氨基17N上的5H,经其在纸面里外翻转的过渡态aSTS1(S表示过渡态aTS1是S型,后文相似的表示不再赘述)摆到纸面里,形成第1中间体aSINT1,此过程中二面角1C-17N-5H-4C从125.83°变为-117.23°,无断键,需越过的能垒仅6.9 kJ·mol-1.然后,12H经过渡态aTS2从手性碳4C迁移至亚氨基17N,形成第2中间体aINT2.此过程中12H-4C键长从0.109 62 nm拉伸至0.134 66 nm断裂,4C-17N键长从0.146 85 nm拉伸至0.159 25 nm断裂.从aSINT1到aTS2断两个键,需要一定的能量,aTS2过渡态为不稳定的三元环,产生的能垒是246.0 kJ·mol-1.接着aINT2经过渡态aTS3, 实现5H从氨基17N向手性碳4C的迁移,异构为第1产物aP1_R-Pro, 实现手性转变.aINT2到aTS3过程中,5H-17N键长从0.104 27 nm拉长至0.118 37断裂,4C-17N键长从0.149 64 nm拉长至1.594 1且断裂,aTS3断两个键,说明aTS3产生的能垒会较高.aTS3与aTS2相似,也是三元环过渡态,它们的能量基本相同,但aINT2的能量高于aSINT1,导致第3基元反应的能垒低于第2基元反应,仅111.2 kJ·mol-1.从S-Pro到aP1_R-Pro,质子从手性碳的一侧迁移至另一侧,并且二面角3C-4C-17N-13C从-123.15°变成122.65°,反应活性中心骨架基本完成对称异构.aP1_R-Pro再经过亚氨基N上的12H在纸面里外翻转的过渡态aRTS4,异构为第2产物aP2_R-Pro.二面角1C-17N-12H-4C从122.75°变为-121.26°,亚氨基17N上的12H从纸面外摆到了纸面里,S-Pro完成了手性对映体转变.此过程无断键,能垒仅17.3 kJ·mol-1.aP1_R-Pro比aP2_R-Pro的构型稳定,逆反应的能垒更低,所以,此通道上的产物多以aP1_R-Pro的形式存在.
在b通道上的旋光异构历程见图 2的A和B.第一基元反应同a通道,形成的产物中间体记作b(a)SINT1.接着手性C上的12H经过渡态bTS2迁移至羰基氧16O上,形成中间体bINT2.从b(a)SINT1到过渡态bTS2,4C-12H键长从0.10962 nm拉伸至0.154 56nm断裂,键长拉伸幅度较大,需要较高的能量,导致bTS2产生的能垒较高,是309.0 kJ·mol-1.而后bINT2经过渡态bTS3,实现12H从16O向亚氨基的17N迁移,形成与a通道上的aINT2相似的中间体,记作bINT3.结构分析表明,二面角13C-16O-12H-17N和16O-12H-17N-4C分别是-7.09°和2.70°,五元环过渡态bTS3基本共面,比较稳定,其能量不高;bINT2到bTS3过程,键长12H-16N从0.097 70 nm拉伸至0.130 00 nm,增幅不大.综合这两个原因,此基元反应的活化能不高,仅54.9 kJ·mol-1.以后的历程相似于aINT2的异构历程,bINT3经5H从亚氨基17N向手性碳4C迁移的过渡态bTS4,异构为产物bP1_R-Pro,完成手性转变;又经过12H里外摆动的过渡态bRTS5,异构为产物bP2_R-Pro,实现手性对映体转变.从图 3可知,bP1_R-Pro比bP2_R-Pro的构型稳定,所以,此通道上的产物多以bP1_R-Pro的形式存在.
在c通道第1和2基元反应同于通道b,异构为的中间体cINT2,记作c(b)INT2.c(b)INT2经图 2C所示的亚氨基和质子化羧基协同异构的过渡态cTS3,12H和15H分别摆进和摆出纸面,5H进一步转进纸面里,形成有利于12H在纸面里向手性碳4C迁移的中间体cINT3.此基元反应过程无断键成键,能垒不高,仅26.8 kJ·mol-1.最后,经12H从16O向手性碳4C迁移的过渡态cTS4,异构为产物cR-Pro,实现手性对映体转变.此基元反应是断键成键过程,四元环过渡态cTS4不共面,cINT3的12H距离4C较远,因此,此基元反应的能垒较高,是199.5 kJ·mol-1.
在d通道上旋光异构历程见图 2D.首先,S-Pro羟基的15H从14O迁移至羰基16O,异构为中间体dINT1.结构分析表明,从S-Pro到dSTS1过程14O-15H拉伸幅度不大,四元环过渡态dSTS1基本共面,相对比较稳定.此基元反应的能垒仅124.3kJ·mol-1.接着手性碳4C上的12H,经过渡态dTS2迁移至羰基16O上,形成产物中间体dINT2.结构分析表明,dINT1到dTS2过程,4C-12H拉伸幅度较大,四元环过渡态dTS2不共面,不稳定,产生的能垒较高,是294.2kJ·mol-1.再经过和c(b)INT2以后相似的过程,即质子化羧基的异构和15H向手性碳的迁移,完成手性转变,这里不再赘述.
从图 3可以看出,各个通道的决速步骤都是第2个基元反应.a通道为优势通道,其决速步骤自由能垒为246.0 kJ·mol-1,由手性C上的12H向亚氨基17N转移的过渡态aTS2产生.246.0 kJ·mol-1的能垒远远高于常温下质子迁移的“极限能垒”167.0 kJ·mol-1[22],说明常温下Pro分子具有稳定性.
2.2 S-Pro旋光异构过程中水分子的催化作用篇幅所限,仅讨论水分子对优势通道决速步骤aSINT1→aTS2→aINT2过程的催化作用,以获得水分子作用下脯氨酸分子旋光异构的最低活化能垒.计算表明,3个H2O分子构成的链做H迁移桥梁,与2个H2O分子链的催化作用相比增加不大,本文仅讨论1个和2个H2O分子的催化作用.
在MP2/6-311++G(2df, pd)//B3LYP/6-31+G(d, p)理论水平上,计算1个H2O分子和2个H2O分子催化aSINT1→aTS2→aINT2反应历程的驻点结构,见图 4A和B,势能面剖面图见图 5.
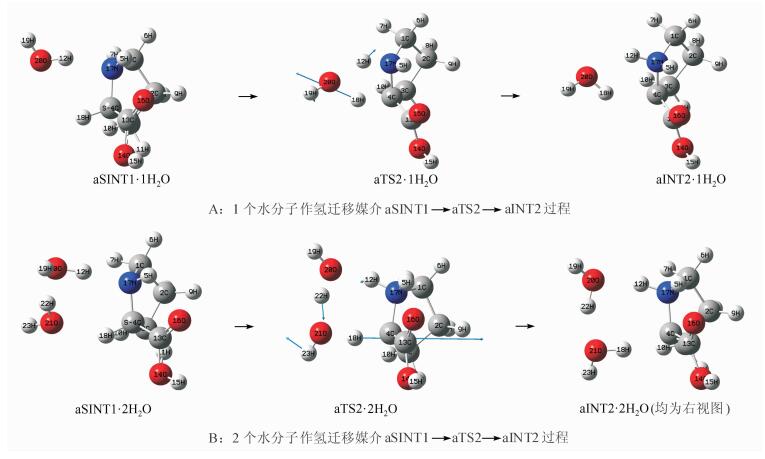
|
| 图 4 水分子为氢迁移媒介,aSINT1→aTS2→aINT2过程A和B Figure 4 The processes A and B of aSINT1→aTS2→aINT2 using water molecular as hydrogen transfer medium |
|
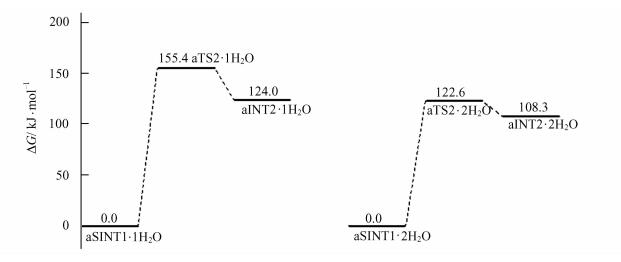
| 图 5 水分子作为氢迁移媒介,aSINT1→aTS2→aINT2过程的自由能势能面示意图 Figure 5 Potential free energy profile of aSINT1→aTS2→aINT 2 processes using water molecular as hydrogen transfer medium |
aSINT1与其18H和17N左侧的1个和2个H2O分子通过氢键作用,形成络合分子,分别记作aSINT1·1H2O和aSINT1·2H2O,它们分别经过渡态aTS2·1H2O和aTS2·2H2O,实现了以1个和2个水分子为媒介,质子从手性碳4C向氨基氮17N的转移,异构为中间体络合物aINT2·1H2O和aINT2·2H2O.过渡态aTS2·1H2O和aTS2·2H2O的主要结构参数见表 1.
| (°) | |||
| Structure | 主要键角1 | 主要键角2 | 主要键角3 |
| aTS2·1H2O | 141.317 (4C-18H-20O) | 132.909 (20O-12H-17N) | |
| aTS2·2H2O | 164.307 (4C-18H-21O) | 163.840 (20O-12H-17N) | 160.760 (21O-22H-20O) |
从表 1可以看出:七元环过渡态aTS2·2H2O的键角4C-18H-21O、20O-12H-17N和21O-22H-20O,都远大于五元环过渡态aTS2·1H2O的键角4C-18H-20O和20O-12H-17N,aTS2·2H2O的氢键键角更接近180°;结构分析表明,七元环过渡态aTS2·2H2O基本共面.因此,七元环结构过渡态aTS2·2H2O比五元环结构过渡态aTS2·1H2O稳定,产生的能垒低.从图 5可知,aTS2·2H2O产生的能垒为122.6 kJ·mol-1.
比较图 3和图 5可以看出,对aSINT1→aTS2→aINT2过程,1个H2O分子有较好的催化作用,使能垒从裸反应的246.0 kJ·mol-1降低至155.4 kJ·mol-1.2个H2O分子构成的链具有极好的催化作用,使能垒从裸反应的246.0 kJ·mol-1降低至122.6 kJ·mol-1.122.6 kJ·mol-1低于常温298.15 K质子迁移的“极限能垒”167.0 kJ·mol-1[22],并且人体正常温度约为310.00 K,高于298.15 K,考虑到体内分子间碰撞、温度涨落等因素,此能垒在生命体内可以越过,说明S-Pro分子在生命体内可以极其缓慢地实现旋光异构.
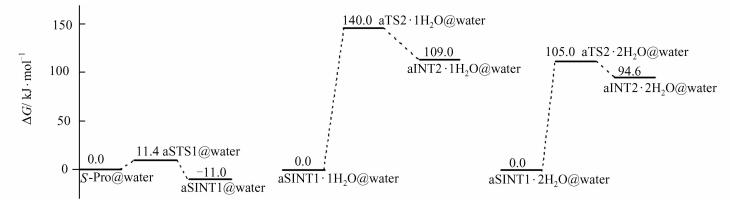
2.3 S-Pro旋光异构过程中水分子的催化与水溶剂效应的共同作用生命体是富水环境,其中的Pro既受到作为离散介质的水分子的作用,同时还应考虑到水作为连续介质的溶剂化效应.本文仅讨论主反应通道主要过程(第1和2基元反应),以获得水分子的催化与水溶剂效应的共同作用对S-Pro旋光异构的影响.在MP2/6-311++G(2df, pd)//B3LYP/6-31+G(d, p)理论水平计算的水环境下主反应通道主要过程的吉布斯势能面,见图 6.
|
| 图 6 水环境下主反应通道主要过程的自由能势能面 Figure 6 In the water environment, potential free energy profiles of the main processes in the dominant reaction |
比较图 6和图 3可以看出:对于无断键异构的第1基元反应,水溶剂化效应使能垒从6.9 kJ·mol-1升高到11.4 kJ·mol-1.对于有断键成键质子迁移异构的第2基元反应,1个水分子的催化与水溶剂化效应的共同作用使能垒从246.0 kJ·mol-1降低至140.0 kJ·mol-1;2个水分子的催化与水溶剂化效应的共同作用使能垒从246.0 kJ·mol-1降低至105.0 kJ·mol-1,比只是H2O分子作桥时的能垒均有所降低,说明水溶剂对水分子催化的H迁移反应具有助催化作用.同2.2节的原因,105.0 kJ·mol-1的能垒在生命体内有越过的几率,S-Pro分子在生命体内可以实现消旋.
3 结论本文采用密度泛函理论的B3LYP方法、微扰论的MP2方法和自洽反应场(SCRF)理论的smd模型方法,研究了脯氨酸手性转变裸反应机理、水分子的催化作用及水溶剂化效应.结构分析表明:七元环结构过渡态aTS2·2H2O比五元环结构过渡态aTS2·1H2O对应的氢键键角大,结构稳定,产生的能垒要低.反应通道研究发现:脯氨酸手性转变反应有4个通道.势能面计算表明:质子以亚氨基为桥迁移的通道为优势反应通道,裸反应决速步骤吉布斯自由能垒为246.0 kJ·mol-1;2个水分子的催化使决速步骤自由能垒降为122.6 kJ·mol-1;2个水分子的催化与水溶剂效应的共同作用,使决速步骤自由能垒降为105.1 kJ·mol-1.结果表明:水分子对氢迁移反应有较好催化作用,水溶剂对水分子催化的H迁移反应具有助催化作用,但对无断键异构反应有很小的抑制作用;脯氨酸在生命体内富水环境可以缓慢地实现左旋体的消旋.
| [1] | KENJI H, AKIKO M, KIYOSHI Z. D-Amino acids in mammals and their diagnostic value[J]. Journal of Chromatography B, 2002, 781(1-2) : 73–91. DOI:10.1016/S1570-0232(02)00690-6 |
| [2] | TOHRU Y, NOBUYOSHI E. Amino acid racemases: Functions and mechanisms[J]. Journal of Bioscience and Bioengineering, 2003, 96(1) : 103–109. DOI:10.1017/S0950268809002428 |
| [3] | NORIKO F. D-Amino acids in living higher organisms[J]. Origins of Life and Evolution of the Biosphere, 2002, 32(1) : 103–127. DOI:10.1023/A:1016031014871 |
| [4] | KENJI H, TOMOMI I, AKIKO M, et al. Determination of free D-proline and D-leucine in the brains of mice lacking D-amino acid oxidase activity[J]. Analytical Biochemistry, 2001, 298 : 253–258. DOI:10.1006/abio.2001.5382 |
| [5] | 漆剑. L-脯氨酸和L-缬氨酸构型转换的研究[D]. 南昌: 南昌大学, 2006. I J. Study on configuration transformation of L-proline and L-valine[D]. Nanchang:Nanchang University, 2006(Ch). http://cdmd.cnki.com.cn/Article/CDMD-11902-2006122019.htm |
| [6] | ULRICH E, GERHARD S, RUDOLF W. New type of asymmetric cyclization to optically active steroid CD partial structures[J]. Angewandte Chemie International Edition, 1971, 10(7) : 496–497. DOI:10.1002/anie.197104961 |
| [7] | 王朝杰, 李永, 杨新宇, 等. 脯氨酸的构象及性质[J]. 物理化学学报, 2007, 23(3) : 305–310. ANG C J, LI Y, YANG X Y, et al. Conformers and properties of proline[J]. Acta Physico-Chimica Sinica, 2007, 23(3) : 305–310(Ch). DOI:10.1016/S1872-1508(07)60024-2(Ch) |
| [8] | MARY Y S, USHAKUMARI L, HARIKUMAR B, et al. FT-IR, FT-raman and PROS spectra of L-proline[J]. Journal of the Iranian Chemical Society, 2009, 6(1) : 138–144. DOI:10.1007/BF03246512 |
| [9] | 刘凤阁, 辛春雨, 闫红彦, 等. 气相赖氨酸分子手性转变机制的理论研究[J]. 武汉大学学报(理学版), 2015, 61(1) : 93–98. IU F G, XIN C Y, YAN H Y, et al. Theoretical research on chiral change mechanism of gaseous lysine molecules[J]. Journal of Wuhan University(Nature Science Edition), 2015, 61(1) : 93–98(Ch). DOI:10.14188/j.1671-8836.2015.01.013(Ch) |
| [10] | 刘凤阁, 王佐成, 梅泽民, 等. 水环境下赖氨酸分子的手性转变机理[J]. 武汉大学学报(理学版), 2015, 61(5) : 491–496. LIU F G, WANG Z C, MEI Z M, et al. Chiral shift mechanism of lysine molecules under water environment[J]. Journal of Wuhan University(Nature Science Edition), 2015, 61(5) : 491–496(Ch). DOI:10.14188/j.1671-8836.2015.05.016(Ch) |
| [11] | 王晓玲, 高峰, 佟华, 等. 赖氨酸分子手性转变机制及水分子和羟自由基的催化作用[J]. 吉林大学学报(理学版), 2016, 54(5) : 1161–1167. WANG X L, GAO F, TONG H, et al. Chiral transition mechanism of lysine molecules and catalysis of water molecules and hydroxyl radical[J]. Journal of Jilin University(Science Edition), 2016, 54(5) : 1161–1167(Ch). DOI:10.13413/j.cnki.jdxblxb.2016.05.38(Ch) |
| [12] | BECKE A D. Density-functional thermochemistry. Ⅲ. The role of exact exchange[J]. Chemistry Physics, 1993, 98(7) : 5648–5652. DOI:10.1063/1.464913 |
| [13] | PARR R G, YANG W. Density-Functional Theory of Atoms and Molecules[M]. New York: Oxford University Press, 1994. |
| [14] | GARRETT B C, TRUHLAR D G. Generalized transition state theory. Classical mechanical theory and applications to collinear reactions of hydrogen molecule[J]. Journal of Physical Chemistry, 1979, 83(8) : 1052–1079. DOI:10.1021/j100471a031 |
| [15] | GARRETT B C, TRUHLAR D G. Criterion of minimum state density in the transition state theory of bimolecular reactions[J]. The Journal of Chemical Physics, 1979, 70(4) : 1593–1598. DOI:10.1063/1.437698 |
| [16] | GONZALEZ C, SCHLEGEL H. Reaction path following in mass-weighted internal coordinates[J]. Journal of Physical Chemistry, 1990, 94(14) : 5523–5527. DOI:10.1021/j100377a021 |
| [17] | ISHIDA K, MOROKUMA K, KOMORNICKI A. The intrinsic reaction coordinate. An ab initio calculation for HNC→HCN and H-+CH4→CH4+ H-*[J]. The Journal of Chemical Physics, 1977, 66(5) : 2153–2156. DOI:10.1063/1.434152 |
| [18] | 徐光宪, 黎乐民, 王德民. 量子化学(中册)[M]. 北京: 科学技术出版社, 1985: 962-986. U G X, LI L M, WANG D M. Quantum Chemistry(middle)[M]. Beijing: Science Press, 1985: 962-986(Ch). |
| [19] | BINKLEY J S, POPLE J A. M eller-plesset theory for atomic ground state energies[J]. International Journal of Quantum Chemistry, 1975, 9(2) : 229–2369. DOI:10.1002/qua.560090204 |
| [20] | MARENICH A V, CRAMER C J, TRUHLAR D G. Universal solvation model based on solute electron density and on a continuum model of the solvent defined by the bulk dielectric constant and atomic surface tensions[J]. The Journal of Physical Chemistry B, 2009, 113(18) : 6378–6396. DOI:10.1021/jp810292n |
| [21] | FRISCH M J, TRUCKS G W, SCHLEGEL H B, et al. Gaussian 09. Revision E.01. New York: Gaussian Inc, Wallingford CT, 2013. |
| [22] | GORB L, LESZCZYNSKI J. Intramolecular proton transfer in mono-and dihydrated tautomers of guanine: An ab initio post Hartree-Fock study[J]. Journal of the American Chemical Society, 1998, 120 : 5024–5032. DOI:10.1021/ja972017w |
 2017, Vol. 63
2017, Vol. 63





