文章信息
- 宋爽, 储林芳, 吕中, 杨浩
- SONG Shuang, CHU Linfang, LÜ Zhong, YANG Hao
- 氧化石墨烯选择性抗菌性能研究
- Research on the Selective Antibacterial Activities of Graphene Oxide
- 武汉大学学报(理学版), 2017, 63(4): 283-288
- Journal of Wuhan University(Natural Science Edition), 2017, 63(4): 283-288
- http://dx.doi.org/10.14188/j.1671-8836.2017.04.001
-
文章历史
- 收稿日期:2017-01-17

石墨烯是由碳原子以sp2杂化轨道组成的六角形单层片状结构,具有独特的二维共轭结构和电子性质[1~3].氧化石墨烯(graphene oxide,GO)是在石墨烯片的边缘含有羧基,在基底上含有酚羟基和环氧基等大量含氧基团的二维石墨烯碳材料[4~6],可视为一种非传统形态的软性材料,具有聚合物、胶体、薄膜的特性,同时具有优异的水分散性、两亲性(即从材料的边缘至中心呈现亲水至疏水的变化)、较高的比表面积和丰富的基团,在生化传感[7, 8]和医药[9, 10]方面有很多潜在的应用.
近年来,一些科研工作者对氧化石墨烯的生物活性进行了很多研究[11~13],发现氧化石墨烯及其复合物,如GO-Ag[14],GO-TiO2[15]和GO-聚醚砜[16]等均具有较好的抗菌性能,但对单纯氧化石墨烯的抗菌性能研究相对较少,且作用的细菌种类相对单一[17].本研究拟采用改进的Hummers方法[18]合成氧化石墨烯,分别与革兰氏阴性菌大肠杆菌和绿脓杆菌以及革兰氏阳性菌金黄色葡萄球菌进行作用,研究其对不同细菌的抗菌活性,并初步探讨氧化石墨烯对细菌的作用过程.
1 实验部分 1.1 主要试剂及菌种石墨粉(纯度99.95%,80~120目)购自上海晶纯生化科技股份有限公司;戊二醛、鱼蛋白胨、琼脂粉和酵母粉由国药集团化学试剂有限公司提供;革兰氏阴性菌大肠杆菌(E.coli, CCTCC AB 93154),绿脓杆菌(P. aeruginosa, CCTCC AB 93066) 和革兰氏阳性菌金黄色葡萄球菌(S. aureus, ATCC 9118) 由武汉大学典型培养物保藏中心提供;其他试剂均为分析纯.每升LB固体培养基含有鱼蛋白胨10g、酵母粉5 g、氯化钠10 g和琼脂粉15 g.实验用水为去离子水.
1.2 氧化石墨烯的制备根据文献[18]的方法合成氧化石墨烯.量取27 mL磷酸和240 mL硫酸,置于500 mL平底烧瓶中,然后加入2 g石墨,搅拌一段时间后缓慢加入6 g高锰酸钾,将混合物于50 ℃恒温水浴,搅拌反应10 h后,倒入装有230 g冰的烧杯中,滴加30%过氧化氢直至溶液变为亮黄色或者无气泡溢出为止.然后将上述反应液离心,取下层沉淀依次用30%盐酸、无水乙醚、无水乙醇、水洗涤至无硫酸根离子检出(用氯化钡检验)且pH值接近中性即可.洗涤后的固体置于50 ℃真空干燥24 h.干燥后的氧化石墨呈片状,需研磨成粉后才能使用.
称量25 mg氧化石墨,加入50 mL水超声分散45 min,记为GO-0,然后将GO-0转移至FS-600N型超声波纳米分散仪(600 W,上海生析超声仪器有限公司)中,分别超声分散5,10,30,50,100 min,所得样品依次标记为GO-1,GO-2,GO-3,GO-4和GO-5.
1.3 分析测试1) GO样品表征.GO样品中有机物的结构以及官能团的变化用Impact 420型傅里叶红外光谱仪(FT-IR,Nicolet公司)表征,横向尺寸和大肠杆菌细胞用Multimode Nanoscope Ⅲa型原子力显微镜(AFM,VEECO公司)观测,AFM图采用轻敲模式,扫描范围5 μm×5 μm,至少扫描3个不同区域以统计GO的横向尺寸,并给出典型的GO尺寸.
2) 细菌形态的AFM观测.配制浓度为4 mg · mL-1的氧化石墨烯分散液,将其与菌液浓度9×108 cfu · mL-1的大肠杆菌混合培养,作用一段时间后取一定量的菌液于灭菌后的离心管中,离心去掉上清液,用PBS缓冲液(10 mmol·L-1,pH 7.4) 洗涤两次,然后用2.5%的戊二醛固定2 h,再离心去掉上清液,依次用2.5%的戊二醛洗涤一次、无菌水洗涤两次,再用无菌水调节菌液浓度至9×108 cfu · mL-1(OD660 nm=0.3).用漩涡混合仪使细菌细胞在溶液中分散均匀后,取适量菌液滴在新鲜解离的云母片上,然后放置在空气中干燥.待干燥完全后用AFM获得大肠杆菌的图像.
1.4 抗菌性能实验氧化石墨烯分散液经紫外线杀菌,制备菌液浓度为107~108 cfu · mL-1的悬浮液(OD660 nm=0.068~0.075).将上述细菌悬浮液稀释一定倍数,分别取氧化石墨烯分散液、无菌水(经过高温杀菌的去离子水)与5 mL稀释后的细菌悬浮液置于灭菌后的试管中,恒温振荡(150 r·min-1)培养2 h后取出.分别从试管中取100 μL混合液涂布于LB固体培养基上,然后用封口膜将培养基封好于37 ℃恒温培养12 h,计算培养基上的菌落数目,以无菌水作为空白对照.
实验选取大肠杆菌、绿脓杆菌和金黄色葡萄球菌作研究对象,其细胞失活率计算如下:
失活率=(对照组菌落数-实验组菌落数)/对照组菌落数×100%
失活率取3次重复实验结果的平均值.
2 结果与分析 2.1 氧化石墨烯的表征图 1为氧化石墨的FT-IR光谱.其中,870 cm-1处为环氧基的特征吸收峰;1 050 cm-1处为C—O—C的振动吸收峰,1 209 cm-1处为sp2 C—O的伸缩振动峰,对应的化合物类型为叔醇、仲烷基醚;1 620 cm-1处为水分子的变形振动吸收峰,说明氧化石墨中仍然有水分子存在;1 720 cm-1处为羧基上CO键的伸缩振动峰;3 403 cm-1处为—OH的伸缩振动峰.通过以上分析可知,合成的氧化石墨存在环氧基、羟基(—OH)、羧基(—COOH)、—CH(O)CH-等基团,与文献报道[18]一致.
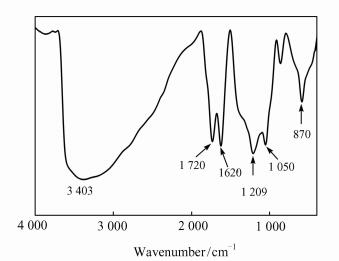
|
| 图 1 氧化石墨的FT-IR光谱 Figure 1 FT-IR spectrum of graphite oxide |
图 2A~E为不同超声时间下得到的氧化石墨烯的AFM图像.可知, 所有氧化石墨烯片层为单层片,厚度约为1 nm.随着超声时间的增加,氧化石墨烯的横向尺寸逐渐减小,GO-0到GO-5的平均横向尺寸分别为2.5,1.2,1.1,0.8,0.5和0.15 μm,且在超声过程中,氧化石墨烯片没有明显聚集.这说明氧化石墨烯纳米片刚从氧化石墨剥离后是以大片形式存在的,随着超声的进行,横向尺寸较大的纳米片会在声空穴作用下被分解为更多尺寸较小的纳米片,通过控制超声时间得到了具有不同横向尺寸的氧化石墨烯纳米片.
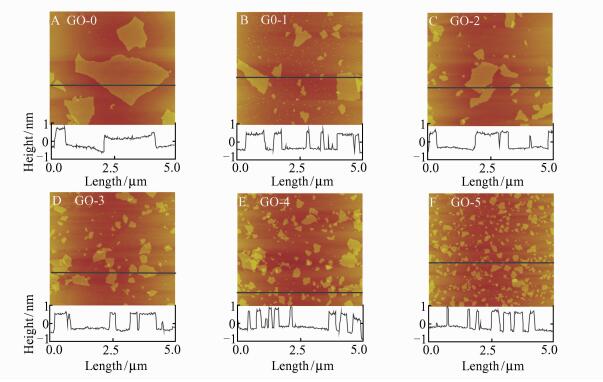
|
| 图 2 不同横向尺寸氧化石墨烯的AFM图像及其截面分析 Figure 2 AFM images and section analyses of GO sheets with different lateral dimensions A:GO-0; B:GO-1; C:GO-2; D:GO-3; E:GO-4; F:GO-5 |
将不同横向尺寸氧化石墨烯的分散液(100 μg·mL-1)与大肠杆菌混合培养后进行菌落计数计算细胞失活率,考察其抗菌性能.由于GO-1和GO-2的横向尺寸相差不大,故选取GO-0,GO-2,GO-3,GO-4和GO-5用于抗菌性能实验,结果如图 3所示.从图 3可知,横向尺寸最大的GO-0表现出最强的抗菌活性,细菌的平均失活率为96.4%,随着氧化石墨烯横向尺寸的减小,其抗菌活性也逐渐降低,GO-2、GO-3、GO-4和GO-5的平均细菌失活率依次为86.2%、69.2%、64.2%和19.4%.特别是当氧化石墨烯的横向尺寸从0.5 μm(GO-4) 减小至0.15 μm(GO-5) 时,其抗菌活性显著降低.因此,本研究选择GO-0进行后续抗菌实验.
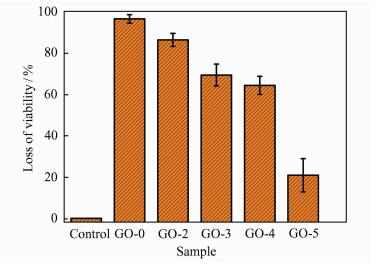
|
| 图 3 不同氧化石墨烯样品作用下大肠杆菌的失活率 Figure 3 The loss of viability of E. coli cells after incub-ating with GO suspensions with different lateral sizes |
配制不同浓度的GO-0分散液,将其分别作用于革兰氏阴性菌大肠杆菌、绿脓杆菌,以及革兰氏阳性菌金黄色葡萄球菌,不同细菌的失活率结果如图 4A所示.在较低浓度(25~100μg· mL-1)时,GO-0对大肠杆菌的抗菌效果最好,绿脓杆菌次之,金黄色葡萄球菌最差.当GO-0分散液浓度达到200μg· mL-1时,GO-0对3种细菌均具有优异的杀菌效果,失活率均达到了90%以上.将细菌失活率(%)对浓度(μg · mL-1)求导得到细菌失活率随浓度变化的关系,如图 4B所示.由图 4B可知,在低浓度(≤ 50μg· mL-1)条件下,GO-0的浓度变化对大肠杆菌和绿脓杆菌的失活率影响较大,而对金黄色葡萄球菌影响较小;在较大浓度(≥ 100μg· mL-1)时,GO-0的浓度变化对3种细菌均没有明显影响.综合图 4A和图 4B可以看出,GO-0对不同细菌具有浓度依赖的选择性抗菌性能:当浓度低于或等于100μg· mL-1时,GO-0对革兰氏阴性菌的抗菌效果优于革兰氏阳性菌;当浓度达到200μg· mL-1时,GO-0对革兰氏阴性菌和革兰氏阳性菌均表现出较高的抗菌活性,无明显的选择性.
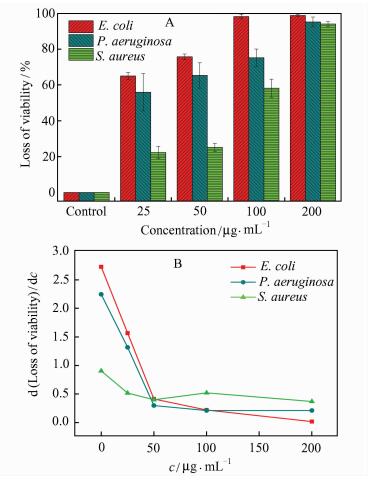
|
| 图 4 不同浓度GO-0作用下细菌的失活率(A)及细菌失活率-浓度变化图(B) Figure 4 The loss of viability of bacteria at different concen-trations of GO-0(A) and the concentration-dependent loss of iability of bacteria after incubating with GO-0 suspension(B) |
利用AFM观测GO-0分散液对大肠杆菌作用1,2,3 h后细胞的表面形貌,探讨GO-0对细菌的作用过程结果.如图 5所示,大肠杆菌的高度、宽度和表面粗糙度等数据列于表 1.由图 5和表 1可知,随着作用时间的延长,大肠杆菌的高度不断降低,宽度逐渐增加,高宽比减小,表面粗糙度增大,说明细胞内容物在GO-0作用后发生泄漏,使细胞体积收缩.观察图 5还可发现,与正常的大肠杆菌相比,作用后的大肠杆菌表面及周围紧密包裹着GO-0纳米片,不同的纳米片在其表面形成了明显的褶皱.当GO-0作用1 h后,大肠杆菌表面开始出现一些凹陷,作用2 h后,大肠杆菌虽然还保持原有的形态,细胞表面的凹陷程度明显增加,作用3 h后,大肠杆菌已经没有杆状的形态,表面完全塌陷和破损.通过AFM结果分析,我们认为GO-0片将细菌包裹,一方面通过氧化应激对细菌的细胞膜造成一定的破坏,另一方面将其与外界环境隔离,使其无法汲取生长所需的营养物质,两种作用的综合作用下,最终导致了细菌的死亡[19~21].GO-0在较低浓度时,不能完全包裹细菌的表面以阻碍营养物质的进入,主要通过氧化应激对细胞膜的破坏发挥抗菌作用.由于革兰氏阴性菌的细胞壁较薄,机械性能弱于革兰氏阳性菌[22],因此在低浓度下GO-0对革兰氏阴性菌的抗菌活性高于对革兰氏阳性菌的抗菌活性.而当GO-0浓度足够高时,细菌完全被氧化石墨烯纳米片阻隔,故不再表现出明显的选择性抗菌活性.
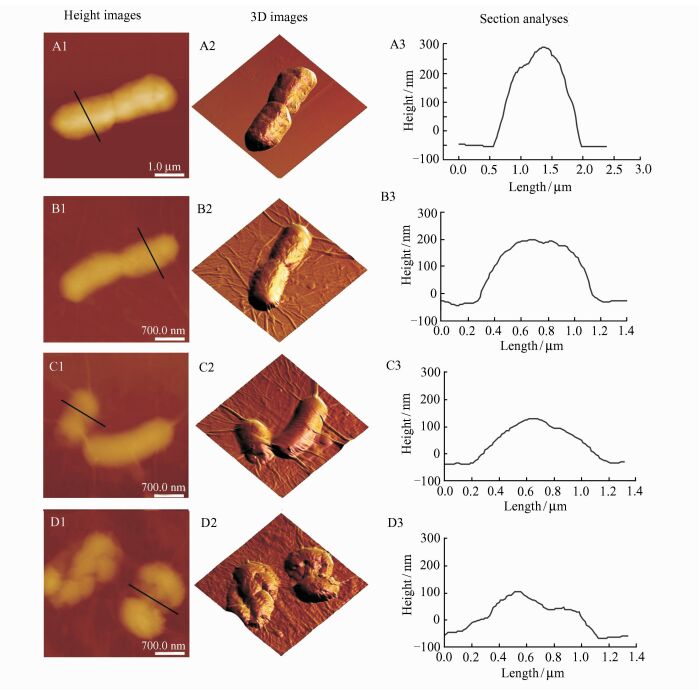
|
| 图 5 正常的大肠杆菌与氧化石墨烯作用0 h(A1~A3),1 h(B1~B3),2 h(C1~C3),3 h(D1~D3) 的AFM图 Figure 5 AFM images of normal E.coli (A1~A3), and E.coli incubating with GO suspensions for 1 h (B1~B3), 2 h (C1~C3) and 3 h (D1~D3) |
| 作用时 间/h | 高度 /nm | 宽度 /nm | 高宽 比 | 平均粗 糙度/nm |
| 0 | 348.50 | 1 408.7 | 0.247 | 13.402 |
| 1 | 223.85 | 959. 59 | 0.233 | 20.526 |
| 2 | 167.78 | 997. 30 | 0.168 | 27.950 |
| 3 | 162.95 | 1 160.47 | 0.140 | 40.404 |
本文以大肠杆菌、绿脓杆菌和金黄色葡萄球菌作为研究对象,研究了氧化石墨烯对革兰氏阴性菌和革兰氏阳性菌的选择抗菌性能,当氧化石墨烯的浓度≤ 100μg· mL-1时,氧化石墨烯对革兰氏阴性菌的抗菌活性高于革兰氏阳性菌;而当浓度达到200μg· mL-1时,氧化石墨烯对革兰氏阴性菌和革兰氏阳性菌均表现出较高的抗菌活性.通过AFM图可以看出,大肠杆菌被氧化石墨烯纳米片包裹,并可能通过氧化应激和阻隔营养物质的输送来杀死细胞,故在低浓度下表现出选择性抗菌活性,而在高浓度下则丧失了这种选择性.该研究表明,氧化石墨烯在一定条件下可表现出选择抗菌性,使得其在抗菌领域具有潜在的应用价值.然而,目前对氧化石墨烯的生物安全性尚存在一些争论,其抗菌机制也未完全阐明.因此,要实现氧化石墨烯的抗菌应用还需更进一步的研究.
| [1] | ALLEN M J, TUNG V C, KANER R B. Honeycomb carbon: A review of graphene[J]. Chemical Reviews, 2010, 110(1) : 132–145. DOI:10.1021/cr900070d |
| [2] | GEIM A K, NOVOSELOV K S. The rise of graphene[J]. Nature Materials, 2007, 6(3) : 183–191. DOI:10.1038/nmat1849 |
| [3] | RAO C N R, SOOD A K, SUBRAHMANYAM K S, et al. Graphene: The new two-dimensional nanomaterial[J]. Angewandte Chemie-International Edition, 2009, 48(42) : 7752–7777. DOI:10.1002/anie.200901678 |
| [4] | DREYER D R, PARK S, BIELAWSKI C W, et al. The chemistry of graphene oxide[J]. Chemical Society Review, 2010, 39(1) : 228–40. DOI:10.1039/b917103g |
| [5] | CHEN D, FENG H, LI J. Graphene oxide: Preparation, functionalization, and electrochemical applications[J]. Chemical Reviews, 2012, 112(11) : 6027–6053. DOI:10.1021/cr300115g |
| [6] | LOH K P, BAO Q, EDA G, et al. Graphene oxide as a chemically tunable platform for optical applications[J]. Nature Chemistry, 2010, 2(12) : 1015–1024. DOI:10.1038/nchem.907 |
| [7] | DONG H, GAO W, YAN F, et al. Fluorescence resonance energy transfer between quantum dots and graphene oxide for sensing biomolecules[J]. Analytical Chemistry, 2010, 82(13) : 5511–5517. DOI:10.1021/ac100852z |
| [8] | JUNG J H, CHEON D S, LIU F, et al. A graphene oxide based immuno-biosensor for pathogen detection[J]. Angewandte Chemie-International Edition, 2010, 49(33) : 5708–5711. DOI:10.1002/anie.201001428 |
| [9] | DURAN N, MARTINEZ D S T, SILVEIRA C P, et al. Graphene oxide: A carrier for pharmaceuticals and a scaffold for cell interactions[J]. Current Topics in Medicinal Chemistry, 2015, 15(4) : 309–327. DOI:10.2174/1568026615666150108144217 |
| [10] | TANG L A L, LEE W C, SHI H, et al. Highly wrinkled cross-linked graphene oxide membranes for biological and charge-storage applications[J]. Small, 2012, 8(3) : 423–431. DOI:10.1002/smll.201101690 |
| [11] | GURUNATHAN S. Cytotoxicity of graphene oxide nanoparticles on plant growth promoting rhizobacteria[J]. Journal of Industrial and Engineering Chemistry, 2015, 32 : 282–291. DOI:10.1016/j.jiec.2015.08.027 |
| [12] | RUIZ O N, FERNANDO K A S, WANG B, et al. Graphene oxide: A nonspecific enhancer of cellular growth[J]. ACS Nano, 2011, 5(10) : 8100–8107. DOI:10.1021/nn202699t |
| [13] | 张华, 孙庆德, 王瑞芳, 等. 石墨烯基季铵盐的制备及其抗菌性能[J]. 天津工业大学学报, 2015, 34(2) : 44–47. ZHANG H, SUN Q D, WANG R F, et al. Fabrication and antibacterial activity of graphene based quaternary ammonium salt[J]. Journal of Tianjin Polytechnic University, 2015, 34(2) : 44–47(Ch). DOI:10.3969/j.issn.1671-024X.2015.02.011(Ch) |
| [14] | LI S, YAN Y, WANG J, et al. Bio-inspired in situ growth of monolayer silver nanoparticles on graphene oxide paper as multifunctional substrate[J]. Nanoscale, 2013, 5(24) : 12616–12623. DOI:10.1039/c3nr03857b |
| [15] | 赵荣涛, 李杨, 贺亚南, 等. 基于氧化石墨烯的纳米材料在抗菌中的应用研究[J]. 公共卫生与预防医学, 2015, 1(26) : 68–71. HAO R T, LI Y, HE Y N, et al. Study on the application of nano materials based on graphene oxide in antibacterial activity[J]. Journal of Public Health and Preventive Medicine, 2015, 1(26) : 68–71(Ch). |
| [16] | TANG X, MU C, ZHU W, et al. Flexible polyurethane composites prepared by incorporation of polyethylenimine-modified slightly reduced graphene oxide[J]. Carbon, 2016, 98 : 432–440. DOI:10.1016/j.carbon.2015.11.030 |
| [17] | 张亚涛, 王琼柯, 许欣, 等. 固定化溶菌酶的氧化石墨烯聚醚砜杂化超滤膜制备及抗菌性能研究[J]. 中国工程科学, 2014, 16(7) : 23–29. HANG Y T, WANG Q K, XU X, et al. Preparation and antibacterial property of polyethersulfone hybrid ultrafiltration membrane containing GO immobilized by lysozyme[J]. Engineering Sciences, 2014, 16(7) : 23–29(Ch). |
| [18] | MARCANO D C, KOSYNKIN D V, BERLIN J M, et al. Improved synthesis of graphene oxide[J]. ACS Nano, 2010, 4(8) : 4806–4814. DOI:10.1021/nn1006368 |
| [19] | LIU S, HU M, ZENG T H, et al. Lateral dimension-dependent antibacterial activity of graphene oxide sheets[J]. Langmuir, 2012, 28(33) : 12364–12372. DOI:10.1021/la3023908 |
| [20] | LIU S, ZENG T H, HOFMANN M, et al. Antibacterial activity of graphite, graphite oxide, graphene oxide, and reduced graphene oxide: Membrane and oxidative stress[J]. ACS Nano, 2011, 5(9) : 6971–6980. DOI:10.1021/nn202451x |
| [21] | AKHAVAN O, GHADERI E. Toxicity of graphene and graphene oxide nanowalls against bacteria[J]. ACS Nano, 2010, 4(10) : 5731–5736. DOI:10.1021/nn101390x |
| [22] | VADILLO-RODR GUEZ V, DUTCHER J R. Viscoelasticity of the bacterial cell envelope[J]. Soft Matter, 2011, 7(9) : 4101. DOI:10.1039/c0sm01054e |
 2017, Vol. 63
2017, Vol. 63





