文章信息
- 程映, 余冰琼, 刘艳红, 李早英, 严琨
- CHENG Ying, YU Bingqiong, LIU Yanhong, LI Zaoying, YAN Kun
- 用于细胞成像的溶酶体pH荧光探针研究进展
- Trend of Lysosome pH Fluorescent Probes in Cellular Imaging
- 武汉大学学报(理学版), 2018, 64(4): 283-294
- Journal of Wuhan University(Natural Science Edition), 2018, 64(4): 283-294
- http://dx.doi.org/10.14188/j.1671-8836.2018.04.001
-
文章历史
- 收稿日期:2017-12-15

细胞内的pH值是一项关键的生理参数[1, 2],它与生命体内一些生理过程,如细胞代谢、酶的活性、免疫接种、离子运输和肿瘤增长等密切相关[3~5].溶酶体是真核细胞中的一种酸性亚细胞器,包含有60多种酸性水解酶、组织蛋白酶和许多特定的膜蛋白.这些物质的存在赋予了溶酶体许多特异性的功能.在细胞代谢过程中,它不仅能够促进大分子物质的降解,而且还能参与细胞分泌过程的调节[6~8].正常情况下,通过三磷酸腺苷水解,释放能量驱动质子泵,将细胞质内的质子转运到溶酶体,使其pH值维持在4.0~5.5[9~11].如果溶酶体内原有的酸性环境被破坏,如在细胞凋亡过程中溶酶体内质子成分丢失,pH值增大,其功能就会紊乱,从而引起一系列常见的疾病,如癌症、休克、类风湿性关节炎、阿尔茨海默氏症和其他神经退行性疾病等[12~16].因此,实时监测生命系统溶酶体内pH的变化在生物成像和疾病诊断方面具有重要意义.
目前,检测溶酶体内pH变化的方法主要有酸碱指示剂滴定法、核磁共振法、微电极法和荧光探针检测法[17~20].其中,荧光探针检测法由于具备操作简单、灵敏度高、选择性好、分辨率高等优势,能够实现无损伤实时检测[21~24]而备受人们青睐.随着激光共聚焦显微镜分辨率的提高和荧光探针分子设计理念的成熟,众多用于细胞成像的溶酶体pH荧光探针被报道,部分已经实现了商业化.这些探针的开发与利用能帮助人们更深入地洞察复杂的亚细胞结构和行为,更好地了解与pH相关的生理和病理过程[25, 26].
荧光探针的作用机理一般分为:光诱导电子转移(PET)、分子内电荷转移(ICT)、荧光共振能量转移(FRET)、激发态分子内质子转移(ESIPT)等.目前,已报道的溶酶体pH荧光探针大多是通过酸性环境下结构或光谱发生的相应变化实现对pH的监测.本文主要从荧光探针的分子设计和识别机理等方面,对近几年文献报道的溶酶体pH荧光探针的相关研究进行概述,同时,对其发展趋势和应用前景进行展望.
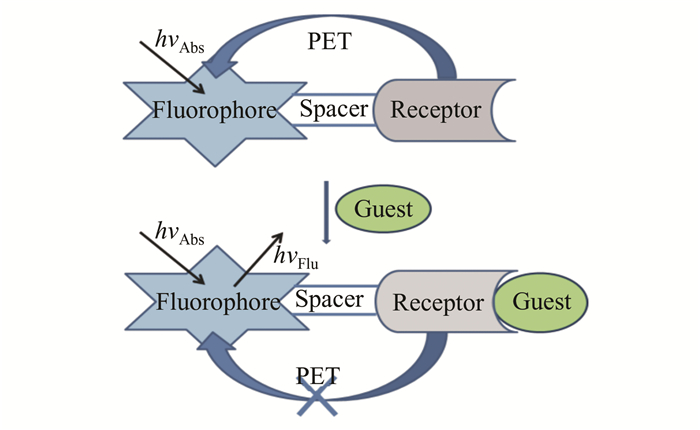
1 基于PET的溶酶体pH荧光探针PET是设计荧光探针的一个重要原理.基于此原理的探针是由荧光基团-桥连基团-识别基团组成,其中,识别基团与发光基团以非共轭的形式相连,在与靶向物发生作用后,PET效应受到抑制,荧光开始显现(如图 1所示).目前,已报道的溶酶体pH荧光探针大多含氨基侧链,故PET类型居多.
|
| 图 1 PET类荧光探针的检测机理 Figure 1 The detection mechanism of PET fluorescent probe |
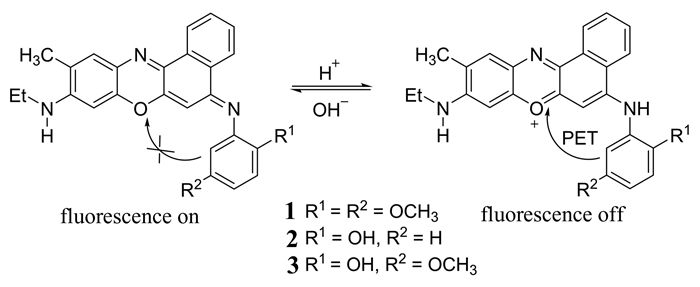
Zhan等[27]合成了3种靶向溶酶体的pH荧光探针1,2,3 (如图 2所示).这3种探针均是以苯并吩噁嗪为母体,分别将2, 5-二甲氧苯基、2-羟苯基、2-羟基-5-甲氧苯基连接到苯并吩噁嗪5位的N原子上,在中性或碱性环境下,电中性的苯并吩噁嗪不足以使电子转移到与其相连的芳基上,但是在酸性条件下,苯并吩噁嗪上的氧原子会质子化,导致电子从芳基转移到缺电子的母体上,即发生PET过程,从而荧光淬灭.探针1在正常细胞和癌细胞中均能发射,不能用来区分这两种细胞,探针2和3均只能在正常细胞溶酶体内发射,因此可以用来区分正常细胞和癌细胞.
|
| 图 2 探针1,2,3对H+的检测机理 Figure 2 The detection mechanism of probes 1, 2, and 3 to H+ |
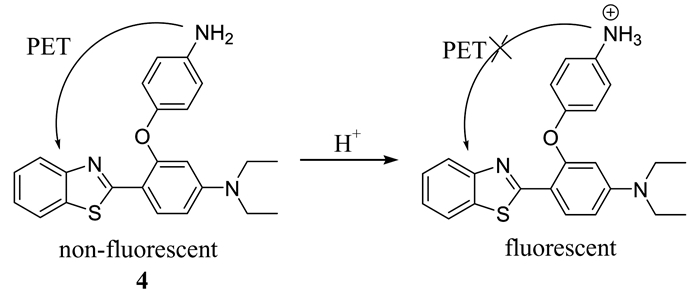
Ma等[28]基于苯并噻唑衍生物,设计合成了一种新颖的溶酶体pH荧光探针4 (如图 3所示).富电子的氨基基团被引入该探针中,通过增强的PET过程,有效地淬灭了苯并噻唑荧光团的荧光,在酸性介质中,氨基中的N原子质子化导致增强的PET过程被中断,从而荧光团的发射恢复,荧光显现.该探针pKa为4.23,对酸性pH响应快, 能成功地用于HeLa细胞中成像,选择性地标记溶酶体,监测其内pH的变化.
|
| 图 3 探针4对H+的响应机理 Figure 3 The response mechanism of probe 4 to H+ |
Vegesna等[29]设计了4种近红外溶酶体pH荧光探针5,6,7,8 (如图 4所示).这4种探针在中性或碱性条件下不发光,在酸性条件下,H+诱导罗丹明螺环内酰胺结构打开,胺上N原子质子化,探针发出荧光,溶液从无色变为粉色.pH从7.4降至4.2的过程中,4种探针的荧光急剧增强200多倍,且膜通透性好,对H+灵敏度高,能够选择性标记溶酶体,为生理和病理过程中监测溶酶体pH变化提供了潜在的非损害性的方法.
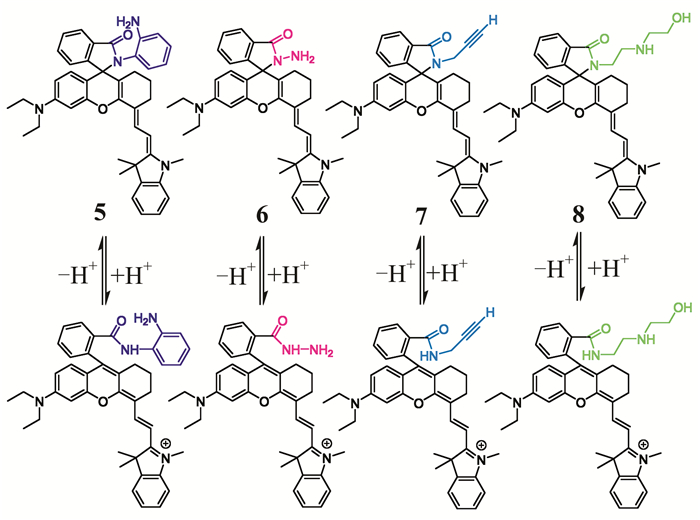
|
| 图 4 探针5,6,7,8对H+的识别机理 Figure 4 The recognition mechanism of probes 5, 6, 7, and 8 to H+ |
同样地,Li等[30]以罗丹明为骨架,引入2, 6-二氨基吡啶官能团,用柔性Schiff碱或刚性萘啶保护氨基侧链,设计合成了3种靶向溶酶体的pH荧光探针9,10,11 (如图 5所示).当pH值从7降至3.67时,探针9的荧光信号约增加62倍,探针10和11的荧光信号均增加约76倍.在弱酸性环境下,3种探针均对H+的选择性好、灵敏度高,且可逆性好,细胞毒性低,有助于了解相关细胞和器官的溶酶体内酸性环境的重要生物学意义,并为肿瘤细胞可视化提供了一种新的手段.
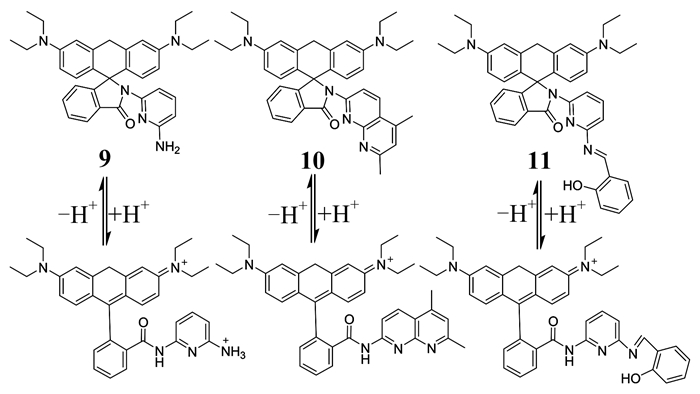
|
| 图 5 探针9,10,11与H+的相互作用 Figure 5 The interaction of probes 9, 10, and 11 with H+ |
2015年,Zhang等[31]设计合成了3种BODIPY类溶酶体pH荧光探针12,13,14 (如图 6所示).这3种探针都连接有吗啉基团,但根据轨道理论计算,吗啉基团既不作为电子给体,也不作为电子受体,因此,在中性或碱性条件下,不能通过PET过程淬灭BODIPY的荧光,在酸性环境下,吗啉上的叔胺质子化,通过d-PET导致BODIPY染料荧光淬灭.3种探针光稳定性好,均能在活细胞溶酶体内实施pH荧光成像,而且探针14还为监测活细胞内pH的变化提供了一种潜在的非损坏性的方法.
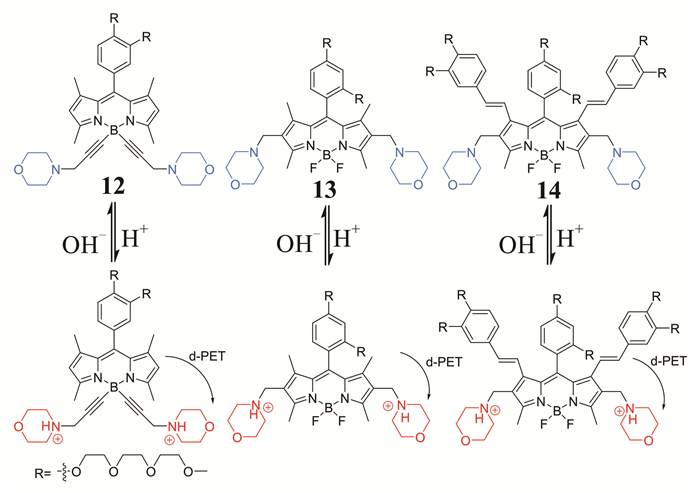
|
| 图 6 探针12,13,14对pH的检测机理 Figure 6 The detection mechanism of probes 12, 13, and 14 to pH |
Fu等[32]报道了作用于人类肝癌细胞的半乳糖萘酰亚胺哌嗪pH荧光探针15 (如图 7所示).在该探针中,哌嗪作为质子位点,萘酰亚胺作为荧光团,半乳糖基为糖蛋白受体提供了选择性识别位点,促进了它特定的内吞作用,进而靶向性追踪溶酶体.在中性pH条件下,探针15的荧光强度较弱,酸性条件下,由于哌嗪质子化,PET过程被阻断,萘酰亚胺的强发射得以恢复.该探针的半乳糖基化能够促进其选择性地积累在溶酶体内,同时还可降低萘酰亚胺染料对人类肝癌细胞的毒性.
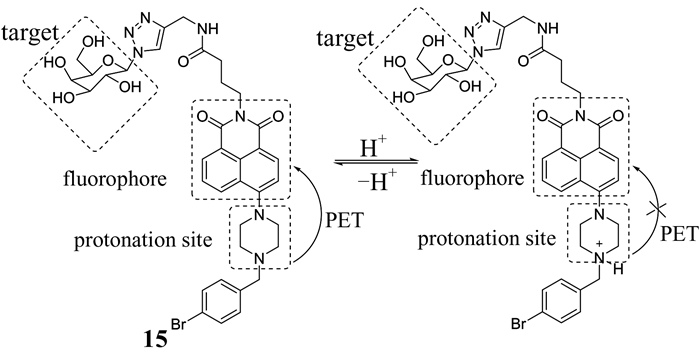
|
| 图 7 探针15的结构及其对H+的检测 Figure 7 The structure of probe 15 and its detection to H+ |
溶酶体内pH与癌细胞转移和凋亡密切相关,因此,检测癌细胞内溶酶体的pH变化有助于分析肿瘤的发展和深入研究溶酶体在肿瘤入侵与转移过程中的作用.
Xiong等[33]设计合成了一种水溶性pH激活近红外荧光探针16 (如图 8所示).该探针以氟硼二吡咯为母体,连接聚乙二醇基团,故水溶性好.在酸性条件下,探针被激活,发出高强度荧光,定位到溶酶体,能在癌细胞内成像,产生的信号强度比正常细胞高,而且在不同肿瘤细胞内产生的信号也不同,因此,探针16能用来检测不同的癌细胞.
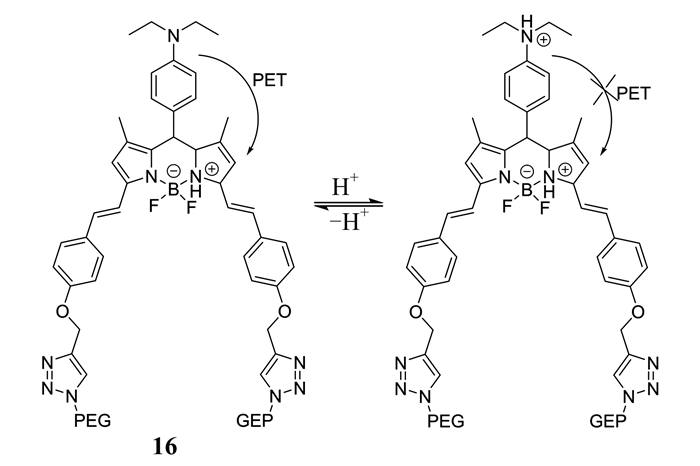
|
| 图 8 探针16对H+的响应机理 Figure 8 The response mechanism of probe 16 to H+ |
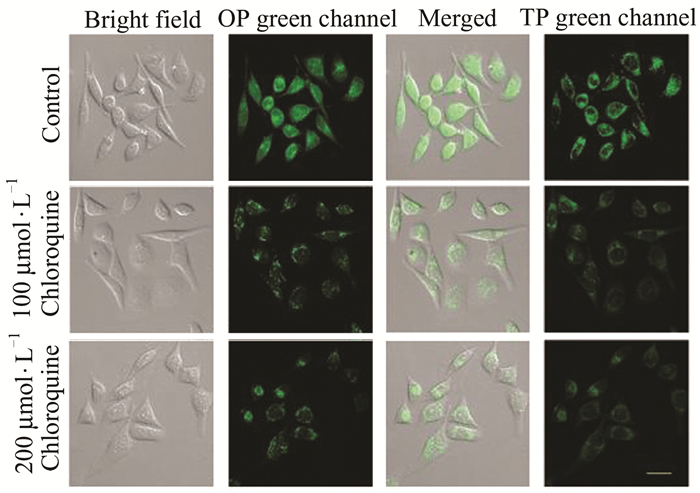
2017年,Dong等[34]首次报道了一种新颖的靶向肿瘤溶酶体的pH双光子荧光探针17 (如图 9所示).该探针中,生物素作为靶向肿瘤的基团被引入,吗啉为溶酶体靶向性基团和H+响应位点,通过PET过程来控制荧光强度.在生物素的作用下,探针对癌细胞的溶酶体pH表现出很强的单光子和双光子荧光响应,而对正常细胞则显示很弱的荧光.此外,这种探针还能在氯喹引起溶酶体pH改变的活细胞内成像(如图 10所示)[34],其设计策略也为发展更多用于生命体系中其他生物分子检测的靶向肿瘤溶酶体的双光子荧光探针提供了可能.
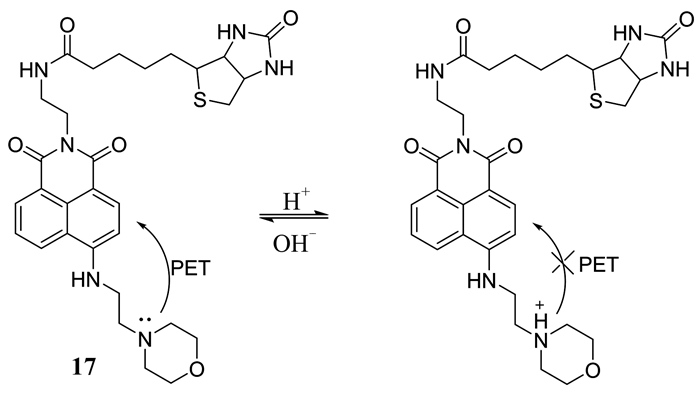
|
| 图 9 探针17的结构及其与H+的相互作用 Figure 9 The structure of probe 17 and its reaction with H+ |
Shi等[35]报道了一种靶向溶酶体的pH荧光探针18 (如图 11所示).这种探针基于不同的pH环境来区分肿瘤组织和正常组织.同样地,由于PET效应的存在,该探针在中性或碱性条件下不发光,在酸性环境下,PET过程被阻断,荧光得以恢复.探针可成功地在小鼠的肿瘤组织内成像,同时,也能定位到溶酶体内,监测其内pH的变化.
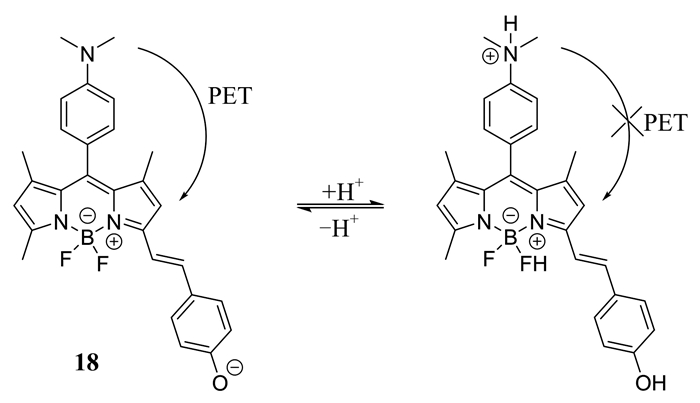
|
| 图 11 探针18的结构及其对H+的响应机理 Figure 11 The structure of probe 18 and its response mechanism to H+ |
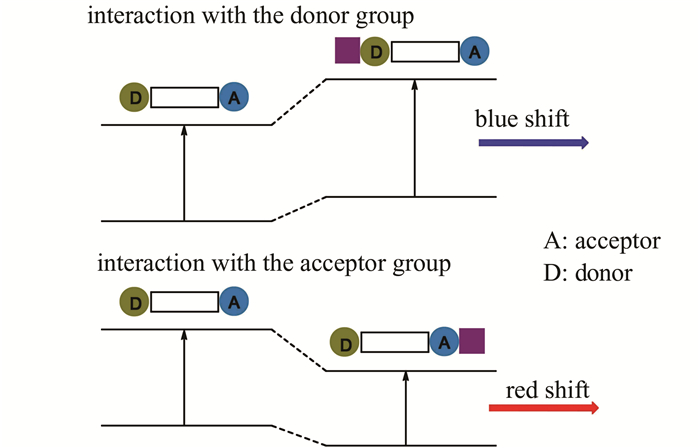
给体和受体通过π键相连所形成的结构常用来构建ICT荧光探针.这类探针在光激发下,给体的部分电子向受体转移,形成推-拉电子共轭体系,分子内偶极矩随之改变,相应的光谱发生红移或蓝移,斯托克斯位移(Stokes shift)增大(如图 12所示)[36].
Zhang等[37]以噻唑为母体,设计合成了一种比率型溶酶体pH荧光探针19 (如图 13所示).该探针由肉桂醛和苯并噻唑通过乙烯桥连而成,前者作为电子给体,后者为电子受体.随着pH逐渐降低,探针的吸收谱和发射谱均表现出明显的蓝移,探针荧光减弱,溶液由黄色变为无色.这是由于二甲氨基质子化,N原子的给电子能力降低,使给体和受体之间的ICT效应降低导致的.荧光强度比F425 nm/F595 nm实现了pH变化的比率型监测.探针与溶酶体染料的Pearson相关系数为0.93,表明其对溶酶体有很好的靶向性能,能成功地用来监测大肠杆菌细胞中强酸性的变化及其他活细胞内pH的波动.
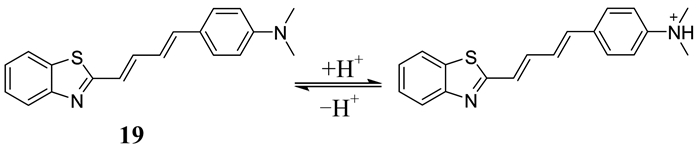
|
| 图 13 探针19的结构及其对H+的响应机理 Figure 13 The structure of probe 19 and its response mechanism to H+ |
Lin等[38]也合成了一种比率型近红外溶酶体pH荧光探针20 (如图 14所示).该探针以香豆素为给体,吲哚为受体,给体和受体之间通过丙烯桥连.探针对H+的识别是通过吲哚质子化和去质子化过程来完成的,加入酸时,探针表现出明显的pH红移特性.这是由于酸性环境下,香豆素和半花菁部分存在ICT过程.探针斯托克斯位移大,膜通透性好,光稳定性高,对H+的检测具有可逆性,能够成为细胞内pH的成像试剂,监测溶酶体内pH的变化.同时,探针在V79细胞和KB癌细胞中的成像实验数据表明其可以用来区分正常细胞和癌细胞.
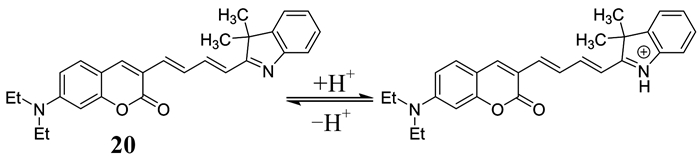
|
| 图 14 探针20对H+的识别机理 Figure 14 The recognition mechanism of probe 20 to H+ |
在细胞成像中,单激发波长能使数据采集在很大程度上得到简化,同时,也能降低多激发波长带来的背景噪音,减少细胞内组织的自发荧光.2017年,Lin等[39]报道了一种基于喹啉发色团单激发波长的比率型溶酶体pH荧光探针21 (如图 15所示).在酸性介质中,这种探针的喹啉环会质子化,诱导ICT过程增强,导致吸收波长红移104 nm,发射波长红移54 nm,从而构成比率型pH荧光传感器.以溶酶体荧光染料Lyso Tracker Deep Red作为参比,该探针染色溶酶体得到的Pearson相关系数为0.97(如图 16所示)[39],能够实现溶酶体pH成像的高效性与选择性.
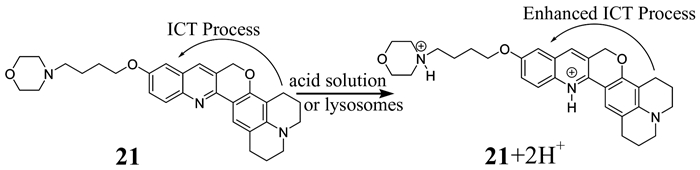
|
| 图 15 探针21对H+的响应机制 Figure 15 The response mechanism of probe 21 to H+ |
Chen等[40]基于A-π-D-π-A体系,通过一步固相反应合成了两种新颖的双光子激发溶酶体pH荧光探针22,23 (如图 17所示).作者在设计的小分子末端连接两个吡啶基团(受体)来提高探针对pH的灵敏性,同时,苯环上连接两个乙氧基(给体)以增加细胞膜的通透性和吡啶基团的碱性.在pH逐渐降低的过程中,这两种探针的吸收光谱和发射光谱均表现出明显的红移.这是由于在该过程中,吡啶基团质子化增强了乙氧基和吡啶之间的ICT效应.在弱酸性环境下,这两种探针灵敏性高,红移大,量子产率高,双光子横截面积大,抗干扰能力强,细胞毒性低,能用于细胞成像,监测溶酶体pH的动态变化.
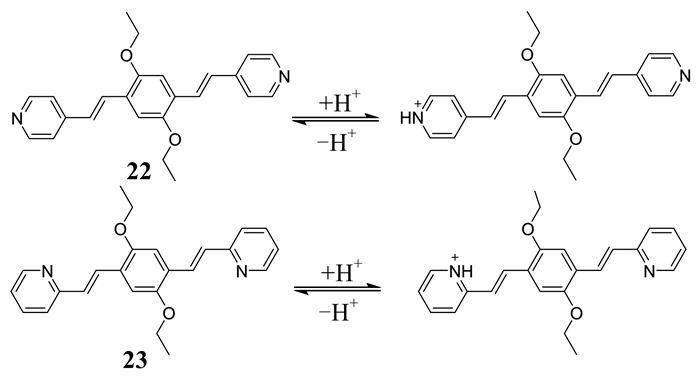
|
| 图 17 探针22,23和H+的相互作用 Figure 17 The interaction of probes 22, and 23 with H+ |
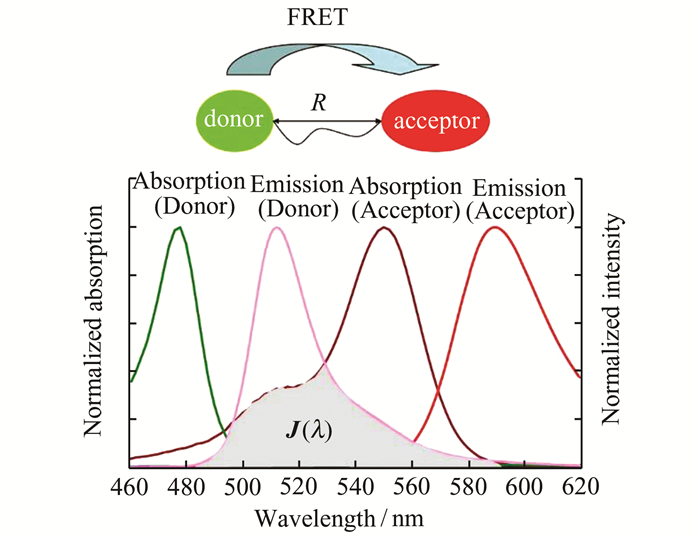
FRET是在设计比率型荧光探针过程中普遍采用的策略.在FRET体系中,给体和受体通过非共轭基团相连,同时,给体的发射谱和受体的吸收谱也必须存在大量的重叠,以实现能量的有效转移(如图 18所示)[41~43].
Fan等[44]基于FRET策略,设计合成了一种萘酰亚胺-罗丹明比率型溶酶体pH荧光探针24 (如图 19所示).该探针中,萘酰亚胺为给体,罗丹明为受体,1, 2, 3-三唑为桥联基团.在pH从6.2到2.0的变化过程中,580 nm处的发射强度和F580 nm/F538 nm逐渐增强,荧光强度和颜色的改变能够通过裸眼识别.室温下,这种探针可以选择性地监测甲醇/HEPES(一种氢离子缓冲剂)溶液中pH的变化,同时,也可通过在细胞内直接成像,研究生物环境及其溶酶体内H+的重要作用.
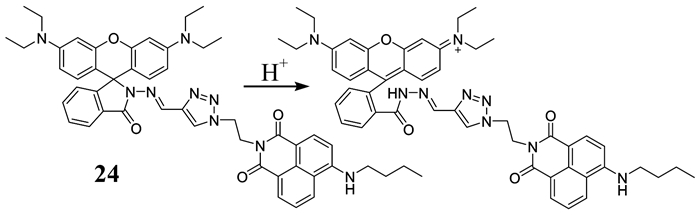
|
| 图 19 探针24的结构及其对H+的检测 Figure 19 The structure of probe 24 and its detection mechanism to H+ |
Song等[45]设计合成了一种水溶性比率型溶酶体pH荧光探针25 (如图 20所示).该探针中,吲哚吡啶季铵盐荧光团作为FRET给体,罗丹明基团作为受体,在pH 5.4~6.6的范围内,随着pH微小的改变,荧光强度比F424 nm/F581 nm会发生很大程度的改变,其pKa为6.30.这是首次报道的吲哚吡啶季铵盐作为FRET给体,用来检测弱酸性pH的荧光探针.这种探针水溶性好,对H+响应快,选择性高,细胞毒性低,能够可逆性检测HeLa细胞溶酶体内pH的变化.
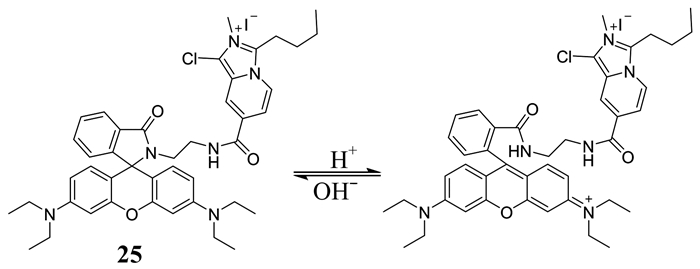
|
| 图 20 探针25的结构及其对pH的响应机理 Figure 20 The structure of probe 25 and its response mechanism to pH |
Zhou等[46]报道了一种用于检测活细胞和组织溶酶体内pH变化的比率型双光子荧光探针26 (如图 21所示).该探针是由D-π-A结构的萘酰亚胺双光子荧光团(给体)和罗丹明(受体)通过一个柔性的哌啶基团相连构成.在pH值从7.0到3.0变化时,探针溶液颜色从绿色变为红色,能够通过裸眼识别.这种探针容易制备,溶酶体靶向性能高,分辨率高,细胞毒性低,能够在活细胞和完整组织溶酶体内,深入180 μm处进行双通道成像.
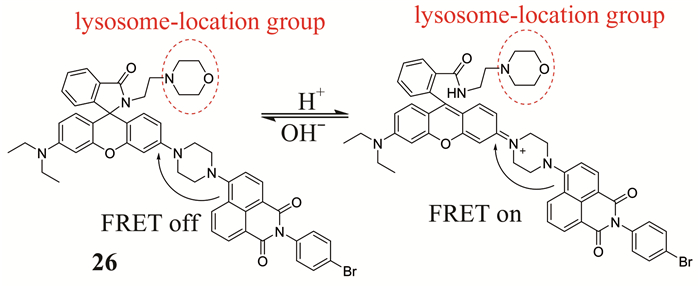
|
| 图 21 探针26对pH的识别机理 Figure 21 The recognition mechanism of probe 26 to pH |
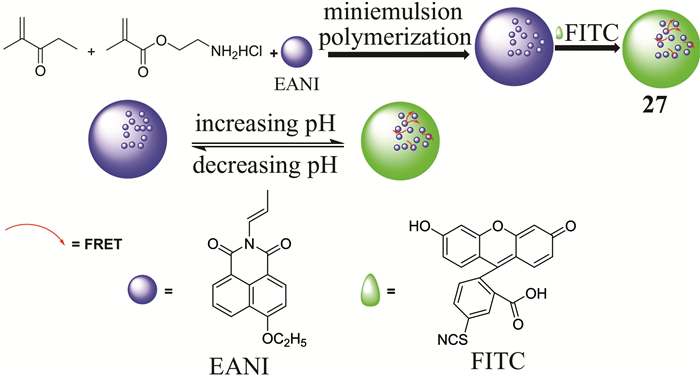
目前,一些基于FRET的比率型溶酶体pH荧光传感器已经被报道,但是,这些传感器都是小分子,水溶性差,在水中易聚集,大多数只能在有机溶剂或水和有机溶剂的混合体系中发挥作用.2016年,Chen等[47]设计了一种靶向溶酶体的比率型荧光聚合物纳米颗粒pH传感器27 (如图 22所示).这种传感器是通过细乳液聚合和表面改性技术合成.在这个体系中,4-乙氧基-9-烯丙基-1, 8-萘酰亚胺(EANI)作为给体,异硫氰酸荧光素(FITC)作为受体,共同构成FRET体系.随着pH改变,传感器表面的FITC部分结构和光谱会发生变化,导致对pH的比率型荧光响应.探针在水中分散性好,对pH可逆性传感,细胞膜通透性好,能实现细胞内溶酶体pH变化可视化.
近年来,ESIPT逐渐成为设计荧光探针和光电材料的机制之一.这类探针的分子内既存在酸性位点,也存在碱性位点,在光激发后,酸性基团的质子向碱性基团转移,即发生ESIPT过程,其一般机理图见文献[36].具备ESIPT特性的荧光探针具有双发射波长,斯托克斯位移大的优点,能够免受其他荧光材料的干扰[48~50].
追踪溶酶体pH的动态变化,有助于我们更好地了解溶酶体相关功能及研究与溶酶体pH异常相关的病理过程.2015年,Wang等[51]报道了一种靶向溶酶体的比率型pH荧光探针28 (如图 23所示).这种探针是由吗啉基团、黄原胶衍生物和邻羟基苯并噁唑基团组合而成,吗啉基团作为溶酶体的靶向基团,黄原胶衍生物则通过环的开闭对pH进行响应,而邻羟基苯并噁唑则控制pH调控的ESIPT过程.这种设计使得该探针在pH 4.0~6.3的范围内实现对pH的比率型响应.同时,这种探针容易合成,光稳定性高,对细胞毒性低,在生物体系中能追踪溶酶体pH的动态变化.
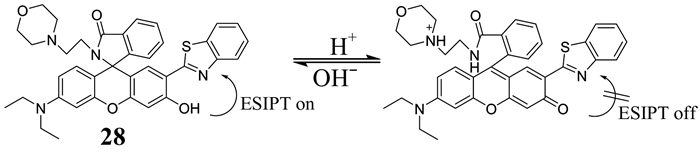
|
| 图 23 探针28的结构及其与H+的相互作用 Figure 23 The structure of probe 28 and its reaction to H+ |
Dahal等[52]将ESIPT机制应用到苯并噻唑鎓盐衍生的花菁染料中,设计合成了一种近红外靶向溶酶体的pH荧光探针29 (如图 24所示).该探针在碱性溶液中由于酚醛基团去质子化而不发光,而在酸性溶液中高度发射荧光,这种发射由ESIPT控制.这种探针的pKa为5.72,细胞毒性低,能靶向定位到溶酶体内,不会造成碱化效应,在活细胞体内成像具有重要的优势.
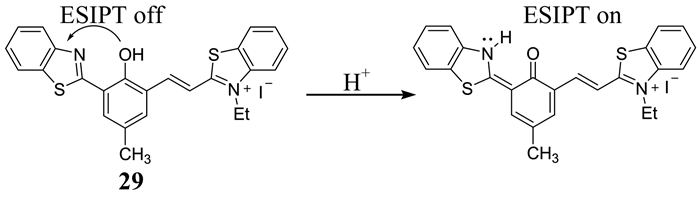
|
| 图 24 探针29对H+的识别机理 Figure 24 The recognition mechanism of probe 29 to H+ |
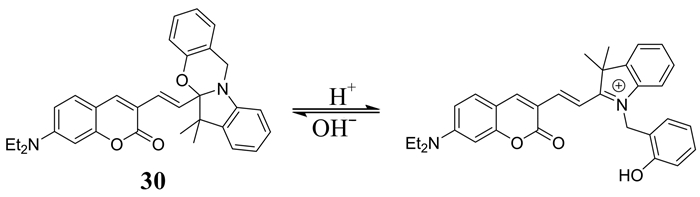
You等[53]设计合成了一种比色和比率型的pH荧光探针30 (如图 25所示).该探针是由香豆素荧光团和氮、氧双取代的缩醛胺醚通过碳碳双键相连构成,在酸性条件下,缩醛胺醚被裂解,释放出吲哚正离子,在中性或碱性条件下,亲核性的游离酚羟基又会环化回到初始的氮、氧双取代的缩醛胺醚的状态.该探针正是通过这种机制来实现对pH的高选择性、快速响应,其pKa为5.7,可用于HK-1细胞成像,实现其pH改变的可视化,同时也能检测由氯喹引起该细胞溶酶体pH增加的变化.
|
| 图 25 探针30对pH的响应机理 Figure 25 The response mechanism of probe 30 to pH |
扭曲的分子内电荷转移(TICT)是ICT中的一种特殊情况,与ICT不同的是,这类探针的电子给体与荧光团之间通过可旋转的单键相连,荧光团受到光激发时,电子给体与芳环的共平面体系被破坏,电子完全被转移.具有这种特性的荧光探针背景信号弱,有利于荧光“off-on”的响应,实现高的检测灵敏度.
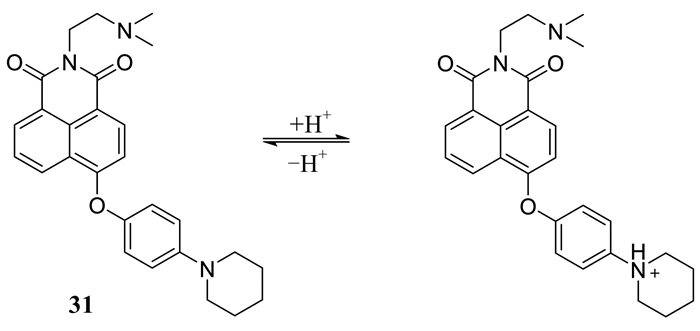
Yu等[54]报道了一种新颖的溶酶体pH荧光探针31 (如图 26所示).作者将给电子能力强和可接受质子的1-哌啶取代基引入到4-苯氧基-1, 8-萘酰亚胺骨架的苯单元上,使得该探针具有TICT特性,同时,将2-甲氨基乙基和酰亚胺基的N原子相连,以提高探针的水溶性.该探针pKa值为5.32,细胞毒性低,对pH的改变表现出可逆的“on-off”型响应,共定位实验表明,该探针能够积累在HeLa细胞的溶酶体内,实现活细胞溶酶体pH变化的可视化.
|
| 图 26 探针31对H+的识别机理 Figure 26 The recognition mechanism of probe 31 to H+ |
跨键能量转移(TBET)也是设计比率型荧光探针常用的策略,与FRET不同的是,TBET体系中,给体和受体是通过电子共轭键直接相连,能量就能从给体转移到受体,并不需要给体的发射谱和受体的吸收谱大量重叠,所以FRET体系对荧光团的选择更为灵活[55~57].
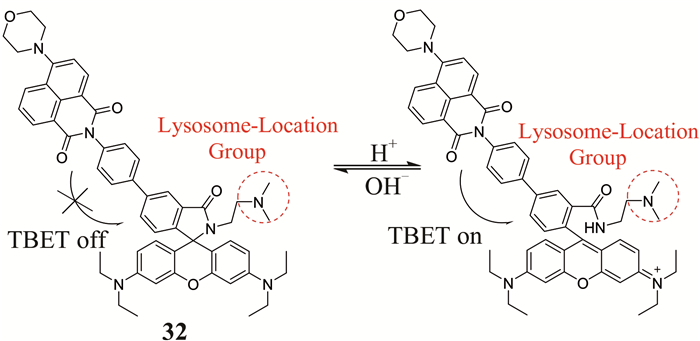
2016年,Zhou等[58]基于TBET策略设计了一种双光子比率型荧光探针32 (如图 27所示),该探针中,D-π-A结构的萘酰亚胺双光子荧光团(给体)和罗丹明(受体)直接相连,二甲氨基是溶酶体的靶向识别基团.pH值从7.4降至3.0时,溶液颜色由绿色变为红色,利用F515 nm/F595 nm实现了pH成像的比率型检测.该探针具备很强的溶酶体靶向性能,高分辨率和低细胞毒性,能用来监测活的动物细胞和植物细胞内pH的变化.
|
| 图 27 探针32的结构及其对pH的响应机理 Figure 27 The structure of probe 32 and its response mechanism to pH |
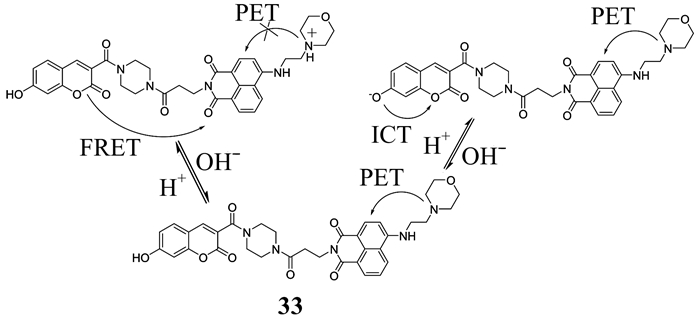
Dong等[59]报道了一种具备双重位点控制的靶向溶酶体的pH荧光探针33 (如图 28所示).该探针分别以香豆素和萘酰亚胺作为供体和受体构建FRET平台.在pH为3.0的体系中,吗啉和萘酰亚胺之间的PET过程被抑制,随着pH增加,PET效应逐渐被激活,羟基和香豆素之间的ICT效应随之增加.因此该探针对pH的响应集ICT,PET和FRET于一体.该探针对pH的响应高度灵敏,对活细胞没有明显的毒性,能成功地用来对溶酶体pH进行荧光成像,而且能实现对氯喹引起的活细胞内pH改变的可视化监测,这为实际监测病原细胞内pH的变化提供了理论基础.
|
| 图 28 探针33对pH的响应机理 Figure 28 The response mechanism of probe 33 to pH |
2017年,Luo等[60]设计了一种靶向溶酶体的可逆的比率型双光子pH荧光探针34 (如图 29所示).该探针由短波长的香豆素荧光团(给体)和萘酰亚胺荧光团(受体)两部分组成,而吗啉则作为溶酶体靶向性基团被引入.在该探针中,香豆素部分的吸收谱和萘酰亚胺的发射谱有很大程度的重叠,而且两种荧光团之间的距离较短,因此,探针表现为FRET过程.酸性(pH 2.0~6.0)环境下,探针在461 nm处表现出较弱的蓝光,555 nm处显示出更强的绿光,这是由FRET过程引起的.在pH为6.5到11.0的范围内,ICT相对FRET来说占主导地位,所以蓝光发射急剧增强,绿光发射缓慢增强.该探针在HeLa细胞中成像实验的Pearson相关系数为0.96,表明探针能够选择性地分布在活细胞的溶酶体内.
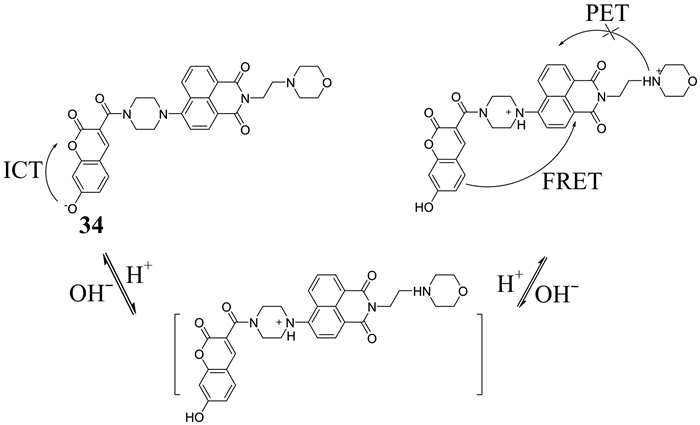
|
| 图 29 探针34的结构及其对pH的检测机理 Figure 29 The structure to probe 34 and its detection mechanism to pH |
大多数商业可用的荧光探针的荧光团是有机染料,在中性pH环境下,这类探针水溶性和光稳定性差,容易光漂白,且存在自发荧光.和有机染料相比,钌复合物表现出很好的溶解性、光稳定性和大的斯托克斯位移[61~64].2017年,Yu等[65]报道了一种钌复合物类溶酶体pH荧光探针35 (如图 30所示).这种探针在中性或碱性条件下不发光,在酸性条件下,能发出很强的近红外荧光,从酸性到碱性的过程中,咪唑上的NH去质子化,形成N-,增加了其给电子能力,因此,金属中心的电荷密度增加,二价钌d轨道和主要配体π轨道间的能级差降低,从而导致金属和配体的电荷转移(MLCT)峰发生明显的红移,溶液呈现不同的颜色,表现出pH独立的荧光“turn-on”特性.这种探针斯托克斯位移大,背景荧光低,稳定性和溶解性好,使其在病理过程中,成为一种很好的溶酶体pH传感器.
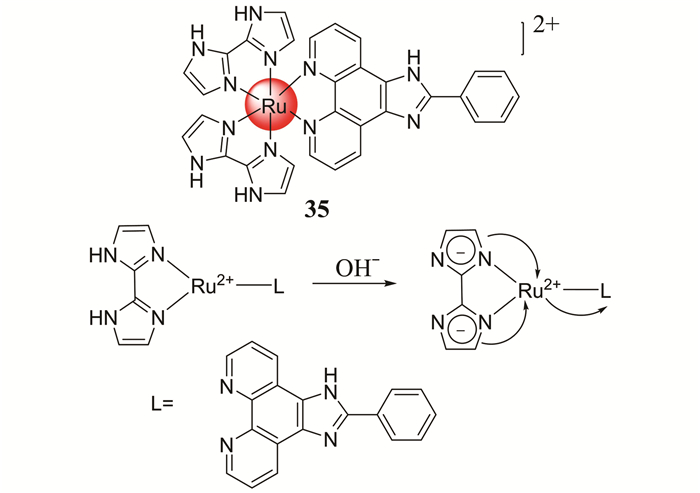
|
| 图 30 探针35的结构及其对pH的响应机理 Figure 30 The structure of probe 35 and its response mechanism to pH |
溶酶体的功能与其内部酸性环境密切相关,若酸性体系被破坏,其内部各种酶就不能有效地发挥作用,由此会引发许多疾病.因此,设计合成靶向溶酶体的pH荧光探针,实时监测溶酶体内的pH变化对研究细胞功能和胞内疾病有着重要的意义.
本文从荧光探针的识别机理,对近几年报道的PET,ICT,FRET,ESIPT等类型的溶酶体pH荧光探针进行了归纳与总结.综合目前文献报道,不同类型的溶酶体pH探针各有优缺点:1)PET类荧光探针能够实现荧光的开关,有效地避免生物体内背景荧光的干扰,但这类探针多为胺类小分子,定位在溶酶体内,容易引起碱化效应,因此,在未来的探针设计中,应该寻找合适的识别基团和定位基团,避免由于探针的积累,造成溶酶体pH的变化;2)ICT类荧光探针与待测物作用后,溶液和荧光颜色会发生明显的变化,能通过裸眼识别,但这类探针存在自身背景荧光干扰;3)FRET和TBET类荧光探针多为比率型荧光探针,能通过两个发射带的自身矫正,避免由于探针浓度、仪器灵敏性和环境等因素造成的数据不真实性等问题,可对溶酶体pH进行定量和精确的检测[66~68],但FRET类探针在荧光团的选择方面受到了一定的限制;4)ESIPT类荧光探针斯托克斯位移大,可避免自吸收带来的荧光猝灭,有效地提高其对溶酶体pH的检测精度.
近年来出现的近红外双光子溶酶体pH荧光探针具备更高的分辨率、更长的观察时间、更深的穿透深度和更低的细胞毒性,能够消除组织自身荧光背景的干扰.因此,发展比率型、双光子、近红外荧光探针是未来溶酶体pH荧光探针领域的重要研究方向.在探针的设计上,应尽量选择发射波长长的荧光团,最好是近红外发射(如罗丹明),也可以将具有双光子特性的荧光团(如萘酰亚胺)与长发射波长的荧光团进行组合,实现pH的比率型响应.由于多数探针会在生命体系中应用,所以应具备一定的水溶性.在探针设计时,可以连接一些水溶性基团(如聚乙二醇,半乳糖基)或用一些斯托克斯位移大、光稳定性好的过渡金属复合物来代替有机染料以提高探针的水溶性.
未来该领域的研究将着眼于开发一系列用于实时、动态、原位和高选择性检测溶酶体pH的荧光探针,为溶酶体内酸性环境异常所引起的各种病理的研究提供平台.
| [1] |
LI Y H, WANG Y J, YANG S, et al. Hemicyanine-based high resolution ratiometric near-infrared fluore- scent probe for monitoring pH changes in vivo[J]. Analytical Chemistry, 2015, 87(4): 2495-2503 . DOI:10.1021/ac5045498 |
| [2] |
YAO Q H, LU S S, LIN F Y, et al. A co-precipita- tion strategy for making a ratiometric pH nanosensor for intracellular imaging[J]. Sensors & Actuators B Chemical, 2017, 250: 484-490 . DOI:10.1016/j.snb.2017.04.097 |
| [3] |
FAN L, FU Y J, LIU Q L, et al. Novel far-visible and near-infrared pH probes based on styrylcyanine for imaging intracellular pH in live cells[J]. Chemical Communications, 2012, 48(91): 11202-11204 . DOI:10.1039/c2cc35363f |
| [4] |
LÜ H S, HUANG S Y, XU Y, et al. A new fluore- scent pH probe for imaging lysosomes in living cells[J]. Bioorganic & Medicinal Chemistry Letters, 2014, 24(2): 535-538 . DOI:10.1016/j.bmcl.2013.12.025 |
| [5] |
CHAO J B, WANG H J, ZHANG Y B, et al. A single pH fluorescent probe for biosensing and imaging of extreme acidity and extreme alkalinity[J]. Analytica Chimica Acta, 2017, 975: 52-60 . DOI:10.1016/j.aca.2017.04.020 |
| [6] |
ZHU W W, CHAI X Y, WANG B G, et al. Spiroboronate Si-rhodamine as a near-infrared probe for imaging lysosomes based on the reversible ring-opening process[J]. Chemical Communications, 2015, 51(47): 9608-9611 . DOI:10.1039/c5cc02496j |
| [7] |
LOU X D, ZHANG M S, ZHAO Z J, et al. A photostable AIE fluorogen for lysosome-targetable imaging of living cells[J]. Journal of Materials Chemistry B, 2016, 4(32): 5412-5417 . DOI:10.1039/c6tb01293k |
| [8] |
李美含, 王宇童, 刘广建, 等. 溶酶体荧光探针研究新进展[J]. 有机化学, 2017, 37(2): 356-374. LI M H, WANG Y T, LIU G J, et al. Recent progress on lysosome-targetable fluorescent probes[J]. Chinese Journal of Organic Chemistry, 2017, 37(2): 356-374 (Ch). DOI:10.6023/cjoc201607004 |
| [9] |
TAMURA A, NISHIDA K, YUI N. Lysosomal pH-inducible supramolecular dissociation of polyrotaxanes possessing acid-labile N-triphenylmethyl end groups and their therapeutic potential for Niemann-Pick type C disease[J]. Science & Technology of Advanced Materials, 2016, 17(1): 361-374 . DOI:10.1080/14686996.2016.1200948 |
| [10] |
GUHA S, COFFEY E E, LU W N, et al. Approaches for detecting lysosomal alkalinization and impaired degradation in fresh and cultured RPE cells: Evidence for a role in retinal degenerations[J]. Experimental Eye Research, 2014, 126(3): 68-76 . DOI:10.1016/j.exer.2014.05.013 |
| [11] |
GOWRISHANKAR S, FERGUSON S M. Lysosomes relax in the cellular suburbs[J]. Journal of Cell Biology, 2016, 212(6): 617-619 . DOI:10.1083/jcb.201602082 |
| [12] |
NIU G L, ZHANG P P, LIU W M, et al. Near-infrared probe based on rhodamine derivative for highly sensitive and selective lysosomal pH tracking[J]. Analytical Chemistry, 2017, 89(3): 1922-1929 . DOI:10.1021/acs.analchem.6b04417 |
| [13] |
SHEN S L, CHEN X P, ZHANG X F, et al. A rhodamine B-based lysosomal pH probe[J]. Journal of Materials Chemistry B, 2015, 3(5): 919-925 . DOI:10.1039/c4tb01763c |
| [14] |
LEE M H, HAN J H, LEE J H, et al. Two-color probe to monitor a wide range of pH values in cells[J]. Angewandte Chemie, 2013, 52(24): 6206-6209 . DOI:10.1002/anie.201301894 |
| [15] |
QIU K Q, HUANG H Y, LIU B Y, et al. Long-term lysosomes tracking with a water-soluble two-photon phosphorescent iridium(Ⅲ) complex[J]. Acs Applied Materials & Interfaces, 2016, 8(20): 12702-12710 . DOI:10.1021/acsami.6b03422 |
| [16] |
LI B, GE G B, WEN L L, et al. A lysosomal probe for monitoring of pH in living cells and ovarian tumour[J]. Dyes & Pigments, 2017, 139: 318-325 . DOI:10.1016/j.dyepig.2016.12.043 |
| [17] |
张思佳, 段小红, 焦阳, 等. 细胞内pH值测定方法的研究进展[J]. 现代生物医学进展, 2014, 14(21): 4164-4167. ZHANG S J, DUAN X H, JIAO Y, et al. Recent progress in the measurements of intracellular pH[J]. Progress in Modern Biomedicine, 2014, 14(21): 4164-4167 (Ch). DOI:10.13241/j.cnki.pmb.2014.21.044 |
| [18] |
GE Y Q, LIU A K, DONG J, et al. A simple pH fluorescent probe based on new fluorophore indolizine for imaging of living cells[J]. Sensors & Actuators B Chemical, 2017, 247: 46-52 . DOI:10.1016/j.snb.2017.02.157 |
| [19] |
TANG B, LIU X, XU K H, et al. A dual near-infrared pH fluorescent probe and its application in imaging of HepG2 cells[J]. Chemical Communications, 2007, 41(36): 3726-3728 . DOI:10.1039/b707173f |
| [20] |
ZHAN Y H, LIU W, SUN R, et al. Diaminodi- benzoxanthenium based near infrared pH probes with lower pKa[J]. Dyes & Pigments, 2016, 132: 223-229 . DOI:10.1016/j.dyepig.2016.05.002 |
| [21] |
ZHANG X, SONG G J, CAO X J, et al. A new fluorescent pH probe for acidic conditions[J]. RSC Advances, 2015, 5(109): 89827-89832 . DOI:10.1039/c5ra14174e |
| [22] |
DAI Z R, GE G B, FENG L, et al. A highly selective ratiometric two-photon fluorescent probe for human cytochrome P450 1A[J]. Journal of the American Chemical Society, 2015, 137(45): 14488-14495 . DOI:10.1021/jacs.5b09854 |
| [23] |
LI Z, ZHAO J L, WU Y T, et al. Highly selective recognition of Al3+ and I- ions using a bi-functional fluorescent probe[J]. Organic & Biomolecular Chemistry, 2017, 15(40): 8627-8633 . DOI:10.1039/c7ob02301d |
| [24] |
DOU K, CHEN G, YU F B, et al. Bright and sensitive ratiometric fluorescent probe enabling endogenous FA imaging and mechanistic exploration of indirect oxidative damage due to FA in various living systems[J]. Chemical Science, 2017, 8(11): 7851-7861 . DOI:10.1039/c7sc03719h |
| [25] |
LIN N, CHEN X H, YAN S H, et al. An aggregation-induced emission based pH-sensitive fluorescent probe for intracellular acidity sensing[J]. RSC Advances, 2016, 6(30): 25416-25419 . DOI:10.1039/c6ra01167e |
| [26] |
ZHANG Y N, GUO S, CHENG S B, et al. Label-free silicon nanodots featured ratiometric fluorescent aptasensor for lysosomal imaging and pH measurement[J]. Biosensors & Bioelectronics, 2017, 94: 478-484 . DOI:10.1016/j.bios.2017.03.041 |
| [27] |
ZHAN Y H, LI X J, SUN R, et al. Distinguishing normal cells from cancer cells via lysosome-targetable pH biomarkers with benzo[J]. Analytica Chimica Acta, 2016, 933: 175-181 . DOI:10.1016/j.aca.2016.05.019 |
| [28] |
MA Q J, LI X, FENG S X, et al. A novel acidic pH fluorescent probe based on a benzothiazole derivative[J]. Spectrochimica Acta Part A Molecular & Biomolecular Spectroscopy, 2017, 177: 6-13 . DOI:10.1016/j.saa.2017.01.024 |
| [29] |
VEGESNA G K, JANJANAM J, BI J H, et al. pH-activatable near-infrared fluorescent probes for detection of lysosomal pH inside living cells[J]. Journal of Materials Chemistry B, 2014, 2(28): 4500-4508 . DOI:10.1039/c4tb00475b |
| [30] |
LI H M, WANG C L, SHE M Y, et al. Two rhodamine lactam modulated lysosome-targetable fluorescence probes for sensitively and selectively monitoring subcellular organelle pH change[J]. Analytica Chimica Acta, 2015, 900: 97-102 . DOI:10.1016/j.aca.2015.10.021 |
| [31] |
ZHANG J T, YANG M, MAZI W, et al. Unusual fluorescent responses of morpholine-functionalized fluorescent probes to pH via manipulation of BODIPY's HOMO and LUMO energy orbitals for intracellular pH detection[J]. Acs Sensors, 2015, 1(2): 158-165 . DOI:10.1021/acssensors.5b00065 |
| [32] |
FU Y X, ZHANG J J, WANG H, et al. Intracellular pH sensing and targeted imaging of lysosome by a galactosyl naphthalimide-piperazine probe[J]. Dyes & Pigments, 2016, 133: 372-379 . DOI:10.1016/j.dyepig.2016.06.022 |
| [33] |
XIONG H, KOS P, YAN Y F, et al. Activatable water-soluble probes enhance tumor imaging by responding to dysregulated pH and exhibiting high tumor-to-liver fluorescence emission contrast[J]. Bioconjugate Chemistry, 2016, 27(7): 1737-1744 . DOI:10.1021/acs.bioconjchem.6b00242 |
| [34] |
DONG B L, SONG X Z, KONG X Q, et al. A tumor-targeting and lysosome-specific two-photon fluorescent probe for imaging pH changes in living cells[J]. Journal of Materials Chemistry B, 2017, 5(5): 988-995 . DOI:10.1039/c6tb02957d |
| [35] |
SHI R G, HUANG L, DUAN X X, et al. Selective imaging of cancer cells with a pH-activatable lysosome-targeting fluorescent probe[J]. Analytica Chimica Acta, 2017, 988: 66-73 . DOI:10.1016/j.aca.2017.07.055 |
| [36] |
LEE M H, KIM J S, SESSLER J L. Small molecule-based ratiometric fluorescence probes for cations, anions, and biomolecules[J]. Chemical Society Reviews, 2015, 44(13): 4185-4191 . DOI:10.1039/c4cs00280f |
| [37] |
ZHANG W J, FAN L, LI Z B, et al. Thiazole-based ratiometric fluorescence pH probe with large Stokes shift for intracellular imaging[J]. Sensors & Actuators B Chemical, 2016, 233: 566-573 . DOI:10.1016/J.snb.2016.04.122 |
| [38] |
LIN X D, XU Y, SUN R, et al. A coumarin-indole-based near-infrared ratiometric pH probe for intracellular fluorescence imaging[J]. Analyst, 2013, 138(21): 6542-6550 . DOI:10.1039/c3an01033c |
| [39] |
LIN X J, SU Y A, TIAN H H, et al. A ratiometric fluorescent probe for lysosomal pH measurement and imaging in living cells using single-wavelength excitation[J]. Analytical Chemistry, 2017, 89(13): 7038-7045 . DOI:10.1021/acs.analchem.7b00754 |
| [40] |
CHEN S Y, ZHAO M, SU J, et al. Two novel two-photon excited fluorescent pH probes based on the A-π-D-π-A system for intracellular pH mapping[J]. Dyes & Pigments, 2016, 136: 807-816 . DOI:10.1016/j.dyepig.2016.09.020 |
| [41] |
WANG W J, LI Y M, REDDY P V, et al. A facile coordination-assisted method to fabricate a FRET-based fluorescent probe for ratiometric analysis with improved selectivity[J]. Sensors & Actuators B Chemical, 2017, 252: 159-164 . DOI:10.1016/j.snb.2017.06.010 |
| [42] |
YUAN L, LIN W Y, ZHENG K B, et al. FRET-based small-molecule fluorescent probes: Rational design and bioimaging applications[J]. Accounts of Chemical Research, 2013, 46(7): 1462-1473 . DOI:10.1021/ar300273v |
| [43] |
ZHENG X L, JI R X, CAO X Q, et al. FRET-based ratiometric fluorescent probe for Cu2+ with a new indolizine fluorophore[J]. Analytica Chimica Acta, 2017, 978: 48-54 . DOI:10.1016/j.aca.2017.04.048 |
| [44] |
FAN J L, LIN C Y, LI H L, et al. A ratiometric lysosomal pH chemosensor based on fluorescence resonance energy transfer[J]. Dyes & Pigments, 2013, 99(3): 620-626 . DOI:10.1016/j.dyepig.2013.06.032 |
| [45] |
SONG G J, BAI S Y, LUO J, et al. A novel water-soluble ratiometric fluorescent probe based on FRET for sensing lysosomal pH[J]. Journal of Fluorescence, 2016, 26(6): 2079-2086 . DOI:10.1007/s10895-016-1902-4 |
| [46] |
ZHOU L Y, LU D Q, WANG Q Q, et al. An efficient two-photon ratiometric fluorescent probe plat form for dual-channel imaging of lysosomes in living cells and tissues[J]. Sensors & Actuators B Chemical, 2017, 238: 274-280 . DOI:10.1016/j.snb.2016.07.075 |
| [47] |
CHEN J, TANG Y, WANG H, et al. Design and fabrication of fluorescence resonance energy transfer-mediated fluorescent polymer nanoparticles for ratiometric sensing of lysosomal pH[J]. Journal of Colloid & Interface Science, 2016, 484: 298-307 . DOI:10.1016/j.jcis.2016.09.009 |
| [48] |
JIANG N, YANG C L, DONG X W, et al. An ESIPT fluorescent probe sensitive to protein α-helix structures[J]. Organic & Biomolecular Chemistry, 2014, 12(28): 5250-5259 . DOI:10.1039/c4ob00405a |
| [49] |
LÜ H M, YUAN D H, LIU W P, et al. A highly selective ESIPT-based fluorescent probe for cysteine sensing and its bioimaging application in living cells[J]. Sensors & Actuators B Chemical, 2016, 233: 173-179 . DOI:10.1016/j.snb.2016.04.054 |
| [50] |
GU B, HUANG L Y, MI N X, et al. An ESIPT-based fluorescent probe for highly selective and ratiometric detection of mercury(Ⅱ) in solution and in cells[J]. Analyst, 2015, 140(8): 2778-2784 . DOI:10.1039/c5an00273g |
| [51] |
WANG Q Q, ZHOU L Y, QIU L P, et al. An efficient ratiometric fluorescent probe for tracking dynamic changes in lysosomal pH[J]. Analyst, 2015, 140(16): 5563-5569 . DOI:10.1039/c5an00683j |
| [52] |
DAHAL D, MCDONALD L, BI X M, et al. An NIR-emitting lysosome-targeting probe with large Stokes shift via coupling cyanine and excited-state intramolecular proton transfer[J]. Chemical Communications, 2017, 53(26): 3697-3700 . DOI:10.1039/c7cc00700k |
| [53] |
YOU Q H, LEE Y M, CHAN W H, et al. A colorimetric and ratiometric fluorescent pH probe based on ring opening/closing approach and its applications in monitoring cellular pH change[J]. Rsc Advances, 2015, 5(6): 4099-4102 . DOI:10.1039/c4ra13445a |
| [54] |
YU F, WANG Y, ZHU W C, et al. A novel fluore- scent pH probe with valuable pKa based on a twisted intramolecular charge transfer mechanism, and its applications in cell imaging[J]. Rsc Advances, 2014, 4(69): 36849-36853 . DOI:10.1039/c4ra06834c |
| [55] |
ZHOU L Y, ZHANG X B, WANG Q Q, et al. Molecular engineering of a TBET-based two-photon fluorescent probe for ratiometric imaging of living cells and tissues[J]. Journal of the American Chemical Society, 2014, 136(28): 9838-9841 . DOI:10.1021/ja504015t |
| [56] |
ZHANG Y R, MENG N, MIAO J Y, et al. A ratiometric fluorescent probe based on a through-bond energy transfer (TBET) system for imaging HOCl in living cells[J]. Chemistry-A European Journal, 2015, 21(52): 19058-19063 . DOI:10.1002/chem.201503500 |
| [57] |
SHEN S L, NING J Y, ZHANG X F, et al. Through-bond energy transfer-based ratiometric fluorescent probe for the imaging of HOCl in living cells[J]. Sensors & Actuators B Chemical, 2017, 244: 907-913 . DOI:10.1016/j.snb.2017.01.073 |
| [58] |
ZHOU L Y, LIU Y C, HU S Q, et al. A new ratiometric two-photon fluorescent probe for imaging of lysosomes in living cells and tissues[J]. Tetrahedron, 2016, 72(31): 4637-4642 . DOI:10.1016/j.tet.2016.06.038 |
| [59] |
DONG B L, SONG X Z, WANG C, et al. Dual site-controlled and lysosome-targeted intramolecular charge transfer-photoinduced electron transfer-fluorescence resonance energy transfer fluorescent probe for monitoring pH changes in living cells[J]. Analytical Chemistry, 2016, 88(7): 4085-4091 . DOI:10.1021/acs.analchem.6b00422 |
| [60] |
LUO W F, JIANG H E, TANG X L, et al. A rever- sible ratiometric two-photon lysosome-targeted probe for real-time monitoring of pH changes in living cells[J]. Journal of Materials Chemistry B, 2017, 5(24): 4768-4773 . DOI:10.1039/c7tb00838d |
| [61] |
DING Y, WU Q, ZHENG K D, et al. Imaging of the nuclei of living tumor cells by novel ruthenium(Ⅱ) complexes coordinated with 6-chloro-5-hydroxylpyrido[J]. Rsc Advances, 2015, 5(78): 63330-63337 . DOI:10.1039/c5ra11127g |
| [62] |
WANG H, TIAN X H, GUAN L J, et al. Targeting mitochondrial DNA with a two-photon active Ru(Ⅱ) phenanthroline derivative[J]. Journal of Materials Chemistry B, 2016, 4(17): 2895-2902 . DOI:10.1039/c6tb00433d |
| [63] |
CAO X H, WANG Q, LI J, et al. Gold nanoparticles functionalized with Ru(Ⅱ)bipyridyl labeled DNA as a luminescent probe for the sensitive determination of DNase Ⅰ[J]. Microchimica Acta, 2017, 184(9): 3273-3279 . DOI:10.1007/s00604-017-2330-0 |
| [64] |
ZHANG W Z, ZHANG F Y, WANG Y L, et al. Red-emitting ruthenium(Ⅱ) and iridium(Ⅲ) complexes as phosphorescent probes for methylglyoxal in vitro and in vivo[J]. Inorganic Chemistry, 2017, 56(3): 1309-1318 . DOI:10.1021/acs.inorgchem.6b02443 |
| [65] |
YU H J, HAO Z F, PENG H L, et al. Near-infrared lysosome pH tracker and naked-eye colorimetric nucleic acids sensor based on ruthenium complexes [Ru(bim)2 (dppz)]2+ and [Ru(bim)2 (pip)]2+[J]. Sensors & Actuators B Chemical, 2017, 252: 313-321 . DOI:10.1016/j.snb.2017.05.164 |
| [66] |
AICH K, GOSWAMI S, DAS S, et al. Cd2+ triggered the FRET "ON": A new molecular switch for the ratiometric detection of Cd2+ with live-cell imaging and bound X-ray structure[J]. Inorganic Chemistry, 2015, 54(15): 7309-7315 . DOI:10.1021/acs.inorgchem.5b00784 |
| [67] |
WU Y X, ZHANG X B, LI J B, et al. Bispyrene-fluorescein hybrid based FRET cassette: A convenient platform toward ratiometric time-resolved probe for bioanalytical applications[J]. Analytical Chemistry, 2014, 86(20): 10389-10396 . DOI:10.1021/ac502863m |
| [68] |
LI S, ZHANG D, XIE X Y, et al. A novel solvent-dependently bifunctional NIR absorptive and fluorescent ratiometric probe for detecting Fe3+/Cu2+ and its application in bioimaging[J]. Sensors & Actuators B Chemical, 2016, 224: 661-667 . DOI:10.1016/j.snb.2015.10.086 |
 2018, Vol. 64
2018, Vol. 64