文章信息
- 黄应平, 付桂荣, 吴斌, 方艳芬
- HUANG Yingping, FU Guirong, WU Bin, FANG Yanfen
- 泡沫镍负载Fe2O3/α-MoO3可见光催化降解水中铜绿微囊藻
- Visible-Light Photocatalytic Removal of Microcystis aeruginosa in Water by Fe2O3/α-MoO3 Loaded on Foam Nickel
- 武汉大学学报(理学版), 2019, 65(1): 49-56
- Journal of Wuhan University(Natural Science Edition), 2019, 65(1): 49-56
- http://dx.doi.org/10.14188/j.1671-8836.2019.01.007
-
文章历史
- 收稿日期:2018-08-03

2. 三峡大学 三峡地区地质灾害与生态环境湖北省协同创新中心,湖北 宜昌 443002;
3. 三峡大学 三峡库区生态环境教育部工程研究中心,湖北 宜昌 443002
2. Collaborative Innovation Center for Geo-Hazards and Eco-Environment in Three Gorges Area, Hubei Province, China Three Gorges University, Yichang 443002, Hubei, China;
3. Engineering Research Center of Eco-Environment in Three Gorges Reservoir Region, Ministry of Education, China Three Gorges University, Yichang 443002, Hubei, China
近年来,由湖泊富营养化导致的大面积水质污染已成为制约我国可持续发展的重大环境问题。铜绿微囊藻(Microcystis aeruginosa,MA)是淡水蓝藻水华中的优势藻种,适应能力强、繁殖速度快,大范围爆发时会快速消耗水体中的溶解氧,不利于其他水生生物的生存;同时,其细胞质和分泌物可能含有微囊藻毒素等有毒物质,严重威胁水生生物和人类饮用水的安全。对已发生藻华的湖泊或静态河流,常使用的除藻技术以物理法[1]和生物法[2]为主,如加入絮凝剂沉降藻类、投放滤食性浮游动物直接清除和消化藻类等。传统的化学法由于去除效率低、易引发二次污染、材料难以回收利用等原因,目前尚未有去除实际水体中MA的应用实例。近年来,以高级氧化技术为主的新兴化学技术已广泛地用于治理水中有毒有机污染物,一些可见光催化材料,如Cu2O-蒙脱土[3]、AgBiO3[4]和g-C3N4[5]等被发现能高效去除水中的MA。光催化除藻的原理主要是基于光催化过程中产生的活性氧物种(reactive oxygen species,ROS)能够直接氧化并去除藻细胞及其分泌的毒素。但常见的光催化剂通常为粉末状固体,实际应用中存在难以回收再利用的问题。因此,对光催化降解MA的循环体系的探索,具有重要的研究意义。
α-MoO3为宽带隙(~3.3 eV)半导体,可见光利用率低,光生电子-空穴复合率高,限制了其实际应用。Fe2O3具有带隙宽度较窄(~2.2 eV),稳定及无毒[6]的特点,又能与其他半导体光催化材料构成异质结[7],降低光生电子-空穴的复合率。将α-MoO3与Fe2O3复合,可以使各催化剂在性质上得到互补,提高光生电子和空穴的寿命,增加对可见光的利用率[8]。泡沫镍具有机械性能好、孔隙率高、稳定性高等特点[9],作为光催化剂载体在异相光催化领域有着广泛的应用,如将TiO2[10]或纳米ZnO-SnO2[11]负载到泡沫镍表面能够提高材料的光催化效果。
基于此,本研究拟采用共沉积法制备不同负载比的Fe2O3/α-MoO3复合材料,并以MA为污染物模型,在可见光(λ≥420 nm)照射下以叶绿素a、丙二醛以及可溶性蛋白含量的变化评估该复合材料对藻类生长和藻细胞活性的影响。将Fe2O3/α-MoO3复合材料负载到泡沫镍上,考察其在实际水体中对藻类的降解效果以及可回收利用性能,有望为光催化治理水华污染领域提供新思路。
1 实验部分 1.1 主要试剂及仪器试剂:钼酸铵((NH4)6Mo7O24·4H2O)、硝酸(HNO3)、硫酸亚铁(FeSO4·7H2O)、乙醇(EtOH)、氯化硝基四氮唑蓝(NBT)均为国产分析纯试剂;泡沫镍(苏州乐翔电子科技有限公司);MA(FACHB-930,中国科学院水生生物研究所淡水藻种库);实验用水为去离子水。
仪器:JXF12-100型均相反应器(松岭化工设备有限公司);D-max2500型X射线衍射仪(XRD,扫描速度6°/min,扫描范围10°~90°,Rigaku公司);F-4500型荧光分光光度计(Hitachi公司);XL30扫描电子显微镜(SEM,样品表面喷碳处理,FEI公司)及电子能谱仪(EDS);Zetasizer Nano ZS90型纳米粒度Zeta电位分析仪(马尔文公司);U-3010型紫外-可见分光光度计(Hitachi公司);光源采用400 W金卤灯(滤去λ < 420 nm的紫外线,南京建成胥江机电厂);Nicolet iS50型傅里叶转换红外光谱仪(FT-IR,Thermo Fisher公司)。
1.2 实验方法 1.2.1 Fe2O3/α-MoO3的制备参照文献方法[8]合成α-MoO3:称取5.76 g钼酸铵于68 mL水中,缓慢加入12 mL 2.0 mol·L-1 HNO3溶液,混合均匀后转入100 mL反应釜,移至均相反应器中,180 ℃加热12 h,自然冷却至室温。将得到的淡蓝色沉淀物用水和无水乙醇反复洗涤数次,置于烘箱中60 ℃干燥6 h,研磨,得到α-MoO3粉末。
称取5.56 g FeSO4·7H2O于陶瓷坩埚中,置于马弗炉中,450 ℃煅烧2 h,自然冷却至室温,研磨得到砖红色Fe2O3粉末。
按一定质量比称取上述方法制备的Fe2O3和α-MoO3固体粉末,加入到30 mL水中,超声分散50 min,离心。所得沉淀用水与无水乙醇反复洗涤数次,置于烘箱中60 ℃干燥6 h,研磨,得到Fe2O3/α-MoO3复合材料。通过改变两种化合物的质量比mFe2O3/mα-MoO3,获得3种不同配比的复合材料(mFe2O3/mα-MoO3=0.5:100、1:100、3:100),分别记为0.5%Fe2O3/α-MoO3、1.0%Fe2O3/α-MoO3、3.0%Fe2O3/α-MoO3。
1.2.2 泡沫镍负载Fe2O3/α-MoO3的制备泡沫镍使用前,用水和无水乙醇反复洗涤后先置于烘箱中60 ℃干燥2 h,然后于马弗炉中110 ℃煅烧2 h,以去除吸附在表面及孔内的粉状杂质和有机污染物。冷却后,将其剪成10 cm×1 cm的带状,每片平均质量约15 mg。
取4 g制备的1.0%Fe2O3/α-MoO3样品在30 mL水中超声分散10 min,然后均匀地涂布于10 cm×1 cm的带状泡沫镍上,在马弗炉中110 ℃煅烧1 h,取出,自然冷却至室温,用水洗去脱落下来的光催化剂,再于60 ℃下烘干,得到泡沫镍负载Fe2O3/α-MoO3样品。根据泡沫镍负载催化剂前后的质量差,计算得到每片泡沫镍带上催化剂的负载量约为60 mg。
1.3 MA藻悬液的配制参照文献方法[12]配制BG-11培养基,在光照培养箱中进行培养,光照强度为2 000 lx,光暗比12 h:12 h,温度(25±1) ℃。实验所用仪器和配制的液体培养基均经过120 ℃的高温高压灭菌。在超净工作台中接种MA,然后置于光照培养箱中培养。当MA生长至对数期时,离心分离收集藻细胞,弃去上清液,再用水配制成浓度为2.0×106个·mL-1的藻悬液,该浓度接近于水华发生时水体中藻细胞浓度(4.78×106个·mL-1)[13]。
1.4 光催化除藻实验取上述藻悬液加水配制成100 mL吸光度A680 nm≈0.2的藻悬液,滴加1 mol·L-1 NaOH溶液调节pH值为7.5,加入40 mg Fe2O3/α-MoO3催化剂,在光化学反应仪(400 W,金卤灯)中模拟可见光下的除藻实验,间隔1 h取样10 mL进行藻生理指标的测定。同样的反应体系,在黑暗条件下进行对照实验。每个处理设置3个平行实验。
以叶绿素a的去除率表征藻类的去除率。反应结束后的藻液静置30 min,取液面下5 cm处藻悬液3 mL,采用乙醇萃取法[14]测定叶绿素a。具体操作如下:在藻悬液中加入等体积的95%乙醇,4 ℃下静置过夜,5 000 r·min-1离心5 min,取上清液测其665 nm和649 nm两处的吸光度A,按(1)式计算叶绿素a的浓度,按(2)式计算藻类的去除率η [15]:
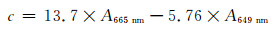
|
(1) |
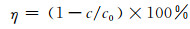
|
(2) |
其中:c0、c(μg·L-1)分别为光催化反应前后MA悬液中叶绿素a的质量浓度。
用稀H2SO4或NaOH溶液调节MA悬液初始pH值分别为4.5、5.5、6.5、7.5、8.5、9.5,分别加入40 mg Fe2O3/α-MoO3催化剂进行光催化实验,考察体系pH值对复合材料除藻效果的影响。在pH 7.5时,考察不同质量配比Fe2O3/α-MoO3 (0、0.5%、1.0%、3.0%)对复合催化剂除藻效果的影响。
1.5 可溶性蛋白、丙二醛以及溶出镍含量的测定在光催化除藻实验中,向初始MA悬液中加入1 mL 0.05 mol·L-1的磷酸盐缓冲液(pH 7.8),利用超声波细胞破碎仪冰浴破碎细胞10 min(工作5 s,间隙20 s),镜检无完整细胞后离心(12 000 r·min-1,10 min),上清液即为粗酶液。可溶性蛋白含量的测定采用考马斯亮蓝法[16],丙二醛含量的测定采用硫代巴比妥酸法[16]。具体测定方法按照南京建成生物工程研究所的蛋白质含量测定试剂盒(A045-2)和丙二醛测定试剂盒(A003-1)的说明书进行。此外,使用火焰原子吸收分光光度法测定上述上清液(5 mL)中溶出的镍含量。
1.6 实际水样的光催化除藻实验取2017年7月份三峡库区香溪河的实际水样,经显微镜观察发现该水样中主要含有MA、小环藻、小球藻等藻类生物,以此作为降解底物,测试泡沫镍负载Fe2O3/α-MoO3对实际水体藻类的去除效果。
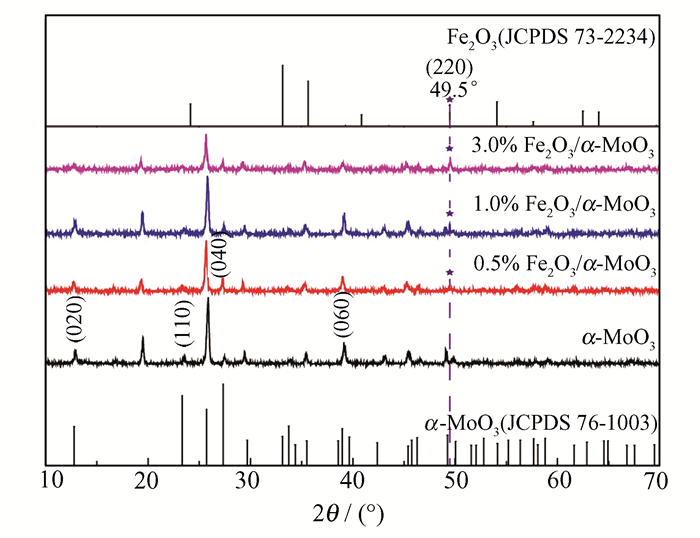
2 结果与讨论 2.1 催化剂的表征 2.1.1 XRD图谱各催化剂的XRD图谱如图 1所示。可知,本文制备的α-MoO3样品的特征衍射峰2θ在13.2°(020),23.4°(110),26.1°(040),40.8°(060)峰位与α-MoO3标准品(JCPDS 76-1003)相对应,表明该样品为正交晶系的α-MoO3[17]。与α-MoO3相比,复合催化剂的图谱中在49.5°(220)处出现微弱的Fe2O3(JCPDS 73-2234)的衍射峰,证实复合物中有Fe2O3的存在。复合催化剂随着Fe2O3用量的改变,部分衍射峰的强度发生了变化,说明了复合催化剂晶体生长具有各向异性。
|
| 图 1 α-MoO3和Fe2O3/α-MoO3催化剂的XRD图谱 Figure 1 XRD patterns of α-MoO3 and Fe2O3/α-MoO3 catalysts |
图 2为α-MoO3与1.0%Fe2O3/α-MoO3的SEM图谱、对应的能谱(EDS)图及面扫元素分布图。由图 2A和图 2B可见,α-MoO3尺寸均匀,表面平整光滑,呈细带状形貌[18],而1.0%Fe2O3/α-MoO3催化剂的形貌与α-MoO3相似,说明负载少量Fe2O3对材料的形貌几乎没有影响。从样品的EDS图谱(插图)可知,α-MoO3样品中仅检出Mo、O两种元素,而1.0%Fe2O3/α-MoO3样品中除Mo、O外还检出了Fe元素。而由图 2C和图 2D也可以观察到,Mo和Fe元素均匀地分布在复合材料中。上述结果表明,Fe2O3已成功地沉积在α-MoO3表面,形成Fe2O3/α-MoO3复合材料。

|
| 图 2 α-MoO3(A)、1.0% Fe2O3/α-MoO3(B)样品的SEM图,对应的EDS图(插图);1.0% Fe2O3/α-MoO3 (B)样品中Mo(C)和Fe(D)的面扫元素分布图 Figure 2 SEM images of α-MoO3 (A), 1.0% Fe2O3/ α-MoO3(B) catalysts (EDS images were inserted), and Mo (C) and Fe(D) surface sweep element distribution map of 1.0% Fe2O3/α-MoO3 |
FT-IR光谱用来表征Fe2O3/α-MoO3催化剂中各组分间的成键情况。如图 3(A)所示,各催化剂均显示有1 430,974,860和498 cm-1的吸收峰,归属为Mo—O键的伸缩振动峰;Fe2O3/α-MoO3催化剂在530 cm-1处吸收峰归属为Fe—O键伸缩振动,但由于Fe2O3复合量较低(质量比 < 3.0%),该峰并不明显;1.0%Fe2O3/α-MoO3在3 330 cm-1处显示有微弱的O—H反对称伸缩振动峰,暗示在此复合比条件下,Fe2O3/α-MoO3之间可能通过形成氢键实现复合。

|
| 图 3 α-MoO3和Fe2O3/α-MoO3催化剂的FT-IR(A)和UV-Vis DRS(B)图谱 Figure 3 FT-IR (A) and UV-Vis DRS(B) spectra of α-MoO3 and Fe2O3/α-MoO3 catalysts |
UV-Vis DRS光谱可用来表征催化剂对光的响应范围。如图 3(B)所示,催化剂对可见光的响应范围随着Fe2O3用量的增大而逐渐向长波方向移动。这是由于Fe2O3本身对可见光具有很强的吸收能力[19],与α-MoO3复合后,随着Fe2O3含量的增加,催化剂对可见光的吸收范围增大,导致其光吸收边缘红移。光催化剂对光吸收范围的扩大有利于提高其可见光利用效率,从而提高其光催化活性。
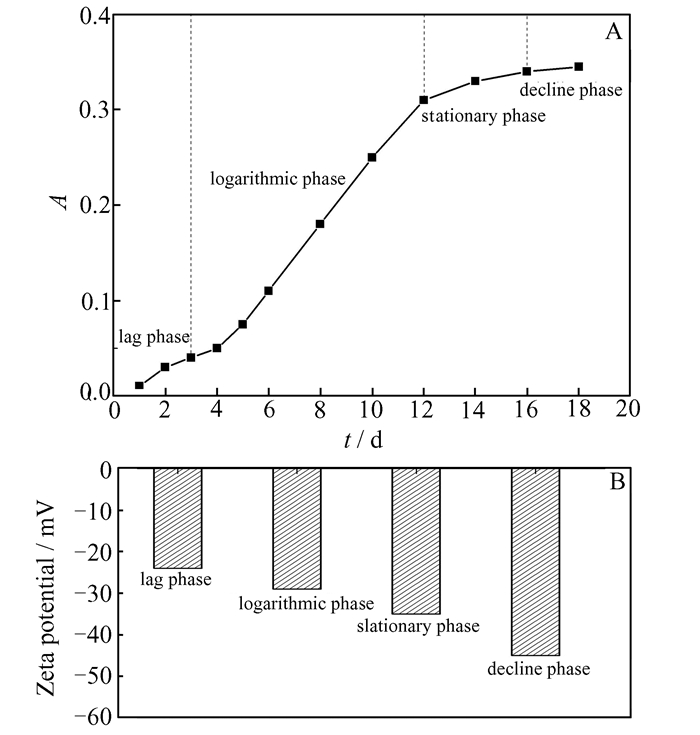
2.2 Fe2O3/α-MoO3复合材料的除藻性能 2.2.1 MA自身生长特性首先研究MA自身的生长特性。如图 4(A)所示,MA细胞在生长前3 d增殖缓慢,为生长迟缓期(lag phase);4~11 d迅速繁殖,并以几何倍数增长,第12 d达到最大值,该阶段为生长对数期(logarithmic phase);12 d后繁殖速度减缓,进入生长稳定期(stationary phase);此后逐渐进入衰亡期(decline phase)。采用Zeta电位仪测定了不同生长阶段MA悬液的Zeta电位值,结果如图 4(B)所示。MA悬液的Zeta电位随着藻细胞的生长而增大,衰亡期初期达到最大值,对数期与衰亡期的Zeta电位值分别为-29、-45 mV,表明MA细胞表面带有负电荷[20]。
|
| 图 4 MA的生长曲线(A)及不同生长阶段的Zeta电位值(B) Figure 4 Growth curve of MA (A) and Zeta potential at different growth stages (B) |
pH值对Fe2O3/α-MoO3催化剂除藻性能有重要影响。pH 4.5~5.5和pH 8.5~9.5范围内,该催化剂对藻细胞均具有较高的去除率。但考虑到pH 6.5~7.5是最适合藻类生长的环境,而藻类爆发时会因藻细胞大量消耗水体中的CO2进行光合作用,导致水体pH值随着CO2的消耗逐渐由弱酸(~6.5)转为弱碱性(~7.5)[21],故后续反应选择pH 7.5。pH 7.5时,MA的去除率达到96%,表明该催化剂具有良好的除藻效果。为了进一步解释不同pH值对光催化除藻效率的影响,测试了分散在水中的1.0%Fe2O3/α-MoO3催化剂的Zeta电位值,如图 5所示。当藻液初始pH < 7.8时,催化剂的Zeta电位值为正值,说明其表面带有正电荷,而此时MA表面带负电荷(图 4B),故催化剂可以在静电引力的作用下,有效地吸附MA,促进MA的光催化降解。
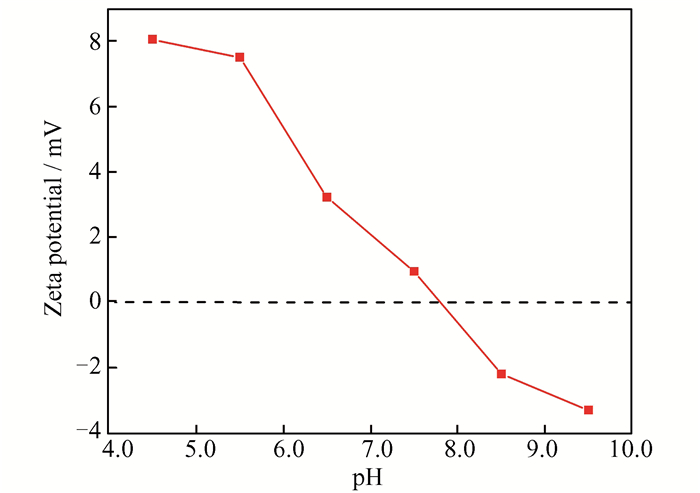
|
| 图 5 不同pH值下1.0%Fe2O3/α-MoO3的Zeta电位 Figure 5 Zeta potential for 1.0% Fe2O3/α-MoO3 at different pH values |
不同配比的Fe2O3/α-MoO3催化剂对MA的去除率如图 6所示。可知,在单纯光照条件下(曲线f)、暗反应条件1.0%Fe2O3/α-MoO3(曲线e)体系中MA的去除率分别为0和11.5%,表明光照无法去除MA,1.0%Fe2O3/α-MoO3在无光照环境下对MA的去除能力较差。在可见光光照5 h后,α-MoO3(曲线a),0.5%Fe2O3/α-MoO3(曲线b),1.0%Fe2O3/α-MoO3(曲线c)、3.0%Fe2O3/α-MoO3(曲线d)对MA去除率分别为48.0%,55.6%、70.4%、47.0%,其中,1.0%Fe2O3/α-MoO3对MA的去除效果最佳。结果表明,复合适量的Fe2O3可增强α-MoO3的光催化活性,但Fe2O3配比过大会掩盖材料表面的部分活性位点,反而不利于反应的进行。因此,本实验选择1.0%Fe2O3/α-MoO3作为光催化剂。
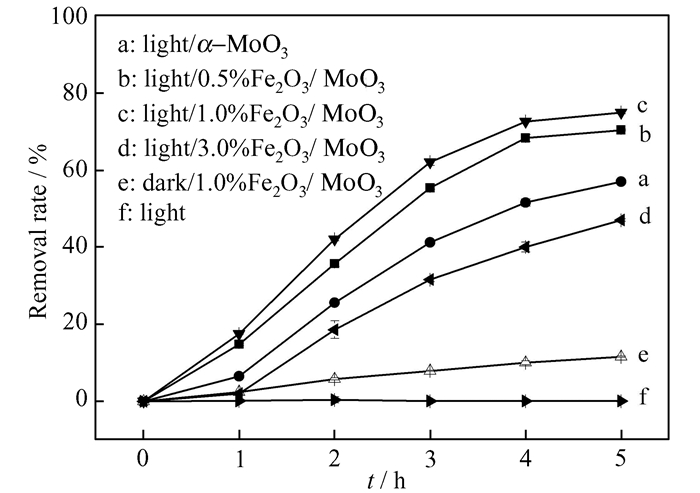
|
| 图 6 各催化剂对MA的去除率 Figure 6 Removal rates of MA with various catalysts |
通过分析除藻过程中可溶性蛋白含量的变化可以考察不同配比Fe2O3/α-MoO3对MA去除效果的影响。如图 7(A)所示,在不添加催化剂条件下,仅通过机械破碎法获得MA内部蛋白含量,为132 mg · L-1 (Blank);当催化剂中Fe2O3质量比由0增加至1.0%时,可溶性蛋白的浓度由104 mg · L-1降低至76 mg · L-1,均低于132 mg · L-1,表明Fe2O3/α-MoO3对MA内部可溶性蛋白有去除作用,且1.0%Fe2O3/α-MoO3的去除效果最佳。而当Fe2O3配比过大时(3.0%Fe2O3/α-MoO3),可溶性蛋白的浓度为112 mg · L-1,去除效果反而减弱。这一结论与Fe2O3/α-MoO3催化剂对MA的去除效率结果一致。
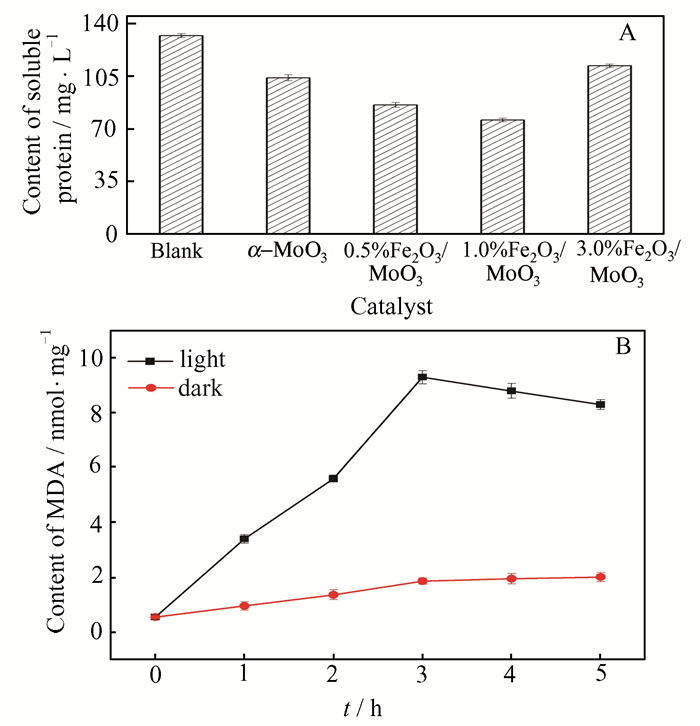
|
| 图 7 光催化除藻过程中可溶性蛋白(A)和丙二醛(B)含量的变化 Figure 7 Changes for the content of soluble protein (A) and malondialdehyde (B) during the photocatalytic process |
当藻细胞被破坏时,细胞膜上的脂质会产生过氧化损伤,终产物丙二醛含量可用于评估其氧化损伤程度。如图 7(B)所示,相较于避光条件,MA在1.0%Fe2O3/α-MoO3的光催化作用下会产生大量丙二醛,其浓度随反应时间延长先升高后降低,反应3 h后达到最大值(9.3 nmol·mg-1)。这是由于藻细胞在催化剂的作用下不断被破坏,导致丙二醛浓度增加,但随着反应的进行,丙二醛被不断累积的活性氧物种进一步氧化,浓度下降。由此可见,复合材料的光催化作用促进了藻细胞的深度降解。
2.3 泡沫镍负载Fe2O3/α-MoO3催化剂的循环使用性能及溶出镍含量测定图 8(A)所示为泡沫镍负载Fe2O3/α-MoO3催化剂除藻的循环使用性能。结果表明,该负载催化剂在循环使用5次后去除率仍能达到82%,具有较好的光催化活性和稳定性。图 8(B)所示为反应5 h内镍的溶出量。结果表明,在该实验过程中,镍溶出量极少,均低于生活饮用水中镍的安全上限0.02 mg · L-1[22],表明使用该复合催化剂除藻不会对水体带来二次污染。
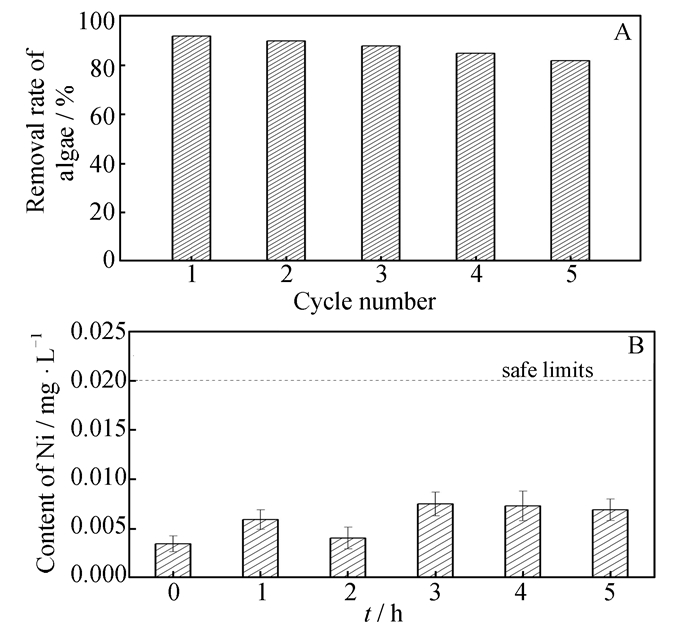
|
| 图 8 泡沫镍负载Fe2O3/α-MoO3催化剂的循环使用性能(A)及溶出镍的含量(B) Figure 8 Cyclic performance of Fe2O3/α-MoO3 loaded on foam nickel (A) and the concentration of Ni dissolved (B) |
可见光照射下,考察了泡沫镍负载1.0%Fe2O3/α-MoO3催化剂的除藻效率,结果如图 9所示。可知,在可见光照条件下,单纯泡沫镍(曲线c),1.0%Fe2O3 /α-MoO3(曲线b)和1.0%Fe2O3/α-MoO3负载泡沫镍(曲线a)对MA去除率分别为55.8%,74.9%和79.5%。结果表明,将Fe2O3/α-MoO3催化剂负载到泡沫镍上可在一定程度上提高其催化活性。
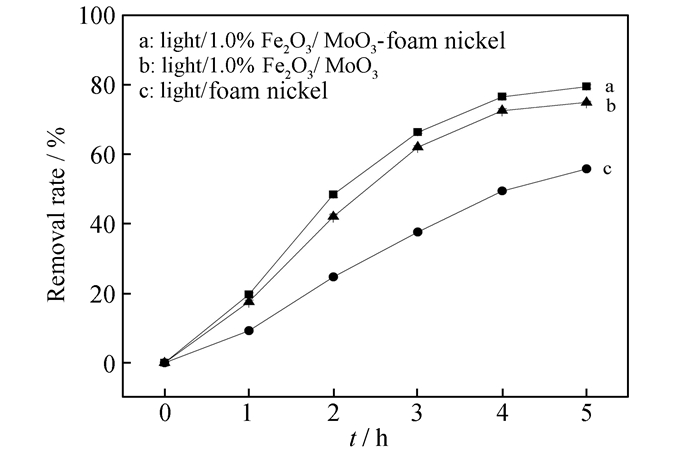
|
| 图 9 泡沫镍负载前后Fe2O3/α-MoO3催化剂的MA去除率 Figure 9 Removal rate of MA by Fe2O3/α-MoO3 before and after loading on foam nickel |
为了检验该负载型催化剂对实际水体中藻类的去除能力,本实验另选小球藻(chlorella)和小环藻(cyclotella)为研究对象,并收集了2017年7月份三峡库区香溪河的实际水样(Xiangxi River),经显微镜观察发现该水样中含有绿藻、小球藻和微囊藻等多种藻类生物。在相同pH值及叶绿素a含量条件下,使用泡沫镍负载1.0%Fe2O3/α-MoO3催化剂分别对上述单一藻溶液和实际水样进行除藻效果检测,结果如图 10。在相同实验条件下,泡沫镍负载1.0%Fe2O3/α-MoO3催化剂对单一藻和实际水样中混合藻的去除率均达到90%以上,表明该负载型催化剂具有应用于实际水体除藻的潜力。
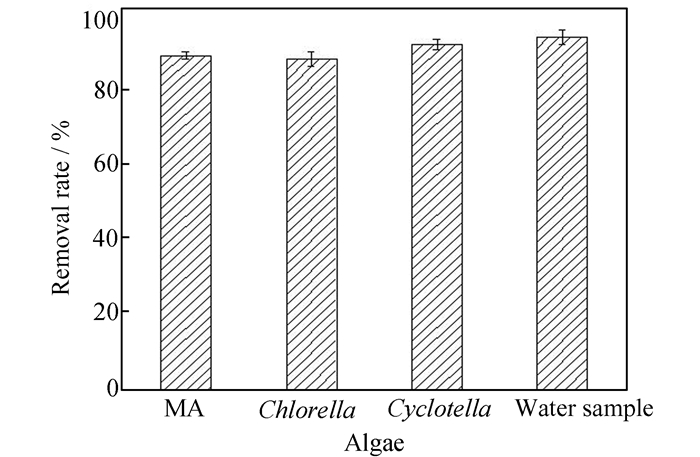
|
| 图 10 泡沫镍负载1.0%Fe2O3/α-MoO3对不同藻液的去除率 Figure 10 Removal rate of different algae liquids by 1.0% Fe2O3/α-MoO3 loaded on foam nickel |
本研究以共沉积法合成了不同配比的Fe2O3/α-MoO3复合光催化剂,以铜绿微囊藻为污染物模型,考察了其在可见光照射下催化除藻的性能。结果表明,mFe2O3/mα-MoO3=1:100的1.0%Fe2O3/α-MoO3催化剂去除效果最佳。在pH 7.5条件下,可见光照射5 h,1.0%Fe2O3/α-MoO3用量为0.4 g/L时,对MA的去除率达96%。将Fe2O3/α-MoO3负载到泡沫镍后,表现出良好的稳定性和循环使用性,对实际水体中的混合藻类的去除率达到90%以上。该研究有望为光催化技术治理水华提供理论依据。
| [1] |
WU Y H, HE J Z, YANG L Z. Evaluating adsorption and biodegradation mechanisms during the removal of Microcystin-RR by periphyton[J]. Environmental Science & Technology, 2010, 44(16): 6319-6324. DOI:10.1021/es903761y |
| [2] |
HYENSTRAND P, ROHRLACK T, BEATTIE K, et al. Laboratory studies of dissolved radiolabelled Microcystin-LR in lake water[J]. Water Research, 2003, 37(14): 3299-3306. DOI:10.1016/S0043-1354(03)00180-5 |
| [3] |
GU N, GAO J L, LI H, et al. Montmorillonite-supported with Cu2O nanoparticles for damage and removal of Microcystis aeruginosa under visible light[J]. Applied Clay Science, 2016, 132-133. DOI:10.1016/j.clay.2016.05.017 |
| [4] |
YU X J, ZHOU J Y, WANG Z P, et al. Medium optimisation for improved growth-rate inhibition of Microcystis aeruginosa exposed to AgBiO3 using response-surface methodology[J]. Advanced Materials Research, 2011, 255-260: 2940-2948. DOI:10.4028/www.scientific.net/AMR.255-260.2940 |
| [5] |
SONG J K, WANG X J, MA J X, et al. Visible-light-driven in situ inactivation of Microcystis aeruginosa with the use of floating g-C3N4 heterojunction photocatalyst: Performance, mechanisms and implications[J]. Applied Catalysis B Environmental, 2018, 226(15): 83-92. DOI:10.1016/j.apcatb.2017.12.034 |
| [6] |
ZHANG G Y, FENG Y, XU Y Y, et al. Controlled synthesis of mesoporous α-Fe2O3 nanorods and visible light photocatalytic property[J]. Materials Research Bulletin, 2012, 47(3): 625-630. DOI:10.1016/j.materresbull.2011.12.032 |
| [7] |
WANG Y M, YU T, CHEN X Y, et al. Enhancement of photoelectric conversion properties of SrTiO3/α-Fe2O3 heterojunction photoanode[J]. Journal of Physics D Applied Physics, 2007, 40(13): 3925-3930. DOI:10.1088/0022-3727/40/13/003 |
| [8] |
甄延忠, 王杰, 王丹军, 等. 一维Fe2O3/α-MoO3异质结的制备及其可见光光催化性能[J]. 人工晶体学报, 2017, 46(1): 55-62. ZHEN Y Z, WANG J, WANG D J, et al. Preparation and visible-light photocatalytic properties of one dimensional Fe2O3/α-MoO3 heterostructures[J]. Journal of Synthetic Crystals, 2017, 46(1): 55-62 (Ch). DOI:10.16553/j.cnki.issn1000-985x.2017.01.010 |
| [9] |
HU H, XIAO W J, YUAN J, et al. Preparations of TiO2 film coated on foam nickel substrate by sol-gel processes and its photocatalytic activity for degradation of acetaldehyde[J]. Journal of Environmental Sciences, 2007, 19(1): 80-85. DOI:10.1016/S1001-0742(07)60013-8 |
| [10] |
刘燕辉, 盛晓波, 董寅生, 等. 纳米TiO2在泡沫镍上的负载技术研究[J]. 应用化工, 2009, 38(1): 80-88. LIU Y H, SHENG X B, DONG Y S, et al. Study on the load of nano-TiO2 on nickel foam[J]. Applied Chemical Industry, 2009, 38(1): 80-88 (Ch). DOI:10.16581/j.cnki.issn1671-3206.2009.01.039 |
| [11] |
张茂林, 安太成, 胡晓洪, 等. 泡沫镍负载纳米ZnO-SnO2光催化降解三氯乙烯[J]. 环境科学学报, 2005, 25(2): 259-263. ZHANG M L, AN T C, HU X H, et al. Photocatalytic degradation of trichloroethylene in air on nanometer ZnO-SnO2 coupled oxides supported onto the po- rous nickel mesh[J]. Acta Scientiae Circumstantiae, 2005, 25(2): 259-263 (Ch). DOI:10.13671/j.hjkxxb.2005.02.023 |
| [12] |
肖媛, 王高鸿, 刘永定. 在不同营养条件下铜绿微囊藻对模拟微重力胁迫的响应[J]. 水生生物学报, 2011, 35(2): 300-306. XIAO Y, WANG G H, LIU Y D. Response ofMicrocystis aeruginosa to simulated microgravity stress under different nutritional conditions[J]. Acta Hydrobiologica Sinica, 2011, 35(2): 300-306 (Ch). DOI:10.3724/SP.J.1035.2011.00300 |
| [13] |
赵远, 谷娜, 李恒, 等. 可见光下亚微米Cu2O微球光催化去除铜绿微囊藻[J]. 环境污染与防治, 2016, 38(4): 45-50. ZHAO Y, GU N, LI H, et al. Photocatalytic removal of Microcystis aeruginosa by sub-micron Cu2O microspheres under visible light[J]. Environmental Pollution Control, 2016, 38(4): 45-50 (Ch). DOI:10.15985/J.cnki.1001-3865.2016.01.009 |
| [14] |
WANG J, ZHAO F, CHEN B H, et al. Small water clusters stimulate microcystin biosynthesis in cya- nobacterial Microcystis aeruginosa[J]. Journal of Applied Phycology, 2013, 25(1): 329-336. DOI:10.1007/s10811-012-9867-4 |
| [15] |
SONG J K, WANG X J, MA J X, et al. Removal of Microcystis aeruginosa and Microcystin-LR using a graphitic-C3N4/TiO2 floating photocatalyst under visible light irradiation[J]. Chemical Engineering Journal, 2018, 348: 380-388. DOI:10.1016/j.cej.2018.04.182 |
| [16] |
邓祥元, 成婕, 周伟华, 等. UV-B辐射对聚球藻7942生长及生理特性的影响[J]. 江苏农业科学, 2014, 42(5): 281-283. DENG X Y, CHENG J, ZHOU W H, et al. Effects of UV-B radiation on the growth and physiological characteristics of synechococcus 7492[J]. Jiangsu Agricultural Sciences, 2014, 42(5): 281-283 (Ch). DOI:10.15889/j.issn.1002-1302.2014.05.032 |
| [17] |
CHEN D L, LIU M N, YIN L L, et al. Single-crystalline MoO3 nanoplates: Topochemical synthesis and enhanced ethanol-sensing performance[J]. Journal of Materials Chemistry, 2011, 21(25): 9332-9342. DOI:10.1039/c1jm11447f |
| [18] |
徐志昌, 张萍. MoO3纳米材料化学合成流程的研究[J]. 中国钼业, 2010, 34(1): 6-20. XU Z C, ZHANG P. Study on chemical synthesis process for preparing nanomaterials of molybdenum trioxide[J]. China Molybdenum Industry, 2010, 34(1): 6-20 (Ch). DOI:10.13384/j.cnki.cmi.1006-2602.2010.01.002 |
| [19] |
谢淑婷.基于咪哇类离子液体的液相法制备α-Fe2O3纳米材料[D].济南: 山东大学, 2015. XIE S T.Preparation of α-Fe2O3 Nanostructures Using Imidozalium-Type Ionic Liquids-Moduated Solution Phase Methods [D]. Jinan: Shandong University, 2015(Ch). |
| [20] |
WILLIAM W, MARY W, STEVEN H, et al. Status of methods for assessing bacterial cell surface charge properties based on zeta potential measurements[J]. Journal of Microbiological Methods, 2001, 43(3): 153-164. DOI:10.1016/S0167-7012(00)00224-4 |
| [21] |
赵孟绪, 韩博平. 汤溪水库蓝藻水华发生的影响因子分析[J]. 生态学报, 2005, 25(7): 1554-1567. ZHAO M X, HAN B P. Analysis of factors affecting cyanobacteria bloom in a tropical reservoir (Tangxi Reservoir, China)[J]. Acta Ecologica Sinica, 2005, 25(7): 1554-1567 (Ch). DOI:10.3321/j.issn:1000-0933.2005.07.004 |
| [22] |
中华人民共和国卫生部. GB/T 5750.6-2006生活饮用水标准检测方法金属指标[S].北京: 中国标准出版社, 2006. People's Republic of China, Ministry of Health. GB/T 5750.6-2006 Standard Examination Methods for Drinking Water-Metal Parameters[S]. Beijing: Standards Press of China, 2006(Ch). |
 2019, Vol. 65
2019, Vol. 65





