文章信息
- 任晓东, 尚华, 马毓梅, 李晓冬
- 以阴道不规则出血为首发症状的胃癌子宫转移一例
- 实用肿瘤杂志, 2021, 36(5): 454-457
-
通信作者
- 李晓冬,E-mail:709866384@qq.com
-
文章历史
- 收稿日期:2020-05-14
2. 河北医科大学第二医院影像科,河北 石家庄 050000;
3. 河北医科大学第二医院病理科,河北 石家庄 050000
胃癌转移途径主要包括:向邻近器官的直接浸润转移;以肝转移居多以及其他部位转移的血行转移;易发生于上腹部和肠系膜上的腹膜转移;以左锁骨上淋巴结转移或脐部为多见的淋巴转移。女性胃癌的患者生殖器官转移以卵巢为常见,即库肯勃瘤,而转移到子宫则较少见。当患者出现阴道淋漓出血和下腹部肿块等妇科相关症状,应考虑到这种少见胃癌子宫远处转移的可能,否则将徒增加手术创伤,也不能改善患者预后,所以妇科医师应熟知此类疾病的鉴别和处理,使患者临床获益最大,同时也避免医疗资源的浪费。
1 病例资料患者女性,39岁,主因阴道不规则出血3个月和自觉下腹部肿物半个月于2019年3月19日收入河北医科大学第二医院。患者平素月经规律,14岁初潮,6~7 d/30 d,量中,色暗红,无血块,无痛经,白带正常,色白,无异味。于3个月前无明显诱因出现阴道不规则出血,量时多时少,周期缩短,未特殊治疗,半个月前自行摸出下腹肿物,伴尿频、下腹坠胀感,无腰酸不适,无腹痛、腹泻,2019年3月5日就诊于当地县医院行超声检查结果示:子宫大于正常、宫壁回声增粗、不均;宫腔积液。行诊刮术,诊刮结果:子宫内膜呈增殖期改变,其内可见大量印戒细胞伴黏液分泌,不除外印戒细胞癌。2019年3月16日于本院病理科会诊,门诊以子宫内膜癌收入妇科病房。G2P2A0。患者既往于2003年行剖宫产+左侧卵巢切除术(左卵巢囊肿),2007年行剖宫产术。
入院查体:体温36.7℃,脉搏100次/min,呼吸25次/min,血压109/70 mmHg(1 mmHg=0.133 kPa);腹部检查:腹部膨隆,可见陈旧性手术瘢痕,未见胃肠型及蠕动波,未见腹壁静脉曲张,腹韧,宫底脐下2指,表面光滑,质硬;阴道检查:已婚未产型外阴,子宫颈口可见少量暗红色血液,子宫颈增大,子宫颈暴露不完整,质极硬,光滑,无压痛及摇摆痛。子宫体前位,大小如孕4个月,质极硬,外形平滑,不活动,无压痛,后穹隆不平,触痛,双附件区未及异常。
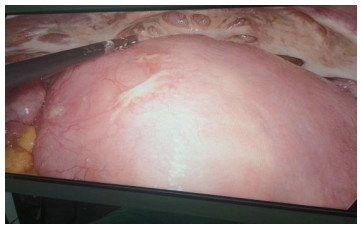
入院后2019年3月20日查妇科超声示:子宫内膜病变伴积血;子宫内多个低回声病变(子宫肌瘤);子宫肌层弥漫性改变(子宫腺肌症);2019年3月22日高危型人乳头瘤病毒检测和子宫颈细胞学检测结果未见异常;2019年3月19日病理会诊结果示:送检内膜可见纤维化区域,其间可见巢团样胞质透亮细胞浸润,偶呈印戒样,结合免疫表型,倾向子宫内膜息肉癌变,考虑为透明细胞癌,但胃肠道肿瘤转移不能完全除外。建议检查消化道。免疫组织化学检查结果:白细胞分化抗原10(cluster of differentiation 10,CD10)(-),CD68(部分+),尾型同源盒转录因子2(caudal-related homeobox transcription factor 2,CDX-2)(-),癌胚抗原(carcinoembryonic antigen,CEA)(+),细胞角蛋白20(cytokeratin 20,CK20)(个别+),CK7(+),广谱细胞角蛋白(pan cytokeratin,CKpan)(+),雌激素受体(estrogen receptor,ER)(-),孕激素受体(progesterone receptor,PR)(-),Vimentin(个别+),Ki-67(+ < 10%),NapsinA(-),p16(+),p53(部分+)。2019年3月20日肿瘤标志物检查示:糖类抗原125(carbohydrate antigen 125,CA125):107 U/mL,CA199:571.4 U/mL,胸苷激酶1(thymidine kinase 1,TK1):1.96 pmol/L。于2019年3月21日取子宫颈组织活检,结果示:子宫颈黏膜下,可见与子宫内膜病变相似的病变组织浸润。2019年3月21日腹部CT检查结果示:(1)肝内2个异常密度影,良性病变可能;(2)腹腔少量积液;(3)可疑胃壁增厚,请结合其他检查;(4)子宫增大,内密度不均,请结合其他检查。2019年3月23日MR盆腔平扫:(1)子宫颈部内膜病变,考虑子宫内膜癌可能,上缘与体部内膜局部分界不清,请结合病理并补充增强扫描;(2)考虑子宫腺肌症和子宫肌层多发肌瘤;(3)少量盆腔积液。双下肢动静脉彩超未见明显异常。2019年3月26日检查示CA724 > 300 U/mL。2019年3月30日激素六项检查结果示:促卵泡生成素5.9 mIU/mL,促黄体生成素5.41 mIU/mL,雌二醇64 pg/mL,孕酮0.31 ng/mL,睾酮0.56 ng/mL,血清泌乳素6.98 ng/mL,抗谬勒氏管激素(anti-Müllerian hormone,AMH)0.1 ng/mL。遂于2019年3月28日行胃镜检查结果示胃癌。2019年3月29日病理检查诊断(胃体小弯,活检)黏液腺癌。超声内镜结果示胃癌(T4aN2)。于2019年4月2日行腹腔镜探查+腹膜病灶活检+右卵巢活检+子宫颈活检+清宫术+热灌注管置管术,术中胃大弯、大网膜、部分肠管表面(图 1)、膈肌表面、脾脏表面、双侧髂窝处腹膜和膀胱子宫反折腹膜可见肿瘤转移病灶,色黄质腻。子宫如孕3个月大小,表面光滑,右侧输卵管未见异常,右侧卵巢大小约5 cm×4 cm×3 cm,表面不平,可见一2 cm×2 cm×3 cm囊肿,壁薄,光滑。外科考虑胃癌晚期,无手术机会,遂放弃手术。行诊刮术,宫腔内流出多量色黄、质腻组织送检。2019年4月8日术后病理检查结果示:(腹膜病灶、右卵巢活检组织、子宫内膜及子宫颈活检组织)均可见低分化腺癌(可见印戒细胞癌和黏液腺癌),结合免疫表型考虑消化道来源。免疫组织化学检查结果显示:CEA(+),CKpan(+)。术后分别于2019年4月2日和2019年4月4日行腹腔热灌注,并给予紫杉醇(白蛋白结合型)+卡铂周期性化疗,同时辅以卡培他滨(用药2周,停药1周)治疗。静脉化疗结束后,于2019年10月25日行超声胃镜检查示:贲门下胃体上部小弯侧可见溃疡性改变。环扫超声内镜沿着病变处从贲门向肛侧扫查,胃壁全层低回声增厚,胃壁浆膜层呈锯齿状,病变与肝左侧关系密切。肝胃间隙、腹腔干和肝门未见明显淋巴结。气管隆突下可见一淋巴结,约0.5 cm×0.4 cm。诊断胃癌(T4aN1),较前有所好转。于2019年11月18日行妇科超声示:子宫大小约8.0 cm×7.3 cm×7.11 cm,子宫颈大小约3.97 cm×2.69 cm,左卵巢显示不清,右卵巢大小约3.51 cm×2.64 cm。现患者一般情况可,院外口服卡培他滨。
|
| 图 1 部分肠管表面肿瘤转移病灶 |
胃癌转移到子宫较少见,容易被妇科和外科医师误诊误治,因此应提高鉴别能力。有报道2例以胃肠道为首发症状的胃癌行胃癌根治术后化疗1年转移到子宫的病例,预后较差,故女性胃癌患者行手术治疗时,应常规探查盆腔,疑有转移应作活检或冷冻切片证实[1]。生殖器外癌转移到子宫是不常见的,而子宫脂肪平滑肌瘤的转移极其罕见,癌细胞对各种转移部位的偏好取决于癌细胞(种子)和特定器官环境(土壤)之间的串扰。受体肿瘤的一些临床和生物学特征,如生长速度慢、高血管性、高胶原蛋白和高脂质含量可能在转移中起显著作用[2]。本例报道的患者患有多发性子宫肌瘤,其子宫肌瘤内或许存在转移瘤,因未行手术治疗将无法得知。过往有报道1例以梗阻性肾功能衰竭为表现的胃癌转移至子宫颈的病例,入院后在患者阴道穹隆外侧和后穹隆、子宫直肠陷凹和两侧宫旁发现多个结节状固定肿瘤,穿刺结果表明可能来源于胃肠道,行消化道内镜活检,结果显示为胃癌,提示对胃癌患者的常规妇科检查必不可少[3]。有研究对16例胃癌转移到子宫颈的腺癌患者进行临床病理分析发现,此类患者发病年龄在29~57岁,平均年龄为44.7岁,81.3%为绝经前妇女[4]。建议绝经前晚期胃癌女性患者应进行定期妇科检查,同时对于子宫颈质硬的患者必要时行子宫颈活检。当然,胃癌子宫转移并不局限于晚期胃癌患者,也有报道称早期胃癌也可单发转移至子宫颈[5]。对患癌症的妇女常规进行子宫颈细胞学检查,在50%的病例中发现肿瘤细胞的存在,其中54%的患者为印戒细胞;13.8%、55.2%和31.0%胃癌患者的细胞学研究结果为可疑、阳性或阴性[6]。有报道1例子宫颈细胞学结果为子宫颈腺癌,子宫颈活检的组织病理学怀疑有胃肠道转移,最终胃镜活检证实为低分化胃腺癌伴有印戒细胞[7]。所以,有时转移性肿瘤可能先于原发性肿瘤的诊断,并可能通过类似晚期子宫颈癌来表现。在多数病例中,胃癌和子宫颈转移的诊断间隔时间很短,或2种病变同时诊断,有少数患者几年后才得以诊断,也有极为罕见的原发性胃癌治疗后 > 10年转移到子宫颈的病例。胃癌转移到子宫或卵巢后,常有阴道不规则流血、绝经后阴道出血、下腹包块及疼痛等症状。故建议对任何有阴道出血、疼痛和(或)腹胀病史的妇女进行完整的妇科检查;对于任何有生殖器外或生殖器转移性肿瘤和子宫颈腺癌病史的妇女应排除转移性子宫颈疾病;应建立完整的工作流程,以便在确诊为子宫颈转移性肿瘤疾病的任何妇女中检测其他可能的肿瘤活动部位[4, 6, 8]。
对于可能为转移性肿瘤的妇科患者,首先应结合病史和体征作出初步判断,如果症状不典型,盆腹腔CT和阴道镜活检、宫内膜活检和腹腔彩超等辅助检查有助于疾病的诊断,若胃镜和肠镜结果正常并不能完全排除胃肠道转移瘤的可能,手术探查必不可少[9]。有报道1例腹痛和生殖道出血的胃癌子宫转移患者11年前因胃癌行手术治疗,入院后行改良根治性子宫切除术+双侧附件切除术+腹部神经(骨盆丛)切除术以减轻疼痛,术后患者的疼痛评分数值下降;所以,对于此种难以忍受的疼痛,可以通过手术缩小肿瘤减轻疼痛,同时又获得明确的病理诊断[8]。对于胃癌转移性腺癌患者,目前还没有确定的化疗方案。无论采用何种治疗方法,预后都很差[4]。目前,对于胃癌子宫转移的患者,尚无有效的治疗方法,手术治疗并不能减轻肿瘤负荷。但近年来,分子靶向药物不断涌现,包括血管内皮生长因子及受体抑制剂、表皮生长因子受体抑制剂和多靶点酪氨酸激酶抑制剂等,同时新型靶向药物的探索也在不断进行中,而且免疫检查点抑制剂也逐渐崭露头角,在晚期胃癌的治疗中颇见成效,或许未来可以成为胃癌子宫转移患者的有效治疗方法[10-11]。
胃癌转移可通过以下途径发生:胃癌中微RNA-7的缺失促进p65介导的活化B细胞κ轻链增强子的核因子异常激活发生;肿瘤相关巨噬细胞衍生外来体通过转移功能性载脂蛋白E发生;ZFAS1通过外来体传递发生等[12-14]。目前胃癌转移到子宫体的机制尚不清楚,淋巴和血液的扩散以及卵巢通过输卵管的直接腔内扩散是可能的潜在机制。子宫体的多数转移是继发于先前卵巢转移的局部淋巴扩散,而当卵巢未受影响时,则可能是通过血液播散。非妇科肿瘤转移到子宫颈的潜在途径包括血行播散、逆行淋巴播散和经腹膜播散。子宫颈转移相对罕见的原因可能是因为子宫颈的高纤维肌组织含量和低血管化过程是转移生长的不利因素,子宫颈具有离心排出的淋巴通道,且只有当远处的通道被肿瘤阻塞并且不允许逆行时,该通道的转移才会发生[15]。本例报道患者卵巢、子宫及子宫颈均存在转移瘤,其子宫转移可能途径是继发于卵巢转移的局部淋巴扩散。对16例转移到子宫颈的胃癌病例进行临床病理回顾分析推测,胃癌子宫颈转移的2种途径为通过卵巢和子宫体以及通过盆腔淋巴通道;这2条途径都抑制逆行淋巴扩散,第1条途径中,肿瘤细胞通过主动脉旁淋巴结逆行转移到卵巢和子宫体,第2条途径中,肿瘤细胞以逆行方式通过主动脉旁淋巴结转移到盆腔淋巴结[4]。总之,淋巴结转移是一种复杂的恶性淋巴结转移行为,涉及一系列生物过程,包括与邻近细胞粘附减少、细胞外基质降解和淋巴通道渗透。淋巴结转移与胃癌患者的治疗反应、局部复发和长期生存直接相关[16]。
综上所述,当患者有阴道淋漓出血、下腹包块和疼痛等妇科相关症状就诊时,应警惕胃癌子宫转移的可能。临床医师应采取一些措施提高鉴别能力,如常规进行子宫颈涂片筛查、必要的妇科查体及直肠检查,可疑部位的子宫颈活组织检查及胃镜检查;女性患者行胃癌手术时常规探查盆腔,必要时行组织学检查;胃癌术后患者常规无限期行妇科检查,从而提高胃癌子宫转移的检出率。胃癌子宫颈转移患者的预后较差,目前尚无有效的治疗方法,主要通过化疗延缓疾病进展,对于难以忍受的癌痛,可以通过手术缩小肿瘤减轻疼痛,但此举并不能改善患者预后。胃癌转移到子宫的机制尚不明确,需要进一步研究来明确可能机制,从而进行必要的干预。
| [1] |
姚定忠, 韩威力, 周丽香. 胃癌生殖道转移二例[J]. 现代实用医学, 2007, 19(4): 330-333. DOI:10.3969/j.issn.1671-0800.2007.04.042 |
| [2] |
Kiyokoba R, Yagi H, Yahata H, et al. Tumor-to-tumor metastasis of poorly differentiated gastric carcinoma to uterine lipoleiomyoma[J]. Case Rep Obstet Gynecol, 2015, 2015: 352369. |
| [3] |
Treszezamsky A, Altuna S, Diaz L, et al. Metastases to the uterine cervix from a gastric carcinoma presenting with obstructive renal failure: a case report[J]. Int J Gynecol Cancer, 2003, 13(4): 555-557. DOI:10.1136/ijgc-00009577-200307000-00026 |
| [4] |
Imachi M, Tsukamoto N, Amagase H, et al. Metastatic adenocarcinoma to the uterine cervix from gastric cancer. A clinicopathologic analysis of 16 cases[J]. Cancer, 1993, 71(11): 3472-3477. DOI:10.1002/1097-0142(19930601)71:11<3472::AID-CNCR2820711103>3.0.CO;2-V |
| [5] |
Yokoyama Y, Sato S, Futagami M, et al. Solitary metastasis to the uterine cervix from the early gastric cancer: a case report[J]. Eur J Gynaecol Oncol, 2000, 21(5): 469-471. |
| [6] |
Perez-Montiel D, Serrano-Olvera A, Salazar LC, et al. Adenocarcinoma metastatic to the uterine cervix: a case series[J]. J Obstet Gynaecol Res, 2012, 38(3): 541-549. DOI:10.1111/j.1447-0756.2011.01747.x |
| [7] |
Matsushita H, Fukase M, Takayanagi T, et al. Metastatic gastric cancer mimicking an advanced cervical cancer: a case report[J]. Eur J Gynaecol Oncol, 2011, 32(2): 199-200. |
| [8] |
Watanabe M, Hasegawa K, Kanamori A, et al. Late recurrence of gastric cancer in the ovary and uterine cervix[J]. Int Cancer Conf J, 2016, 5(4): 206-213. DOI:10.1007/s13691-016-0259-5 |
| [9] |
蒋斌, 薛敏. 胃印戒细胞癌宫颈转移1例报告[J]. 吉林大学学报: 医学版, 2013, 39(3): 431. |
| [10] |
李丹妮, 刘静, 刘云鹏. 胃癌靶向治疗的现状与思考[J]. 实用肿瘤杂志, 2019, 34(2): 106-110. |
| [11] |
韩光锋. 晚期胃癌的内科治疗现状和进展[J]. 实用肿瘤杂志, 2017, 32(6): 569-574. |
| [12] |
Tingbo Y, Meihua Y, Daochao H, et al. MicroRNA-7 as a potential therapeutic target for aberrant NF-κB-driven distant metastasis of gastric cancer[J]. BioMed Central, 2019, 38(1): 55. |
| [13] |
Peiming Z, Qin L, Weiwei W, et al. Tumor-associated macrophages-derived exosomes promote the migration of gastric cancer cells by transfer of functional Apolipoprotein E[J]. Cell Death Dis, 2018, 9(4): 434. DOI:10.1038/s41419-018-0465-5 |
| [14] |
Lei P, Wei L, Min F, et al. Exosomes-mediated transfer of long noncoding RNA ZFAS1 promotes gastric cancer progression[J]. J Cancer Res Clin Oncol, 2017, 143(6): 991-1004. DOI:10.1007/s00432-017-2361-2 |
| [15] |
Matsushita H, Watanabe K, Wakatsuki A. Metastatic gastric cancer to the female genital tract[J]. Mol Clin Oncol, 2016, 5(5): 495-499. DOI:10.3892/mco.2016.1035 |
| [16] |
Zhu T, Hu X, Wei P, et al. Molecular background of the regional lymph node metastasis of gastric cancer[J]. Oncol Lett, 2018, 15(3): 3409-3414. |
 2021, Vol. 36
2021, Vol. 36


