文章信息
- 程广艳, 王明宇, 曲芃芃
- Cheng Guangyan, Wang Mingyu, Qu Pengpeng
- 子宫肉瘤预后分析
- Prognostic factors related to uterine sarcoma
- 实用肿瘤杂志, 2020, 35(5): 454-458
- Journal of Practical Oncology, 2020, 35(5): 454-458
-
作者简介
- 程广艳(1979-), 女, 天津人, 主治医师, 硕士生, 从事妇科肿瘤临床研究.
-
通信作者
- 曲芃芃. E-mail:qu.pengpeng@hotmail.com
-
文章历史
- 收稿日期:2020-08-04
子宫肉瘤是女性少见的恶性肿瘤,发病率仅占所有女性生殖道恶性肿瘤的1%,子宫体恶性肿瘤的3%~7%[1]。子宫肉瘤的术前诊断由于其非特异性临床表现和症状与子宫肌瘤的相似性而具有挑战性,且无特殊的肿瘤标志物,早期缺乏有效的诊断措施,多数患者依靠术中冰冻或术后病理诊断意外发现[2]。由于子宫肉瘤疾病特点及处理方法的不同,患者的预后差异较大。由于子宫肉瘤病例少见,目前仍缺乏相关预后因素共识。一些学者认为影响患者的预后因素主要包括年龄、临床分期、肌层浸润深度、脉管淋巴管有无癌栓、淋巴结转移、雌激素受体(estrogen receptor,ER)和(或)孕激素受体(progesterone receptor,PR)表达情况以及治疗方法[3]。目前认为分期是最重要的预后因素。本研究对子宫肉瘤患者进行随访及临床病理资料分析,进一步探讨影响子宫肉瘤的预后因素。
1 资料与方法 1.1 一般资料回顾性分析2008年1月至2014年1月于天津中心妇产科医院妇瘤科就诊的资料完整的子宫肉瘤患者83例。年龄24~69岁,(49.51±8.96)岁,中位数年龄50岁。收集患者的临床资料包括年龄、绝经状态、肿物大小、临床分期、术前肿瘤标志物、手术类型、病理类型、脉管有无癌栓、淋巴结转移情况以及ER、PR和Ki-67的表达。分析患者临床特征与生存之间的关系。患者均进行子宫肉瘤的分期手术(全子宫+双附件切除术或全子宫+双附件+盆腔淋巴结切除术),18例为二次手术(首次手术均为子宫肌瘤剔除术:开腹肌瘤剔除13例,腹腔镜子宫肌瘤剔除4例,宫腔镜子宫肌瘤剔除术1例),根据术后病理检查进行临床分期。部分具有高危因素[晚期子宫平滑肌肉瘤(leimyosarcoma,LMS)、Ⅱ期以上高级别子宫内膜间质肉瘤(endomitrial stromal sarcoma,ESS)和未分化子宫肉瘤(undifferentiated uterine sarcoma,UUS)]患者行术后化疗(多柔比星+异环磷或吉西他滨+多西他赛,4~6个周期)。
1.2 随访术后1年每月复查1次,化疗病例例行检查,1年后每3个月随诊1次,至2019年1月83例患者完成全程随访,随访时间13~120个月,中位随访时间为63个月。自确诊为子宫肉瘤的起始日期至死亡或至随访的终点日期为生存时间。
1.3 统计学分析采用SPSS 21.0软件进行数据处理。计数资料和分类变量均采用χ2检验。采用Kaplan-Meier法绘制生存曲线,Log-rank检验比较生存率。多因素分析采用Cox比例风险回归模型。以P < 0.05为差异具有统计学意义。
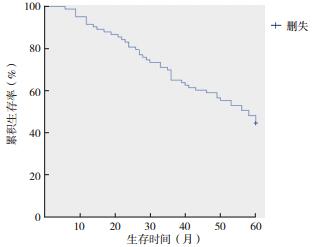
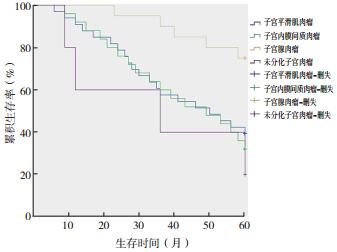
2 结果 2.1 总体生存分析83例患者随访期间46例死亡。1、3和5年总生存率分别为91.6%、65.1%和44.6%(图 1)。LMS患者33例,1、3和5年总生存率分别为91.0%、57.6%和39.4%。ESS患者25例,1、3和5年总生存率分别为92.0%、60.0%和32.0%。子宫腺肉瘤(adenosarcoma,AS)患者20例,1、3和5年总生存率分别为100.0%、90.0%和75.0%;UUS患者5例,1、3和5年总生存率分别为60.0%、40.0%和20.0%(图 2)。
|
| 图 1 子宫肉瘤患者总生存曲线 Fig.1 The cumulative survival rate of uterine sarcoma |
|
| 图 2 不同子宫肉瘤病理类型总生存曲线比较 Fig.2 The overall survival curves of different pathological types of uterine sarcoma |
83例患者5年复发率为51.8%(43/83)。LMS、ESS、AS和UUS患者5年复发率分别为60.6%(20/33)、64.0%(16/25)、20.0%(4/20)和60.0%(3/5)。
18例行二次分期手术的患者中10例复发,5年总生存率为45.5%。行二次分期手术的患者中,10例为LMS,6例复发,5年总生存率为40.0%;5例为ESS,3例复发,5年总生存率为40.0%;2例为AS,无复发,随访5年,患者均生存。1例为UUS,患者复发,随访5年患者均死亡。各病理类型分组中,行二次手术的患者与所有患者的5年总生存率比较,差异均无统计学意义(均P > 0.05, 表 1)。
| 病理类型 | 5年总生存 (例,%) |
二次分期 手术患者 (例) |
二次分期 手术患者 5年总生存 (例,%) |
P值 |
| 子宫平滑肌肉瘤 (n=33) |
13(39.4) | 10 | 4(40.0) | 0.833 |
| 子宫内膜间质肉瘤 (n=25) |
8(32.0) | 5 | 2(40.0) | 0.551 |
| 子宫腺肉瘤 (n=20) |
15(75.0) | 2 | 2(100.0) | 0.589 |
| 未分化子宫肉瘤 (n=5) |
1(20.0) | 1 | 0(0.0) | 0.624 |
单因素分析显示,肿瘤直径 < 5 cm、肿瘤标志物糖类抗原125(carbohydrate antigen 125,CA125) < 35 U/L、无脉管内癌栓、无淋巴结转移、临床分期早期和病理类型为AS的患者5年总生存率均较高(均P < 0.05)。患者5年总生存率在年龄、绝经状态、手术类型、ER、PR及Ki-67的表达情况方面比较,差异均无统计学意义(均P > 0.05,表 2)。
| 临床病理特征 | 例数 | 5年总生存(例,%) | P值 |
| 年龄 | 0.713 | ||
| < 45岁 | 43 | 20(46.5) | |
| ≥45岁 | 40 | 17(42.5) | |
| 绝经状态 | 0.440 | ||
| 未绝经 | 50 | 24(48.0) | |
| 已绝经 | 33 | 13(39.4) | |
| 肿瘤大小 | 0.002 | ||
| < 5 cm | 45 | 27(60.0) | |
| ≥5 cm | 38 | 10(26.3) | |
| FIGO分期 | < 0.01 | ||
| Ⅰ期 | 62 | 35(56.5) | |
| Ⅱ期 | 17 | 2(11.8) | |
| Ⅲ期 | 4 | 0(0.0) | |
| 术前CA125水平 | < 0.01 | ||
| < 35 U/L | 58 | 35(60.3) | |
| ≥35 U/L | 25 | 2(8.0) | |
| 手术类型 | 0.859 | ||
| 全子宫+双附件切除术 | 48 | 21(43.8) | |
| 全子宫+双附件+ 盆腔淋巴结切除术 |
35 | 16(45.7) | |
| 病理类型 | 0.014 | ||
| 子宫平滑肌肉瘤 | 33 | 13(39.4) | |
| 子宫内膜间质肉瘤 | 25 | 8(32.0) | |
| 子宫腺肉瘤 | 20 | 15(75.0) | |
| 未分化子宫肉瘤 | 5 | 1(20.0) | |
| 脉管内癌栓 | 0.006 | ||
| 有 | 21 | 4(19.0) | |
| 无 | 62 | 33(53.2) | |
| 淋巴结转移 | 0.044 | ||
| 有 | 4 | 1(25.0) | |
| 无 | 31 | 25(80.6) | |
| ER表达 | 0.904 | ||
| 阳性 | 32 | 14(43.8) | |
| 阴性 | 51 | 23(45.1) | |
| PR表达 | 0.859 | ||
| 阳性 | 35 | 16(45.7) | |
| 阴性 | 48 | 21(43.8) | |
| Ki-67表达 | 0.064 | ||
| 阳性 | 56 | 18(32.1) | |
| 阴性 | 27 | 19(70.4) | |
| 注 FIGO:国际妇产科协会(Federation International of Gynecology and Obstetrics);CA125:糖类抗原125(carbohydrate antigen 125);ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterone receptor) | |||
将CA125、肿瘤直径、国际妇产科协会(Federation International of Gynecology and Obstetrics,FIGO)分期、脉管内癌栓情况和淋巴结转移情况引入Cox模型,采用输入法,行多因素分析显示,随着肿瘤直径的增大(≥5 cm)、FIGO分期的升高及脉管内癌栓转移是子宫肉瘤患者预后的独立危险因素(均P < 0.05,表 3)。
| 影响因素 | B值 | SE | Wald值 | Exp(B) | 95% CI用 于Exp(B) |
P值 |
| CA125水平 ≥35 U/L |
0.886 | 0.234 | 28.983 | 1.360 | 0.630~1.860 | 0.079 |
| FIGO分期 | 0.576 | 0.092 | 27.004 | 2.210 | 1.510~3.230 | < 0.01 |
| 肿瘤直径≥5 cm | 0.334 | 0.067 | 13.672 | 1.890 | 1.080~3.010 | 0.041 |
| 脉管内癌栓 | 0.545 | 0.097 | 20.669 | 2.410 | 1.530~3.480 | 0.001 |
| 淋巴结转移 | 0.973 | 0.347 | 32.665 | 1.740 | 0.880~2.130 | 0.098 |
| 注 CA125:糖类抗原125(carbohydrate antigen 125);FIGO:国际妇产科协会(Federation International of Gynecology and Obstetrics) | ||||||
本研究中,子宫肉瘤患者1、3和5年总生存率分别为91.6%、65.1%和44.6%,子宫肉瘤的复发率为51.8%,其中LMS、ESS、AS及UUS复发率分别为60.6%、64.0%、20.0%和60.0%。一项对59例子宫肉瘤患者进行的回顾性分析认为,子宫肉瘤5年复发率为59.2%,远处转移中肺转移最多见,其次是肝脏和骨骼[4]。本研究中5年总生存率稍高于既往研究报道(40%)[4],子宫肉瘤复发率低于既往研究报道[4],考虑可能是由于本研究样本量少。
本研究表明,患者的肿瘤大小、病理类型、FIGO分期、脉管内癌栓、淋巴结转移及术前CA125水平是子宫肉瘤患者预后的影响因素,其中肿瘤大小、FIGO分期及脉管内癌栓是独立预后危险因素,这与多项研究结果一致[5]。不同病理类型的子宫肉瘤预后存在差异,有研究报道,早期ESS、LMS、AS、UUS及其他类型子宫肉瘤的5年总生存率分别为84.0%、51.0%、76.0%、57.0%和43.0%[6]。有研究表明,AS的5年总生存率最高(78.7%),其次为ESS(71.8%)和LMS(41.9%)[2]。本研究也发现,病理类型是影响子宫肉瘤患者预后的重要因素,AS患者的5年总生存率较其他组织类型高。多数研究表明,临床分期越晚,子宫肉瘤患者的预后越差[7]。有研究显示,子宫肉瘤的预后较差,Ⅰ期、Ⅱ期、Ⅲ期和Ⅳ期患者5年总生存率分别为63.6%、41.2%、10.0%和0.0%[4]。本研究也发现,Ⅰ期子宫肉瘤患者5年总生存率为83.9%,较Ⅱ期及Ⅲ期升高。研究表明,Ⅰ期和Ⅱ期LMS的5年总生存率分别为51.0%和25.0%;Ⅰ期、Ⅱ期和Ⅲ期ESS的5年总生存率分别为84.0%、62.0%和40.0%,1例Ⅳ期患者在2年内死亡;多因素预后分析中,临床分期是影响预后的独立因素[6]。这与本研究结果一致。
本研究中,肿瘤直径≥5 cm、肿瘤标志物CA125≥35 U/L、淋巴脉管内癌栓及淋巴结转移是子宫肉瘤的预后相关因素。有研究报道,AS的预后与肿瘤直径大及淋巴脉管间隙浸润有关,肿瘤直径小的AS患者中位总生存时间长于肿瘤直径大的AS患者[8]。ESS随着肿瘤直径的增加,5年总生存率降低[8]。另外,绝经状态、肉瘤过度生长、淋巴脉管间隙浸润、切缘情况、肌层浸润深度和核分裂象等因素也与子宫肉瘤的预后相关[9-12]。
目前,子宫肉瘤的主要治疗方法为手术治疗,全子宫+双附件切除术为主要手术方式;对于病灶局限在子宫的LMS,保留卵巢并不影响患者的预后。有研究认为,原发性LMS向卵巢的转移是罕见的,发生率 > 5%,故对于年轻的LMS患者,可以保留卵巢[13];但对于ESS和腺肉瘤患者保留卵巢的安全性并没有相关证实[14];如术中发现子宫外病灶,建议行细胞减灭术。早期LMS、ESS和AS的淋巴结转移率分别为0%~3.7%、25%和0%~6.5%,清扫淋巴结并未增加子宫肉瘤患者的生存获益[15],故对于子宫肉瘤不常规推荐行盆腔淋巴结切除术,如术前影像学提示有增大的淋巴结,则建议性淋巴结切除或者活检术。行辅助化疗并不是治疗子宫肉瘤的标准,即使对于高危复发患者临床指南不能明确其在辅助设置中的作用。研究表明,免疫组织化学检测Ki-67水平发现其在平滑肌肉瘤组织中高表达,且与肌瘤患者比较,差异具有统计学意义(P < 0.05),故联合检测用于LMS的辅助鉴别及评估有一定价值[16],但是尚无研究报道Ki-67与子宫肉瘤预后的关系。本研究中Ki-67水平不影响子宫肉瘤预后。ESS常表达ER和PR(分别为43.8%和45.7%),对于晚期患者,激素治疗可降低复发风险,而辅助放化疗效果不理想[17-18]。其他类型子宫肉瘤ER和PR表达少见。本研究中ER和PR表达与子宫肉瘤的预后不相关(均P > 0.05),可能与本研究病例数少有关。
子宫肉瘤发病率低,但恶性程度高,预后差。临床工作中可根据不同的分期、病理类型及存在的高危因素制定个体化的治疗方案,延长患者的生存期,减少复发。
| [1] |
Zhang Y, Li Y, Qin M, et al. High-grade endometrial stromal sarcoma:a retrospective study of factors influencing prognosis[J]. Cancer Manag Res, 2019, 17(11): 831-837. |
| [2] |
Peter M. Uterine sarcoma-difficult to diagnose, hard to treat[J]. Oncol Res Treat, 2018, 41(11): 674. DOI:10.1159/000494393 |
| [3] |
叶丹, 袁蕾, 尧良清. 子宫肉瘤与癌肉瘤预后相关因素的分析[J]. J Int Obstet Gynecol, 2016, 43(3): 353-356. |
| [4] |
Nassar OA, Moaty BE, Khalil ES, et al. Outcome and prognostic factors of uterine sarcoma in 59 patients:single institutional results[J]. J Egypt Natl Canc Inst, 2010, 22(2): 113-122. |
| [5] |
Anastasios K, Michael L, Dimitrios C, et al. Management of uterine sarcomas and prognostic indicators:real world data from a single-institution[J]. BMC Cancer, 2018, 18(1): 1247-1254. DOI:10.1186/s12885-018-5156-1 |
| [6] |
Abeler VM, Røyne O, Thoresen S, et al. Uterine sarcomas in Norway.A histopathological and prognostic survey of a total population from 1970 to 2000 including 419 patients[J]. Histopathology, 2009, 54(3): 355-364. DOI:10.1111/j.1365-2559.2009.03231.x |
| [7] |
Kokawa K, Nishiyama K, Ikeuchi M, et al. Clinical outcomes of uterinsarcomas:results from 14 years worth of experience in the Kinki district in Japan (1990-2003)[J]. Int J Gynecol Cancer, 2006, 16(3): 358-363. |
| [8] |
Carroll A, Ramirez PT, Westin SN, et al. Uterine adenosarcoma:an analysis on management, outcomes, and risk factors for recurrence[J]. Gynecol Oncol, 2014, 135(3): 455-461. DOI:10.1016/j.ygyno.2014.10.022 |
| [9] |
Tropé CG, Abeler VM, Kristensen GB. Diagnosis and treatment of sarcoma of the uterus.A review[J]. Acta Oncol, 2012, 51(6): 694-705. DOI:10.3109/0284186X.2012.689111 |
| [10] |
Bai H, Yang J, Cao D, et al. Ovary and uterus-sparing procedures for low-grade endometrial stromal sarcoma:a retrospective study of 153 cases[J]. Gynecol Oncol, 2014, 132(3): 654-660. DOI:10.1016/j.ygyno.2013.12.032 |
| [11] |
Carroll A, Ramirez PT, Westin SN, et al. Uterine adenosarcoma:an analysis on management, outcomes, and risk factors for recurrence[J]. Gynecol Oncol, 2014, 135(3): 455-461. DOI:10.1016/j.ygyno.2014.10.022 |
| [12] |
Park JY, Kim DY, Suh DS, et al. Prognostic factors and treatment outcomes of patients with uterine sarcoma:analysis of 127 patients at asingle institution, 1989-2007[J]. J Cancer Res Clin Oncol, 2008, 134(12): 1277-1287. DOI:10.1007/s00432-008-0422-2 |
| [13] |
D'Angelo E, Prat J. Uterine sarcomas:a review[J]. Gynecol Oncol, 2010, 116(1): 131-139. |
| [14] |
Nasioudis D, Chapman-Davis E, Frey M, et a1. Safety of ovarian preservation in premenopausal women with stageI uterine sarcoma[J]. J Gynecol Oncol, 2017, 28(4): e46. DOI:10.3802/jgo.2017.28.e46 |
| [15] |
Seagle BL, Sobecki-Rausch J, Strohl AE, et al. Prognosis and treatment of uterine leiomyosarcoma:A National Cancer Database study[J]. Gynecol Oncol, 2017, 145(1): 61-70. DOI:10.1016/j.ygyno.2017.02.012 |
| [16] |
赵欣, 马文文, 李丹丹, 等. P16、Bcl-2、Ki-67、P53、ER、PR在子宫平滑肌肿瘤中的表达及临床意义[J]. 中国妇幼保健, 2017, 32(13): 2912-2914. |
| [17] |
Gantzer J, Ray-Coquard I. Gynecological sarcomas:what's new in 2018, a brief review of published literature[J]. Curr Opin Oncol, 2018, 30(4): 246-251. |
| [18] |
Elif M, Mehmet MN. Prognostic factors, survival outcomes, and surgical practices when dealing with uterine sarcomas:8 years'clinical experience[J]. Turk Ger Gynecol Assoc, 2019, 20(4): 154-164. |
 2020, Vol. 35
2020, Vol. 35


