文章信息
- 许慧芹, 吴锦昌, 张兰胜, 徐金格, 程玉峰
- 卡瑞丽珠单抗在肺癌治疗中引起免疫性血小板减少一例
- 实用肿瘤杂志, 2021, 36(5): 451-453
基金项目
- 泰山学者工程专项经费资助(ts20190973)
-
通信作者
- 许慧芹,E-mail:13585397309@139.com
-
文章历史
- 收稿日期:2020-04-26
2. 徐州医科大学第二附属医院血液科,江苏 徐州 221000;
3. 山东大学齐鲁医院放疗中心,山东 济南 250000
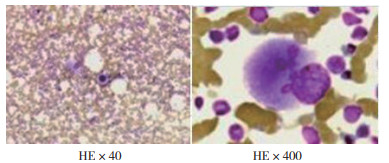
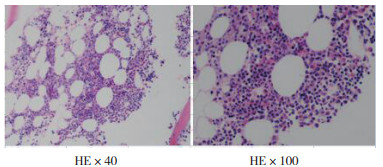
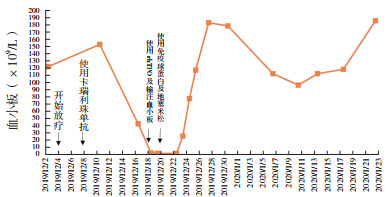
2019年12月徐州医科大学第二附属医院放疗科收治非小细胞肺癌(non-small-cell lung cancer,NSCLC)1例,男性,60岁,既往体建,否认高血压、心脏病、糖尿病及遗传性疾病史。2019年10月在外院支气管镜及头颅MR确诊左上肺黏液腺癌并脑转移,表皮生长因子受体(epidermal growth factor receptor,EGFR)基因突变阴性,患者拒绝手术治疗,入院前1个月2019年11月在当地医院行培美曲塞联合顺铂化疗(培美曲塞1.0 g,顺铂120 mg)1个周期,疗效评估疾病稳定(stable disease,SD)。2019年12月1日收住徐州医科大学第二附属医院后,查体:全身皮肤黏膜无出血点。头颅无明显异常,两肺呼吸音粗,无干湿性啰音,心律齐,腹部软,无明显肝脾肿大,未触及肿块,四肢活动正常。于2019年12月2日开始在放疗科行胸部原发肿瘤病灶和脑部转移病灶同时单纯放疗,胸部放疗剂量为60 Gy/30 F, 脑部50 Gy/25 F,未行化疗。患者于放疗后(2019年12月8日)使用程序性死亡蛋白1(programmed death -1,PD-1)抗体(卡瑞利珠单抗200 mg)1次,10 d后出现鼻出血,查体:鼻腔内出血,口腔无异常,可见皮肤瘀斑,无明显皮疹和皮肤瘙痒不适,无皮肤毛细血管增生,无消化道和呼吸道出血,给予急查血常规:血小板2×109/L(正常值100~300×109/L),C反应蛋白水平升高26.9 mg/L(正常值0~3.45 mg/L),紧急输注血小板1 U/d×3 d,使用重组人血小板生成素(recombinant human thrombopoietin,rhTPO)15 000 U/d×9 d,暂停放疗,2 d后复查血常规,血小板计数未见好转,仍为2×109/L,骨髓细胞学提示骨髓增生明显活跃,全片可见巨核细胞321个,分类25个(其中幼稚巨核细胞2个,颗粒巨核细胞23个),血小板散在罕见(图 1)。骨髓病理检查提示骨髓有核细胞增生活跃(造血容量约50%),粒细胞与红细胞比值大致正常,未见典型异位未成熟前体细胞(abnormal localization of immature precursor,ALIP)及热点现象,未见明显异型细胞(图 2)。骨髓检查排除放化疗后导致的严重骨髓抑制(患者当时未进行同步化疗,放疗开始8次,剂量16 Gy/8 F,此放疗剂量引起Ⅳ度骨髓抑制和血小板低至2×109/L尚未见报道)。根据骨髓报告结合临床特征符合特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)诊断标准:(1)≥2次血常规检测仅血小板 < 100×109/L;(2)皮肤出血点、瘀斑和(或)黏膜及脏器出血等临床表现;(3)一般无脾脏肿大。临床诊断ITP,确定使用类固醇激素(地塞米松磷酸钠注射液)20 mg/d×3 d后改10 mg/d×3 d,使用类固醇激素第3天时同时加用静脉滴注丙种免疫球蛋白35g/d×3 d,在激素使用4 d和丙种免疫球蛋白同时使用2 d后,患者持续降低的血小板(2×109/L)开始回升,随后继续完成胸部和脑部放疗计划。患者治疗期间血常规变化情况见图 3和表 1。
|
| 注 骨髓增生明显活跃,全片可见巨核细胞321个,分类25个(其中幼稚巨核细胞2个,颗粒巨核细胞23个),血小板散在罕见 图 1 肺癌患者骨髓涂片细胞学检查结果 |
|
| 注 骨髓有核细胞增生活跃(造血容量约50%),粒红比大致正常,未见典型异位未成熟前体细胞及热点现象,未见明显异型细胞 图 2 肺癌患者骨髓活检病理检查结果 |
|
| 注 rhTPO:重组人血小板生成素(recombinant human thrombopoietin) 图 3 肺癌患者放疗联合卡瑞利珠单抗治疗期间血小板变化曲线 |
| 时间 | 白细胞(×108/L) | 血小板(×109/L) | 血红蛋白(g/L) | 治疗情况 |
| 2019年12月2日 | 34.3 | 122 | 137 | 入院放疗,第1个周期化疗(培美曲塞1.0 g,顺铂120 mg)后20 d |
| 2019年12月8日 | - | - | - | 使用卡瑞利珠单抗治疗 |
| 2019年12月10日 | 19.9 | 152 | 138 | |
| 2019年12月16日 | 82.4 | 43 | 125 | |
| 2019年12月18日 | 86.8 | 3 | 120 | 停止放疗,使用rhTPO 15 000 U/d×10 d,血小板1 U/d×6 d |
| 2019年12月19日 | 114.3 | 2 | 118 | |
| 2019年12月19日 | 110.1 | 2 | 111 | 12月20日开始地塞米松20 mg×3 d,后改为10 mg×3 d |
| 2019年12月20日 | - | - | - | 开始使用免疫球蛋白3 d |
| 2019年12月22日 | 69.8 | 2 | 109 | |
| 2019年12月23日 | 61.1 | 26 | 105 | |
| 2019年12月24日 | 59.5 | 78 | 108 | 继续放疗 |
| 2019年12月25日 | 68.4 | 117 | 103 | 地塞米松5 mg×5 d |
| 2019年12月27日 | 61.7 | 182 | 108 | |
| 2019年12月30日 | 37.2 | 178 | 115 | |
| 2020年01月6日 | 21.0 | 112 | 104 | |
| 2020年01月10日 | 48.5 | 96 | 95 | |
| 2020年01月13日 | 39.2 | 112 | 92 | |
| 2020年01月17日 | 50.7 | 118 | 93 | 头部放疗结束 |
| 2020年01月22日 | 104.6 | 185 | 100 | 胸部放疗结束 |
| 注PD-1:程序性死亡蛋白1(programmed death-1);rhTPO:重组人血小板生成素(recombinant human thrombopoietin) | ||||
患者1次抗PD-1单抗免疫治疗及放疗后,胸部CT检查示,肿瘤病灶稳定(病灶缩小体积 < 25%),无明显超进展现象;复查血肿瘤标志物各项指标明显降低(表 2)。随访3个月后,患者放疗结束继续给予培美曲塞联合顺铂化疗(培美曲塞1.0 g,顺铂120 mg)2个周期,耐受性较好,未再使用PD-1抗体(卡瑞利珠单抗)。病程中复查血常规无再次出现血小板危象,虽然出现明显的严重免疫治疗相关不良反应,但未引起病情进展。
| 时间 | CA125(U/mL) | CA153(U/mL) | CA50(U/mL) | AFP(ng/mL) | CEA(ng/mL) | CA199(U/mL) |
| 2019年12月2日 | 145.20 | 48.10 | 2 000 | 1 000 | 77.59 | 9.70 |
| 2020年1月22日 | 45.50 | 33.60 | 1209 | 500 | 27.80 | 3.80 |
| 注CA125:糖类抗原125(carbohydrate antigen 125);AFP:甲胎蛋白(alpha-fetoprotein);CEA:癌胚抗原(carcinoembryonic antigen) | ||||||
有研究鉴定168例ITP的个例安全性报告(individual case safety reports,ICSRs)显示,ITP事件发生在治疗的早期(平均40 d),并与12%的病例的致死结果相关[1-3]。回顾性研究分析接受免疫检查点抑制剂(immune checkpoint inhibitor,ICI)治疗的2 360例黑素瘤患者,有 < 1%的患者发生血小板减少,多数患者无需治疗即可恢复正常[4]。
Birtas等[5]检测67例ITP患者和21名健康对照者的血清提示,血清可溶性PD-1和可溶性程序性死亡因子配体-1(programmed death ligand 1,PD-L1)在ITP患者中均降低,和血小板计数存在着正相关,没有PD-1抑制监管, 持续激活的T细胞可能会导致ITP的炎性反应[6]。PD-1信号通路的主要作用是抑制自身反应性T细胞,异常的PD-1和PD-L信号转导可能导致外周耐受性的崩溃,并导致自身免疫性疾病[7-8]。
在ITP患者的外周血中已发现CD4+ T细胞和CD8+细胞毒性T细胞,血小板自身反应性T细胞减少细胞凋亡,并产生细胞因子失衡,从而导致调节性T细胞的水平降低和功能异常[9-10],T细胞失调是ITP发病的主要原因之一。ITP患者激活PD-1和PD-L1可恢复T辅助细胞(helper T cell,Th)1/Th2和辅助性T细胞(regulatory T cells,Treg)/Th17细胞亚群的失衡,而抗PD-1可能通过增强干扰素-γ(interferon-γ,IFN-γ)的产生而加重疾病[11]。
ITP是一种排除性诊断,由于缺乏特异性检查,且其鉴别诊断范围广,可能具有一定的挑战性。ICI诱导的ITP的发生是罕见的。据报道,1例肺癌患者在第1次输注nivolumab后的第15天突然出现严重的血小板减少症,还表现出口腔黏膜出血和瘀斑性皮疹[2]。本例患者使用PD-1抗体前1个月未进行任何化疗,放疗开始约2周,总剂量为18 Gy/9 F,对于此剂量放疗尚未见相关报道引起Ⅳ度骨髓抑制,且血小板降低后立刻停止放疗,输注血小板后血小板未升高,直至只用免疫球蛋白免疫制剂后血小板恢复正常,其后继续放疗,停止使用免疫抑制剂后未再次出现Ⅳ度骨髓抑制,血小板降低。基于骨髓穿刺检查显示无发育异常或侵犯,骨髓像表现以骨髓增生活跃,巨核细胞增加为主,发育成熟障碍,血小板外周破坏为主,而非放化疗后骨髓增生减低,巨核细胞减少的骨髓像,并且血小板最低的时候白细胞正常,升高趋势,血红蛋白正常,因此排除放疗引起的血小板降低,诊断单抗诱导的免疫性血小板减少症。在使用ICI之后,输血缺乏疗效,这说明出现免疫相关的血液不良事件,必须立即处理, 按照ITP治疗后血小板快速恢复正常,支持免疫性血小板的诊断。
严重血小板减少突然出现可能与免疫治疗有关,糖皮质激素及免疫球蛋白是治疗免疫介导的血液毒性的主要支柱,应监测ICI治疗期间的完整血液细胞计数,需要进一步研究以确定患者特异性危险因素。未来的研究应该评估血液毒性的发病率,阐明危险因素,确定血液毒性的最佳管理策略。
| [1] |
Davis EJ, Salem JE, Young A, et al. Hematologic complications of immune checkpoint inhibitors[J]. Oncologist, 2019, 4(5): 584-588. |
| [2] |
Mori H, Sakai C, Iwai M, et al. Immune thrombocytopenia induced by nivolumab in a patient with non-small cell lung cancer[J]. Respir Med Case Rep, 2019, 28: 28. |
| [3] |
Nie M, Liu Y, Li XX, et al. PD-1/PD-L pathway potentially involved in ITP immunopathogenesis[J]. Thromb Haemost, 2019, 119(5): 758-765. DOI:10.1055/s-0039-1679909 |
| [4] |
Shiuan E, Beckermann KE, Ozgun A, et al. Thrombocytopenia in patients with melanoma receiving immune checkpoint inhibitor therapy[J]. J Immunother Cancer, 2017, 5: 8. DOI:10.1186/s40425-017-0210-0 |
| [5] |
Birtas Atesoglu E, Tarkun P, Demirsoy ET, et al. Soluble programmed death 1 (PD-1) is decreased in patients with immune thrombocytopenia (ITP): potential involvement of PD-1 pathway in ITP immunopathogenesis[J]. Clin Appl Thromb Hemost, 2016, 22(3): 248-251. DOI:10.1177/1076029614562952 |
| [6] |
李秀秀. 免疫性血小板减少症患者外周血中负性协同刺激分子PD-1及其配体的表达[D]. 济南: 山东大学医学院, 2017.
|
| [7] |
聂牧. PD-1/PD-L1通路相关病理机制在免疫性血小板减少症中的研究[D]. 济南: 山东大学医学院, 2019.
|
| [8] |
王英营. ITP患者中存在PD-1+CD4+T细胞以及PDL1+DC细胞比例增高现象[D]. 乌鲁木齐: 新疆医科大学第一附属医院内科, 2017.
|
| [9] |
Zhong J, Chen S, Xu L, et al. Lower expression of PD-1 and PD-L1 in peripheral blood from patients with chronic ITP[J]. Hematology, 2016, 21(9): 552-557. DOI:10.1080/10245332.2016.1155347 |
| [10] |
Xie J, Cui D, Liu Y, et al. Changes in follicular helper T cells in idiopathic thrombocytopenic purpura patients[J]. Int J Biol Sci, 2015, 11(2): 220-229. DOI:10.7150/ijbs.10178 |
| [11] |
Wu D, Liu Y, Pang N, et al. PD-1/PD-L1 pathway activation restores the imbalance of Th1/Th2 and Treg/Th17 cells subtypes in immune thrombocytopenic purpura patients[J]. Medicine (Baltimore), 2019, 98(43): e17608. DOI:10.1097/MD.0000000000017608 |
 2021, Vol. 36
2021, Vol. 36


