文章信息
- 陈华福, 林晓强, 陈达丰
- 肝上皮样血管内皮细胞瘤一例
- 实用肿瘤杂志, 2021, 36(2): 174-177
-
通信作者
- 陈达丰, E-mail: cdfeng1977@163.com
-
文章历史
- 收稿日期:2020-03-01
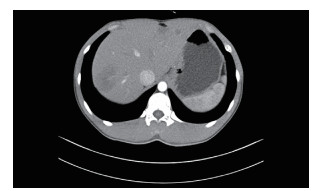
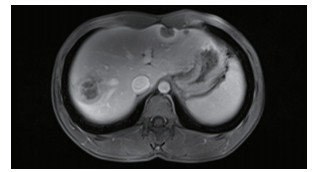
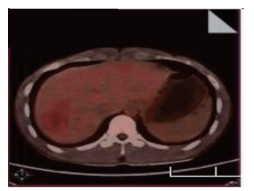
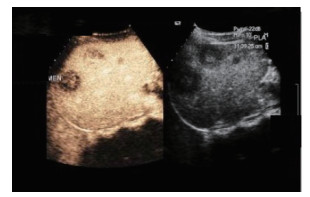
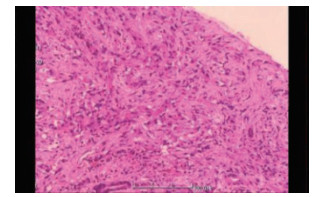
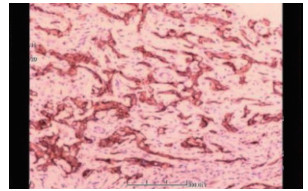
患者男性,21岁,士兵,未婚,因右上腹闷胀不适2个月余,于2017年6月8日收治联勤保障部队第909医院普通外科。既往无肝病病史,各系统回顾无特殊病史,无疫区和疫水接触史,无家族史。患者无明显诱因感右上腹闷胀不适2个月余,无腹痛、畏寒、发热、乏力、纳差、厌油、恶心、呕吐、呕血或黑便,未引起重视,未行特殊处理,症状逐渐加重。于2017年6月6日就诊本院门诊,查腹部彩超提示:肝内多发实性肿块,胆、胰、脾和双肾未见明显异常。腹部CT检查提示:肝内多发占位,考虑恶性肿瘤,转移瘤可能性大。体格检查:体温36.5℃,血压125/85 mmHg(1 mmHg=0.133 kPa),全身皮肤和巩膜无黄染,浅表淋巴结未触及肿大,心肺未见明显异常。腹部平软,无压痛、肌紧张和反跳痛,未触及明显肿物,肝、脾和肋下未触及明显肿大,莫菲氏征阴性,肝区无叩击痛,移动性浊音阴性,肠鸣音正常。实验室检查肿瘤标志物示,甲胎蛋白(alpha fetoprotein,AFP)、癌胚抗原(carcinoembryonic antigen,CEA)、糖蛋白抗原19-9(carbohydrate antigen 19-9,CA19-9)、CA125、CA153和CA72-4均未见明显异常。血常规和肝功能检查无明显异常。棘球蚴病抗体IgG(-)。腹部增强CT检查示(图 1):肝内见多发低密度结节及肿块,CT值约30~37 Hu,边界清楚,可见双环征,较大的位于肝右叶,大小约5.4 cm×4.2 cm,呈葫芦状,增强扫描边缘环形进行性强化,动、门脉期及延时期CT值分别约64、74和82 Hu;肝内外胆管无扩张;提示肝内多发占位,考虑血管内皮瘤、转移瘤和肉芽肿性炎。上腹部MRI平扫+增强检查示(图 2):肝内见多发大小不等结节及肿块,呈长T1、环状长T2信号,边界清楚,较大的位于肝右叶,大小约5.4 cm×4.2 cm,呈葫芦状,扩散加权成像(diffusion-weighted imaging,DWI)呈环形高信号,表观弥散系数(apparent diffusion coefficient,ADC)图呈等高信号,增强扫描边缘环形进行性强化,部分病灶中央可见絮状强化;肝内外胆管无扩张;提示肝内多发占位,考虑血管内皮瘤、转移瘤和肉芽肿性炎。PET/CT全身扫描检查示(图 3):肝内可见多发大小不等结节状低密度影,最大直径约3.4 cm,CT值约32 Hu,边界清楚,密度不均,周围可见晕征,PET于上述部位放射性摄取环形增高,标准摄取值(standard uptake value,SUV)最大值3.1,平均值2.6;提示肝内多发占位伴环形代谢增高,并两肺多发小结节,考虑上皮样血管内皮瘤。肝脏超声造影成像示(图 4),超声造影显示肝内多发结节、肿块,见结节肿块自动脉期约11 s开始增强,表现为环状高增强,17 s达峰值,大部分结节、肿块中央部充填缺损呈“牛眼”征,动脉晚期25 s开始超声造影剂开始消退,门脉期35 s廓清呈低增强;提示肝内多发病灶呈环状“快进快出”表现,考虑恶性肿瘤(肝上皮样血管内皮瘤可能性大)。彩超引导下肝脏肿瘤穿刺组织学活检。送检穿刺组织中见一病灶区域,其中见不等量大小形态不一的血管腔,局灶呈分支状,肿瘤细胞从扩张的血管腔内向周围软组织浸润性生长,肿瘤细胞排列呈条索状或小巢状,细胞圆形、梭形或多角形,胞质丰富,略嗜酸,部分胞质内见空泡形成,间质纤维组织增生变性伴散在炎细胞浸润,病灶周肝组织中肝细胞肿胀变性,汇管区纤维增生(图 5)。免疫组织化学检查示(图 6),肿瘤细胞波形蛋白(vimentin,Vim)(+),血小板-内皮细胞黏附分子(platelet endothelial cell adhesion molecule-1,PECAM-1/CD31)(+),CD34(+),平滑肌肌动蛋白(smooth muscle actin,SMA)(+),上皮膜抗原(epithelial membrane antigen,EMA)(-),甲胎蛋白(alpha fetoprotein,AFP)(-),鼠抗人肝细胞抗原(Hep paraffin 1,Hep)(-),D2-40(-),Ki-67约6%,小胆管上皮细胞角蛋白(cytokeratin,CK)(+),CK7(+),CK8/18(+),CK19(+),特殊染色:网染(+),过碘酸雪夫氏染色(periodic acid-schiff stain, PAS染色)(-)。结合影像学及免疫组织化学检查,考虑上皮样血管内皮瘤。
|
| 图 1 2017年6月11日肝上皮样血管内皮细胞瘤患者腹部增强CT检查结果 |
|
| 图 2 2017年6月13日肝上皮样血管内皮细胞瘤患者腹部MRI检查结果 |
|
| 图 3 2017年6月14日肝上皮样血管内皮细胞瘤患者全身PET/CT检查结果 |
|
| 图 4 2017年6月13日肝上皮样血管内皮细胞瘤患者肝脏超声造影检查结果 |
|
| 图 5 2017年6月20日肝上皮样血管内皮细胞瘤患者肝脏穿刺组织病理检查结果(HE×100) |
|
| 图 6 2017年6月22日肝上皮样血管内皮细胞瘤患者免疫组织化学检查示CD31阳性(MaxVision×100) |
诊断明确后,请上级医院(中国人民解放军南京军区福州总医院)会诊后建议可尝试针对肉瘤的化疗方案(异环磷酰胺+多柔比星+顺铂),鉴于治疗意见不统一,请解放军总医院中国人民解放军总医院(301医院)会诊,经协调后拟行网络会诊,患者家属与所在部队协商后要求出院,回当地医院治疗,随后失访。
讨论上皮样血管内皮细胞瘤(epithelioid hemangioendothelioma,EHE)是一种临床罕见的低度恶性的血管源性肿瘤,多发于软组织、肺、骨和肝等部位。肝上皮样血管内皮细胞瘤于1984年首次报道[1],近年来国内外报道例数有所增加,可发生于任何年龄,以成年女性多见,发病初期无明显特异性临床表现,患者多因体检发现肝脏占位入院,部分患者可有腹胀、腹痛、恶心和体质量减轻等症状[2]。发病机制尚不清楚,可能与病毒性肝炎、孕激素失调、饮酒和口服避孕药等因素有关[3]。
在影像学检查表现方面,增强CT检查以多结节较为常见,部分瘤结节可融合,以包膜下分布为主。典型病灶可见包膜回缩征、靶征(target sign)及晕征(halo sign)[4]。MRI检查影像表现复杂多变,肿块边界较清晰,多发病变可呈融合趋势,病灶多位于肝脏边缘。肿瘤容易沿起源血管侵及肝静脉或门静脉系统的分支,导致血管管腔变窄或发生闭塞终止于病灶的边缘而形成棒棒糖征[5]。
在诊断及鉴别诊断方面,肝上皮样血管内皮细胞瘤主要需与肝癌、转移瘤、胆管细胞癌、硬化性血管瘤及血管肉瘤等鉴别。影像学检查出现棒棒糖征和包膜回缩征等一些较有提示性的影像学表现,对鉴别诊断有很大帮助,但最终确诊仍需要病理学结果。肝上皮样血管内皮细胞瘤肿瘤组织中免疫组织化学染色CD34、因子Ⅷ(factor Ⅷ,FⅧ)和钙调蛋白结合转录激活因子-1(calmodulin binding transcription activator 1,CAMTA1)相关抗原等内皮细胞标志物阳性[6]。也有研究报道,肝上皮样血管内皮细胞瘤肿瘤细胞表达转录因子E3(transcription factor E3,TFE3)[7]。此例患者作为1名战士,经常参与各种野外训练,虽无明显疫区和疫水接触史,但行穿刺组织病理学检查前仍需排除棘球蚴病,避免误诊穿刺后肝棘球蚴病囊液引致过敏和扩散,查棘球蚴病抗体结果为阴性后予安排穿刺活检证实。
在治疗及预后方面,本病目前尚无标准治疗方案,对于病变单发或局限于肝段或肝叶的肝上皮样血管内皮细胞瘤,治疗上首选根治性切除术,可获得较好的预后,其5年生存率可高达55%[8]。对于不能切除的病例,肝移植是治疗肝上皮样血管内皮细胞瘤的有效治疗措施,有数据显示,肝外转移并非行肝移植的绝对禁忌证[9-10]。一项研究总结于1984年11月至2014年5月在欧洲肝移植注册系统登记的149例肝上皮样血管内皮细胞瘤患者显示,肝移植术后1、5和10年生存率分别为88.6%、79.5%和74.4%,1、5和10年无瘤生存率分别为88.7%、79.4%和72.8%[10]。对于无法行根治性切除或肝移植治疗的病例,可选择化疗或经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)治疗。目前尚无统一化疗方案,可尝试应用氟尿嘧啶、多柔比星、紫杉醇、卡铂和依托泊苷等[11-12]。回顾性分析研究显示,TACE和手术切除的效果相似,3年生存率分别为81.6%和71.4%[13]。根据肿瘤病理特性,具有抑制新生血管形成的沙利度胺、来那度胺和干扰素-α等可通过抑制血管内皮细胞的增殖而对肝上皮样血管内皮细胞瘤有一定治疗作用[14-16]。美国一项贝伐珠单抗Ⅱ期临床试验和法国一项索拉非尼Ⅱ期临床研究均显示抗血管生成靶向药物对肝上皮样血管内皮细胞瘤具有潜在治疗价值[17-18]。
| [1] |
Ishak KG, Sesterhenn IA, Goodman MZ, et al. Epithelioid hemangioendothelioma of the liver: a clinicopathologic and follow up study of 32 cases[J]. Hum Pathol, 1984, 15(9): 839-852. DOI:10.1016/S0046-8177(84)80145-8 |
| [2] |
Marco SZ, Jordi R, Carla M, et al. Hepatic epithelioid hemangioendothelioma: An international multicenter study[J]. Dig Liver Dis, 2020, 52(9): 1041-1046. DOI:10.1016/j.dld.2020.05.003 |
| [3] |
Yang JW, Li Y, Xie K, et al. Spontaneous rupture of hepatic epithelioid hemangioendothelioma: A case report[J]. World J Gastroenterol, 2017, 23(1): 185-190. DOI:10.3748/wjg.v23.i1.185 |
| [4] |
Ganeshan D, Pickhardt PJ, Morani AC, et al. Hepatic hemangioendothelioma: CT, MR, and FDG-PET-CT in 67 patients-a bi-institutional comprehensive cancer center review[J]. Eur Radiol, 2020, 30(5): 2435-2442. DOI:10.1007/s00330-019-06637-3 |
| [5] |
丛振杰, 王彬, 林俊东, 等. 肝脏上皮样血管内皮细胞瘤的影像学检查特征[J]. 中华消化外科杂志, 2015, 14(10): 870-874. DOI:10.3760/cma.j.issn.1673-9752.2015.10.019 |
| [6] |
Taniai T, Onda S, Sato S, et al. Hepatic epithelioid hemangiothelioma: difficult differential diagnosis from angiosarcoma[J]. Case Rep Gastroenterol, 2020, 14(1): 56-62. DOI:10.1159/000505513 |
| [7] |
Puls F, Niblett A, Clarke J, et al. YAP1-TFE3 epithelioid hemangioendothelioma: a case without vasoformation and a new transcript variant[J]. Virchows Arch, 2015, 466(4): 473-478. DOI:10.1007/s00428-015-1730-y |
| [8] |
Yousaf N, Maruzzo M, Judson I, et al. Systemic treatment options for epithelioid hem angioendothelioma: the Royal Marsden Hospital experience[J]. Anticancer Res, 2015, 35(1): 473-480. |
| [9] |
Xiana R, Javier LM, Jose LL, et al. Hepatic epithelioid hemangioendothelioma as a rare indication for liver transplation[J]. Transpl Proc, 2020, 52(5): 1453-1454. DOI:10.1016/j.transproceed.2020.01.090 |
| [10] |
Lai Q, Feys E, Karam V, et al. Hepatic epithelioid hemangioendothelioma and adult liver transplantation: proposal for a prognostic score based on the analysis of the ELTR-ELITA registry[J]. Transplantation, 2017, 101(3): 555-564. DOI:10.1097/TP.0000000000001603 |
| [11] |
Sardaro A, Bardoscia L, Petruzzelli MF, et al. Epithelioid hemangioendothelioma: an overview and update on a rare vascular tumor[J]. Oncol Rev, 2014, 8(2): 259. |
| [12] |
Yousaf N, Maruzzo M, Judson I, et al. Systemic treatment options for epithelioid haemangioendothelioma: the Royal Marsden Hospital experience[J]. Anticancer Res, 2015, 35(1): 473-480. |
| [13] |
Wang LR, Zhou JM, Zhao YM, et al. Clinical experience with primary hepatic epithelioid hemangioendothelioma: retrospective study of 33 patients[J]. World J Surg, 2012, 36(11): 2677-2683. DOI:10.1007/s00268-012-1714-x |
| [14] |
Salech F, Valderrama S, Nervi B, et al. Thalidomide for the treatment of metastatic hepatic epithelioid hemangioendothelioma: a case report with along term follow-up[J]. Ann Hepatol, 2011, 10(1): 99-102. DOI:10.1016/S1665-2681(19)31596-0 |
| [15] |
Pallotti MC, Nannini M, Agostinelli C, et al. Long-term durable response to lenalidomide in a patient with hepatic epithelioid hemangioendothelioma[J]. World J Gastroenterol, 2014, 20(22): 7049-7054. DOI:10.3748/wjg.v20.i22.7049 |
| [16] |
Demir L, Can A, Oztop R, et al. Malignant epithelioid hemangioendothelioma progressing after chemotherapy and interferon treatment: a case presentation and a brief review of the literature[J]. J Cancer Res Ther, 2013, 9(1): 125-127. DOI:10.4103/0973-1482.110386 |
| [17] |
Agulnik M, Yarber JL, Okuno SH, et al. An open-label, multicenter, phase Ⅱ study of bevacizumab for the treatment of angiosarcoma and epithelioid hemangioendotheliomas[J]. Ann Oncol, 2013, 24(1): 257-263. DOI:10.1093/annonc/mds237 |
| [18] |
Chevreau C, Le Cesne A, Ray-Coquard I, et al. Sorafenib in patients with progressive epithelioid hemangioendothelioma: a phase 2 study by the French Sarcoma Group (GSF/GETO)[J]. Cancer, 2013, 119(14): 2639-2644. DOI:10.1002/cncr.28109 |
 2021, Vol. 36
2021, Vol. 36


