文章信息
- 杨兆硕, 厉天瑜, 鲍旭霞, 范越, 楼文晖
- Yang Zhaoshuo, Li Tianyu, Bao Xuxia, Fan Yue, Lou Wenhui
- 改良吉西他滨联合白蛋白结合型紫杉醇方案一线治疗不可切除进展期胰腺癌的临床研究
- Clinical study of modifi ed gemcitabine plus nab-paclitaxel in fi rst-line treatment of unresectable advanced pancreatic cancer
- 实用肿瘤杂志, 2021, 36(6): 535-541
- Journal of Practical Oncology, 2021, 36(6): 535-541
-
通信作者
- 范越, E-mail: fan.yue@zs-hospital.sh.cn
-
文章历史
- 收稿日期:2021-01-28
2. 复旦大学附属中山医院胰腺外科, 上海 200032
2. Department of Pancreatic Surgery, Zhongshan Hospital, Fudan University, Shanghai 200032, China
胰腺导管腺癌是临床常见消化系统恶性肿瘤之一,占胰腺癌患者的90%[1]。胰腺癌病死率仍呈逐步增长趋势,死亡率居于全球恶性肿瘤第4位[2]。胰腺癌发病隐匿,患者早期多无明显不适症状,确诊时 > 90%的患者存在远处转移灶,5年总生存(overall survival,OS)率约为9%[3-4]。
吉西他滨(gemcitabine)可改善转移性胰腺癌的预后,其中位OS约6个月[5]。FOLFIRINOX方案(亚叶酸钙+氟尿嘧啶+伊立替康+奥沙利铂)较GEM延长不可切除进展期胰腺癌患者的中位OS(11.1个月 vs 6.8个月,P < 0.01)及无进展生存期(progression-free survival,PFS;6.4个月 vs 3.3个月,P < 0.01),但FOLFIRINOX方案的不良反应发生率较高,> 45%的患者出现≥3级的不良事件[5],限制其临床的广泛使用,适用于美国东部肿瘤协作组(Eastern Cooperative Oncology Group,ECOG)评分较好的不可切除进展期胰腺癌患者。此后几项吉西他滨为基础的化疗方案的临床研究相继开展,其中有关AG方案(吉西他滨+白蛋白结合型紫杉醇)和吉西他滨联合替吉奥的临床研究的结果使吉西他滨为基础的化疗方案成为最主要的转移性胰腺癌治疗选择之一[6-8]。其中AG方案较吉西他滨单药延长患者中位OS 1.9个月(8.7个月 vs 6.6个月,P < 0.01)和PFS 2个月(5.5个月 vs 3.7个月,P < 0.01),AG方案成为转移性胰腺癌的一线治疗选择之一。
虽然AG方案的耐受性较好,但研究表明,仍有 > 37%的不可切除进展期胰腺癌患者出现≥3级的不良事件[5]。但由于种族差异及基因多态性的不同,不同人群的化疗耐受性及疗效有一定差别。美国和欧洲的胰腺肿瘤中心已开展改良2周AG方案,结果显示在体力评分较差的不可切除进展期胰腺癌患者中,化疗的安全性及有效性与标准方案相当而化疗完成率更高。在中国人群中未有相关临床试验报道。本中心在前期临床观察基础上[9],探索适合于中国人群的AG方案,使用2周AG方案(吉西他滨1 000 mg/m2 d1+白蛋白结合型紫杉醇d1 125 mg/m2)方案,同时与3周AG方案比较[吉西他滨(1 000 mg/m2,d1、d8)+白蛋白结合型紫杉醇(125 mg/m2,d1、d8)]。本研究拟回顾性分析2周AG方案在不可切除进展期胰腺癌一线治疗中的安全性及有效性。
1 资料与方法 1.1 一般资料收集复旦大学附属中山医院胰腺肿瘤中心2013年3月至2018年12月142例使用AG方案一线治疗晚期不可切除进展期胰腺癌患者的资料。所有患者治疗前均已了解化疗可能出现的不良反应,并签署治疗知情同意书。
1.2 纳入和排除标准纳入标准:(1)均经病理组织学或细胞病理学确诊为胰腺腺癌;(2)存在≥1个可评估和测量远处转移病灶;(3)应用AG方案周期≥2个周期;(4)治疗前血常规、肝肾功能和心电图在正常范围;(5)年龄18~85岁;(6)ECOG评分≤2分。排除标准:(1)多原发肿瘤及病理学不明确的患者;(2)接受过吉西他滨联合其他药物方案治疗;(3)化疗前已接受过手术、放疗或粒子照射等治疗;(4)研究资料不全。最终纳入本研究的患者的治疗方案剂量及用法参考美国国立综合癌症网络(National Comprehensive Cancer Network,NCCN)胰腺癌临床实践指南(2011)[10]。纳入本研究人群均重复疗程直至疾病变化、出现不可耐受不良反应或患者拒绝治疗。
1.3 治疗方案所有患者分为两组,2周方案组和3周方案组。2周方案组治疗方案:白蛋白结合型紫杉醇125 mg/m2静脉滴注,d1;吉西他滨1 000 mg/m2静脉滴注,d1;14 d为1个周期,共治疗12个周期。3周方案组治疗方案:白蛋白结合型紫杉醇125 mg/m2静脉滴注,d1、d8;吉西他滨1 000 mg/m2静脉滴注,d1、d8;21 d为1个周期,共治疗6个周期。化疗前完善相关检查,行血常规、肝肾功能、电解质和心脏标志物检查,如出现3/4级血液学毒性者延迟化疗周期进行治疗,待患者各项指标符合化疗标准后进行下一个周期的化疗。如出现体质量下降或化疗相关不良反应则在下次化疗时按体表面积及患者状态情况进行减量治疗。
1.4 观察指标及随访本研究主要终点指标为两组患者治疗后临床疗效评估、PFS及OS。PFS(从第1次接受化疗到放射影像学及其他检查发现肿瘤出现进展或因其他任何原因导致死亡的时间)评价疾病控制情况。评估结果参照实体瘤反应评价标准(Response Evaluation Criteria in Solid Tumors,RECIST)1.1标准分为完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)及疾病进展(progressive disease,PD),CR+PR为客观有效率(objective response rate,ORR)[11-12]。通过血常规及肝肾功能等检查以及临床观察,参照患者自我报告结果的通用不良事件术语标准(Patient Reported Outcomes-Common Terminology Criteria Adverse Events Version,PRO-CTCAE)[13],记录治疗过程中出现的3/4级不良反应事件次数。结合住院病历、门诊病历及微信随访,对患者相关临床数据进行录入。记录患者疾病进展及死亡时间、治疗效果及3/4级不良反应事件发生情况。已出院但未达研究终点患者,每1个月进行电话或短信随访,结合门诊记录,对患者相关资料进行后续收集。以第1次接受化疗的时间作为OS及PFS计算的起点时间。如截至最后随访时间(2020年9月30日)仍未出现PD或死亡,记为删失。
1.5 统计学分析采用SPSS 22.0软件进行数据分析。Kaplan-Meier法进行生存分析。计数资料采用频数(百分比)表示,组间比较采用χ2检验和非参数检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床特征142例患者中,2周方案组76例,3周方案组66例。2周方案组和3周方案组患者中位年龄分别为66岁(43~81岁)和65岁(37~82岁)。2周方案组患者肿瘤部位位于胰头、胰体和胰尾的比例分别为46.0%、34.2%和19.7%,3周方案组则为42.4%、28.7%和28.7%。2周方案组ECOG评分0、1、2和3分以及未记录的患者为8、29、28、1和10例,3周方案组为15、25、23、0和3例。根据美国肿瘤联合会(American Association of Cancer,AJCC)(第8版)分期标准[14],2周方案组局部进展期患者24例,远处转移52例。3周方案组局部进展期患者21例,远处转移45例。两组患者主要转移的脏器为肝脏、肺、腹膜和淋巴结。2周方案组中位化疗周期高于3周方案组。两组患者在ECOG评分方面比较,差异具有统计学意义(P=0.03,表 1),两组其余临床特征比较,差异均无统计学意义(均P > 0.05)。
| 临床特征 | 2周方案组(n=76) | 3周方案组(n=66) | χ2值 | P值 |
| 中位年龄(岁,范围) | 66(43~81) | 65(37~82) | 0.611 | 0.54 |
| 性别 | 0.112 | 0.74 | ||
| 男性 | 47(61.8) | 39(59.1) | ||
| 女性 | 29(38.2) | 27(40.9) | ||
| 肿瘤部位 | 0.879 | 0.35 | ||
| 胰头 | 35(46.0) | 28(42.4) | ||
| 胰体 | 26(34.2) | 19(28.7) | ||
| 胰尾 | 15(19.7) | 19(28.7) | ||
| ECOG评分 | 7.017 | 0.03 | ||
| 0 | 8(10.5) | 15(22.7) | ||
| 1 | 29(38.1) | 25(37.8) | ||
| 2 | 28(36.8) | 23(34.8) | ||
| 3 | 1(1.3) | 0(0.0) | ||
| 未记录 | 10(13.1) | 3(4.5) | ||
| 分期 | 0.001 | 0.98 | ||
| 局部进展期 | 24(31.5) | 21(31.8) | ||
| 远处转移 | 52(68.4) | 45(68.1) | ||
| 主要转移的病灶 | 5.201 | 0.267 | ||
| 肝脏 | 45(59.2) | 25(37.8) | ||
| 肺 | 12(15.7) | 9(13.6) | ||
| 腹膜 | 18(23.6) | 21(31.8) | ||
| 淋巴结 | 25(32.8) | 28(42.4) | ||
| 其他 | 42(55.2) | 31(46.9) | ||
| CA199水平 | 0.004 | 0.95 | ||
| 正常(≤35 kU/L) | 14(18.4) | 9(13.6) | ||
| > 正常且 < 60倍正常上限 | 29(38.1) | 31(46.9) | ||
| ≥60倍正常上限 | 33(43.4) | 26(39.3) | ||
| 中位化疗周期(范围) | 11(2~20) | 7(2~17) | ||
| 注 ECOG:美国东部肿瘤协作组(Eastern Cooperative Oncology Group);CA199:糖类抗原199(carbohydrate antigen 199) | ||||
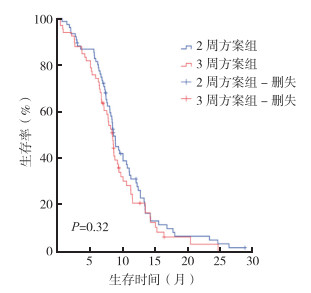
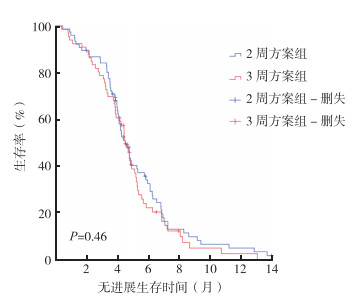
2周方案组和3周方案组中位OS分别为8.7个月(95%CI:8.09~9.27个月)和8.5个月(95%CI:7.66~9.38个月),两组比较,差异无统计学意义(P=0.32,图 1)。两组中位PFS分别为4.7个月(95%CI:3.8~5.1个月)和4.6个月(95%CI:4.1~4.9个月),两组比较,差异无统计学意义(P=0.46,图 2)。2周方案组8例记为无法评估(5例后续治疗在外地完成,3例病情变化无法及时评估);其余患者CR 1例,PR 19例,SD 23例,PD 25例。3周方案组8例记为无法评估(5例化疗2个周期后不能耐受拒绝治疗,3例在外地治疗无法及时评估);其余患者CR 0例,PR 15例,SD 19例,PD 24例。两组治疗ORR分别为26.1%和22.7%(χ2=-0.66,P=0.51;表 2)。
|
| 图 1 AG方案2周方案组和3周方案组的不可切除进展期胰腺癌患者的总生存曲线比较 Fig.1 Overall survival curves of unresectable advanced pancreatic cancer patients treated with AG regimen in the biweekly group and the 3-weekly group |
|
| 图 2 AG方案2周方案组和3周方案组的不可切除进展期胰腺癌患者的无进展生存曲线比较 Fig.2 Progression free survival curves of unresectable advanced pancreatic cancer patients treated with AG regimen in the biweekly group and the 3-weekly group |
| 治疗反应 | 2周方案组(n=76) | 3周方案组(n=66) |
| CR | 1 | 0 |
| PR | 19 | 15 |
| SD | 23 | 19 |
| PD | 25 | 24 |
| 无法评估 | 8 | 8 |
| ORR(%) | 26.1 | 22.7 |
| 注 CR:完全缓解(complete response);PR:部分缓解(partial response);SD:疾病稳定(stable disease);PD:疾病进展(progressive disease);ORR:客观有效率(objective response rate) | ||
化疗期间,2周方案组有37例发生3/4级不良反应事件(82次),其中最常见3/4级不良反应为中性粒细胞减少(27.6%)、周围神经毒性(17.1%)、感染性发热(14.5%)、血红蛋白减少(11.8%)及血小板减少(11.8%)。3周方案组有28例发生3/4级不良反应事件(114次),其中最常见3/4级不良反应为中性粒细胞减少(39.4%)、周围神经病变(31.8%)、感染性发热(18.1%)及血红蛋白减少(16.7%)。出现不良反应的患者在治疗过程中出现≥3级不良反应事件,经对症支持治疗后均可耐受后续化疗。2周方案组3/4级周围神经毒性发生率低于3周方案组,差异具有统计学意义(P=0.04,表 3)。其余3/4级不良反应发生率两组比较,差异均无统计学意义(均P > 0.05,表 3)。3周方案组使用粒细胞集落刺激因子患者比例高于2周方案组[51.5%(34/66) vs 26.3%(20/76),χ2=9.518,P=0.02]。
| 3/4级不良反应 | 2周方案组(n=76) | 3周方案组(n=66) | χ2值 | P值 |
| 中性粒细胞减少 | 21(27.6) | 26(39.4) | 2.203 | 0.13 |
| 血小板减少 | 7(9.2) | 8(12.1) | 0.317 | 0.57 |
| 血红蛋白减少 | 9(11.8) | 11(16.7) | 0.679 | 0.41 |
| 感染性发热 | 11(14.5) | 12(18.1) | 0.358 | 0.55 |
| 周围神经毒性 | 13(17.1) | 21(31.8) | 4.199 | 0.04 |
| 腹泻 | 5(6.5) | 4(6.1) | 1.032 | 0.90 |
| 过敏反应 | 2(2.6) | 1(1.5) | 0.213 | 0.64 |
| 恶心 | 2(2.6) | 3(4.5) | 0.381 | 0.54 |
| 呕吐 | 2(2.6) | 4(6.1) | 1.026 | 0.31 |
| 肝功能损害 | 4(5.2) | 6(9.1) | 0.791 | 0.37 |
| 乏力 | 4(5.2) | 8(12.1) | 2.147 | 0.14 |
| 纳差 | 7(9.2) | 10(15.1) | 1.183 | 0.27 |
胰腺癌恶性程度高,发病隐匿,早期症状不明显,整体5年OS率 < 9%,晚期患者中位OS仅6个月,是目前预后最差的实体肿瘤之一[15]。患者就诊时往往处于进展期,手术是根治性治疗胰腺癌的首选方式,但仅有约20%的患者可行手术切除。因此,对于不能手术切除或术后复发的患者,系统化疗仍是目前最为主要的治疗方法之一[10]。多项研究结果显示,AG方案可有效延长不可切除进展期胰腺癌的OS并控制疾病进展[7],同时与FOLFIRINOX方案比较,具有更低的不良反应发生率和更高的耐受性[16-17],为高龄患者和ECOG评分≤2的患者提供有效的可选方案。
尽管AG方案能够延长不可切除进展期胰腺癌患者的OS,但因进展期胰腺癌患者ECOG评分较低,血液系统及肝肾功能储备功能有限,同时标准的AG方案每周给药与显著的毒性有关,约50%的患者需要延迟或减少剂量[18]。同时标准每周化疗方案的累积药物毒性将显著限制一线化疗耐药后续治疗方案的选择。MPACT临床试验中不可切除进展期胰腺癌患者接受标准的AG方案为白蛋白结合型紫杉醇(125 mg/m2静脉滴注,d1、d8、d15)联合吉西他滨(1 000 mg/m2静脉滴注,d1、d8、d15),28 d为1个周期[19]。其中只有71%的患者全剂量接受标准方案的化疗,41%和47%的患者需要分别减少蛋白结合型紫杉醇和吉西他滨的用量,22%的患者因为药物毒性停止治疗,主要的3/4不良反应包括神经系统和血液系统不良反应等。在中国人群的亚组分析中,最常见的≥3/4级不良事件为白细胞减少(35%)、中性粒细胞减少(34%)、贫血(15%)、血小板减少(10%)和疲劳(13%),其中49%的中国患者需要减少药物使用剂量或者延迟化疗时间[19]。
基于上述研究结果,笔者考虑进一步改良方案,降低药物毒性,改善患者预后,保持疗效稳定。因此在临床实践中笔者采用2周AG方案和3周AG方案。本研究回顾性分析发现2周方案组和3周方案组中位OS分别为8.7个月和8.5个月(P=0.32)。中位PFS分别为4.7个月和4.6个月。而采用4周标准AG方案的不可切除进展期胰腺癌患者中位OS为8.5个月,中位PFS为5.5个月,与2周及3周AG方案疗效基本相当。在MPACT临床试验中,接受标准AG方案治疗的不可切除进展期胰腺癌患者中位OS为9.8个月,中位PFS为6个月[19]。造成这些差异的主要原因有:本研究是单中心回顾性研究,研究样本偏少,可能存在选择偏倚,而MPACT试验为多中心、前瞻性临床试验,研究样本431例;本研究中2周方案组和3周方案组的中位年龄为66岁及65岁,高于MPACT试验的中位年龄61岁;本研究患者ECOG评分较低,超过1/3的患者ECOG评分≤2分。而MPACT试验患者仅有 < 10%的患者卡氏(Karnofsky,KPS)评分 < 70分。同时在其他中心开展的接受AG方案治疗的不可切除进展期胰腺癌患者的回顾性研究也显示,2周方案不劣效于标准4周方案的疗效。美国一项包含79例接受2周AG方案治疗的不可切除进展期胰腺癌患者的回顾性研究的患者的基线数据与本研究相似,中位OS和PFS分别为10.0个月和5.4个月,但研究中排除了ECOG评分≥2的患者[15]。在另外一项46例2周AG方案治疗的不可切除进展期胰腺癌患者加量2周方案的临床回顾性研究中(白蛋白结合型紫杉醇175 mg/m2静脉滴注,d1;吉西他滨1 500 mg/m2静脉滴注,d1;14 d为1个周期),患者基线特征与本研究相似,患者中位OS和PFS分别为10个月和5个月[20]。在安德森肿瘤中心开展的235例接受2周AG方案治疗的不可切除进展期胰腺癌患者的回顾性研究显示,中位OS和PFS分别为7.5个月和5.3个月,基线数据及使用结果与本研究基本相似[21]。在3周AG方案中,中国患者中位OS及PFS分别为12.2个月和5.2个月,主要原因是该研究中中国患者偏少(仅21例),患者ECOG评分均≤1且中位年龄仅为55岁。在笔者既往的研究中,接受3周AG方案治疗的不可切除进展期胰腺癌患者患者的中位PFS和OS分别为5.0个月和8.0个月,2周方案不劣于3周方案[9]。在其他中心开展的临床试验也表明,3周AG方案的中位OS和PFS分别为10.6个月和3.9个月,说明2周AG方案不劣于3周AG方案[22]。
本研究显示,在安全性方面,两组患者3/4级不良反应发生率除周围神经毒性外,在其他方面差异均无统计学意义(均P > 0.05)。而在MPACT试验中,最常见的不良反应为中性粒细胞减少(38%)、周围神经毒性(23%)和发热(17%)。在中性粒细胞减少方面,本研究的2周方案组(27.6%)优于MPACT试验,3周方案组(39.4%)与MPACT试验基本相似。而在周围神经毒性方面,2周方案组(17.1%)优于3周方案(31.8%)及MPACT试验(23%)。说明2周方案组能够减少患者的周围神经毒性。在使用粒细胞集落刺激因子患者比例上,2周方案组和3周方案组分别为26.3%和51.5%,2周方案组优于3组方案,说明2周方案组能够减少患者化疗延迟,提高化疗完成率。
综上所述,基于回顾性研究的初步结果,2周AG方案与3周AG方案比较,生存获益相当,不良反应减少。如何探索进一步优化改良方案(如探索不同状态患者化疗合适剂量强度)值得持续关注并探索。基因检测结果与肿瘤标志物联合监测利于预测个体化胰腺癌化疗疗效的研究同样值得关注[23-24]。总体来说,本研究为单中心回顾性研究,纳入病例数尚少,随访时间较短,有待扩大样本量及开展前瞻性研究更客观地验证2周AG方案在一线转移性胰腺癌中的应用价值及优势。
| [1] |
Ducreux M, Cuhna AS, Caramella C, et al. Cancer of the pancreas: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up[J]. Ann Oncol, 2015, 26(Suppl 5): v56-68. |
| [2] |
Miller KD, Fidler-Benaoudia M, Keegan TH, et al. Cancer statistics for adolescents and young adults, 2020[J]. CA Cancer J Clin, 2020, 70(6): 443-459. DOI:10.3322/caac.21637 |
| [3] |
肖洪斌, 张莹. YAP1蛋白表达在胰腺癌肿瘤异质性及病理诊断中的应用[J]. 实用肿瘤杂志, 2020, 35(6): 530-533. |
| [4] |
McGuigan A, Kelly P, Turkington RC, et al. Pancreatic cancer: A review of clinical diagnosis, epidemiology, treatment and outcomes[J]. World J Gastroenterol, 2018, 24(43): 4846-4861. DOI:10.3748/wjg.v24.i43.4846 |
| [5] |
Conroy T, Desseigne F, Ychou M, et al. FOLFIRINOX versus gemcitabine for metastatic pancreatic cancer[J]. N Engl J Med, 2011, 364(19): 1817-1825. DOI:10.1056/NEJMoa1011923 |
| [6] |
Von Hoff DD, Ervin T, Arena FP, et al. Increased survival in pancreatic cancer with nab-paclitaxel plus gemcitabine[J]. N Engl J Med, 2013, 369(18): 1691-1703. DOI:10.1056/NEJMoa1304369 |
| [7] |
Ueno H, Ioka T, Ikeda M, et al. Randomized phase Ⅲ study of gemcitabine plus S-1, S-1 alone, or gemcitabine alone in patients with locally advanced and metastatic pancreatic cancer in Japan and Taiwan: GEST study[J]. J Clin Oncol, 2013, 31(13): 1640-1648. DOI:10.1200/JCO.2012.43.3680 |
| [8] |
刘艳杰, 陆翰杰. 白蛋白结合紫杉醇联合替吉奥治疗晚期胰腺癌的疗效及安全性观察[J]. 中国临床新医学, 2019, 12(9): 997-1000. DOI:10.3969/j.issn.1674-3806.2019.09.17 |
| [9] |
宋超, 冯艺, 范越, 等. 白蛋白结合型紫杉醇联合吉西他滨一线治疗晚期胰腺癌的疗效观察[J]. 临床肿瘤学杂志, 2016, 21(7): 642-645. |
| [10] |
虞先濬, 刘亮, 徐华祥, 等. 胰腺癌综合诊治指南(2018版)[J]. 中华外科杂志, 2018, 56(7): 481-494. |
| [11] |
Kitajima K, Maruyama M, Minami T, et al. Comparison of modified Response Evaluation Criteria in Solid Tumors, European Organization for Research and Treatment of Cancer criteria, and PET Response Criteria in Solid Tumors for evaluation of tumor response to chemotherapy and prognosis prediction in patients with unresectable malignant pleural mesothelioma[J]. Nucl Med Commun, 2020, 41(8): 790-799. DOI:10.1097/MNM.0000000000001223 |
| [12] |
Frampas E, David A, Regenet N, et al. Pancreatic carcinoma: Key-points from diagnosis to treatment[J]. Diagn Interv Imaging, 2016, 97(12): 1207-1223. DOI:10.1016/j.diii.2016.07.008 |
| [13] |
Pelzer U, Opitz B, Deutschinoff G, et al. Efficacy of prophylactic low-molecular weight heparin for ambulatory patients with advanced pancreatic cancer: outcomes from the CONKO-004 trial[J]. J Clin Oncol, 2015, 33(18): 2028-2034. DOI:10.1200/JCO.2014.55.1481 |
| [14] |
Allen PJ, Kuk D, Castillo CF, et al. Multi-institutional validation study of the American Joint Commission on Cancer (8th edition) changes for T and N staging in patients with pancreatic adenocarcinoma[J]. Ann Surg, 2017, 265(1): 185-191. DOI:10.1097/SLA.0000000000001763 |
| [15] |
Chen AP, Setser A, Anadkat MJ, et al. Grading dermatologic adverse events of cancer treatments: the Common Terminology Criteria for Adverse Events Version 4.0[J]. J Am Acad Dermatol, 2012, 67(5): 1025-1039. DOI:10.1016/j.jaad.2012.02.010 |
| [16] |
Han SY, Kim DU, Seol YM, et al. Comparison of gemcitabine plus nab-paclitaxel and FOLFIRINOX in metastatic pancreatic cancer[J]. World J Clin Cases, 2020, 8(17): 3718-3729. DOI:10.12998/wjcc.v8.i17.3718 |
| [17] |
钱元, 郑松, 贾长库. 改良FOLFIRINOX与吉西他滨为基础的化疗方案在进展期胰腺癌治疗中的对比研究[J]. 实用肿瘤杂志, 2018, 33(3): 237-245. |
| [18] |
Philip PA, Lacy J, Portales F, et al. Nab-paclitaxel plus gemcitabine in patients with locally advanced pancreatic cancer (LAPACT): a multicentre, open-label phase 2 study[J]. Lancet Gastroenterol Hepatol, 2020, 5(3): 285-294. DOI:10.1016/S2468-1253(19)30327-9 |
| [19] |
Vogel A, Römmler-Zehrer J, Li JS, et al. Efficacy and safety profile of nab-paclitaxel plus gemcitabine in patients with metastatic pancreatic cancer treated to disease progression: a subanalysis from a phase 3 trial (MPACT)[J]. BMC Cancer, 2016, 16(1): 817. DOI:10.1186/s12885-016-2798-8 |
| [20] |
Kokkali S, Tripodaki ES, Drizou M, et al. Biweekly gemcitabine/nab-paclitaxel as first-line treatment for advanced pancreatic cancer[J]. In Vivo, 2018, 32(3): 653-657. |
| [21] |
Luo G, Liu C, Guo M, et al. Potential biomarkers in lewis negative patients with pancreatic cancer[J]. Ann Surg, 2017, 265(4): 800-805. DOI:10.1097/SLA.0000000000001741 |
| [22] |
陆滢滢, 吉冬丽, 殷荣华, 等. 白蛋白结合型紫杉醇联合吉西他滨一线治疗晚期胰腺癌的疗效观察[J]. 临床和实验医学杂志, 2019, 18(24): 2649-2652. DOI:10.3969/j.issn.1671-4695.2019.24.020 |
| [23] |
Wang Y, Camateros P, Cheung WY. A real-world comparison of FOLFIRINOX, gemcitabine plus nab-paclitaxel, and gemcitabine in advanced pancreatic cancers[J]. J Gastrointest Cancer, 2019, 50(1): 62-68. DOI:10.1007/s12029-017-0028-5 |
| [24] |
Otsuka T, Shirakawa T, Shimokawa M, et al. A multicenter propensity score analysis of FOLFIRINOX vs gemcitabine plus nab-paclitaxel administered to patients with metastatic pancreatic cancer: results from the NAPOLEON study[J]. Int J Clin Oncol, 2021, 26(5): 941-950. DOI:10.1007/s10147-021-01859-2 |
 2021, Vol. 36
2021, Vol. 36


