文章信息
- 周剑烽, 王铁君
- 异时性鼻咽癌、背部皮肤隆突性纤维肉瘤和外耳道癌三重癌一例
- 实用肿瘤杂志, 2021, 36(4): 358-362
-
通信作者
- 王铁君, E-mail: m13943016598@163.com
-
文章历史
- 收稿日期:2020-07-09
多原发癌(multiple primary malignant neoplasms,MPMNs)是指人体内单个或多个器官同时或先后发生≥2个原发癌。多原发癌可出现三重癌、四重癌甚至六重癌,其发病率依次呈逐渐降低趋势,二重癌最常见[1]。本文报道1例外耳道癌、鼻咽癌和背部皮肤纤维肉瘤三重癌患者经综合治疗后取得满意疗效的经过,并讨论多重癌的发病机制及诊疗标准。
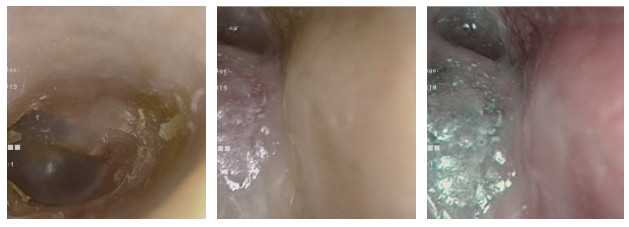
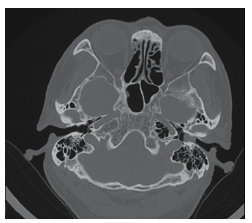
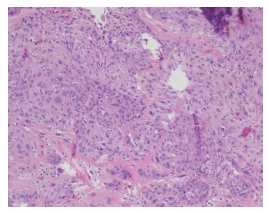
1 病例资料患者男性,66岁。2019年3月无明显诱因出现左耳流液,无臭味,无疼痛,无血丝。2019年4月出现听力下降,伴有耳闷感,伴有枕后部麻木,无耳痛及耳鸣。2019年5月22日就诊于吉林大学第二医院。2019年5月23日电子鼻咽镜检查示,左侧外耳道似肉芽样物堵塞,表面附分泌物,鼓膜视不见,右耳鼓膜标志清(图 1)。2019年5月23日颞骨CT检查示,左侧外耳道可见软组织密度影,最大层面大小约为9 mm×7 mm,CT值约为54 HU,紧贴鼓膜,周围骨质未见破坏(图 2)。于2019年5月29日在插管全麻下行左侧外耳道肿物取检、左侧外耳道恶性肿瘤切除、左乳突根治、左侧外耳道切除和左侧外耳道植皮成形术。术后病理检查提示(左外耳道)中分化鳞状细胞癌。免疫组织化学染色结果示人类疱疹病毒早期核糖核酸(Epstein-Barr virus early RNA,EBER)(-)和表皮生长因子受体(epidermal growth factor receptor,EGFR)(大部分+),见图 3。
|
| 图 1 异时性鼻咽癌、背部皮肤隆突性纤维肉瘤和外耳道癌三重癌患者电子鼻咽镜检查结果(2019年5月23日) |
|
| 图 2 异时性鼻咽癌、背部皮肤隆突性纤维肉瘤和外耳道癌三重癌患者颞骨CT检查结果(2019年5月23日) |
|
| 图 3 异时性鼻咽癌、背部皮肤隆突性纤维肉瘤和外耳道癌三重癌患者外耳道肿瘤手术标本病理切片(HE×100) |
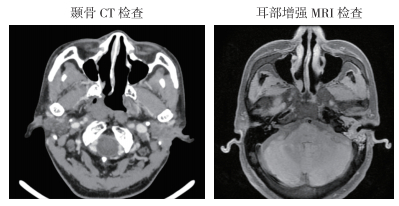
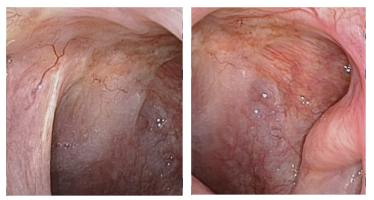
后因个人原因未行术后预防性放疗,后左侧耳道肿物复发。2019年10月8日于吉林大学第二医院行颞骨CT检查示左侧乳突骨质局部骨质缺如,周围可见片状软组织密度影,增强扫描软组织影呈明显不均匀强化,鼓膜增厚,左侧中耳乳突气化不良,其内可见片状密度增高影(图 4)。2019年10月16日耳部增强MRI检查示,左侧外耳道较右侧增宽,形态不规整,周围骨质信号局部缺如,左侧术后残腔、左侧鼓室及鼓窦内可见一大小约19 mm×16 mm×18 mm稍长T1稍长T2信号影,增强扫描不均匀强化,扩散加权成像(diffusion-weighted imaging,DWI)呈高信号。左侧乳突区可见斑片状长T1长T2信号影,DWI呈低信号,增强扫描未见强化。左侧外耳道恶性肿瘤术后残腔及中耳内异常信号符合恶性肿瘤术后复发(图 4)。2019年10月14日给予根治性放疗及对症支持治疗,处方剂量计划肿瘤靶区(planning gross tumor volume,PGTV):71.94 Gy/33 F,计划靶区(planning target volume,PTV):60.06 Gy/33 F。计划危及体积(planning risk volume,PRV)限制为:脊髓≤40 Gy,脑干≤54 Gy。该患者20年前诊断为右侧鼻咽癌,给予根治性放疗后定期复查,未见明显异常。2019年10月16日鼻咽镜检查示,右侧咽隐窝浅,左侧鼻咽部黏膜光滑(图 5)。
|
| 注 颞骨CT检查和耳部增强MRI检查均提示左侧外耳道恶性肿瘤复发 图 4 异时性鼻咽癌、背部皮肤隆突性纤维肉瘤和外耳道癌三重癌患者颞骨CT检查(2019年10月8日) 和耳部增强MRI检查结果(2019年10月16日) |
|
| 图 5 异时性鼻咽癌、背部皮肤隆突性纤维肉瘤和外耳道癌三重癌患者鼻咽镜检查结果(2019年10月16日) |
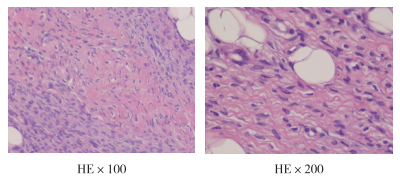
该患者于2017年年初无明显诱因发现左侧背部肿物,后肿物逐渐增大,于外院行手术治疗及病理检查(软组织肿瘤,细胞具有异型,可见核分裂,考虑为肉瘤)。患者术后发现肿物复发,2019年1月16日于吉林大学第二医院行MRI胸部平扫示,背部皮下偏左上部三角肌外侧见大小约69 mm×27 mm×29 mm等T1等长T2信号,T2压脂相病灶边缘见环形高信号,未见累及肌肉组织。2019年1月18日行全麻下背部肿物切除术。术后病理检查示,(左侧背部)结合免疫组织化学染色结果及形态学特征符合隆突性皮肤纤维肉瘤,(二次送检周切缘)未见肿瘤(图 6)。免疫组织化学染色结果示,H-Caldesmon(+),平滑肌动蛋白(smooth muscle actin,SMA)(-),CD34(+),Desmin(-),Ki-67(阳性率20%),S-100(-),细胞角蛋白(cytokeratin,CK)AE1/AE3(-),Vimentin(+)。现术后恢复良好,无复发。
|
| 图 6 异时性鼻咽癌、背部皮肤隆突性纤维肉瘤和外耳道癌三重癌患者隆突性皮肤纤维肉瘤手术标本病理切片(2019年1月20日) |
该患者已完成外耳道癌部分的放疗计划,处方剂量PGTV:71.94 Gy/33 F,PTV:60.06 Gy/33 F。放疗后至今,随访患者自述现身体状况良好,于当地医院定期体检未见明显异常。
2 讨论1899年多原发癌定义被提出,1932年根据Warren和Gates修改的标准定义多原发癌,而后1979年MPMNs诊断标准又有了新的补充[2]。对152例多原发癌的患者的统计分析显示,头颈部肿瘤或泌尿系肿瘤患者发生MPMNs的风险更大[3]。MPMNs的发病率约0.7%~11.7%[4]。MPMNs诊断标准: (1)每个肿瘤必须都是恶性;(2)每个肿瘤必须有其独特的病理形态;(3)每个肿瘤必须发生在不同的部位;(4)必须排除转移或复发。本例3种癌符合上述诊断标准。根据肿瘤发生时间的间隔长短分为同时性多原发癌和异时性多原发癌[5]。患者确诊恶性肿瘤时间间隔≤6个月者称同时性多原发癌,约占10%;确诊恶性肿瘤时间间隔 > 6个月者称为异时性多原发癌,约占90%[6]。本例患者确诊时间间隔 > 6个月,故为异时性多原发癌。对这种特殊的癌症群体的研究有限,这些患者可以持续出现癌症,但却可以生存相当长的一段时间,其原因值得探究。对多原发癌的发病原因、治疗及预后进行研究是有必要的。
MPMNs发病原因尚不明确。可能致病原因有:(1)免疫功能缺陷;(2)家族基因缺陷;(3)医源因素,如放疗和化疗;(4)不良的生活方式,如吸烟和饮酒;(5)职业因素、环境和内分泌因素等[7-9]。癌基因异常激活、抑癌基因沉默、表观遗传改变、染色体不稳定、过度毒物暴露和免疫缺陷都是潜在的致病因素[3, 10-12]。肿瘤患者往往具有易感体质,再次发生新癌的概率比健康人高6~12倍[13]。场癌变理论(field cancerization theory)指出在多次致癌暴露后,由于多种基因异常,整个头颈浅表上皮发生恶性病变的风险增加。一些MPMNs的发病机制可能与家族遗传有关。近年来,分子遗传学的发展支持癌基因的存在。其中p53基因是目前研究最深入的癌基因。p53突变导致的细胞周期与细胞凋亡失控是产生多数恶性肿瘤的重要机制之一p16表达缺失在伴有纤维肉瘤转化和转移性疾病的隆突性皮肤纤维肉瘤中很常见。一项对150例已行根治性放疗的前列腺癌患者的回顾性研究显示,放疗后患继发恶性肿瘤的风险增加[14]。对多发性原发性恶性肿瘤患者基因多态性的遗传易患性的研究发现,患者基因的多样性参与Fanconi贫血途径,而Fanconi贫血途径所涉及的DNA损伤修复缺陷可能是多种原发性癌症的原因之一[15]。一项包含106例多原发癌患者的研究指出,放疗极大地提高患多原发癌的风险[16]。本例患者20年前因患鼻咽癌行放疗,当时放疗技术为二维放疗,对周围正常组织损伤大,故该患者外耳道肿瘤可能与鼻咽癌放疗史有关。该患者鼻咽肿瘤及外耳道肿瘤免疫组织化学结果显示EGFR均为阳性。经询问,该患者有肿瘤家族史,可能与此有关,建议行基因检测进一步明确该观点,患者因个人原因未行基因检测。
多原发癌与转移癌在治疗原则上截然不同[17]。MPMNs的治疗原则倾向于手术及放化疗综合治疗。有资料显示,MPMNs患者的所有癌均经病理证实,早期被发现,及时手术切除并辅以化疗,至今已生存16年[18]。这说明MPMNs患者经过合理的诊疗后,可以达到理想的生存期。在第7届国际头颈肿瘤学创新方法大会(International Congress on Innovative Approaches in Head and Neck Oncology,ICHNO)会议上发布的关于未行手术治疗的多原发癌患者的治疗研究结果显示,同期放化疗是未行手术的多原发癌患者的首选治疗方法。外耳道癌发病较隐匿,需及时诊断并加以治疗,否则会侵及其他部位,如中耳和颞骨等。目前外耳道癌主要以手术辅以术后放疗为治疗原则。一项回顾性研究分析13例晚期(T3和T4)外耳道鳞状细胞癌(squamous cell carcinoma,SCC)患者的临床资料,评估碳离子放疗(carbon ion radiotherapy,C-ion-RT)治疗外耳道晚期鳞状细胞癌的安全性和有效性[19]。有报道1例外耳道鳞状细胞癌患者经白蛋白结合紫杉醇加卡铂方案化疗后得到满意的临床疗效,患者对治疗的耐受性良好,并且未观察到任何重大的不良反应。另有报道1例背部隆突性皮肤纤维肉瘤患者,指出转移性或不能手术的隆突性皮肤纤维肉瘤患者可从伊马替尼治疗中获益[20]。由此可见,MPMNs的治疗应以个体化综合治疗为主。本例患者鼻咽癌诊断及治疗及时,且鼻咽癌对放疗敏感,因此预后良好;而外耳道癌术后因个人原因未行术后放疗,故导致肿瘤复发;背部隆突性皮肤纤维肉瘤经手术治疗后现恢复良好,皮肤表面无异常症状,仅有少量色素沉着。
多原发癌的预后难以统计,受到肿瘤的发生部位、病理类型及身体状况多种因素的影响。有学者认为异时性多原发癌发生间隔的时间越长预后越好,而发生间隔时间越短则越差。如果多原发癌其中之一出现转移,则预后很差[21]。总体来讲,早期发现多原发癌并进行干预治疗,其预后优于单原发恶性肿瘤的复发或转移。尽可能对每一原发肿瘤行根治性治疗是改善MPMNs患者预后的关键因素。一项针对多原发性癌患者的医疗状况和身体功能缺陷的研究统计多原发性癌患者(n=1 003)、单原发性癌患者(n=12 849)和无癌症组(n=63 578)患糖尿病、心脏病、脑血管疾病、肺气肿、慢性支气管炎和骨质疏松症等疾病的患病率比(prevalence ratio,PR)显示,多原发性癌患者和另外2组患者的疾病PR比较,差异无统计学意义(P > 0.05),但是多原发性癌患者比单原发性癌患者(PR=1.48,95%CI:1.28~1.71)和无癌症组(PR=1.64,95%CI:1.42~1.88)更可能出现身体功能严重受限[22]。人类疱疹病毒(Epstein-Barr virus,EBV)基因组、EGFR、血管表皮生长因子(vascular endothelial grown factor,VEGF)和细胞程序性死亡-配体1(programmed cell death 1 ligand 1,PD-L1)等生物因素与鼻咽癌的预后相关[23]。本例患者鼻咽癌放疗后20年,复查鼻咽镜无异常;背部皮肤恶性肿瘤切除术后16个月,控制良好;外耳道癌术后因个人原因未及时放疗导致复发,给予复发肿瘤区及淋巴引流区放疗;无其余基础疾病。
通过对该患者的临床表现及诊治过程分析病史分析显示,应该加强对MPMNs的认识:在致病因素方面,考虑为癌基因导致的DNA修复损伤所致,需要进行更深层次的研究;而在治疗原则方面,与单原发肿瘤相同,早期诊断并给予合理的治疗方案,从而提高患者的生存期及局部控制率。在临床工作中,临床医师往往只诊断1种原发癌,而忽视其他同时性多原发癌,从而失去患者最佳的治疗时机。对于长期生存的癌症患者,定期复查对于发现MPMNs至关重要[24]。有研究表明,在接受PET/CT全身扫描的患者中,≥1.2%的癌症患者中发现另一种原发性恶性肿瘤[25]。当癌症患者出现其他肿瘤的临床表现时,不仅要考虑转移,而且要考虑MPMNs的可能性[26]。在诊治原发癌的过程中,发现与其不相关的临床表现及体征,一定要给予重视,积极开展多学科诊疗(multidisciplinary team,MDT),做到早发现、早诊断和早治疗。
总之,对于MPMNs患者来说,早期发现并给予规范化治疗,有利于提高肿瘤的控制率,提高生存期。
| [1] |
朱莉菲, 薛鹏, 王理伟. 65例多原发癌的临床回顾性研究[J]. 复旦学报: 医学版, 2010, 37(5): 591-593. DOI:10.3969/j.issn.1672-8467.2010.05.020 |
| [2] |
Mochizuki Y, Harada H, Ikuta M, et al. Clinical characteristics of multiple primary carcinomas of the oral cavity[J]. Oral Oncol, 2015, 51(2): 182-189. DOI:10.1016/j.oraloncology.2014.11.013 |
| [3] |
Liu Z, Liu C, Guo W, et al. Clinical analysis of 152 cases of multiple primary malignant tumors in 15, 398 patients with malignant tumors[J]. PLoS One, 2015, 10(5): e0125754. DOI:10.1371/journal.pone.0125754 |
| [4] |
De Luca A, Frusone F, Vergine M, et al. Breast cancer and multiple primary malignant tumors: case report and review of the literature[J]. In Vivo, 2019, 33(4): 1313-1324. DOI:10.21873/invivo.11605 |
| [5] |
Kourie HR, Markoutsaki N, Roussel H, et al. Double pancreatic and gastric adenocarcinomas: a rare association[J]. Clin Res Hepatol Gastroenterol, 2013, 37(6): e137-140. DOI:10.1016/j.clinre.2012.09.008 |
| [6] |
Zeng QA, Qiu J, Zou R, et al. Clinical features and outcome of multiple primary malignancies involving hepatocellular carcinoma: a long-term follow-up study[J]. BMC Cancer, 2012, 12: 148. DOI:10.1186/1471-2407-12-148 |
| [7] |
Utada M, Ohno Y, Hori M, et al. Incidence of multiple primary cancers and interval between first and second primary cancers[J]. Cancer Sci, 2014, 105(7): 890-896. DOI:10.1111/cas.12433 |
| [8] |
Coyte A, Morrison DS, McLoone P. Second primary cancer risk-the impact of applying different definitions of multiple primaries: results from a retrospective population-based cancer registry study[J]. BMC Cancer, 2014, 14: 272. DOI:10.1186/1471-2407-14-272 |
| [9] |
Park SL, Caberto CP, Lin Y, et al. Association of cancer susceptibility variants with risk of multiple primary cancers: The population architecture using genomics and epidemiology study[J]. Cancer Epidemiol Biomarkers Prev, 2014, 23(11): 2568-2578. DOI:10.1158/1055-9965.EPI-14-0129 |
| [10] |
Travis LB, Rabkin CS, Brown LM, et al. Cancer survivorship——genetic susceptibility and second primary cancers: research strategies and recommendations[J]. J Natl Cancer Inst, 2006, 98(1): 15-25. DOI:10.1093/jnci/djj001 |
| [11] |
Salem A, Abu-Hijlih R, Abdelrahman F, et al. Multiple primary malignancies: analysis of 23 patients with at least three tumors[J]. J Gastrointest Cancer, 2012, 43(3): 437-443. DOI:10.1007/s12029-011-9296-7 |
| [12] |
Demandante CG, Troyer DA, Miles TP. Multiple primary malignant neoplasms: case report and a comprehensive review of the literature[J]. Am J Clin Oncol, 2003, 26(1): 79-83. DOI:10.1097/00000421-200302000-00015 |
| [13] |
孙海燕, 潘战宇, 张新伟, 等. 40例多原发癌姑息治疗多学科会诊临床分析[J]. 中国肿瘤临床, 2016, 43(15): 674-678. DOI:10.3969/j.issn.1000-8179.2016.15.595 |
| [14] |
Okajima K, Ishikawa K, Matsuura T, et al. Multiple primary malignancies in patients with prostate cancer: increased risk of secondary malignancies after radiotherapy-[J]. Int J Clin Oncol, 2013, 18(6): 1078-1084. DOI:10.1007/s10147-012-0496-3 |
| [15] |
Wang L, Wang H, Wang T, et al. Analysis of polymorphisms in genes associated with the FA/BRCA pathway in three patients with multiple primary malignant neoplasms[J]. Artif Cells Nanomed Biotechnol, 2019, 47(1): 1101-1112. DOI:10.1080/21691401.2019.1575846 |
| [16] |
耿振英, 焦顺昌, 王甦, 等. 106例多原发癌的临床回顾性研究[J]. 世界最新医学信息文摘, 2017, 17(12): 1-2, 19. |
| [17] |
任明艳, 袁中琴, 周永红, 等. 169例初诊肺癌骨转移患者临床特征及预后分析[J]. 实用肿瘤杂志, 2020, 35(4): 322-327. |
| [18] |
戢楠楠, 周业琴, 林斌伟, 等. 多原发五重恶性肿瘤1例报道[J]. 肿瘤预防与治疗, 2015, 28(4): 239-241. DOI:10.3969/j.issn.1674-0904.2015.04.013 |
| [19] |
Koto M, Hasegawa A, Takagi R, et al. Carbon ion radiotherapy for locally advanced squamous cell carcinoma of the external auditory canal and middle ear[J]. Head Neck, 2016, 38(4): 512-516. DOI:10.1002/hed.23905 |
| [20] |
Hrudka J, Charvát M, Grossmann P, et al. Dermatofibrosarcoma protuberans with fibrosarcomatous transformation: a case report[J]. Cesk Patol, 2020, 56(2): 89-93. |
| [21] |
Ikeda Y, Saku M, Kawanaka H, et al. Features of second primary cancer in patients with gastric cancer[J]. Oncology, 2003, 65(2): 113-117. DOI:10.1159/000072335 |
| [22] |
Anderson C, Gapstur SM, Leach CR, et al. Medical conditions and physical function deficits among multiple primary cancer survivors[J]. J Cancer Surviv, 2020, 14(4): 518-526. DOI:10.1007/s11764-020-00872-0 |
| [23] |
陆颖, 黄海欣. 鼻咽癌相关生物因素的预后价值及临床应用进展[J]. 实用肿瘤杂志, 2019, 34(1): 90-94. |
| [24] |
Liu K, Zhang XX, Chen NX, et al. Clinical characteristics, treatments, and prognosis of patients with multiple primary carcinoma of head and neck[J]. Chin Med J (Engl), 2020, 133(3): 377-378. DOI:10.1097/CM9.0000000000000632 |
| [25] |
Sapalidis K, Schizas N, Lazopoulos A, et al. Multiple metachronous and synchronous malignancies with lung and thorax involvement. Report of two cases[J]. Respir Med Case Rep, 2018, 24: 5-7. |
| [26] |
Song L, Li Q, Yang K, et al. Three primary synchronous malignancies of the uterus, cervix, and fallopian tube: A case report[J]. Medicine (Baltimore), 2018, 97(24): e11107. DOI:10.1097/MD.0000000000011107 |
 2021, Vol. 36
2021, Vol. 36


