文章信息
- 张修振, 杨勇进, 赵艳敏, 王冉冉, 陈成武, 亓玉琴
- Zhang Xiuzhen, Yang Yongjin, Zhao Yanmin, Wang Ranran, Chen Chengwu, Qi Yuqin
- miR-126-5p靶向抑制ERCC1增加结肠癌细胞对奥沙利铂化疗的敏感性
- miR-126-5p inhibits ERCC1 to increase sensitivity of colon cancer cells to oxaliplatin chemotherapy
- 实用肿瘤杂志, 2022, 37(5): 433-438
- Journal of Practical Oncology, 2022, 37(5): 433-438
基金项目
- 济南市卫建委科技计划项目(2019-2-67)
-
通信作者
- 张修振, E-mail: marsz3842417@126.com
-
文章历史
- 收稿日期:2021-08-07
2. 青岛市市立医院消化内科, 山东 青岛 266000
2. Department of Gastroenterology, Qingdao Municipal Hospital, Qingdao 266000, China
结肠癌是常见恶性肿瘤之一,根治性手术是主要治疗方式,但术后复发和转移严重影响患者的生存,辅助化疗作为术后的主要治疗手段,能够降低复发和转移的风险[1]。肿瘤微转移的存在及化疗药物耐药性的增加使如何更好地选择化疗方案及基因干预靶点成为近年研究的热点。铂类药物是结肠癌化疗的基石类药物。多数含铂方案的有效率均≤50%,铂类原发或继发耐药现象限制其在临床的应用[2]。核苷酸切除修复(nucleotide excision repair, NER)是导致铂类耐药的主要原因之一,核苷酸切除修复交叉互补基因1(excision repair cross complement 1,ERCC1)蛋白是NER中的关键蛋白[3]。本研究组前期研究也证实,ERCC1基因表达水平与肿瘤微转移和铂类继发耐药相关[4]。
微小RNA(microRNA,miRNA)是一类短的非编码RNA分子,主要功能是结合靶基因mRNA的3'-UTR区,对其进行降解,从而沉默靶基因,通过这种负性调控靶基因的表达,miRNA表达异常可影响肿瘤细胞的增殖、凋亡、转移和耐药等生物学行为[5]。研究表明,miR-126-5p在肺癌、结肠癌、卵巢癌和巨细胞瘤等肿瘤中表达下调,从而发挥抑癌作用。miR-126-5p表达与转移性结直肠癌的无进展生存期和总生存期相关[6]。miR-126-5p可以靶向细胞周期蛋白依赖激酶6(cyclin-dependent kinase 6,CDK6),并在抑制食管癌细胞的增殖和迁移方面具有积极作用[7]。miR-126可被长链非编码RNA(long noncoding RNA,lncRNA)HOTAIR抑制,以增强胃癌的顺铂耐药性[8],但是关于miR-126-5p在结肠癌耐药中的作用及分子机制研究较少。本课题通过探讨miR-556-3p对ERCC1的调控作用以及对耐奥沙利铂(oxaliplatin,L-OHP)结肠癌细胞株HCT116/L-OHP的影响,为逆转结肠癌铂类耐药提供新的理论依据。
1 材料与方法 1.1 细胞株及材料试剂人结肠癌细胞株HCT116购自中国科学院上海细胞库(货号JRDC105)。
L-OHP购自美国MCE公司。Annexin V-FITC细胞凋亡检测试剂盒、CCK8试剂盒、羊抗兔HRP标记二抗和羊抗鼠HRP标记二抗购自上海碧云天生物技术有限公司。SYBR Green PCR试剂盒购自美国Thermo公司。反转录试剂盒购自美国Fermentas。Lipofectamine® 2000试剂购自美国ThermoFisher公司。miR-126-5p模拟物(miR-126-5p mimics)、miR模拟物阴性对照(miRNC)、ERCC1-WT质粒和ERCC1-MUT质粒均购自广州锐博生物科技有限公司。ERCC1抗体由美国Proteintech提供。胎牛血清购自美国GIBCO公司。RMPI-1640培养液购自美国Hyclone公司。蛋白印迹电泳仪购自美国BIO-RAD公司。实时荧光定量PCR仪(ABI 7500)购自美国ABI公司。
1.2 人结肠癌耐L-OHP细胞株HCT116/L-OHP构建取对数生长的人结肠癌HCT116细胞,调整细胞密度为1×105个细胞/mL接种于培养瓶,加0.5 μg/mL L-OHP培养液作用48 h,弃去上清,加入不含L-OHP的新鲜培养液继续培养,待细胞恢复正常生长后,消化传代,再用0.5 μg/mL L-OHP培养液连续作用48 h。如此反复换液和传代,再逐步提高L-OHP的浓度(0.5、0.8、1.5、2、2.5、3和6 μg/mL)。当细胞在含6 μg/mL L-OHP培养液中稳定生长时,以含加倍质量浓度(12~24 μg/mL)大剂量L-OHP培养液对HCT116细胞间断诱导,最终获得对L-OHP耐药的HCT116细胞株,即HCT116/L-OPH细胞株。并维持培养在含2 μg/mL的L-OHP培养液中,于实验前1周停用L-OHP处理。
1.3 CCK8检测细胞增殖取对数生长期的HCT116和HCT116/L-OHP细胞,稀释为5×104个细胞/mL,每孔100 μL接种于96孔板。培养24 h后,弃培养液,分别加入不同浓度的L-OHP(0、10、20、50、100、200、250和300 μg/mL),每组设置3个复孔,培养48 h后,每孔加入CCK-8溶液10 μL,继续培养2 h后,在450 nm处测定吸光度(absorbance,A)值。
1.4 HCT116和HCT116/L-OHP细胞miR-126-5p和ERCC1表达检测取生长状况良好的HCT116和HCT116/L-OHP细胞,采用Trizol法提取各细胞株总RNA,所得RNA A260 nm/A280 nm > 1.7,符合纯度要求。反转录和PCR反应严格按照试剂盒操作说明进行。PCR反应条件:95℃ 10 s;95℃ 5 s,60℃ 45 s,共40个循环。miR-126-5p上游引物为5'- GGTATAATCCGCCGCTTAGCTGCC-3',下游引物为5'-GTGCAGGGTTGCAAGGT-3';ERCC1上游引物为5'-TAATTCCCGACTATGTGCTG-3',下游引物为5'-AGGTCCGCTGGTTTCTGCG-3';GAPDH上游引物为5'-GGATTGTCTGGCAGTAGCC-3',下游引物为5'-ATTGTGAAAGGCAGGGAG-3'。结果采用2-ΔΔCt表示miR-126-5p和ERCC1相对表达量。
1.5 细胞转染和耐药检测人结肠癌HCT116/L-OHP细胞进行传代培养,6孔板接种HCT116/L-OHP细胞,待细胞密度达到70%~80%的时候,按照Lipofectamine® 2000操作说明分别转染miR-126-5p mimics和miR-NC质粒(miR-126-5p mimics组和miR-NC组),并设置HCT116/L-OHP未转染组。转染6 h,采用CCK-8法检测不同浓度(0、50、100、150和200 μg/mL)L-OHP作用48 h后HCT116/L-OHP未转染组、miR-NC组和miR-126-5p mimics组细胞存活率,验证转染效果。
1.6 双荧光素酶报告基因实验先用TargetScan7.1软件预测miR-126-5p与ERCC1的3'UTR之间存在碱基互补关系,然后构建ERCC1-WT质粒和ERCC1-MUT质粒,并将所构建的质粒和miR-126-5p mimics及miR-NC分别转染到HCT116/L-OHP细胞中,分为WT+miR-NC组、WT+miR-126-5p mimics组、MUT+miR-NC组和MUT+miR-126-5p mimics组。培养48 h后,严格按照双荧光素酶检测说明书操作,检测各组荧光素酶活性。
1.7 流式细胞仪检测细胞凋亡取转染miR-NC和miR-126-5p mimics后的HCT116/L-OHP细胞,加入L-OHP 100 μg/mL,24 h后收集细胞,按照操作说明分别加入195 μL Annexin V-FITC结合液轻轻重悬细胞,加入10 μL Annexin V-FITC,轻轻混匀,加入5 μL碘化丙啶染色液,轻轻混匀,室温避光孵育15 min,随后置于冰浴。同时以不加AnnexinV-FITC及PI的一管作为阴性对照,进行流式细胞仪检测。
1.8 Western blot法检测蛋白表达分别检测miR-126-5p mimics组、miR-NC组和HCT116/L-OHP未转染组ERCC1蛋白表达水平。以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,应用细胞裂解液裂解细胞,100℃沸水加热10 min,12 000 r/min离心10 min,提取细胞总蛋白,经过SDS-PAGE电泳、转膜和封闭后,加入稀释后的一抗(ERCC1 1∶1 000和GAPDH 1∶5 000),室温孵育2 h,TBST洗涤后加入二抗(1∶1 000),与膜37℃孵育1 h,加入化学发光试剂进行化学发光显影,ImageJ软件计算条带灰度值,分析蛋白表达量。
1.9 统计学分析采用SPSS 26.0和GraphPadPrism 7.0对数据进行分析和作图。细胞实验结果均重复≥3次。计量资料采用均数±标准差(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 HCT116/L-OHP细胞对L-OHP的耐药验证CCK8细胞增殖检测实验结果显示,HCT116/L-OHP细胞比HCT116细胞具有更强的耐药特性,HCT116/L-OHP细胞的半数抑制浓度(half maximal inhibitory concentration,IC50)值为(151.66±3.42)μg/mL,而HCT116细胞的IC50值为(9.75±0.88)μg/mL,耐药倍数为15.55,差异具有统计学意义(P < 0.05,图 1)。
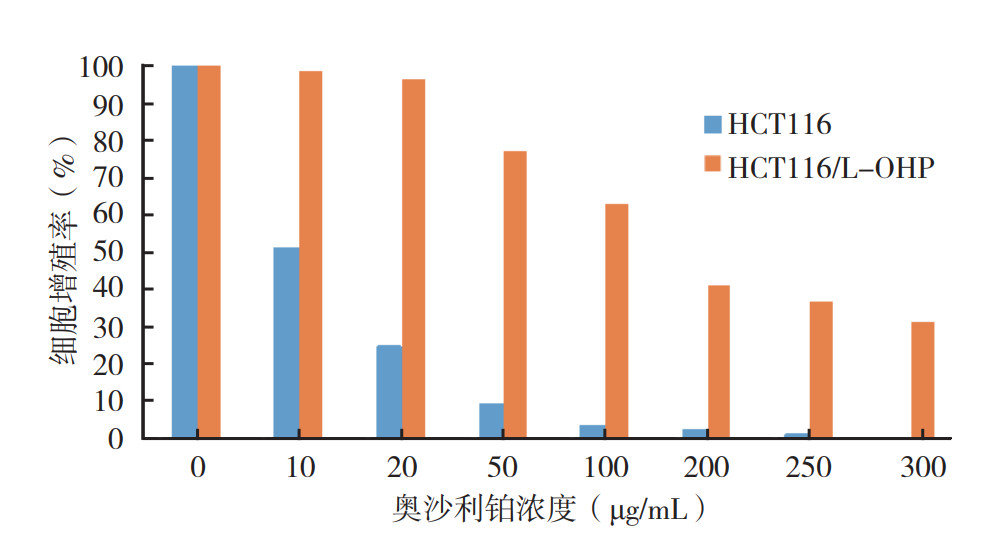
|
| 图 1 不同浓度奥沙利铂对HCT116和HCT116/L-OHP细胞增殖的影响 Fig.1 Effects of different concentrations of oxaliplatin on cell proliferation in HCT116 and HCT116/L-OHP cells |
与HCT116细胞比较,miR-126-5p在HCT116/L-OHP细胞中的表达降低(P < 0.05,图 2)。
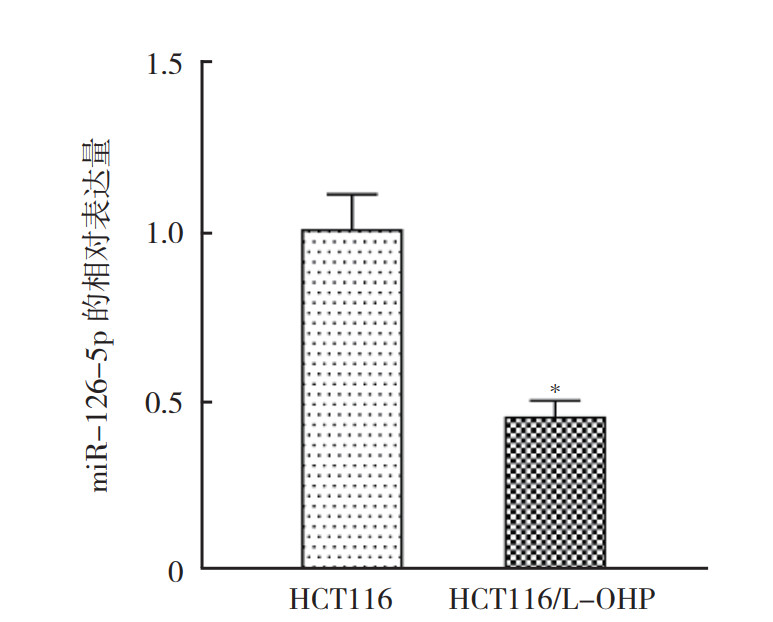
|
| 注 *P < 0.05 图 2 qRT-PCR检测miR-126-5p在HCT116和HCT116/L-OHP细胞中的表达量 Fig.2 qRT-PCR detection of miR-126-5p expression in HCT116 and HCT116/L-OHP cells |
行CCK8实验观察药物作用48 h后对细胞增殖的抑制作用,结果显示,miR-126-5p mimics转染后的细胞IC50为(9.22±1.03)μg/mL,低于miR-NC组的(149.73±3.58)μg/mL(P < 0.05,图 3)。miR-126-5p mimics的转染降低了HCT116/L-OHP细胞的增殖活性(P < 0.05,图 3)。
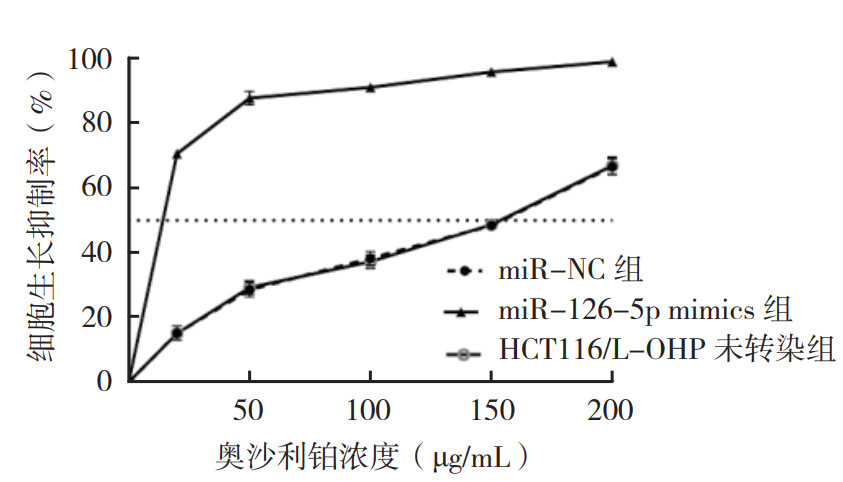
|
| 图 3 CCK8法检测奥沙利铂对miR-NC组、miR-126-5p mimics组和HCT116/L-OHP未转染组细胞增殖抑制作用 Fig.3 Inhibition of oxaliplatin on the cell proliferation of miR-NC, miR-126-5p mimics, and untransfected HCT116/L-OHP groups determined by CCK8 |
TargetScan软件预测结果显示,ERCC1是miR-126-5p的潜在靶基因(图 4A)。RT-qPCR检测显示,与HCT116细胞比较,ERCC1在HCT116/L-OHP细胞中的表达升高(P < 0.05,图 4B)。转染效率验证显示,在HCT116/L-OHP细胞中过表达miR-126-5p 48 h后,ERCC1 mRNA和ERCC1蛋白与miR-NC组和HCT116/L-OHP未转染组比较,均出现降低,差异均具有统计学意义(均P < 0.05),而miR-NC组和HCT116/L-OHP未转染组ERCC1表达比较,差异无统计学意义(P > 0.05,图 4C~4D)。
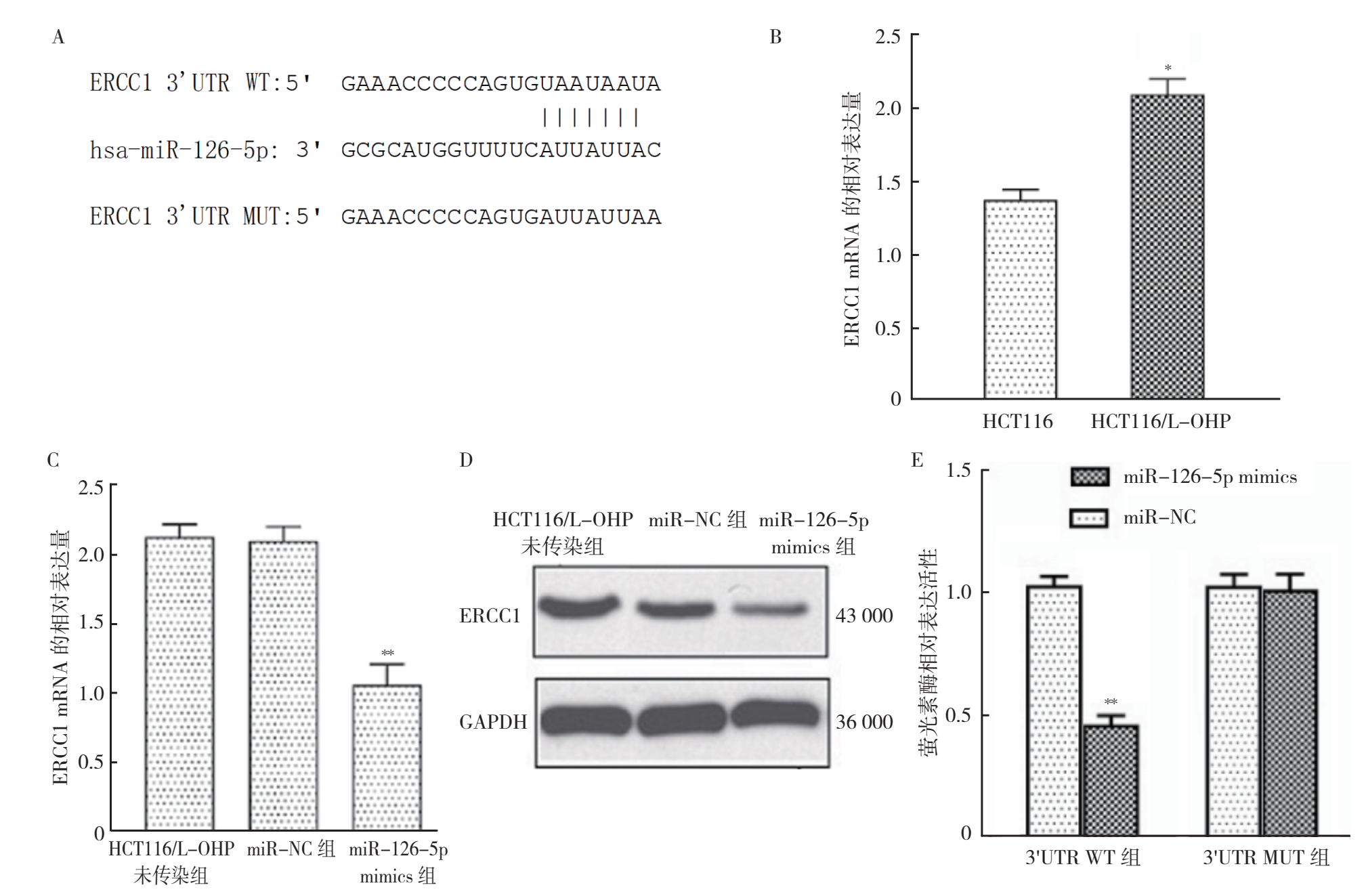
|
| 注 A:TargetScan软件预测ERCC1 mRNA 3' UTR存在miR-126-5p的靶向结合位点;B:RT-PCR检测ERCC1在HCT116和HCT116/L-OHP细胞中的表达量;C:miR-126-5p转染48 h后,HCT116/L-OHP细胞ERCC1 mRNA相对表达量的变化;D:miR-126-5p转染48 h后,ERCC1蛋白表达量的变化;E;荧光素酶报告实验检测HCT116/L-OHP细胞中miR-126-5p对ERCC1野生型及突变型3'UTR活性的影响;*P < 0.05;**P < 0.01 图 4 HCT116/L-OHP细胞中miR-126-5p与ERCC1 mRNA 3' UTR存在靶向结合的验证 Fig.4 Verification of direct binding of miR-126-5p to ERCC1 mRNA 3' UTR in HCT116/L-OHP cells |
双荧光素酶结果显示,与WT+miR-NC组比较,WT+miR-126-5p mimics组ERCC1荧光素酶的活力值降低,差异具有统计学意义(P < 0.05)。MUT+miR-126-5p mimics组与MUT+miR-NC组荧光素酶的活力值比较,差异无统计学意义(P > 0.05),证明miR-126-5p靶向结合ERCC1的3'-UTR(图 4E)。
2.5 miR-126-5p促进L-OHP诱导的结肠癌耐药细胞的凋亡将miR-126-5p mimics和miR-NC分别转染HCT116/L-OHP细胞,给予L-OHP(10 μg/mL)处理后,流式细胞术检测细胞凋亡率变化。miR-NC组的细胞凋亡率为(3.18±0.56)%,miR-126-5p mimics组的细胞凋亡率为(12.67±1.02)%,差异具有统计学意义(P < 0.05,图 5)。
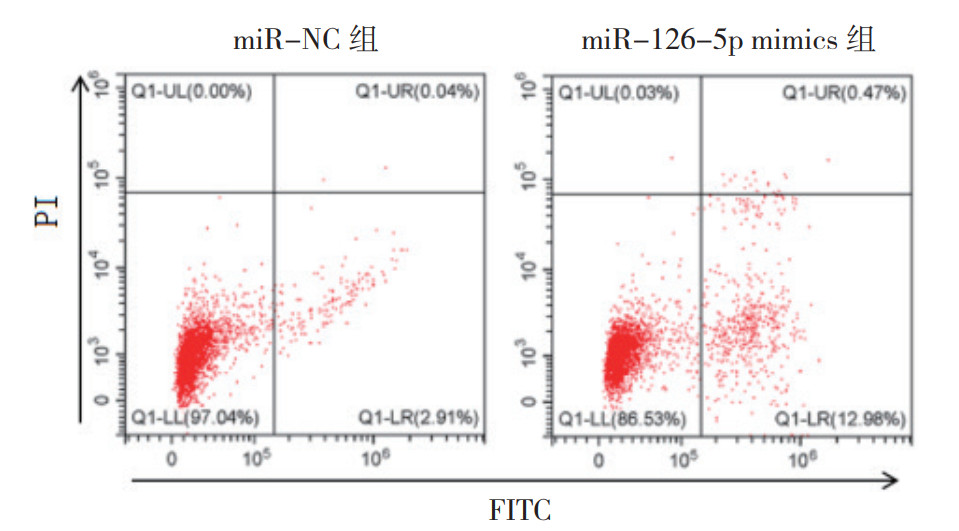
|
| 图 5 miR-126-5p对奥沙利铂诱导HCT116/L-OHP细胞凋亡的影响 Fig.5 Effect of miR-126-5p on the oxaliplatin induced apoptosis of HCT116/L-OHP cells |
结直肠癌发病率和死亡率呈逐年上升趋势。接受根治性手术治疗的患者中仍有30%~50%最终出现局部复发或远处转移[9]。近年来化疗联合分子靶向和免疫治疗等治疗手段取得巨大进步,其中L-OHP是转移性结直肠癌标准化疗中基石类药物,但因个体基因和遗传差异,L-OHP的耐药问题成为导致肿瘤患者化疗失败的主要原因,因此关于L-OHP耐受分子机制的研究成为近年来研究的热点[10]。
miRNA可通过结合靶基因mRNA的3'-UTR区参与致癌或抑癌作用[11]。miR-126-5p在发挥抑癌作用和降低化疗耐药性过程中发挥重要作用。miR-126-5p可通过抑制ADAM9提高非小细胞肺癌的顺铂敏感性[12]。在卵巢癌细胞株中,miR-126-5p通过调控Wnt/β-catenin信号,提高化疗敏感性[13]。lncRNA CRNDE通过调节miR-126-5p/三磷酸腺苷酶家族蛋白2(ATPase family AAA domain-containing protein 2,ATAD2)轴来调节结肠癌的进展和化疗耐药性[14]。miR-126-5p可以通过丝/苏氨酸激酶(serine/threonine protein kinases, AKT)/细胞外信号调节激酶1/2(extra cellular signal regulated kinase 1/2,ERK1/2)信号通路靶向抑制趋化因子受体4(chemokine receptor 4,CXCR4)基因,从而抑制结肠癌的增生[15]。miR-126-5p可以通过调节耐药靶基因和信号通路逆转化疗耐药。本研究结果显示,在结肠癌耐药细胞株HCT116/L-OHP中miR-126-5p呈异常低表达,上调miR-126-5p的表达水平可抑制HCT116/L-OHP细胞的增殖活性,但miRNA对结直肠癌患者L-OHP耐药的逆转机制研究目前尚不明确。
L-OHP可导致双向功能的DNA损伤,诱导肿瘤细胞凋亡,而正常细胞中存在一些修复体系可以将受损的DNA进行修复,其中发挥关键作用的是ERCC1[16]。铂类药物作用后,使受损细胞周期阻滞在G2/M期。而ERCC1过度表达,可使停滞在G2/M期损伤的DNA迅速修复。有研究通过定量蛋白质组学分析确定结肠癌耐L-OHP细胞株HCT116/OXA中ERCC1和p53等蛋白表达较其亲本细胞株上调[17],这与本研究结果基本一致。该研究还显示,转染si-ERCC1导致HCT116/OXA细胞对L-OHP的敏感性增强,证实上调的ERCC1表达在维持抗性表型方面发挥重要作用[17]。一项敲低ERCC1后分析HCT116/OXA细胞对L-OHP的敏感性的研究结果显示,HCT116/OXA细胞中si-ERCC1转染抑制ERCC1 mRNA和蛋白质表达水平,有效减弱HCT116/OXA细胞中的L-OHP抗性,证实ERCC1表达与结肠癌L-OHP耐药性有关[18]。基于上述理论,推测ERCC1是参与结肠癌细胞L-OHP耐药性的关键靶点。本研究通过双荧光素酶报告和Western blot法证实,ERCC1是miR-126-5p的下游靶基因,CCK8和流式凋亡检测实验显示,上调miR-126-5p的表达可以抑制ERCC1蛋白的表达,影响肿瘤细胞的增殖和凋亡,从而降低HCT116/L-OHP细胞对L-OHP的耐药性。
综上所述,本研究结果表明,miR-126-5p可以通过靶向调控ERCC1有效增加结肠癌细胞对L-OHP的敏感性,这为结肠癌的化疗提供了一定的理论基础,但还需要就miR-126-5p调控的化疗敏感相关基因作进一步的研究。
| [1] |
刘爽, 姜婷, 陈功, 等. 局部进展期直肠癌治疗模式新进展[J]. 实用肿瘤杂志, 2021, 36(1): 10-17. |
| [2] |
雷建卫, 杨乔, 赵志龙, 等. 奥沙利铂为主的两种化疗方案治疗晚期结直肠癌患者的效果比较[J]. 临床医学研究与实践, 2020, 5(16): 47-49. DOI:10.19347/j.cnki.2096-1413.202016018 |
| [3] |
Guo JN, Zhu CL, Yang KQ, et al. Poly(C)-binding protein 1 mediates drug resistance in colorectal cancer[J]. Oncotarget, 2017, 8(8): 13312-13319. DOI:10.18632/oncotarget.14516 |
| [4] |
张修振, 闫燕, 陈成武, 等. 5-氮杂-2'-脱氧胞苷对胃癌SGC-7901细胞生长及ERCC1基因表达的影响[J]. 临床消化病杂志, 2020, 32(5): 280-284. |
| [5] |
Ali Syeda Z, Langden SSS, Munkhzul C, et al. Regulatory mechanism of microRNA expression in cancer[J]. Int J Mol Sci, 2020, 21(5): 1723. DOI:10.3390/ijms21051723 |
| [6] |
Fiala O, Pitule P, Hosek P, et al. The association of miR-126-3p, miR-126-5p and miR-664-3p expression profiles with outcomes of patients with metastatic colorectal cancer treated with bevacizumab[J]. Tumour Biol, 2017, 39(7): 1010428317709283. |
| [7] |
Gu JF, Liu SG, Pan Q, et al. Negative regulation of CDK6 expression by microRNA-126-5p and its influence on the proliferation and invasion of esophageal cancer cells[J]. Anat Rec (Hoboken), 2020, 303(11): 2811-2820. DOI:10.1002/ar.24362 |
| [8] |
Yan J, Dang YN, Liu SY, et al. LncRNA HOTAIR promotes cisplatin resistance in gastric cancer by targeting miR-126 to activate the PI3K/AKT/MRP1 genes[J]. Tumour Biol, 2016, 37: 16345-16355. DOI:10.1007/s13277-016-5448-5 |
| [9] |
王保信, 刘军, 唐雪飞, 等. 手辅助腹腔镜技术与开腹手术治疗直肠癌的疗效对比研究[J]. 实用肿瘤杂志, 2021, 36(2): 114-117. |
| [10] |
张逸羿, 卢星榕. 结直肠癌奥沙利铂化疗耐药机制的研究进展[J]. 生理科学进展, 2018, 49(2): 144-148. |
| [11] |
Saliminejad K, Khorram Khorshid HR, Soleymani Fard S, et al. An overview of microRNAs: Biology, functions, therapeutics, and analysis methods[J]. J Cell Physiol, 2019, 234(5): 5451-5465. |
| [12] |
Liu B, Wang R, Liu HY. miR-126-5p promotes cisplatin sensitivity of non-small-cell lung cancer by inhibiting ADAM9[J]. Biomed Res Int, 2021, 2021: 6622342. |
| [13] |
Wang CL, Zhou B, Liu M, et al. miR-126-5p restoration promotes cell apoptosis in cervical cancer by targeting Bcl2l2[J]. Oncol Res, 2017, 25(4): 463-470. |
| [14] |
Liu C, Hou JF, Shan FX, et al. Long non-coding RNA CRNDE promotes colorectal carcinoma cell progression and paclitaxel resistance by regulating miR-126-5p/ATAD2 axis[J]. Onco Targets Ther, 2020, 13: 4931-4942. |
| [15] |
Liu YL, Zhou Y, Feng X, et al. microRNA-126 functions as a tumor suppressor in colorectal cancer cells by targeting CXCR4 via the AKT and ERK1/2 signaling pathways[J]. Int J Oncol, 2014, 44(1): 203-210. |
| [16] |
Guyon-Debast A, Rossetti P, Charlot F, et al. The XPF-ERCC1 complex is essential for genome stability and is involved in the mechanism of gene targeting in Physcomitrella patens[J]. Front Plant Sci, 2019, 10: 588. |
| [17] |
Wei W, Ma XD, Jiang GM, et al. The AKT/GSK3-mediated slug expression contributes to oxaliplatin resistance in colorectal cancer via upregulation of ERCC1[J]. Oncol Res, 2020, 28(4): 423-438. |
| [18] |
Li JM, Jiang GM, Zhao L, et al. Dehydrogenase/reductase SDR family member 2 silencing sensitizes an oxaliplatin-resistant cell line to oxaliplatin by inhibiting excision repair cross-complementing group 1 protein expression[J]. Oncol Rep, 2019, 42(5): 1725-1734. |
 2022, Vol. 37
2022, Vol. 37


