文章信息
- 冯鑫, 郇福奎, 陈欢, 芦凤玉, 李朝辉, 李伟, 王淑莲, 张彦新
- Feng Xin, Huan Fukui, Chen Huan, Lu Fengyu, Li Zhaohui, Li Wei, Wang Shulian, Zhang Yanxin
- 光学体表监测系统在乳腺癌改良根治术后放疗中的应用研究
- Application of optical surface monitoring system during postmastectomy radiotherapy for patients with breast cancer
- 实用肿瘤杂志, 2023, 38(1): 59-65
- Journal of Practical Oncology, 2023, 38(1): 59-65
基金项目
- 中国癌症基金会北京希望马拉松课题基金(LC2019L02)
-
通信作者
- 张彦新, E-mail: yanxin_zhang@163.com
-
文章历史
- 收稿日期:2021-12-03
放疗已成为乳腺癌根治术或改良根治术后辅助治疗的重要手段之一。全乳切除术后放疗可以使腋窝淋巴结阳性的患者5年局部区域复发率降低到原来的1/4~1/3,由于胸壁和锁骨上是最常见的复发部位,约占所有复发部位的80%,所以这两个区域是术后放疗的主要靶区[1-3]。胸壁+锁骨上下区放疗靶区较长,动度影响较大,需要兼顾胸壁和锁骨上下区的体位重复性,患者治疗过程中的非自然呼吸、耸肩和手臂位置改变等均会对靶区剂量分布造成影响,所以治疗过程中的摆位挑战很大。胸壁和锁骨上下靶区位置表浅,光学体表监测系统(optical surface monitoring system,OSMS)有助于改善摆位的重复性[4-5]。本研究通过回顾性分析OSMS辅助摆位技术在乳腺癌改良根治术后放疗摆位中的作用,为临床应用提供证据。
1 资料与方法 1.1 入组条件选取2021年5月至8月于中国医学科学院北京协和医学院肿瘤医院接受放疗的女性乳腺癌病例32例,分为OSMS辅助摆位组和常规摆位组。OSMS辅助摆位组使用OSMS系统辅助常规体表标记进行摆位,常规摆位组仅依靠体表标记线配合激光灯进行摆位。纳入条件:(1)乳腺癌改良根治术后行胸壁+锁骨上下区单中心调强照射,并签署《放射治疗知情同意书》;(2)使用颈胸一体架固定体位;(3)放疗前使用加速器机载锥形束CT(cone-beam CT,CBCT)图像引导系统采集CT验证图像, 扫描范围包括胸壁+锁骨上下区;(4)患者CBCT扫描时使用OSMS辅助摆位和仅使用体表标记线激光灯常规摆位交替进行。本研究已通过中国医学科学院北京协和医学院肿瘤医院伦理委员会审批。
1.2 体位固定采用颈胸一体架固定(广州科莱瑞迪),两臂上举分别置于臂托和腕托之上,使患侧上臂外展约120°,双手分别握对应立柱;患侧手臂外展不佳时,患侧手握住对应腕托。根据患者的身高颈长,调节头枕的位置和型号,使用专用的患侧乳腺区域开窗颈胸一体膜或者头部面罩进行固定,保证足够的体表皮肤暴露(图 1)。

|
| 注 A:头部面罩;B:颈胸一体膜 图 1 颈胸一体架固定装置 Fig.1 Integral cervicothoracic fixation device |
所有患者均在自由呼吸状态下行CT定位扫描(Philips Brilliance Big Bore,飞利浦公司,荷兰;或者Siemens SOMATOM Definition AS 40,西门子公司,德国),扫描条件:120 kV、150 mAs,扫描层厚和层距均为5 mm,扫描上界至颅底,下界至肺下5 cm。在患者体表画摆位线,体中线延长至脐部。通过MOSAIQ网络系统(医科达公司,瑞典)将CT模拟定位图像传输至Pinnacle(version 9.10)计划系统(飞利浦公司,荷兰)进行靶区勾画和计划设计。物理师重建患者体表轮廓(OUTLINE),并将RT Plan和RT Structure从Pinnacle系统传输至OSMS系统(Align RT,Vision RT Ltd,英国)以供治疗使用。
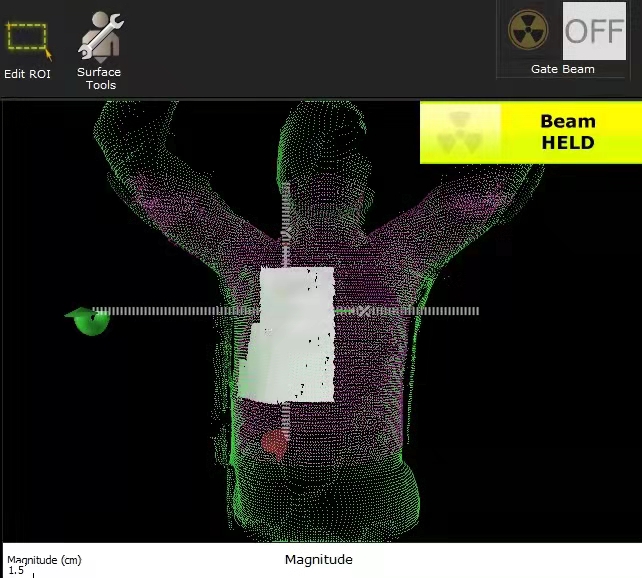
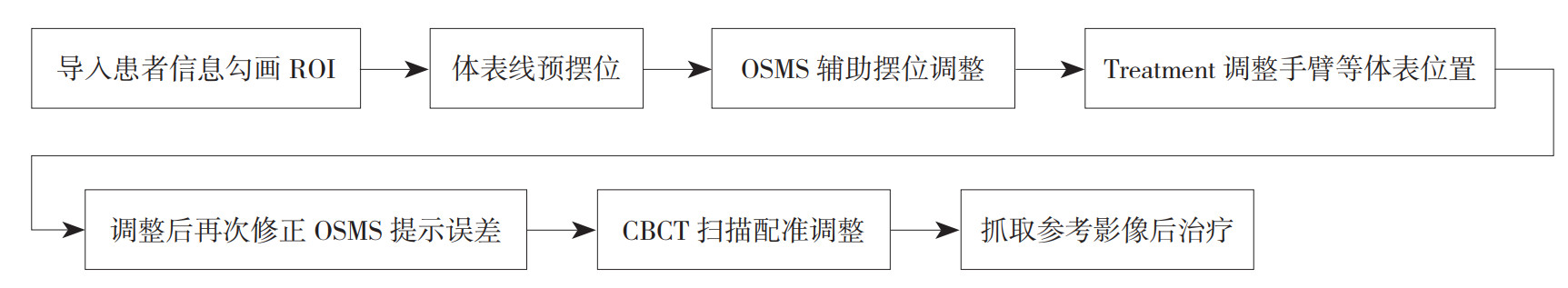
1.4 OSMS流程治疗师导入RT Plan和RT Structure,勾画感兴趣区(region of interest,ROI)后进行辅助摆位,手臂位置和身体角度使用Align RT软件中“Treatment”功能进行辅助校正(图 2)。在治疗前需要在OSMS系统勾画ROI,ROI应包括治疗计划靶区并避开腋窝等不稳定区域。在患者治疗前,将加速器机架归零,减少机架对摄像头的遮挡。放疗师按照CT模拟定位预设颈胸一体架各项参数固定,辅助患者平躺。嘱患者放松平静呼吸,调整治疗床和患者体位,先进行预摆位使患者体表标记线与激光灯一致,再打开Align RT软件,通过软件提示先修正旋转误差再修正平移误差,修正阈值1°/1 mm,之后使用“Treatment”功能调整手臂位置和身体角度,调整完成后再次核对旋转和平移误差,全部确认无误后行CBCT图像扫描。具体流程见图 3。
|
| 注 ROI:感兴趣区(region of interest);OSMS:光学体表监测系统(optical surface monitoring system);CBCT:锥形束CT(cone-beam CT) 图 2 用于校正患者手臂姿势和身体角度的Treatment功能 Fig.2 Treatment function for correcting the patient's arm posture and body angle |
|
| 图 3 光学体表监测系统辅助摆位流程 Fig.3 Process to assist positioning with optical surface monitoring system |
患者使用OSMS辅助摆位和仅使用体表标记线常规摆位交替进行,行CBCT扫描并记录数据,扫描范围的上界在环状软骨上2 cm处,下界至健侧腺体下缘水平,前外界为胸壁皮肤以外,后内界包全整个椎体。配准框的范围以计划靶区(planning target volume,PTV)为基础在三维方向上各外放2 cm,并包含附近的胸椎。基于灰度值进行CBCT图像自动配准得到3个方向上的平移误差X(左右方向)、Y(头脚方向)和Z(腹背方向)。经过主管医师与放疗师共同确认靶区位置后,可对自动配准结果进行手动微调,治疗时只作平移误差校正。当平移误差 > 1 mm时,在线校正治疗床位置。回顾性分析摆位误差数据时,基于灰度值进行CBCT图像自动配准,手动调整后记录平移误差X、Y和Z以及旋转误差Rx(矢状面)、Ry(横断面)和Rz(冠状面)6个自由度摆位误差。
1.6 肩锁关节位置移动幅度及三维空间位移计算回顾性分析肩锁关节位置移动幅度时,分别以颈椎和胸锁关节为配准标志得到平移误差X-sc、Y-sc和Z-sc,以肩锁关节为配准标志得到平移误差X-ac、Y-ac和Z-ac,二者之差取绝对值,ΔX=|X-sc-X-ac|、ΔY=|Y-sc-Y-ac|和ΔZ=|Z-sc-Z-ac|,用来表示肩锁关节的位置移动幅度。用位移
应用SPSS 22.0软件对摆位误差和所有病例每个分次的肩锁关节的位置移动幅度ΔX、ΔY和ΔZ以及三维空间的位移d进行配对样本t检验或秩和检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 患者临床特征共入组患者32例,年龄33~63岁,中位年龄44岁。中位体质量指数(body mass index,BMI)24.2 kg/m2(范围19.5~33.4 kg/m2)。卡氏评分90~100分。所有病例共行284次CBCT扫描,OSMS辅助摆位组和常规摆位组均为142次。
2.2 摆位误差OSMS辅助摆位组和常规摆位组的平移和旋转摆位误差结果见表 1。两组在Y和Rz方向的摆位误差比较,差异均具有统计学意义(均P < 0.05)。
| 摆位误差 | OSMS辅助摆位组 | 常规摆位组 | t值 | P值 |
| X(cm) | 0.17±0.12 | 0.21±0.15 | 0.856 | 0.394 |
| Y(cm) | 0.14±0.13 | 0.24±0.19 | -2.221 | 0.026 |
| Z(cm) | 0.13±0.12 | 0.19±0.21 | -0.537 | 0.591 |
| Rx(°) | 0.60±0.52 | 0.51±0.52 | 0.949 | 0.344 |
| Ry(°) | 0.61±0.60 | 0.75±0.71 | -1.302 | 0.195 |
| Rz(°) | 0.65±0.62 | 0.85±0.65 | -2.238 | 0.025 |
| 注 OSMS:光学体表监测系统(optical surface monitoring system) | ||||
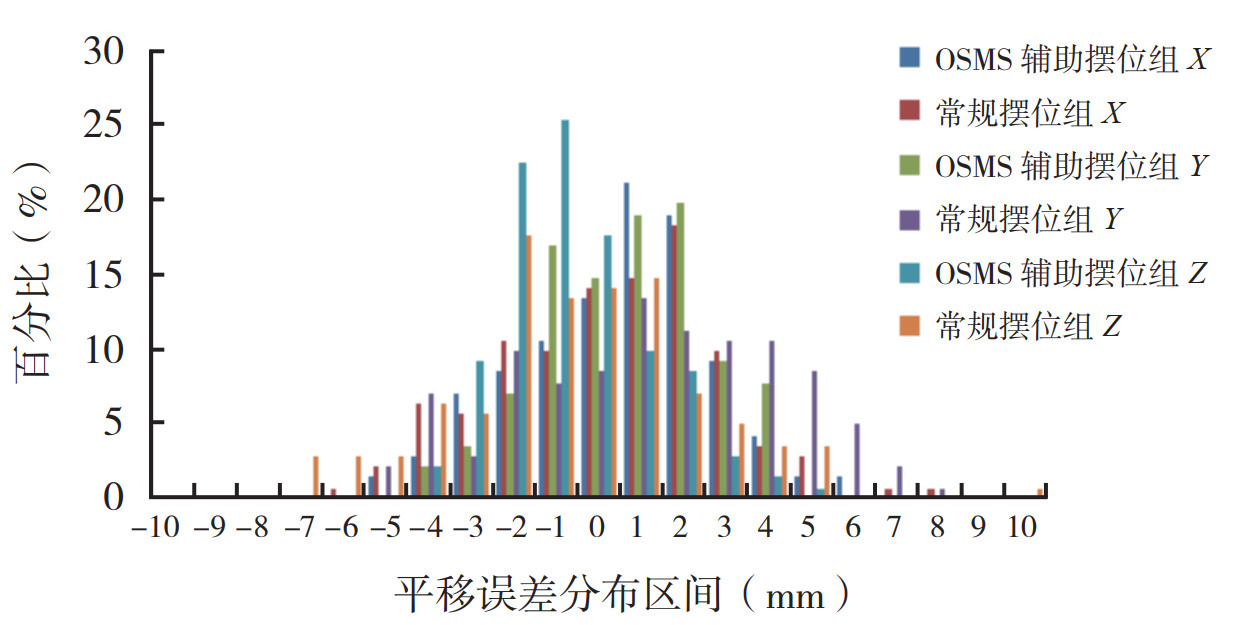
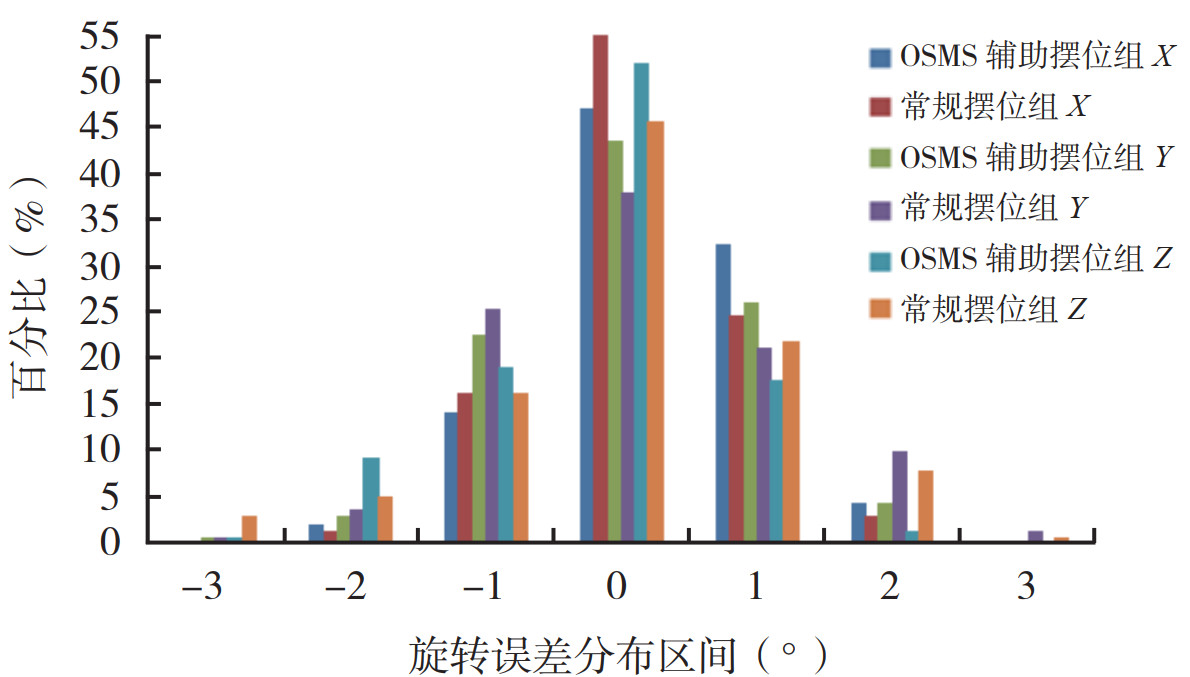
OSMS辅助摆位组和常规摆位组在X、Y和Z方向平移摆位误差 < 3 mm的百分比分别为88.72%、90.13%、95.78%和83.09%、64.09%、77.46%,< 5 mm的百分比分别为98.59%、100%、100%和97.88%、92.25%、93.66%(图 4)。OSMS辅助摆位组和常规摆位组在矢状面Rx、横断面Ry和冠状面Rz的旋转误差 < 1°的百分比分别为93.65%、92.26%、88.73%和95.78%、84.51%、83.80%,< 2°的百分比分别为100%、99.31%、99.29%和100%、97.89%、96.48%(图 5)。
|
| 注 横坐标-2表示误差区间为(-3,-2],-1表示误差区间为(-2,-1],0表示误差区间为(-1,0],1表示误差区间为(0,1],2表示误差区间为(1,2],以此类推;OSMS:光学体表监测系统(optical surface monitoring system) 图 4 OSMS辅助摆位组和常规摆位组的平移误差分布图 Fig.4 Distribution of translational setup errors in the OSMS assisted group and conventional group |
|
| 注 横坐标-3表示误差区间为[-3,-2),-2表示误差区间为[-2,-1),-1表示误差区间为[-1,0),0表示误差区间为[0,1),1表示误差区间为[1,2),2表示误差区间为[2,3),3表示误差区间为[3,4);OSMS:光学体表监测系统(optical surface monitoring system) 图 5 OSMS辅助摆位组和常规摆位组的旋转误差分布图 Fig.5 Distribution of rotational setup errors in the OSMS assisted group and conventional group |
OSMS辅助摆位组的肩锁关节位置在ΔZ方向上的移动幅度小于常规摆位组(P=0.009,表 2),而两组肩锁关节位移的三维空间位移d比较,差异无统计学意义(P=0.066)。
| 位移动度 | OSMS辅助摆位组 | 常规摆位组 | t值 | P值 |
| ΔX | 0.12±0.10 | 0.13±0.10 | -0.603 | 0.546 |
| ΔY | 0.10±0.13 | 0.10±0.12 | -0.575 | 0.565 |
| ΔZ | 0.11±0.12 | 0.12±0.13 | -2.616 | 0.009 |
| d | 0.16±0.14 | 0.17±0.13 | -1.838 | 0.066 |
| 注 OSMS:光学体表监测系统(optical surface monitoring system) | ||||
OSMS辅助摆位组和常规摆位组摆位时间分别为(5.82±1.66)min和(5.17±1.31)min(P < 0.05,图 6)。
|
| 注 OSMS:光学体表监测系统(optical surface monitoring system) 图 6 OSMS辅助摆位组和常规摆位组摆位时间分布图 Fig.6 Distribution of the setup time in the OSMS assisted group and conventional group |
应用van Herk[6]的公式MPTV=2.5∑+0.7σ,计算临床靶体积(clinical target volume,CTV)至PTV的外扩边界值,保证90%的患者的CTV至少可达到95%的处方剂量。使用光学辅助摆位和仅使用体表标记线常规摆位,PTV在X、Y和Z方向的外扩边界值分别为5.1、4.4、4.1和6.3、7.3、6.2 mm。
3 讨论本研究发现乳腺癌改良根治术后胸壁和锁骨上下区调强放疗时,应用OSMS辅助摆位在未增加摆位时间的情况下,改善摆位误差并减少肩锁关节的移动幅度。
乳腺癌放疗过程中的误差可能会影响靶区剂量分布并危及正常组织[7-8]。乳腺癌患者的预期生存期很长,因此要尽量减少分次误差以提高放疗精准性。CBCT是检验位置精准性的金标准[9]。本研究中,对于同1例患者分别使用不同的方式进行摆位,然后行CBCT验证。最大程度减少其他无关因素的干扰,以更好地评估不同摆位方式对治疗精度的影响。
本研究通过对284组CBCT图像进行回顾性分析发现,辅助摆位组和常规摆位组在X、Z、Rx和Ry方向上准确性相当,OSMS辅助摆位组误差略小于常规摆位组;在Y和Rz方向上OSMS辅助摆位组优于常规摆位组。
常规摆位组在Y和Rz方向上误差相对较大的主要原因在于:(1)常规摆位时缺乏对患者手臂等位置的有效监测,手臂上举抓杆时患者耸肩、肘部角度变化和握杆的松紧程度等均会导致摆位误差的产生,患者容易产生皮肤牵拉,导致体位重复性不佳误差增大;(2)对于肥胖和健侧乳房体积较大的患者,由于腺体的形变和位置的不固定性,实际治疗摆位时身体两侧摆位线很难与激光灯完全重合,这也导致了常规摆位组误差相对增大。
OSMS辅助摆位组中,Align RT系统中“Treatment”功能在确定的扫描体积内将参考表面与实时表面相匹配,通过不同的颜色来提示两者之间的差异,从而有效修正实际治疗时患者的位置,提高患者体位的重复性。同时由于体表标记线仅能提供十字交叉方向的摆位信息,而OSMS系统可以提供整个ROI平面的信息,更丰富的体表信息也会减少随机误差的产生[10]。所以辅助摆位组误差相对较小。
用于本研究的OSMS是Align RT表面成像系统在医科达VersaHD加速器上的集成实现。其使用投射在患者身上的可见光散斑图案来确定ROI在患者表面上的位置[11]。使用Align RT时,患者的位置由设立在患者前方和左右两侧3个方向上投影仪和摄像机组成的摄像单元监控。光学系统将实际患者表面与来自定位CT的参考表面或来自治疗室中光学采集的参考表面进行对比获得六维方向上实时位置误差信息以辅助患者摆位[12-13]。
本研究中,摆位时应用OSMS可以提供患者手臂等部位位置信息,摆位时使身体更好地重复到定位时的位置,以提高摆位的精准性。常规摆位中由于缺乏患者的姿势信息,很容易导致上肢上举时位置无法完全一致,导致锁骨上下区剂量分布的不确定性,会加重脊髓、甲状腺及臂丛神经等重要器官损伤的可能[14-16]。同时手臂等位置的不确定性也会导致肩关节动度增加从而影响辐射剂量分布。OSMS辅助摆位的应用能够减少肩关节活动障碍和疼痛风险的增加[17]。本研究中OSMS辅助摆位和常规摆位交替进行,患者手臂等位置得到有效纠正形成肌肉记忆,所以OSMS辅助摆位组肩关节动度和常规摆位组相当,都相对较小[(0.16±0.14)cm vs(0.17±0.13)cm]。可见,OSMS辅助摆位技术在患者锁骨上下区精准摆位上具有临床意义。
OSMS的临床应用不仅可以提高治疗精度,同时由于其没有额外的辐射风险,可以应用于每天的辅助摆位和实时监测,大大减少了CBCT等有辐射装置的应用,具有更好的经济效益和社会效益。此外,OSMS可以安全地监控整个治疗过程,减少可能导致治疗风险发生的相关错误,有效预防事故和(或)不良事件的发生[18]。
研究表明,与激光对准比较,仅使用光学表面成像技术摆位可减少患者摆位的时间[19]。本研究中,先通过激光灯预摆位对好大体位置,然后进行光学辅助精准摆位,所以导致OSMS辅助摆位组总体时间略有增长,统计发现,OSMS辅助摆位组摆位时间为(5.82±1.66)min,常规摆位组为(5.17±1.31)min,该结果与Kost等[20]的研究结果一致。与总体治疗时间比较,辅助摆位增加的时间可以接受。与提高摆位精度比较时间增加差异不明显,因此可以将光学辅助摆位作为常规摆位方法应用到实际治疗中。Hoisak等[21]的研究也表明,光学体表监测系统的一个明显优势是没有辐射剂量,而且该程序只会最低限度地增加整体治疗时间。
体表摆位线是弹性身体器官上的“固定”标志,其弹性在放疗期间会发生变化从而影响治疗准确性。对于一些年长的患者,皮肤可能会变得更加松弛,这也会导致摆位线偏移和降低位置准确性[22]。体表标记线的存在还会影响患者日常的清洁护理甚至可能发生过敏现象,同时会时刻提醒患者曾经或者正在接受乳腺癌治疗,增加患者的心理负担。OSMS系统在辅助摆位中的应用可有效克服标记线偏移、模糊和丢失等放疗临床常见问题,减少对患者体表标记线的依赖,降低因此带来的不适和情绪负担[23]。
应用OSMS辅助摆位能够监测到更多体表信息,减少摆位时对摆位线的依赖,纠正患者治疗姿势,提高摆位的重复性和精准度,推荐将OSMS辅助摆位作为常规摆位方法应用到实际治疗中。本研究也存在许多不足之处,样本量较小且局限于乳腺癌改良根治术后放疗的比较,后续将会开展更多部位大样本量的相关研究,为临床应用提供更多的依据和参考。
| [1] |
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2019年版)[J]. 中国癌症杂志, 2019, 29(8): 609-680. |
| [2] |
Recht A, Comen EA, Fine RE, et al. Postmastectomy radiotherapy: an American Society of Clinical Oncology, American Society for Radiation Oncology, and Society of Surgical Oncology focused guideline update[J]. J Clin Oncol, 2016, 34(36): 4431-4442. DOI:10.1200/JCO.2016.69.1188 |
| [3] |
Montero A, Ciérvide R, García-Aranda M, et al. Postmastectomy radiation therapy in early breast cancer: utility or futility?[J]. Crit Rev Oncol Hematol, 2020, 147: 102887. DOI:10.1016/j.critrevonc.2020.102887 |
| [4] |
Wiant D, Pursley J, Sintay B. SU-D-213CD-02:the accuracy of AlignRT guided set-up for whole breast and chestwall irradiation[J]. Med Phys, 2012, 39(6Part3): 3617-3618. |
| [5] |
González-Sanchis A, Brualla-González L, Fuster-Diana C, et al. Surface-guided radiation therapy for breast cancer: more precise positioning[J]. Clin Transl Oncol, 2021, 23(10): 2120-2126. DOI:10.1007/s12094-021-02617-6 |
| [6] |
van Herk M. Errors and margins in radiotherapy[J]. Semin Radiat Oncol, 2004, 14(1): 52-64. DOI:10.1053/j.semradonc.2003.10.003 |
| [7] |
徐微. 乳腺癌放疗对乳腺畸形的影响及额外边界设置的必要性分析[J]. 实用肿瘤杂志, 2021, 36(2): 149-153. |
| [8] |
Xiao AN, Jutzy J, Hubert G, et al. A study of the dosimetric impact of daily setup variations measured with cone-beam CT on three-dimensional conformal radiotherapy for early-stage breast cancer delivered in the prone position[J]. J Appl Clin Med Phys, 2020, 21(12): 146-154. DOI:10.1002/acm2.13080 |
| [9] |
赖建军, 苏志伟, 蒋璐, 等. ExacTrac X线系统二种不同图像配准序列在头颈部肿瘤放疗中的应用研究[J]. 实用肿瘤杂志, 2021, 36(3): 263-267. |
| [10] |
Kügele M, Mannerberg A, Nørring Bekke S, et al. Surface guided radiotherapy (SGRT) improves breast cancer patient setup accuracy[J]. J Appl Clin Med Phys, 2019, 20(9): 61-68. DOI:10.1002/acm2.12700 |
| [11] |
Hattel SH, Andersen PA, Wahlstedt IH, et al. Evaluation of setup and intrafraction motion for surface guided whole-breast cancer radiotherapy[J]. J Appl Clin Med Phys, 2019, 20(6): 39-44. DOI:10.1002/acm2.12599 |
| [12] |
Freislederer P, Kügele M, Öllers M, et al. Recent advanced in surface guided radiation therapy[J]. Radiat Oncol, 2020, 15(1): 187. DOI:10.1186/s13014-020-01629-w |
| [13] |
Wei WB, Ioannides PJ, Sehgal V, et al. Quantifying the impact of optical surface guidance in the treatment of cancers of the head and neck[J]. J Appl Clin Med Phys, 2020, 21(6): 73-82. DOI:10.1002/acm2.12867 |
| [14] |
Laaksomaa M, Sarudis S, Rossi M, et al. AlignRT ® and CatalystTM in whole-breast radiotherapy with DIBH: is IGRT still needed?[J]. J Appl Clin Med Phys, 2019, 20(3): 97-104. DOI:10.1002/acm2.12553 |
| [15] |
Laaksomaa M, Kapanen M, Haltamo M, et al. Determination of the optimal matching position for setup images and minimal setup margins in adjuvant radiotherapy of breast and lymph nodes treated in voluntary deep inhalation breath-hold[J]. Radiat Oncol, 2015, 10: 76. DOI:10.1186/s13014-015-0383-y |
| [16] |
Zhou JD, Li S, Ye CW, et al. Analysis of local setup errors of sub-regions in cone-beam CT-guided post-mastectomy radiation therapy[J]. J Radiat Res, 2020, 61(3): 457-463. DOI:10.1093/jrr/rraa007 |
| [17] |
Johansen S, Fosså K, Nesvold IL, et al. Arm and shoulder morbidity following surgery and radiotherapy for breast cancer[J]. Acta Oncol, 2014, 53(4): 521-529. DOI:10.3109/0284186X.2014.880512 |
| [18] |
Al-Hallaq H, Batista V, Kügele M, et al. The role of surface-guided radiation therapy for improving patient safety[J]. Radiother Oncol, 2021, 163: 229-236. DOI:10.1016/j.radonc.2021.08.008 |
| [19] |
Jimenez RB, Batin E, Giantsoudi D, et al. Tattoo free setup for partial breast irradiation: a feasibility study[J]. J Appl Clin Med Phys, 2019, 20(4): 45-50. DOI:10.1002/acm2.12557 |
| [20] |
Kost S, Guo BQ, Xia P, et al. Assessment of setup accuracy using anatomical landmarks for breast and chest wall irradiation with surface guided radiation therapy[J]. Pract Radiat Oncol, 2019, 9(4): 239-247. DOI:10.1016/j.prro.2019.03.002 |
| [21] |
Hoisak JDP, Pawlicki T. The role of optical surface imaging systems in radiation therapy[J]. Semin Radiat Oncol, 2018, 28(3): 185-193. DOI:10.1016/j.semradonc.2018.02.003 |
| [22] |
Rigley J, Robertson P, Scattergood L. Radiotherapy without tattoos: could this work?[J]. Radiography (Lond), 2020, 26(4): 288-293. |
| [23] |
Moser T, Creed M, Walker R, et al. Radiotherapy tattoos: Women's skin as a carrier of personal memory-What do we cause by tattooing our patients?[J]. Breast J, 2020, 26(2): 316-318. |
 2023, Vol. 38
2023, Vol. 38


