文章信息
- 周津卉, 谢锋
- Zhou Jinhui, Xie Feng
- 改良格拉斯哥评分和血清癌胚抗原水平对结直肠癌肝转移的预测价值
- Predictive signifi cance of modifi ed Glasgow prognostic score and serum carcinoembryonic antigen level in liver metastasis from colorectal cancer
- 实用肿瘤杂志, 2022, 37(5): 424-432
- Journal of Practical Oncology, 2022, 37(5): 424-432
基金项目
- 辽宁省科学技术计划项目(2021-MS-065)
-
通信作者
- 谢锋, E-mail: 15040255877@163.com
-
文章历史
- 收稿日期:2021-08-29
结直肠癌是世界范围内的主要恶性肿瘤之一,也是癌症致死的主要原因之一。转移是癌症最致命的特征,将严重限制许多实体肿瘤的成功治疗,从而影响患者的生存率。在结直肠癌中,肝脏是结直肠癌最常见的转移部位,约50%的患者会在病程中发生肝转移[1]。由于成像技术质量的提高而更早发现转移、肝转移不再作为手术禁忌证以及提供降期或延期的全身或局部治疗策略的迅速发展等原因,在过去的20年中,转移性结直肠癌的中位总生存期(overall survival,OS)增加1倍,目前已经 > 30个月[2]。早期发现和治疗是结直肠癌肝转移治疗的关键。结直肠癌合并肝转移患者早期无明显症状,除了通过使用影像技术或血清标志物监测转移,使用预测分子标志物来识别肝转移的高风险也尤为重要。
自从首次用“种子和土壤”理论描述肿瘤微环境以来,越来越多的证据表明癌症相关间质可能影响癌细胞本身并促进癌症进展[3]。肿瘤微环境的主要成分是微血管(微血管和淋巴管)、炎性反应细胞和癌症相关成纤维细胞。有研究表明,C反应蛋白(C reactive protein,CRP)不仅在炎性反应过程中升高,CRP表达还与参与结直肠癌发展的重要基因的表达增加有关,V-Ki-ras2 Kirsten大鼠肉瘤病毒癌基因同源物(V-Ki-ras 2 Kirsten rat sarcoma viral oncogene homolog,KRAS)突变和某些CRP基因型引起的炎性反应还可加重结直肠肝转移[4]。除了CRP外,基于循环白细胞的其他炎性反应预后参数如中性粒细胞/淋巴细胞比率(neutrophil/lymphocyte ratio,NLR)、血小板/淋巴细胞比率(platelet/lymphocyte ratio,PLR)和淋巴细胞/单核细胞比率(lymphocyte/monocyte ratio,LMR)等,已经在多种实体肿瘤中显示出预后价值,如结直肠癌[5]、肺癌[6]和肾细胞癌[7]等实体肿瘤。癌胚抗原(carcinoembryonic antigen,CEA)是术后或系统治疗期间评估疗效及复发的首选血清肿瘤标志物。
转移瘤完全性切除是在转移性癌症的治疗中也最有效及最有潜力的治疗方法,较大的转移性肝肿瘤“占位效应”引起的肝功能检查异常与预后不良有关[8],还会影响结直肠癌合并肝转移的肝切除术中阴性切缘状态[9]。肿瘤负荷的评估可能有助于指导治疗方案的选择。
因此,本研究的目的是在基于炎性反应的相关评分和血清CEA水平中寻找预测结直肠癌合并肝转移的可能标志物,并且探讨与肝转移肿瘤负荷的相关性,更准确地描绘研究人群中有意义的预后亚群,指导结直肠癌肝转移的风险分层和治疗决策。
1 资料与方法 1.1 一般资料回顾性分析2016年1月至2020年12月在辽宁省人民医院接受结直肠癌原发肿瘤根治性切除的患者。根据以下纳入标准确定符合条件的患者:(1)经临床实验室、影像学和病理学检测证实的结直肠癌;(2)术前未接受新辅助放化疗;(3)肿瘤切除边缘阴性的根治性手术;(4)没有与炎性反应性肠病相关的癌症以及其他恶性肿瘤病史;(5)术前没有病原体感染、自身免疫性或慢性肾脏疾病、血液病、肝病或心脑血管疾病;(6)未服用抗菌药物、非甾体抗感染药物或抗血小板药物,未输血或静脉补充白蛋白。所有肝转移的诊断均由2位放射科医师独立通过腹部增强CT检查确认。根据术后有无肝转移将结直肠癌患者分为肝转移组和未发生肝转移组,未发生肝转移的定义需在原发肿瘤根治性切除后随访≥3年的背景下确认。其中结直肠癌诊断时或诊断前发生肝转移的患者纳入同时性肝转移组,其余时间点发生肝转移的患者纳入异时性肝转移组。本研究的回顾性方案经辽宁省人民医院伦理委员会批准,所有数据都是根据“赫尔辛基宣言”获得的。在回顾性研究中,数据是匿名分析的,对所有患者的隐私保密,辽宁省人民医院伦理委员会免除了知情同意。
1.2 临床病理资料记录研究对象的人口学变量和癌组织病理变量,肿瘤(T)和淋巴结分期(N)基于美国癌症联合委员会(American Joint Committee on Cancer,AJCC)分期[10]。肿瘤部位按国际疾病分类法确定:盲肠、升结肠、结肠肝曲和横结肠的肿瘤为右侧结直肠癌;结肠脾曲、降结肠、乙状结肠和直肠的肿瘤为左侧结直肠癌[10]。术前7 d内测定常规实验室指标,构建并计算NLR、PLR、LMR、改良格拉斯哥评分(modified Glasgow prognostic score,mGPS)、预后指数(prognostic index,PI)、预后营养指数(prognostic nutritional index,PNI)、全身炎性反应指数(systemic inflammatory response index,SIRI)和全身免疫炎性反应指数(systemic immune-inflammatory index,SII),根据受试者工作特征(receiver operating characteristic,ROC)曲线计算最佳截断值(表 1)。肿瘤负荷以肿瘤负荷评分(tumor burden score,TBS)计算,公式如下:(TBS)2=(最大肿瘤直径)2+(病灶个数)2,最大肿瘤直径单位为cm。肿瘤的大小和数目在腹部CT或MRI成像检查静脉期进行,以便准确地区分正常的健康肝脏和肝转移瘤。
| 评分系统 | 得分 |
| NLR | |
| < 2.0 | 0 |
| ≥2.0 | 1 |
| PLR | |
| < 130 | 0 |
| ≥130 | 1 |
| LMR | |
| < 3.5 | 0 |
| ≥3.5 | 1 |
| mGPS | |
| CRP≤10 mg/L | 0 |
| CRP > 10 mg/L且白蛋白≥35 g/L | 1 |
| CRP > 10 mg/L且白蛋白 < 35 g/L | 2 |
| PI | |
| CRP≤10 mg/L且白细胞计数≤10×109/L | 0 |
| CRP≤10 mg/L且白细胞计数 > 10×109/L | 1 |
| CRP > 10 mg/L且白细胞计数≤10×109/L | 1 |
| CRP > 10 mg/L且白细胞计数 > 10×109/L | 2 |
| PNI | |
| 白蛋白(g/L)+5×淋巴细胞计数(×109/L)≥49.5 | 0 |
| 白蛋白(g/L)+5×淋巴细胞计数(×109/L) < 49.5 | 1 |
| SII | |
| 血小板计数(×109/L)×NLR < 618 | 0 |
| 血小板计数(×109/L)×NLR≥618 | 1 |
| SIRI | |
| 单核细胞计数(×109/L)×NLR < 1.40 | 0 |
| 单核细胞计数(×109/L)×NLR≥1.40 | 1 |
| 注 NLR:中性粒细胞/淋巴细胞比率(neutrophil/lymphocyte ratio);PLR:血小板/淋巴细胞比率(platelet/lymphocyte ratio);LMR:淋巴细胞/单核细胞比率(lymphocyte/monocyte ratio);mGPS:改良格拉斯哥评分(modified Glasgow prognostic score);CRP:C反应蛋白(C reactive protein);PI:预后指数(prognostic index);PNI:预后营养指数(prognostic nutritional index);SII:全身免疫炎性反应指数(systemic immune-inflammatory index);SIRI:全身炎性反应指数(systemic inflammatory response index) | |
对检查时未发生肝转移的患者进行随访以确定是否发生肝转移(随访目的是确定是否有异时性肝转移及对未发生肝转移的患者持续随访)。随访截止日期为2021年3月31日。随访时间为12~39个月,中位随访时间为29个月。随访方案包括原发肿瘤术后定期临床评估、常规血清学检查(包括肝功能和血清CEA)及胸部、腹部和盆腔CT和(或)MRI扫描。结直肠癌肝转移的诊断是通过肝肿瘤切除或细针穿刺活检后病理证实,或典型的临床疾病进展(如随访过程中CEA水平升高)结合增强CT/MRI检查观察到新发肝转移瘤影像,排除任何其他癌症来确认的。肝转移瘤大小和数目在全腹或肝胆脾增强CT和(或)MRI静脉期评估。所有失访患者均未入组本研究。
1.4 统计学分析使用SPSS25.0及R 3.6.1统计学软件进行数据分析。计量资料采用均数±标准差(x±s)表示,组间比较采用t检验。计数资料采用频数(百分比)表示,使用χ2检验或Fisher精确检验进行比较。通过Logistic回归模型进行单因素和多因素分析,单因素分析中P < 0.10的因素纳入多因素分析,找出肝转移的危险因素。用ROC曲线分析计算约登指数以确定最佳阈值,并计算各参数的曲线下面积(area under the curve,AUC),AUC > 0.70为具有临床意义。决策曲线分析(decision curve analysis,DCA)通过量化不同阈值概率下的净收益来确定临床实用性。采用Pearson相关性及Spearman等级相关评估肝转移肿瘤负荷与炎性反应相关预后因素的相关性,连续变量均进行log10对数转换。以双侧P < 0.05为差异具有统计学意义。
2 结果 2.1 患者临床病理特征本研究共纳入69例接受根治性切除术的结直肠癌患者,其中男性47例,女性22例;年龄46~88岁,(65.87±8.94)岁。截至随访结束,38例证实为结直肠癌肝转移。按结直肠癌患者是否发生肝转移将患者分为肝转移组和未发生肝转移组。两组在性别、年龄、原发病灶位置、T分期和PNI方面比较,差异均无统计学意义(均P > 0.05,表 2);在N分期、组织学分化程度、NLR、LMR、SIRI、mGPS、PI和CEA方面比较,差异均具有统计学意义(均P < 0.05)。
| 临床特征 | 无肝转移组(n=31) | 肝转移组(n=38) | t/χ2值 | P值 |
| 年龄(岁,x±s) | 65.87±8.94 | 64.37±11.49 | 0.595 | 0.554 |
| 性别 | 0.336 | 0.562 | ||
| 男性 | 20(42.6) | 27(57.4) | ||
| 女性 | 11(50.0) | 11(50.0) | ||
| 原发肿瘤位置 | 0.052 | 0.819 | ||
| 右侧结直肠癌 | 9(42.9) | 12(57.1) | ||
| 左侧结直肠癌 | 22(45.8) | 26(54.2) | ||
| 原发肿瘤T分期 | 3.516 | 0.118 | ||
| T1~2 | 6(60.0) | 4(40.0) | ||
| T3 | 22(47.8) | 24(52.2) | ||
| T4 | 3(23.1) | 10(76.9) | ||
| 原发肿瘤N分期 | 5.766 | 0.019 | ||
| N0~1 | 30(50.8) | 29(49.2) | ||
| N1~2 | 1(10.0) | 9(90.0) | ||
| 分化程度 | 4.195 | 0.041 | ||
| 低~中分化 | 8(29.6) | 19(70.4) | ||
| 高分化 | 23(54.8) | 19(45.2) | ||
| NLR | 5.740 | 0.017 | ||
| < 2.0 | 15(65.2) | 8(34.8) | ||
| ≥2.0 | 16(34.8) | 30(65.2) | ||
| PLR | 2.586 | 0.108 | ||
| < 130 | 12(60.0) | 8(40.0) | ||
| ≥130 | 19(38.8) | 30(61.2) | ||
| LMR | 7.680 | 0.006 | ||
| < 3.50 | 10(28.6) | 25(71.4) | ||
| ≥3.50 | 21(61.8) | 13(38.2) | ||
| PNI | 2.648 | 0.104 | ||
| < 49.5 | 23(52.3) | 21(47.7) | ||
| ≥49.5 | 8(32.0) | 17(68.0) | ||
| SII | 3.791 | 0.052 | ||
| < 618 | 17(58.6) | 12(41.4) | ||
| ≥618 | 14(35.0) | 26(65.0) | ||
| SIRI | 10.003 | 0.002 | ||
| < 1.40 | 24(61.5) | 15(38.5) | ||
| ≥1.40 | 7(23.3) | 23(76.7) | ||
| mGPS | 23.066 | < 0.01 | ||
| 0分 | 16(76.2) | 5(23.8) | ||
| ≥1分 | 2(7.7) | 24(92.3) | ||
| PI | 19.846 | < 0.01 | ||
| 0分 | 15(75.0) | 5(25.0) | ||
| ≥1分 | 3(11.1) | 24(88.9) | ||
| CEA | 17.179 | < 0.01 | ||
| < 16.80 ng/mL | 28(63.6) | 16(36.4) | ||
| ≥16.80 ng/mL | 3(12.0) | 22(88.0) | ||
| 注 NLR:中性粒细胞/淋巴细胞比率(neutrophil/lymphocyte ratio);PLR:血小板/淋巴细胞比率(platelet/lymphocyte ratio);LMR:淋巴细胞/单核细胞比率(lymphocyte/monocyte ratio);PNI:预后营养指数(prognostic nutritional index);SII:全身免疫炎性反应指数(systemic immune-inflammatory index);SIRI:全身炎性反应指数(systemic inflammatory response index);mGPS:改良格拉斯哥评分(modified Glasgow prognostic score);PI:预后指数(prognostic index);癌胚抗原(carcinoembryonic antigen,CEA) | ||||
根据肝转移发生时间,队列中有同时性肝转移28例,异时性肝转移10例。同时性肝转移组与异时性肝转移组在人口学变量、癌组织病理变量及常规实验室检查等方面比较,差异均无统计学意义(均P > 0.05,表 3)。
| 临床特征 | 同时性肝转移组 | 异时性肝转移组 | t/χ2值 | P值 |
| 年龄(x±s,岁) | 64.75±11.29 | 63.30±12.58 | 0.338 | 0.737 |
| 性别 | 0.007 | 1.000 | ||
| 男性 | 20(74.1) | 7(25.9) | ||
| 女性 | 8(72.7) | 3(27.3) | ||
| 原发肿瘤位置 | 0.445 | 0.694 | ||
| 右侧结直肠癌 | 8(66.7) | 4(33.3) | ||
| 左侧结直肠癌 | 20(76.9) | 6(23.1) | ||
| 原发肿瘤T分期 | 1.929 | 0.257 | ||
| T1~2 | 3(75.0) | 1(25.0) | ||
| T3 | 16(66.7) | 8(33.3) | ||
| T4 | 9(90.0) | 1(10.0) | ||
| 原发肿瘤N分期 | 1.406 | 0.396 | ||
| N0~1 | 20(69.0) | 9(31.0) | ||
| N1~2 | 8(88.9) | 1(11.1) | ||
| 分化程度 | 0.543 | 0.461 | ||
| 低~中分化 | 13(68.4) | 6(31.6) | ||
| 高分化 | 15(78.9) | 4(21.1) | ||
| NLR | 0.654 | 0.411 | ||
| < 2.0 | 5(62.5) | 3(37.5) | ||
| ≥2.0 | 23(76.7) | 7(23.3) | ||
| PLR | 0.009 | 1.000 | ||
| < 130 | 6(75.0) | 2(25.0) | ||
| ≥130 | 22(73.3) | 8(26.3) | ||
| LMR | 1.503 | 0.263 | ||
| < 3.50 | 20(80.0) | 5(20.0) | ||
| ≥3.50 | 8(61.5) | 5(38.5) | ||
| PNI | 0.152 | 0.727 | ||
| < 49.5 | 16(76.2) | 5(23.8) | ||
| ≥49.5 | 12(70.6) | 5(29.4) | ||
| SII | 0.445 | 0.694 | ||
| < 618 | 8(66.7) | 4(33.3) | ||
| ≥618 | 20(76.9) | 6(23.1) | ||
| SIRI | 0.002 | 1.000 | ||
| < 1.40 | 11(73.3) | 4(26.7) | ||
| ≥1.40 | 17(73.9) | 6(26.1) | ||
| mGPS | 0.174 | 1.000 | ||
| 0分 | 4(80.0) | 1(20.0) | ||
| ≥1分 | 17(70.8) | 7(29.2) | ||
| PI | 0.174 | 1.000 | ||
| 0分 | 4(80.0) | 1(20.0) | ||
| ≥1分 | 17(70.8) | 7(29.2) | ||
| CEA | 1.783 | 0.267 | ||
| < 16.80 ng/mL | 10(62.5) | 6(37.5) | ||
| ≥16.80 ng/mL | 18(81.8) | 4(18.2) | ||
| 注 NLR:中性粒细胞/淋巴细胞比率(neutrophil/lymphocyte ratio);PLR:血小板/淋巴细胞比率(platelet/lymphocyte ratio);LMR:淋巴细胞/单核细胞比率(lymphocyte/monocyte ratio);PNI:预后营养指数(prognostic nutritional index);SII:全身免疫炎性反应指数(systemic immune-inflammatory index);SIRI:全身炎性反应指数(systemic inflammatory response index);mGPS:改良格拉斯哥评分(modified Glasgow prognostic score);PI:预后指数(prognostic index);癌胚抗原(carcinoembryonic antigen,CEA) | ||||
将所有炎性反应指标齐全的47例患者纳入Logistic回归分析。单因素分析显示,NLR、SIRI、PI、mGPS和CEA水平是结直肠癌肝转移的危险因素,LMR和组织学分化程度为保护因素(均P < 0.10,表 4)。纳入以上因素作多因素Logistic回归分析显示,组织学分化程度(OR=0.02,95%CI:0.001~0.399,P=0.032)、mGPS(OR=36.22,95%CI:1.32~2954.8,P=0.048)和CEA水平(OR=39.67,95%CI:2.18~3469.6,P=0.040)是独立预测因子(表 5)。
| 临床病理特征 | 单因素分析 | ||
| OR | 95%CI | P值 | |
| 性别 | |||
| 男性 | ref | ||
| 女性 | 1.33 | 0.34~5.29 | 0.682 |
| 原发肿瘤位置 | |||
| 右侧结直肠癌 | ref | ||
| 左侧结直肠癌 | 1.11 | 0.32~3.09 | 0.869 |
| 原发肿瘤T分期 | |||
| T1~2 | ref | ||
| T3~4 | 1.08 | 0.16~7.20 | 0.934 |
| 原发肿瘤N分期 | |||
| N0~1 | ref | ||
| N1~2 | 5.41 | 0.61~48.27 | 0.131 |
| 分化程度 | |||
| 低~中分化 | ref | ||
| 高分化 | 0.23 | 0.05-0.83 | 0.030 |
| PLR | |||
| < 130 | ref | ||
| ≥130 | 2.00 | 0.56~7.15 | 0.286 |
| PNI | |||
| < 49.5 | ref | ||
| ≥49.5 | 1.68 | 0.51~5.56 | 0.393 |
| SII | |||
| < 618 | ref | ||
| ≥618 | 2.05 | 0.62~6.75 | 0.240 |
| NLR | |||
| < 2.0 | ref | ||
| ≥2.0 | 3.07 | 0.85~11.69 | 0.089 |
| LMR | |||
| < 3.50 | ref | ||
| ≥3.50 | 0.26 | 0.07~0.88 | 0.035 |
| SIRI | |||
| < 1.40 | ref | ||
| ≥1.40 | 4.94 | 1.43~19.32 | 0.015 |
| PI | |||
| 0分 | ref | ||
| ≥1分 | 24.00 | 5.62~137.92 | < 0.01 |
| mGPS | |||
| 0分 | ref | ||
| ≥1分 | 38.40 | 7.92~300.97 | < 0.01 |
| CEA | |||
| < 16.80 ng/mL | ref | ||
| ≥16.80 ng/mL | 20.92 | 3.56~402.63 | 0.005 |
| 注 PLR:血小板/淋巴细胞比率(platelet/lymphocyte ratio);PNI:预后营养指数(prognostic nutritional index);SII:全身免疫炎性反应指数(systemic immune-inflammatory index);NLR:中性粒细胞/淋巴细胞比率(neutrophil/lymphocyte ratio);LMR:淋巴细胞/单核细胞比率(lymphocyte/monocyte ratio);SIRI:全身炎性反应指数(systemic inflammatory response index);PI:预后指数(prognostic index);mGPS:改良格拉斯哥评分(modified Glasgow prognostic score);癌胚抗原(carcinoembryonic antigen,CEA);ref:参考(reference) | |||
| 临床病理特征 | 多因素分析 | ||
| OR | 95%CI | P值 | |
| 分化程度 | |||
| 低~中分化 | ref | ||
| 高分化 | 0.02 | 0.00~0.40 | 0.032 |
| NLR | |||
| < 2.0 | ref | ||
| ≥2.0 | 27.49 | 0.50~1 299.82 | 0.158 |
| LMR | |||
| < 3.50 | ref | ||
| ≥3.50 | 14.18 | 0.03~5 732.62 | 0.605 |
| SIRI | |||
| < 1.40 | ref | ||
| ≥1.40 | 2.95 | 0.00~1 202.81 | 0.831 |
| PI | |||
| 0分 | ref | ||
| ≥1分 | 14.73 | 0.34~1 084.53 | 0.146 |
| mGPS | |||
| 0分 | ref | ||
| ≥1分 | 36.22 | 1.32~2 954.85 | 0.048 |
| CEA | |||
| < 16.80 ng/mL | ref | ||
| ≥16.80 ng/mL | 39.67 | 2.18~3 469.65 | 0.040 |
| 注 NLR:中性粒细胞/淋巴细胞比率(neutrophil/lymphocyte ratio);LMR:淋巴细胞/单核细胞比率(lymphocyte/monocyte ratio);SIRI:全身炎性反应指数(systemic inflammatory response index);PI:预后指数(prognostic index);mGPS:改良格拉斯哥评分(modified Glasgow prognostic score);癌胚抗原(carcinoembryonic antigen,CEA);ref:参考(reference) | |||
mGPS、CEA和组织学分化程度的AUC值分别为0.86、0.75和0.66,尽管显示出一定的预测价值,但mGPS、CEA联合组织学分化程度的预测价值最高,AUC值为0.95(图 1)。通过DCA进行临床实用性分析表明,mGPS、CEA联合组织学分化程度的模型净获益率总是优于其他3个单因素模型(图 2)。
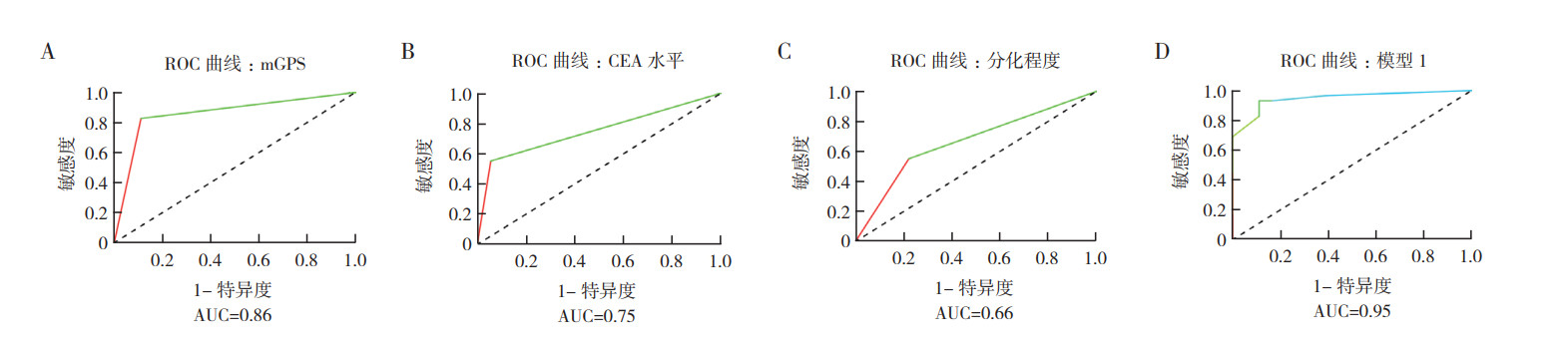
|
| 注 A:mGPS预测结直肠癌肝转移的ROC曲线;B:CEA预测结直肠癌肝转移的ROC曲线;C:组织学分化程度预测结直肠癌肝转移的ROC曲线;D:模型1预测结直肠癌肝转移的ROC曲线;mGPS:改良格拉斯哥评分(modified Glasgow prognostic score);CEA:癌胚抗原(carcinoembryonic antigen);ROC:受试者工作特征(receiver operating characteristic); AUC:曲线下面积(area under the curve) 图 1 mGPS、CEA水平、组织学分化程度和三者联合(模型1)的ROC曲线预测结直肠癌肝转移 Fig.1 ROC curves of mGPS, CEA level, degree of histological differentiation, and their combination (model 1) in predicting liver metastasis in colorectal cancer |
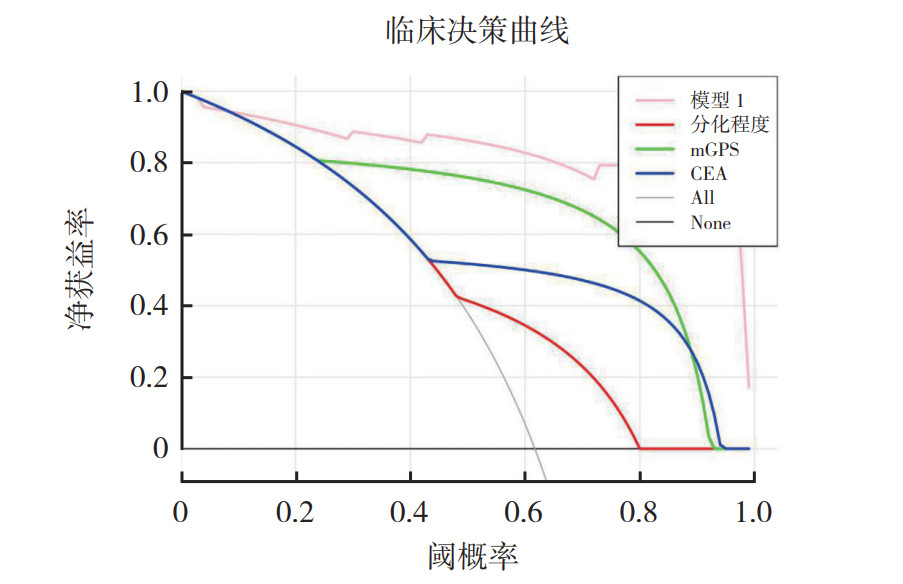
|
| 注 mGPS:改良格拉斯哥评分(modified Glasgow prognostic score);CEA:癌胚抗原(carcinoembryonic antigen) 图 2 mGPS、CEA水平、组织学分化程度和三者联合(模型1)预测结直肠癌患者肝转移的决策曲线 Fig.2 Decision curve analysis of mGPS, CEA level, degree of histological differentiation, and their combination (model 1) in predicting liver metastasis in colorectal cancer |
血清CEA水平与肝转移肿瘤负荷呈正相关(r=0.580,P < 0.01;图 3),LMR与肝转移肿瘤负荷呈负相关(r=-0.430,P=0.007)。SIRI(r=0.360,P=0.025)和mGPS[Spearman相关系数(rs)=0.370,P=0.046]与肝转移肿瘤负荷的相关性较弱(图 4)。
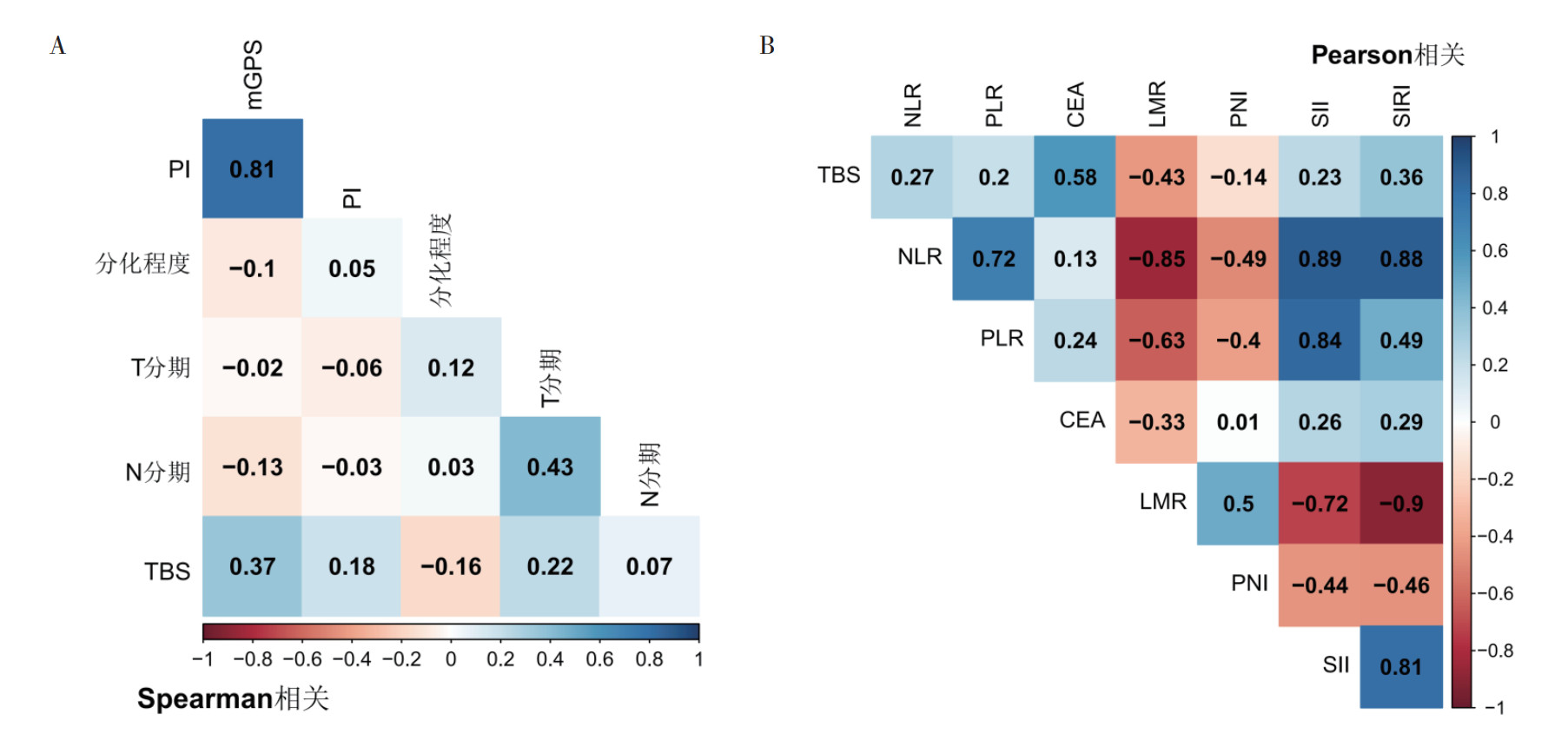
|
| 注 A:结直肠癌肝转移肿瘤负荷的多变量Spearman相关性分析图;B:结直肠癌肝转移肿瘤负荷的多变量Pearson相关性分析图;图中数字代表相关系数;所有原始数据均经过log10对数转换;PI:预后指数(prognostic index);TBS:肿瘤负荷评分(tumor burden score);mGPS:改良格拉斯哥评分(modified Glasgow prognostic score);NLR:中性粒细胞/淋巴细胞比率(neutrophil/lymphocyte ratio);PLR:血小板/淋巴细胞比率(platelet/lymphocyte ratio);CEA:癌胚抗原(carcinoembryonic antigen);LMR:淋巴细胞/单核细胞比率(lymphocyte/monocyte ratio);PNI:预后营养指数(prognostic nutritional index);SII:全身免疫炎性反应指数(systemic immune-inflammatory index);SIRI:全身炎性反应指数(systemic inflammatory response index) 图 3 结直肠癌肝转移肿瘤负荷的多变量相关性分析图 Fig.3 Multivariate correlation analysis of the tumor burden of liver metastasis from colorectal cancer |
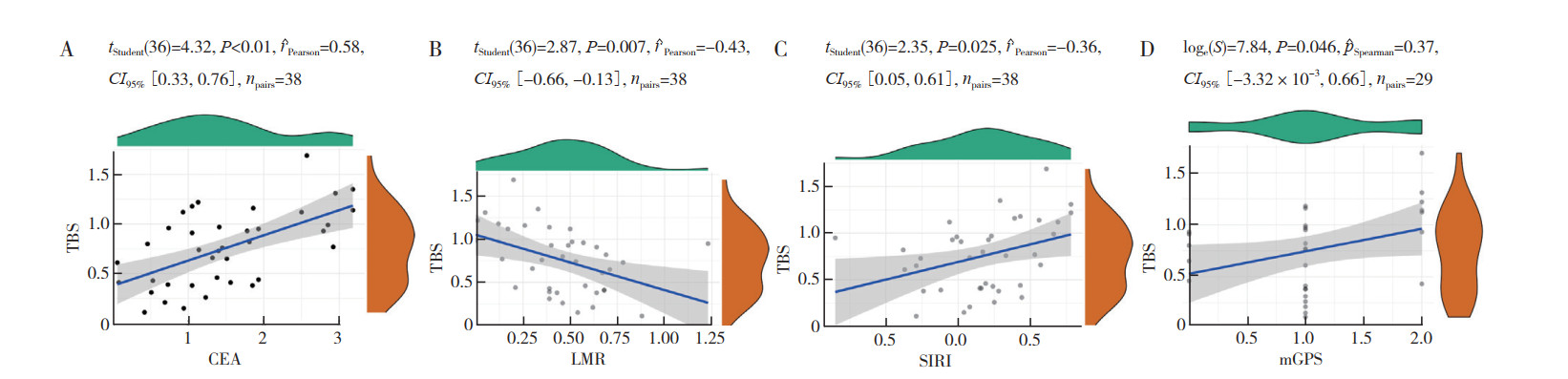
|
| 注 A:肝转移肿瘤负荷与术前CEA的相关性;B:肝转移肿瘤负荷与术前LMR的相关性;C:肝转移肿瘤负荷与术前SIRI的相关性;D:肝转移肿瘤负荷与术前mGPS的相关性;蓝色斜线为最佳拟合线;灰色区域为95%CI;TBS:肿瘤负荷评分(tumor burden score);癌胚抗原(carcinoembryonic antigen,CEA);LMR:淋巴细胞/单核细胞比率(lymphocyte/monocyte ratio);SIRI:全身炎性反应指数(systemic inflammatory response index);mGPS:改良格拉斯哥评分(modified Glasgow prognostic score) 图 4 经结直肠癌原发肿瘤切除术后患者的肝转移肿瘤负荷与术前CEA水平、LMR、SIRI和mGPS的相关性 Fig.4 Correlation between the tumor burden of liver metastasis and preoperative CEA level, LMR, SIRI, and mGPS in patients after primary colorectal cancer resection |
近十年来,扩大的切除标准和疾病术前降期治疗的改善增加了可行结直肠癌肝转移手术切除的患者数量。对于那些认为不适合肝转移手术切除的患者来说,局部治疗[如经皮消融[11]、放射栓塞[12]与装载伊立替康的药物洗脱微珠(drug-eluting beads loaded with irinotecan,DEBIRI)[13]等]越来越多被承认是可行的治疗选择,局部治疗能实现局部控制并增加肝脏的无瘤生存期。对肝转移的早期预测是决定治疗策略的重要依据,确定预测结直肠癌患者是否肝转移的较好炎性反应指标也变得至关重要。
以mGPS、NLR和PLR等为代表的炎性反应相关评分是基于不同的循环白细胞或急性时相蛋白的比率,代表 2个不同器官的系统反应,即淋巴/髓系组织和肝脏。本研究采用ROC曲线确定预测肝转移的最佳阈值,发现合并肝转移的结直肠癌患者的NLR、SIRI、mGPS、PI以及CEA水平较未发生肝转移的患者更高,LMR相对较低,尽管多因素分析中只有mGPS及CEA水平是独立预测因子,但仍然提示免疫机制与肿瘤进展相关:结直肠癌患者合并肝转移时机体呈现中性粒细胞和单核细胞升高、淋巴细胞减少、CRP升高和白蛋白减少的免疫状态。这一结果支持以前的研究结果:中性粒细胞在肿瘤的炎性反应中起着中心作用,通过释放活性氧(reactive oxygen species,ROS)、活性氮(reactive nitrogen species,RNS)或蛋白酶以及促进循环生长因子如白细胞介素-1、白细胞介素-6和血管内皮生长因子的分泌,参与肿瘤的起始、生长、增殖或转移扩散等多个过程[14]。淋巴细胞在肿瘤免疫应答过程中能促进细胞毒细胞死亡和抑制肿瘤细胞的增殖和迁移发挥重要的抗肿瘤作用[15],因此淋巴细胞减少反映机体较差的抗肿瘤免疫状态,可能会为肿瘤细胞的扩散创造有利的微环境。此外,单核细胞会抑制宿主对癌症的免疫反应,逃避免疫监视从而促进肿瘤的生长[16],单核细胞的降低一定程度上提示肿瘤生长速度及侵袭能力的减低。这也可以部分解释LMR与肝转移肿瘤负荷之间的负相关性。
本研究中,mGPS高、CEA水平高以及原发肿瘤分化程度低的患者肝转移的风险较高,这为结直肠癌肝转移的预后分层以及预测结直肠癌肝转移提供了新的思路。其中mGPS是基于血清CRP和白蛋白水平计算的,反映了患者的炎性反应和营养状况。CRP是一种由肝细胞合成的急性时相反应物,受促炎性反应细胞因子调节,CRP的升高体现了肝细胞响应炎性反应、组织损伤和感染等病理生理过程[17],而低蛋白血症与更大的营养风险、贫血、低骨骼肌质量和低骨骼肌密度等营养不良和恶病质状态有关[18]。本研究还发现,CEA水平与结直肠癌肝转移肿瘤负荷呈中度正相关,这可能与CEA在原发肿瘤的存在下,诱导肝转移灶和原发肿瘤周围正常肝组织中促血管生成因子的增加有关,包括血管内皮生长因子-A(vascular endothelial growth factor-A,VEGF-A),血管内皮生长因子受体1(vascular endothelial growth factor receptor 1,VEGFR1),肝转移和正常肝组织中血管生成素(angiopoietin 2/angiopoietin 1,Ang2/Ang1),这为肿瘤细胞转移生长准备了“肥沃土壤”[19]。CRP还会促进CEA的表达和分泌,高浓度CRP对CEA受体的刺激可能在肝转移中起重要作用通过上调CEA、基质金属蛋白酶1(matrix metalloproteinase 1,MMP1)和MMP2的表达,刺激氧化低密度脂蛋白受体-1(Lectin-like Ox-LDL receptor 1,LOX-1)依赖的途径,激活与肝转移相关的基因,促进肿瘤细胞生长、侵袭和转移[20]。
根据肝转移相对于原发性结直肠癌诊断的时间,结直肠癌肝转移分为“同时性”或“异时性”。出于以下原因选择结直肠癌诊断时或诊断前作为分界点:原发肿瘤根治切除前或切除时发生的肝转移,可能是在原发肿瘤的影响下生长的,而原发肿瘤根治性切除后发生的肝转移,可能代表肝转移是独立于原发肿瘤生长的。有研究提出,与预后不良相关的临床和病理特征在同时性肝转移患者中更常见[21-22],包括随机世界卫生组织(World Health Organization,WHO)表现状态较差,诊断时CEA水平更高、T分期和N分期更高以及高的组织学分级等,但在本研究中同时性肝转移组与异时性肝转移组在人口学变量、癌组织病理变量及炎性反应预后变量方面比较,差异均无统计学意义(均P > 0.05),这可能与其他研究中所使用的定义时间点未达成共识有关,如Colloca等[23]和Reetta等[24]均使用6个月作为同时性与异时性肝转移的分界点。
尽管mGPS、血清CEA水平以及原发肿瘤分化程度对结直肠癌肝转移的预测能力已得到证实,但这项研究仍存在一些局限性。首先,各循环白细胞或急性时相蛋白是对肿瘤炎性反应的间接测量,目前尚无广泛接受的最佳截断值。本研究的截断值也与既往的研究[25-26]有一定偏差,但本研究通过ROC曲线分析计算约登指数确定最佳的阈值,能较大程度减小受检测设备及受检个体不同实体肿瘤类型等原因带来的偏差。此外,本研究为回顾性研究,所有患者的数据都是从1个医院收集的,患者数量较少,因此,本研究的结论可能有偏差,需要进行更大规模的前瞻性研究来证实这些初步结果。尽管存在上述局限性,由于指标是基于容易获得的术前实验室检查,具有操作简单、经济以及实用性和可重复性高的优点。mGPS和CEA水平对结直肠癌患者合并肝转移的预测意义仍具有一定的临床应用价值。对于mGPS及血清CEA水平高的结直肠癌患者,现有的治疗策略联合抗感染治疗、循环白细胞的靶向药物和抗血管生成药物等更积极的治疗是否能带来一定的生存益处,值得进一步研究。
综上所述,本研究显示,mGPS、血清CEA水平和原发肿瘤组织学分化程度是结直肠癌术后肝转移的独立预测指标,其在预测肝转移方面优于其他炎性反应相关评分。并且血清CEA水平与肝转移肿瘤负荷呈中度正相关。这些发现应该在未来的前瞻性研究中进一步评估。
| [1] |
Andres A, Mentha G, Adam R, et al. Surgical management of patients with colorectal cancer and simultaneous liver and lung metastases[J]. Br J Surg, 2015, 102(6): 691-699. DOI:10.1002/bjs.9783 |
| [2] |
张丽娜, 孔祥兴, 李昕琳, 等. 结直肠癌pT4期诊断的难点及辅助诊断方案的研究进展[J]. 实用肿瘤杂志, 2021, 36(1): 6-10. DOI:10.13267/j.cnki.syzlzz.2021.002 |
| [3] |
Wikman H, Vessella R, Pantel K. Cancer micrometastasis and tumour dormancy[J]. APMIS, 2008, 116(7/8): 754-770. |
| [4] |
Huang CJ, Teng HW, Chien CC, et al. Prognostic significance of C-reactive protein polymorphism and KRAS/BRAF in synchronous liver metastasis from colorectal cancer[J]. PLoS One, 2014, 8(6): e65117. |
| [5] |
Ying HQ, Liao YC, Sun F, et al. The role of cancer-elicited inflammatory biomarkers in predicting early recurrence within stage Ⅱ-Ⅲ colorectal cancer patients after curable resection[J]. J Inflamm Res, 2021, 14: 115-129. DOI:10.2147/JIR.S285129 |
| [6] |
姚源山, 华青旺, 沈海波, 等. 格拉斯哥预后评分联合中性粒细胞与淋巴细胞比值对肺癌预后的预测价值[J]. 实用肿瘤杂志, 2020, 35(3): 245-249. |
| [7] |
Hu X, Shao YX, Yang ZQ, et al. Preoperative systemic immune-inflammation index predicts prognosis of patients with non-metastatic renal cell carcinoma: a propensity score-matched analysis[J]. Cancer Cell Int, 2020, 20: 222. DOI:10.1186/s12935-020-01320-w |
| [8] |
Jiang Z, Li CX, Zhao ZX, et al. Abnormal liver function induced by space-occupying lesions is associated with unfavorable oncologic outcome in patients with colorectal cancer liver metastases[J]. Biomed Res Int, 2018, 2018: 9321270. |
| [9] |
Oshi M, Margonis GA, Sawada Y, et al. Higher tumor burden neutralizes negative margin status in hepatectomy for colorectal cancer liver metastasis[J]. Ann Surg Oncol, 2019, 26(2): 593-603. DOI:10.1245/s10434-018-6830-x |
| [10] |
Benson AB, Venook AP, Al-Hawary MM, et al. Colon Cancer, Version 2.2021, NCCN Clinical Practice Guidelines in Oncology[J]. J Natl Compr Canc Netw, 2021, 19: 329-359. DOI:10.6004/jnccn.2021.0012 |
| [11] |
Ruers T, Punt C, van Coevorden F, et al. Radiofrequency ablation combined with systemic treatment versus systemic treatment alone in patients with non-resectable colorectal liver metastases: a randomized EORTC Intergroup phase Ⅱ study (EORTC 40004)[J]. Ann Oncol, 2012, 23(10): 2619-2626. DOI:10.1093/annonc/mds053 |
| [12] |
van Hazel GA, Heinemann V, Sharma NK, et al. SIRFLOX: randomized phase Ⅲ trial comparing first-line mFOLFOX6 (plus or minus bevacizumab) versus mFOLFOX6 (plus or minus bevacizumab) plus selective internal radiation therapy in patients with metastatic colorectal cancer[J]. J Clin Oncol, 2016, 34(15): 1723-1731. DOI:10.1200/JCO.2015.66.1181 |
| [13] |
Martin RC 2nd, Scoggins CR, Schreeder M, et al. Randomized controlled trial of irinotecan drug-eluting beads with simultaneous FOLFOX and bevacizumab for patients with unresectable colorectal liver-limited metastasis[J]. Cancer, 2015, 121(20): 3649-3658. DOI:10.1002/cncr.29534 |
| [14] |
Ocana A, Nieto-Jiménez C, Pandiella A, et al. Neutrophils in cancer: prognostic role and therapeutic strategies[J]. Mol Cancer, 2017, 16(1): 137. DOI:10.1186/s12943-017-0707-7 |
| [15] |
Yang J, Guo XL, Wang MN, et al. Pre-treatment inflammatory indexes as predictors of survival and cetuximab efficacy in metastatic colorectal cancer patients with wild-type RAS[J]. Sci Rep, 2017, 7(1): 17166. DOI:10.1038/s41598-017-17130-6 |
| [16] |
Augier S, Ciucci T, Luci C, et al. Inflammatory blood monocytes contribute to tumor development and represent a privileged target to improve host immunosurveillance[J]. J Immunol, 2010, 185(12): 7165-7173. DOI:10.4049/jimmunol.0902583 |
| [17] |
Liao DW, Hu X, Wang Y, et al. C-reactive protein is a predictor of prognosis of prostate cancer: a systematic review and meta-analysis[J]. Ann Clin Lab Sci, 2020, 50(2): 161-171. |
| [18] |
Almasaudi AS, Dolan RD, Edwards CA, et al. Hypoalbuminemia reflects nutritional risk, body composition and systemic inflammation and is independently associated with survival in patients with colorectal cancer[J]. Cancers (Basel), 2020, 12(7): E1986. DOI:10.3390/cancers12071986 |
| [19] |
van der Wal GE, Gouw AS, Kamps JA, et al. Angiogenesis in synchronous and metachronous colorectal liver metastases: the liver as a permissive soil[J]. Ann Surg, 2012, 255(1): 86-94. DOI:10.1097/SLA.0b013e318238346a |
| [20] |
Ghazi-Khanloosani M, Bandegi AR, Kokhaei P, et al. CRP and LOX-1: a mechanism for increasing the tumorigenic potential of colorectal cancer carcinoma cell line[J]. Pathol Oncol Res, 2019, 25(4): 1467-1475. DOI:10.1007/s12253-018-0507-4 |
| [21] |
Zheng P, Ren L, Feng QY, et al. Differences in clinical characteristics and mutational pattern between synchronous and metachronous colorectal liver metastases[J]. Cancer Manag Res, 2018, 10: 2871-2881. DOI:10.2147/CMAR.S161392 |
| [22] |
Mekenkamp LJ, Koopman M, Teerenstra S, et al. Clinicopathological features and outcome in advanced colorectal cancer patients with synchronous vs metachronous metastases[J]. Br J Cancer, 2010, 103(2): 159-164. DOI:10.1038/sj.bjc.6605737 |
| [23] |
Colloca GA, Venturino A, Guarneri D. Different variables predict the outcome of patients with synchronous versus metachronous metastases of colorectal cancer[J]. Clin Transl Oncol, 2020, 22: 1399-1406. DOI:10.1007/s12094-019-02277-7 |
| [24] |
Reetta P, Kaisa A, Jaana H, et al. High TKTL1 expression as a sign of poor prognosis in colorectal cancer with synchronous rather than metachronous liver metastases[J]. Cancer Biol Ther, 2020, 21: 826-831. DOI:10.1080/15384047.2020.1803008 |
| [25] |
Ying HQ, Liao YC, Sun F, et al. The role of cancer-elicited inflammatory biomarkers in predicting early recurrence within stage Ⅱ-Ⅲ colorectal cancer patients after curable resection[J]. J Inflamm Res, 2021, 14: 115-129. DOI:10.2147/JIR.S285129 |
| [26] |
Dolan RD, McSorley ST, Park JH, et al. The prognostic value of systemic inflammation in patients undergoing surgery for colon cancer: comparison of composite ratios and cumulative scores[J]. Br J Cancer, 2018, 119: 40-51. DOI:10.1038/s41416-018-0095-9 |
 2022, Vol. 37
2022, Vol. 37


