文章信息
- 徐微
- Xu Wei
- 乳腺癌放疗对乳腺畸形的影响及额外边界设置的必要性分析
- Effect of breast cancer radiotherapy on breast malformation and necessity of additional boundary setting
- 实用肿瘤杂志, 2021, 36(2): 149-153
- Journal of Practical Oncology, 2021, 36(2): 149-153
-
通信作者
- 徐微, E-mail: xxxuwei0@126.com
-
文章历史
- 收稿日期:2019-11-14
乳腺癌保乳手术后全乳外束放疗是临床上治疗的金标准,可以降低局部复发的风险[1]。然而,放疗同时可伴随急性或晚期的毒性反应,包括红斑、水肿、肺炎、纤维化、乳房萎缩和心脏毒性等,其发生风险与不良的剂量分布相关。近年来容积旋转调强放疗技术已有所改善,采用此技术能够减少乳腺癌放疗中传递至肺脏与心脏等重要结构中的剂量,同时增加治疗区域的均匀分布,从而有利于降低毒性反应的发生[2-4]。乳腺癌放疗中临床靶体积(clinical target volume, CTV)包括乳腺及邻近的皮肤,为确保CTV的全部剂量覆盖,鉴于治疗相关的分割间及分割内存在不确定性,通常需要制定计划靶体积(planning target volume, PTV)进行一定程度的扩展[5]。本研究旨在通过分析治疗区域锥形束计算机断层扫描(cone beam computed tomography,CBCT)图像的每日变化来评价乳腺畸形变化的程度,以为临床的诊疗与操作实践提供一定的参考。
1 资料与方法 1.1 一般资料研究对象为2017年10月至2019年1月至中国科学院大学附属肿瘤医院(浙江省肿瘤医院)就诊且行手术治疗与术后放疗的156例女性乳腺癌患者。其中,乳腺癌左侧75例,右侧81例;患者年龄为43~88岁,(65.5±1.2)岁。
纳入标准:(1)根据影像学检查及组织病理学检查明确诊断为乳腺癌;(2)具备手术及术后辅助治疗的指征和条件;(3)临床资料完整。排除标准:(1)合并其他的肿瘤;(2)晚期乳腺癌;(3)既往乳腺手术史;(4)乳腺畸形;(5)意识或精神状态异常,无法配合者。本研究所有操作与相关内容均经患者本人及本院伦理委员会知情同意。患者所采用的手术类型包括保乳手术(仅肿块切除)9例、保乳手术及前哨淋巴结活检(sentinel lymph node biopsy, SLNB)96例和保乳手术及根治性腋窝淋巴结清扫51例。88例(56.4%)接受新辅助化疗,其中16例(10.3%)患者为人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阳性(表 1)。
| 临床特征 | 例数(%) |
| 病灶位置 | |
| 左侧 | 75(48.1) |
| 右侧 | 81(51.9) |
| DIBH | |
| 是 | 31(19.9) |
| 否 | 125(80.1) |
| 分割 | |
| 低分割(15次) | 82(52.6) |
| 常规(25次) | 74(47.4) |
| 手术类型 | |
| 仅保乳手术 | 9(5.8) |
| 保乳手术+前哨淋巴结活检 | 96(61.5) |
| 保乳手术+根治性腋下淋巴结切除 | 51(32.7) |
| 切除的淋巴结数量 | |
| 0~2枚 | 55(35.3) |
| 3~10枚 | 52(33.3) |
| > 10枚 | 50(32.1) |
| 辅助化疗 | |
| 是 | 88(56.4) |
| 否 | 68(43.6) |
| 手术与CT模拟之间时间间隔 | |
| < 1个月 | 36(23.1) |
| 1~4个月 | 48(30.8) |
| > 4个月 | 72(46.2) |
| 体质量指数 | |
| < 25 kg/m2(正常) | 45(28.8) |
| 25~30 kg/m2(超重) | 77(49.4) |
| > 30 kg/m2(肥胖) | 34(21.8) |
| 注 DIBH: 深吸气屏息技术(deep inspiration breath-hold) | |
每日低剂量CBCT图像(成像协议100 kV,20 mA/帧,10 ms/帧,174帧,S20准直仪,旋转190°,持续时间约32 s,1次CBCT扫描的平均剂量约为0.001 Gy)在对患者进行设置后获取,并根据3D图像配准定位相应的治疗中心位置。根据Mosaiq患者验证系统(v2.62,Elekta公司,瑞典)回顾性分析所获得的每日CBCT图像;最大交互信息配准是在6D中盒子形状的区域内对CBCT和相应的计划CT图像进行的。根据胸壁进行自动配准,并记录各自的移位和旋转;配准仅限于乳腺组织的表面区域,并且再次记录2次配准之间的差异;2次不同配准的差异可以显示出乳房表面轮廓的平均变化,与患者定位中的误差无关。自每次分割中获得二维前后和左右矢量幅度,以显示最大乳房表面扩张(maximum value of breast surface expansion, MBSE);根据MBSE的数值进一步确定乳腺癌放疗中为消除解剖学变化而需要增加的外部边缘范围。
1.3 放疗所有患者于胸板(C-QualTM胸板,Civco放射治疗公司,美国)上仰卧位成像以制定治疗计划,手臂置于头顶之上,采用西门子Somatom Definition AS CT扫描仪进行扫描。31例左侧患者在光学系统(Sentinel,C-RAD公司,瑞典)的引导下于深吸气屏气(deep inspiration breath-hold, DIBH)成像,其余患者则在自由呼吸下成像。划定的CTV在82例(52.6%)患者中包括整个乳房和胸壁,其他74例(47.4%)患者中则纳入腋下淋巴结;CTV增加5 mm的边缘以获得PTV。仅乳房治疗的患者采用低分割(15×2.67 Gy,总计40.05 Gy),而腋窝淋巴结划定在内的患者则采用常规分割(25×2 Gy,总计50 Gy)进行治疗。所有患者均采用6 MV光子能量的VMAT技术进行治疗,或是2个相对切向的容积旋转调强技术(volumetric intensity modulated arc therapy, VMAT)场,或是2个连续的约240°的顺时针和逆时针的VMAT场。依据文献[6]中的治疗计划系统,对于PTV每个治疗区域均设置为具有2 cm的自动闪光(剂量扩散至空气)。采用瑞典Elekta公司MLC Elekta Infinity线性加速器对患者进行治疗;每次治疗分割之前通过患者的皮肤标记和激光对患者的位置进行调整。
1.4 统计学分析采用Microsoft Excel进行统计学分析。计量资料组间比较采用双侧Student’s t检验。相关性分析采用Pearson相关分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 放疗结果本研究总计纳入156例乳腺癌患者,治疗分割总计3 115次;211张CBCT图像被排除,主要因为CBCT图像边缘上的伪影以及图像质量太差而无法进行自动配准。因此,纳入研究分析的CBCT图像总计2 904张,患者年龄为43~88岁,(65.5±1.2)岁,PTV为324~2 488 cm3,(1 488.5±33.6)cm3,该体积中还包括淋巴结区域。图 1显示为治疗分割中CBCT与计划CT扫描图像上的轮廓比较。
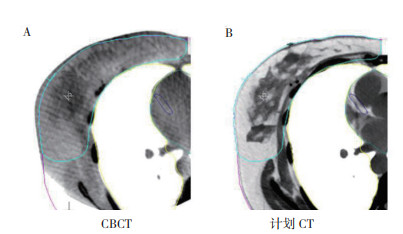
|
| 图 1 治疗分割中CBCT与计划CT轮廓显示比较 Fig.1 Contour display of CBCT and planned CT in treatment segmentation |
手术与CT模拟之间的时间间隔为(114±55)d,CT模拟与第1次治疗分割间的时间间隔为(9.5±2.5)d,平均总治疗时间为(30.5±1.2)d。治疗期间整个患者群体的MBSE为(2.8±1.8)mm,其中60例(38.5%)患者的MBSE始终< 3 mm;53例(34.0%)MBSE≥5 mm,21例(13.5%)MBSE≥8 mm。研究中MBSE的最大值为15.0 mm,而480次(16.5%)分割的MBSE≥5 mm。研究结果表明,8 mm的外部边缘能够在95%的治疗分割中足以覆盖整个乳房表面,图 2显示为记录的MBSE数值与相应的治疗分割间的关系分布。CBCT与计划CT间绝对的旋转误差平均值在冠状面、矢状面和横截面上分别为1.8°、1.8°和2.0°,在21.1%的治疗分割中乳腺分旋转误差 > 4°。
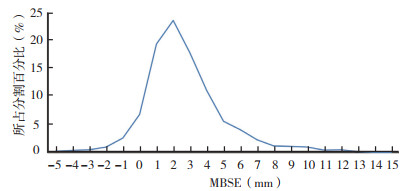
|
| 注 MBSE:乳房表面扩张最大值(maximum value of breast surface expansion);正值表示乳腺轮廓畸形扩张 图 2 MBSE数值与相应的治疗分割间的关系分布 Fig.2 The relationship between MBSE value and the corresponding treatment segmentation |
Pearson相关分析显示,体质量指数(body mass index, BMI)与记录的MBSE呈正相关关系(r=0.36,P < 0.01)。左侧患者的MBSE数值大于右侧,分别为(2.9±2.0)mm和(2.2±1.4)mm(P=0.002)。冠状位左侧和右侧的旋转误差差异分别为(0.6±0.4)°和(-0.1±0.2)°,横截面左侧和右侧的旋转误差差异分别为(-0.9±1.2)°和(0.3±1.6)°,左侧和右侧比较,差异均具有统计学意义(均P < 0.01)。MBSE与患者年龄(r=0.14,P=0.26)、手术范围(r=0.05,P=0.92)、手术与放疗时间间隔(r=0.14,P=0.18)、手术切除的结节数量(r=0.03,P=0.84)无相关性,而与PTV显示出较弱的相关性(r=0.24,P=0.05)。
3 讨论乳房水肿是乳腺癌患者放疗过程中解剖学上的不确定因素之一,保乳手术患者中发病率可达15%~90%[7];考虑到这些解剖学变化,治疗计划中通过设定额外边界以将全部放射剂量传递至靶体积区域内。切向放疗技术中场的大小可在皮肤外部以适当的边缘进行调节,无需增加对健康结构的辐射,此外多数调强放疗技术可通过手动调节将剂量扩展至皮肤区域外,以确保及时在乳房变性的情况下达到理想的靶剂量[8]。然而,VMAT技术在皮肤表面以外的剂量扩展也存在问题。目前外部PTV边缘的范围对皮肤外部剂量扩展的影响尚不清楚。放疗过程中乳房的肿胀与位置变化可能对靶体积的剂量覆盖产生影响。这是乳腺癌放疗对乳腺畸形产生影响的主要原因之一。本研究通过分析2 904个CBCT图像对乳腺癌放疗中乳腺畸形变化的程度进行量化研究显示,在16.5%的患者治疗分割中MBSE变化≥5 mm,提示在使用VMAT或IMRT技术进行逆向优化时,需要增加额外的外部边缘,以避免乳房组织分布剂量不足。
乳腺癌放疗过程中可能发生乳房水肿、皮下积液和血肿形成,在接受改良根治性乳房切除术或保乳手术患者中乳房水肿发生率约为15.8%,并且水肿的发生通常是不可预测的[9];有学者认为乳房水肿一定程度上与手术操作因素相关[10]。本研究中,所有患者均采用保乳手术治疗,> 34%的乳腺癌患者在放疗过程中乳房肿大 > 5 mm。乳房水肿的其他相关因素还包括手术类型和乳房的大小,本研究中其发生则与体质量指数相关。此外,PTV量与MBSE之间存在临界相关性,尽管年龄增长也被认为是导致乳房水肿的危险因素,但在本研究中未显示。
研究中将乳房表面的差异定义为计划CT的外部轮廓与每日CBCT图像之间的差异,难以避免在比较中由于乳房肿胀和定位误差使得结果存在一定的局限。即使研究中采用的装置具有手臂固定功能,仍然难以避免患者的手臂在每次CBCT中的位置存在不同,从而可能对乳房的位置亦产生影响。然而,由于位置变化或肿胀导致的乳房表面变化均会导致计划的计量分布减低。
目前临床中通常采用2D电子成像系统确定患者的位置,其主要依据骨骼解剖(如胸骨、椎骨和肋骨等)作为软组织的替代,据报道采用此种方式可低估分割内的运动[11-13]。本研究中通过每日CBCT图像来量化乳房表面变化的程度,目前这方面的研究报道中较少。乳房水肿对VMAT治疗计划质量的影响相关研究较少,治疗中若没有剂量扩展至空气中,当患者存在乳房水肿或位置移动时则较容易出现严重的剂量不足,5 mm与10 mm的偏差可使得V95%分别降低5%与25%[14]。有学者报道,对于多数乳腺癌患者,采用5 mm的空气扩展和8 mm的组织等效补偿膜能够实现对PTV较为理想的优化。若变形较大(10 mm)则采用更大的PTV扩展或重新设计[15-16]。然而,自动闪光工具当光束方向和叶片运动与PTV及空中接口相交时,准直器叶片会打开,这一性能尚未被多数人所知[17],基于本研究的结果应扩展≥8 mm。
本研究中的MBSE数值还考虑了乳房位置的旋转误差,在所有3个方向上的平均旋转误差约为2°。21%的分割中存在≥1次旋转误差 > 4°。此外,本研究未分析单个点位置的最大表面形状改变,而是分析整个区域的皮肤变化的平均值,单个点位置的最大表面扩展值将大于MBSE的平均值。借助于3D图像的引导,可以将设置相关的不确定性最小化,尽管无法将其完全消除。如先前所述,患者或者乳房本身的旋转误差可能导致PTV远端边界较为显著的不确定性,本研究中乳房形态的解剖学变化有助于这些不确定因素的形成。另外,治疗中可能存在的患者的移动和呼吸运动等在制定放疗计划时需要考虑分析,如果治疗的患者能够自主呼吸,那么运动幅度也会使得所需的表面扩张量增加,据报道呼吸相关的幅度约为1.5~2.0 mm[18-19]。本研究中CBCT的采集时间为35 s,CBCT的慢成像可能导致重建图像的模糊,但这并不能用于解释畸形,因为模糊也是发生于作为参照的胸壁上。此外,本研究未发现DIBH及自主呼吸患者间的MBSE差异。
本研究存在一定的局限性,主要表现在为单中心的小样本研究、在患者的选择和治疗方法上可能存在偏倚和实践中可能会因诊疗机构的不同而方法上存在差异。其次,所有患者均采用相同的固定系统进行固定,与放射科常用的手臂固定于头顶上方不同,但不同手臂位置固定系统产生的差异较小,可以忽略不计。
综上所述,本研究结果显示在乳腺癌放疗期间乳房表面会发生改变,主要原因为乳房的肿胀与位置变化对靶体积的剂量覆盖可产生影响。因此,除常规PTV边缘设置的误差外,乳房表面有设置额外边界必要性,身体以外的边界设置需 > 8 mm以避免乳房在治疗过程中的变形。虽然BMI是相关因素,但其无法用于预测治疗中乳房发生畸形的风险。
| [1] |
余韬, 李岩. 三阴性乳腺癌生存分析及预后影响因素[J]. 实用肿瘤杂志, 2017, 32(1): 61-65. |
| [2] |
吴传锋, 吴锦昌, 顾科, 等. 利用CBCT研究乳腺托架固定下乳腺癌放疗下颈摆位误差及相应CTV外放边界[J]. 中华放射医学与防护杂志, 2016, 36(10): 753-756. DOI:10.3760/cma.j.issn.0254-5098.2016.10.007 |
| [3] |
夏校春, 宁丽华, 严森祥. 乳腺癌放疗中两种不同摆位方式的剂量分布及摆位误差比较[J]. 中华放射医学与防护杂志, 2018, 38(9): 675-679. DOI:10.3760/cma.j.issn.0254-5098.2018.09.007 |
| [4] |
Haffty BG, Buchholz TA, Mccormick B. Should intensity-modulated radiation therapy be the standard of care in the conservatively managed breast cancer patient?[J]. J Clin Oncol, 2016, 26(13): 2072-2074. |
| [5] |
赵喜, 姚炜, 刘静. 早期乳腺癌保乳术后3D-CRT和IMRT-SIB治疗的近期美容疗效和急性放射性不良反应比较[J]. 实用肿瘤杂志, 2019, 34(4): 358-361. |
| [6] |
Karlsson P, Cole BF, Price KN, et al. Timing of radiation therapy and chemotherapy after breast-conserving surgery for node-positive breast cancer: long-term results from international breast cancer study group trials Ⅵ and Ⅶ[J]. Int J Radiat Oncol Biol Phys, 2016, 96(2): 273-279. DOI:10.1016/j.ijrobp.2016.06.2448 |
| [7] |
徐晓, 张敏娜, 王冰, 等. 乳腺癌保乳术后调强放疗摆位误差相关因素分析[J]. 中华放射医学与防护杂志, 2019, 39(6): 434-438. DOI:10.3760/cma.j.issn.0254-5098.2019.06.006 |
| [8] |
Maier J, Knott B, Maerz M, et al. Simultaneous integrated boost (SIB) radiation therapy of right sided breast cancer with and without flattening filter-A treatment planning study[J]. Radiat Oncol, 2016, 11(1): 111. DOI:10.1186/s13014-016-0687-6 |
| [9] |
王玉洁, 陈佳艺. 符合ACOSOG Z0011研究标准乳腺癌的放疗问题[J]. 中国实用外科杂志, 2018, 38(11): 1270-1276. |
| [10] |
Currey AD, Carmen B, Kelly TR, et al. Reducing the human burden of breast cancer: advanced radiation therapy yields improved treatment outcomes[J]. Breast J, 2016, 21(6): 610-620. |
| [11] |
洪超善, 梁世雄, 何尧林. 摆位误差对乳腺癌患者放疗中心脏受量的影响[J]. 广西医学, 2016, 38(12): 49-53. |
| [12] |
Bernalestévez D, Sánchez R, Tejada RE, et al. Chemotherapy and radiation therapy elicits tumor specific T cell responses in a breast cancer patient[J]. BMC Cancer, 2016, 16(1): 591. DOI:10.1186/s12885-016-2625-2 |
| [13] |
Hu ZI, Ho AY, Mcarthur HL. Combined radiation therapy and immune checkpoint blockade therapy for breast cancer[J]. Int J Radiat Oncol Biol Phys, 2017, 99(1): 153-164. DOI:10.1016/j.ijrobp.2017.05.029 |
| [14] |
郑林晶, 杨东, 胡兵, 等. 早期乳腺癌保乳术后大分割放疗的临床观察[J]. 国际肿瘤学杂志, 2019, 46(6): 331-336. DOI:10.3760/cma.j.issn.1673-422X.2019.06.003 |
| [15] |
Zhang F, Xu W, Jiang H, et al. Dosimetric evaluation of VMAT radiation therapy technique for breast cancer after conservative surgery based on three different types of multileaf collimators[J]. Oncol Translat Med, 2018, 4(5): 28-34. |
| [16] |
李欢, 黄娟, 纪晓萌, 等. 呼吸控制技术在左侧乳癌放射治疗应用的研究进展[J]. 青岛大学医学院学报, 2018, 195(4): 124-126. |
| [17] |
刘利彬, 张小清, 杨海松, 等. 乳腺癌放疗中两种体位固定方式应用比较[J]. 中国医学物理学杂志, 2018, 35(7): 753-757. DOI:10.3969/j.issn.1005-202X.2018.07.003 |
| [18] |
Xiao C, Miller AH, Felger J, et al. A prospective study of quality of life in breast cancer patients undergoing radiation therapy[J]. Adv Radiat Oncol, 2016, 1(1): 10-16. DOI:10.1016/j.adro.2016.01.003 |
| [19] |
Schmidt ME, Meynköhn A, Habermann N, et al. Resistance exercise and inflammation in breast cancer patients undergoing adjuvant radiation therapy: mediation analysis from a randomized, controlled intervention trial[J]. Int J Radiat Oncol Biol Phys, 2016, 94(2): 329-337. DOI:10.1016/j.ijrobp.2015.10.058 |
 2021, Vol. 36
2021, Vol. 36


