文章信息
- 张君, 张佳梦, 毕焕焕, 王红梅
- Zhang Jun, Zhang Jiameng, Bi Huanhuan, Wang Hongmei
- NSCLC非经典EGFR突变患者临床特点及治疗预后分析
- Clinical characteristics and prognosis of non-classical mutations of epidermal growth factor receptor in non-small-cell lung cancer
- 实用肿瘤杂志, 2021, 36(1): 47-51
- Journal of Practical Oncology, 2021, 36(1): 47-51
-
通信作者
- 王红梅,E-mail: dor.whm@163.com
-
文章历史
- 收稿日期:2019-11-17
2. 青岛大学附属医院呼吸与危重症医学科,山东 青岛 266000
2. Department of Respiratory and Critical Care Medicine, Affiliated Hospital of Qingdao University, Qingdao 266000, China
肺癌是全世界死亡率最高的肿瘤。多数患者确诊时已属于晚期。晚期肺癌患者的中位生存时间为8~17个月,5年总体生存率仅9%~13%[1]。近年来,随着基因测序的发展,晚期非小细胞肺癌(non-small-cell lung cancer, NSCLC)的靶向治疗已成为主要的治疗手段之一[2],其中表皮生长因子受体酪氨酸激酶抑制剂(epidermal growth factor receptor-tyrosine kinase inhibitor,EGFR-TKI)开启了肺癌靶向治疗的新纪元。EGFR能够加快肿瘤细胞的自我增殖,并抑制肿瘤细胞的凋亡[3]。经典的19del和21位点L858R突变阳性的晚期NSCLC应用EGFR-TKI治疗效果更佳[4],多数EGFR非经典突变类型对TKI的疗效反应仍不明确。非经典突变发生率低,仅有小样本的回顾性研究报道[5-7],结论仍不明确,因此,对EGFR非经典突变进行大规模和系统性临床研究任重而道远。本文通过对EGFR非经典突变患者的临床特点及靶向治疗的效果进行回顾性研究分析,进一步加深对EGFR非经典突变的认识,为临床指导非经典突变的治疗提供数据支持。
1 资料与方法 1.1 一般资料收集2017年1月1日至2019年8月1日就诊于青岛大学附属医院携带EGFR非经典突变的56例NSCLC患者的临床资料。其中男性20例,女性36例;年龄41~72岁,中位年龄61岁。对其临床数据进行分析,主要包括年龄、性别、吸烟史、病理类型和TNM分期等方面。接受EGFR-TKI治疗指接受≥30 d吉非替尼、厄洛替尼、埃克替尼或阿法替尼的标准治疗。
1.2 疗效评价对经病理证实的ⅢB/Ⅳ期并接受EGFR-TKI治疗的患者进行回顾性临床数据分析,主要包括肺、骨扫描和颅脑等影像学及肿瘤标志物血液指标等,根据实体瘤的疗效评价标准(response evaluation criteria in solid tumor,RECIST)来评价使用EGFR-TKI治疗后患者的客观缓解率(the objective response rate,ORR)、疾病控制率(the disease control rate,DCR)以及中位无进展生存期(median progression-free survival,mPFS)[8]。
1.3 统计学分析采用SPSS 22.0统计学软件处理数据。本研究中分析非经典单突变和双突变患者的临床特征,分类变量采用χ2检验;Fisher精确检验比较29例非经典单突变和双突变患者应用EGFR-TKI后mPFS的差异。采用Kaplan-Meier法进行生存分析并行Log-rank检验;采用双侧概率检验,以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床特征分析根据条件筛选的56例NSCLC患者(已明确为耐药突变的20外显子T790M突变未纳入)中,男性20例(35.7%),女性36例(64.3%);吸烟17例(30.4%),不吸烟39例(69.6%);中位年龄61岁(41~72岁),> 61岁22例(39.3%),≤61岁34例(60.7%);鳞癌2例(3.6%),腺癌54例(96.4%)。根据第AJCC第7版TNM分期[9],其中Ⅳ期21例(37.5%),ⅢB期8例(14.3%),ⅠA~ⅢA期27例(48.2%)。
2.2 非经典突变类型分布56例非经典突变中单突变39例,双突变17例。单突变与双突变患者在性别、吸烟史、年龄、病理类型和TNM分期等方面比较,差异均无统计学意义(均P > 0.05, 表 1)。单突变中G719X(X=A/S/C)15例(26.8%),S768I 4例(7.1%),L861Q 9例(16.1%),19ins 3例(5.4%),20ins 8例(14.3%)。双突变中G719X+S768I 8例(14.3%),L858R+V834L 2例(3.6%),G719X+L861Q 1例(1.8%),S768I+L861Q 1例(1.8%),L861Q+20ins 1例(1.8%),G719X+E709A 1例(1.8%),19del+S768I 1例(1.8%),19del+L861Q 1例(1.8%),S768I+L858R 1例(1.8%)。
| 临床特征 | 单突变(n=39) | 双突变(n=17) | χ2值 | P值 |
| 性别 | 0.002 | 0.965 | ||
| 男性 | 14(35.9) | 6(35.3) | ||
| 女性 | 25(64.1) | 11(64.7) | ||
| 吸烟史 | 1.102 | 0.294 | ||
| 有 | 14(35.9) | 3(17.6) | ||
| 无 | 25(64.1) | 14(82.4) | ||
| 年龄 | 2.541 | 0.111 | ||
| > 61岁 | 18(46.2) | 4(23.5) | ||
| ≤61岁 | 21(53.8) | 13(76.5) | ||
| 病理类型 | < 0.01 | 1.000 | ||
| 腺癌 | 38(97.4) | 16(94.1) | ||
| 鳞癌 | 1(2.6) | 1(5.9) | ||
| 分期 | 0.484 | 0.487 | ||
| ⅠA~ⅢA期 | 20(51.3) | 7(41.2) | ||
| ⅢB~Ⅳ期 | 19(48.7) | 10(58.8) |
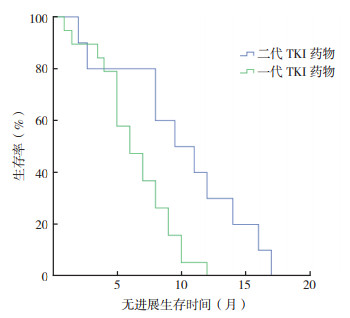
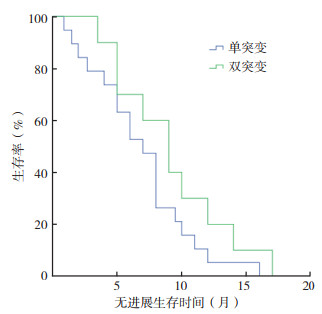
56例非经典突变患者中,29例接受EGFR-TKI的治疗。7例应用吉非替尼,8例埃克替尼,4例厄洛替尼,10例阿法替尼。其中一线治疗21例,二线及以上治疗8例。截止随访结束时间2019年9月1日,共9例出现疾病进展,接受EGFR-TKI治疗的患者mPFS是8个月。其中疗效评价为完全缓解(complete response,CR)者0例(0.0%),部分缓解(partial response,PR)者10例(34.5%),疾病稳定(stable disease,SD)者12例(41.4%),疾病进展(progressive disease,PD)者7例(24.1%),ORR为34.5%,DCR为75.9%。29例患者中接受第一代EGFR-TKI药物治疗的患者19例, 接受第二代EGFR-TKI药物治疗的患者10例。接受第一代和第二代EGFR-TKI药物治疗的患者mPFS比较,差异具有统计学意义(6个月vs 9.5个月,P=0.011,图 1)。29例患者中单突变组(n=19)和双突变组(n=10)mPFS比较,差异无统计学意义(7个月vs 9个月,P=0.173,图 2)。
|
| 图 1 非经典突变NSCLC患者接受一代和二代TKI药物的无进展生存曲线比较 Fig.1 Comparison of progression-free survival curves of NSCLC patients with non-classical mutations who received first-generation and second-generation TKI drugs |
|
| 图 2 单突变与双突变NSCLC患者接受EGFR-TKI治疗的无进展生存曲线比较 Fig.2 Comparison of progression-free survival curves of NSCLC patients with single mutation and double mutations treated with EGFR-TKI |
本研究对56例非经典突变患者的临床资料进行分析发现,非经典突变同样符合无吸烟史、女性和肺腺癌患者中常见的特点。有研究发现,218例非经典突变中男性和吸烟者较多见[10],本研究与之结论不一致,考虑原因为本研究样本量少,非经典突变的人群特点需要更大的数据研究进一步验证。对单突变与双突变患者的临床资料进行分析比较显示,两者在年龄、性别、吸烟史、病理类型及病理分期方面比较,差异均无统计学意义(均P > 0.05)。29例接受EGFR-TKI治疗的患者ORR为34.5%,DCR为75.9%,mPFS为8个月,这与目前相关临床分析结果相吻合[5, 11]。接受二代TKI药物治疗患者的mPFS为9.5个月,接受一代TKI药物的mPFS为6个月,单因素生存分析提示应用二代TKI药物患者的mPFS优于应用一代TKI药物的患者,与相关研究报道的结论一致(11.0个月vs 3.6个月)[12]。29例接受TKI药物治疗的患者包含单突变和双突变,两者对TKI药物的反应不同,单因素生存分析提示双突变患者mPFS略优于单突变患者(9个月vs 7个月),这与以往研究结论相符(7.4个月vs 5.1个月)[13]。本研究样本量较小,非经典单突变与双突变接受TKI治疗的反应比较尚需进一步扩大样本量加以证明。
单突变患者中,G719X突变15例,发生频率最高,与史云舒等[14]报道结果一致。其中12例接受TKI治疗。G719X是18外显子突变中最常见的类型,G719X包括G719A、G719C、G719D、G719S和G719V这5种突变类型,本研究中G719X包含G719A、G719C和G719S。这3种类型也是G719X中最常见的突变类型,分别指18号外显子719位氨基酸上的甘氨酸—丙氨酸/半胱氨酸/丝氨酸替换。12例G719X突变患者中7例接受一代TKI治疗的mPFS为5个月,5例接受二代TKI治疗的mPFS为8个月。G719X单突变中应用阿法替尼的PFS最长时间为17个月。研究显示,18例G719X突变患者经阿法替尼治疗后ORR为77.8%, mPFS为13.8[6]。G719X突变的肺腺癌患者是否应用二代TKI效果更佳,尚需更多的临床数据支持。EGFR突变主要发生于肺腺癌中,在鳞癌中非常少见。本研究中1例男性鳞癌患者突变类型为G719X,诊断时为ⅢB期,二线应用阿法替尼治疗,截止随访日期,PFS为9.5个月,疗效评价为PR。目前关于肺鳞癌EGFR突变应用TKI药物治疗的病例报道多数是敏感突变的小样本报道,本例为鳞癌EGFR非经典突变,发生率极低,因此肺鳞癌中EGFR非经典突变的机制及TKI治疗疗效有待进一步研究。
56例非经典突变中共8例20ins,但只有1例20ins患者接受一代TKI药物治疗,突变形式为p.N771delinsPP,共突变基因为TP53,PFS仅为1.5个月。Lux Lung 2、Lux Lung 3和Lux Lung 6临床研究是目前最大的关于EGFR-TKI对具有非经典EGFR突变的患者疗效的前瞻性研究,研究中阿法替尼治疗20ins患者的ORR < 10%,mPFS为2.7个月[15]。有报道,1例20ins患者应用TKI的PFS为2.9个月[16],2例20ins患者应用TKI的PFS分别为1个月和1.5个月[17]。既往研究报道,EGFR 20外显子的插入突变患者生存率较低, 对一代和二代EGFR-TKI治疗都不敏感(除了EGFR外显子20插入A763_Y764insFQEA)[18-19]。一项对85例20ins患者一线靶向治疗与含培美曲塞的化疗反应的比较研究显示,20ins突变对TKI的反应较差[20]。阿法替尼或奥西替尼治疗的非经典突变患者预后优于第一代TKI,这表明第二代或第三代TKI可能是该人群的首选治疗方案。国外研究表明,20ins的患者对TKI有中度反应[21]。国内一项研究中,2 316例NSCLC中有53例20ins突变患者,其中6例接受奥西替尼一线或二线以上治疗,mPFS为6.2个月。4例(67.7%)疗效评价为PR,2例(33.3%)为SD,DCR为100%[22]。该研究首次显示奥希替尼在20ins突变的疗效不错,但样本量太小,所以奥西替尼治疗20ins突变的疗效值得进一步研究。
值得注意的是,本研究中有2例L858R+V834L,诊断时均为Ⅳ期,均应用吉非替尼治疗,疗效评价均为SD,1例为腺癌,PFS为7个月;另1例为低分化鳞癌,PFS为9个月。V834L突变是EGFR第834位密码子发生碱基替换(G-T)突变,该位点的氨基酸由缬氨酸(V)转变为亮氨酸(L)。既往报道极少。一项研究发现,V834L不影响TKI治疗的疗效及耐药性,可能与较长的PFS有关[23]。胡文[24]首次成功建立L858R+V834L双突变位点的皮下移植瘤小鼠模型, 并观察吉非替尼在这一模型中的治疗效应, 发现该模型对吉非替尼治疗敏感。
综上所述,EGFR非经典单突变与双突变在临床特征方面比较,差异均无统计学意义(均P > 0.05);本研究中,在TKI治疗疗效上双突变优于单突变,考虑可能与部分双突变中存在敏感突变有关,但差异无统计学意义(P > 0.05),考虑样本量不足,尚需大样本的临床实验进一步研究;二代TKI在非经典突变的治疗中疗效优于一代TKI。非经典突变作为特殊类型的EGFR突变,包含不同的突变亚型,不同的亚型之间mPFS存在差异,但总体介于野生型与敏感突变之间。由于非经典突变发生率低,目前对非经典突变的认知尚无统一的定论,因此,尚需进一步扩大样本研究明确非经典突变的临床特征及治疗策略,从而指导临床治疗。
| [1] |
毕良文, 张丽珍, 赵滑峰, 等. 转移性Ⅳ期非小细胞肺癌患者的生存状况及预后分析[J]. 实用肿瘤杂志, 2018, 33(5): 421-425. |
| [2] |
王思斯, 陈明, 孙哲, 等. 非小细胞肺癌生存预测列线图的构建与验证[J]. 实用肿瘤杂志, 2020, 35(4): 327-335. |
| [3] |
姚源山, 沈海波. 肺癌脉管内癌栓中EGFR、ERCC1和c-Met的相关性分析[J]. 实用肿瘤杂志, 2019, 34(5): 441-444. |
| [4] |
张萍, 武晓楠, 聂鑫, 等. 晚期肺腺癌EGFR基因突变及临床特征分析[J]. 实用肿瘤杂志, 2018, 33(2): 150-153. |
| [5] |
Chiu C, Yang C, Shih J, et al. Epidermal growth factor receptor tyrosine kinase inhibitor treatment response in advanced lung adenocarcinomas with G719X/L861Q/S768I mutations[J]. J Thorac Oncol, 2015, 10(5): 793-799. DOI:10.1097/JTO.0000000000000504 |
| [6] |
Yang JCH, Sequist LV, Geater SL, et al. Clinical activity of afatinib in patients with advanced non-small cell lung cancer harbouring uncommon EGFR mutations: a combined post-hoc analysis of LUX-Lung 2, LUX-Lung 3, and LUX-Lung 6[J]. Lancet Oncol, 2015, 16(7): 830-838. DOI:10.1016/S1470-2045(15)00026-1 |
| [7] |
Zhang Y, Wang Z, Hao X, et al. Clinical characteristics and response to tyrosine kinase inhibitors of patients with non-small cell lung cancer harboring uncommon epidermal growth factor receptor mutations[J]. Chinese J Cancer Res, 2017, 29(1): 18-24. DOI:10.21147/j.issn.1000-9604.2017.01.03 |
| [8] |
Eisenhauer EA, Therasse P, Bogaerts J, et al. New Response Evaluation Criteria in Solid Tumours: revised RECIST guideline (version 1.1)[J]. Eur J Cancer, 2008, 45(2): 228-247. |
| [9] |
Groome PA, Bolejack V, Crowley JJ, et al. The IASLC Lung Cancer Staging Project: validation of the proposals for revision of the T, N, and M descriptors and consequent stage groupings in the forthcoming (seventh) edition of the TNM classification of malignant tumours[J]. J Thorac Oncol, 2007, 2(8): 694-705. DOI:10.1097/JTO.0b013e31812d05d5 |
| [10] |
Tu HY, Ke EE, Yang JJ, et al. A comprehensive review of uncommon EGFR mutations in patients with non-small cell lung cancer[J]. J Lung Cancer, 2017, 114: 96-102. DOI:10.1016/j.lungcan.2017.11.005 |
| [11] |
杨雪, 陈含笑, 张弘, 等. NSCLC携带EGFR少见突变分析及EGFR-TKI疗效初步观察[J]. 中国肺癌杂志, 2015, 18(8): 31-37. |
| [12] |
Shen YC, Tseng GC, Tu CY, et al. Comparing the effects of afatinib with gefitinib or Erlotinib in patients with advanced-stage lung adenocarcinoma harboring non-classical epidermal growth factor receptor mutations[J]. J Lung Cancer, 2017, 110: 56-62. DOI:10.1016/j.lungcan.2017.06.007 |
| [13] |
Baek JH, Sun JM, Min YJ, et al. Efficacy of EGFR tyrosine kinase inhibitors in patients with EGFR-mutated non-small cell lung cancer except both exon 19 deletion and exon 21 L858R: a retrospective analysis in Korea[J]. J Lung Cancer, 2015, 87(2): 148-154. DOI:10.1016/j.lungcan.2014.11.013 |
| [14] |
史云舒, 李盼华, 李班班, 等. EGFR基因少见突变型非小细胞肺癌的临床特征及应用EGFR-TKIs治疗效果评价[J]. 中国肺癌杂志, 2019, 22(5): 299-305. |
| [15] |
Wu YL, Hirsh V, Sequist LV, et al. Does EGFR mutation type influence patient-reported outcomes in patients with advanced EGFR mutation-positive non-small-cell lung cancer? Analysis of two large, phase Ⅲ studies comparing afatinib with chemotherapy (LUX-Lung 3 and LUX-Lung 6)[J]. Patient, 2018, 11(1): 131-141. DOI:10.1007/s40271-017-0287-z |
| [16] |
Kuiper JL, Hashemi SMS, Thunnissen E, et al. Non-classic EGFR mutations in a cohort of Dutch EGFR-mutated NSCLC patients and outcomes following EGFR-TKI treatment[J]. Br J Cancer, 2016, 115(12): 1504-1512. DOI:10.1038/bjc.2016.372 |
| [17] |
Wu JY, Yu CJ, Chang YC, et al. Effectiveness of tyrosine kinase inhibitors on "unc-ommon" epidermal growth factor receptor mutations of unknown clinical significance in non-small cell lung cancer[J]. Clin Cancer Res, 2011, 17(11): 3812-3821. DOI:10.1158/1078-0432.CCR-10-3408 |
| [18] |
Oxnard GR, Lo PC, Nishino M, et al. Natural history and molecular characteristics of lung cancers harboring EGFR exon 20 insertions[J]. J Thorac Oncol, 2013, 8(2): 179-184. DOI:10.1097/JTO.0b013e3182779d18 |
| [19] |
Yasuda H, Park E, Yun CH, et al. Structural, biochemical, and clinical characterization of epidermal growth factor receptor (EGFR) exon 20 insertion mutations in lung cancer[J]. Sci Transl Med, 2013, 5(216): 216ra177. DOI:10.1126/scitranslmed.3007205 |
| [20] |
Wu JY, Yu CJ, Shih JY. Effectiveness of treatments for advanced non-small-cell lung cancer with Exon 20 insertion epidermal growth factor receptor mutations[J]. Clin Lung Cancer, 2019, 20(6): e620-630. DOI:10.1016/j.cllc.2019.06.018 |
| [21] |
Zhang T, Wan B, Zhao Y, et al. Treatment of uncommon EGFR mutations in non-small cell lung cancer: new evidence and treatment[J]. Transl Lung Cancer Res, 2019, 8(3): 302-316. DOI:10.21037/tlcr.2019.04.12 |
| [22] |
Fang W, Huang Y, Hong S, et al. EGFR exon 20 insertion mutations and response to osimertinib in non-small-cell lung cancer[J]. BMC Cancer, 2019, 19: 595-604. DOI:10.1186/s12885-019-5820-0 |
| [23] |
Wu SG, Chang YL, Hsu YC, et al. Good response to gefitinib in lung adenocarcinoma of complex epidermal growth factor receptor (EGFR) mutations with the classical mutation pattern[J]. Oncologist, 2008, 13(12): 1276-1284. DOI:10.1634/theoncologist.2008-0093 |
| [24] |
胡文. 特异性基因改变的人非小细胞肺癌原代动物模型构建及药物效果评价[D]. 湖南: 中南大学临床医学外科学, 2013.
|
 2021, Vol. 36
2021, Vol. 36


