文章信息
- 侯婉云, 刘发煇, 龙朴泽, 梁家东, 刘肸琳, 罗春英
- 肿瘤微环境对铁死亡的影响
- 实用肿瘤杂志, 2022, 37(4): 371-375
基金项目
- 广西自然科学基金项目(2020GXNSFAA259052);右江民族医学院附属医院高层次人才科研项目(Y20196301,R202011708)
-
通信作者
- 罗春英,E-mail:chun2005008@163.com
-
文章历史
- 收稿日期:2021-09-24
2. 右江民族医学院附属医院病理科,广西 百色 533000
癌症是导致我国人口死亡率增高的主要原因,尤其是肺癌和肝癌[1]。手术、化疗和放疗依然是临床上治疗癌症的主要方法,其中传统化疗药物疗效欠佳,这与肿瘤微环境(tumor microenvironment)有关。肿瘤微环境是由癌细胞、非肿瘤细胞(如免疫细胞等)和各种细胞外因子组成的复杂系统,共同支持癌症的发生和发展[2-3]。2012年研究发现的铁依赖的脂质过氧化驱动的新型细胞死亡类型[4],由RAS选择性致死化合物(RAS-selective lethal compounds,RSLs)等药物诱发一种与凋亡和坏死等有差异的细胞死亡,称为铁死亡(ferroptosis)。这类药物在抗癌方面受到极大关注。铁死亡在杀癌和抑癌过程中有关键作用,并有研究证实,免疫系统可能通过铁死亡部分抑制肿瘤发生[5-7]。这些研究揭示了免疫系统可以通过癌细胞铁死亡途径抑制肿瘤发生和发展的新机制,与潜在的肿瘤微环境密不可分。
1 铁死亡的发生机制和保护机制不饱和脂肪酸含磷脂的氧化、铁的依赖性和消除脂质过氧化产物修复系统的故障是铁死亡激活的3个标志。这些标志是铁死亡激活所必需的,定义了铁死亡的发生过程是一种依赖铁合成脂质过氧化物的氧化还原反应[8]。铁死亡发生机制的核心是通过抑制胱氨酸-谷氨酸反转运体[被称为系统xc-(system xc-,xCT)]耗竭细胞中的抗氧化肽谷胱甘肽(glutathione,GSH),最终导致致死水平的脂质过氧化物累积[9]。
针对细胞避免铁死亡发生的保护机制的探索,Yang等[10]发现首个铁死亡抑制轴GSH-谷胱甘肽过氧化物酶4(glutathione peroxidase 4,GPX4)轴。另有研究发现,铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1)介导一个新的由烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)和泛醌(ubiquinone,CoQ10)参与的NADPH-FSP1-CoQ10铁死亡抑制轴,并且与GSH-GPX4轴有平行作用[11]。除外,许多参与铁死亡途径的激活基因(ACSL4、ALOXs、ATP5G3、CARS、CS、DPP4、GLS2、LPCAT3、NCOA4、RPL8、SAT1、TFRC、TP53和TTC35/EMC2等)和抑制基因(NRF2、SLC7A11、AKR1C1-3、CD44v、CISD1、FANCD2、GCLC/GCLM、GSS和NFE2L2等)已被发现[12]。
2 细胞铁死亡的特征及临床意义铁死亡在形态学、生物学及形式上差异于凋亡、各种形式的坏死和自噬。在形态上,铁死亡细胞的线粒体较小,线粒体嵴减少,线粒体膜密度升高,线粒体膜破裂增加。在生物成分上,铁死亡细胞内有铁的累积、脂质过氧化物的累积和谷氨酰胺分解[13]。从形式上看,铁死亡是一种调节性细胞死亡,与程序性细胞死亡不同,依赖于特定分子机制,因此可以使用特定的药物和基因干预来加快或减慢铁死亡过程[14]。
近年来对铁死亡相关抗癌药物的研究日益增多。多种铁死亡诱导剂已用于抗癌治疗,如爱拉斯汀(erastin)、索拉菲尼(sorafenib)、谷氨酸(glutamate)、磺胺嘧啶(sulfadiazine)、(1S,3R)-RSL3和干扰素-γ(interferon-γ,IFN-γ)等。其中索拉非尼可通过抑制xCT以耗竭GSH最终促进癌细胞铁死亡,临床上已经用于治疗晚期肾癌和肝细胞癌[15]。铁死亡这一细胞死亡类型的发现为抗癌治疗提供新思路。驱动癌细胞铁死亡可能作为一种很有前途的抗癌策略。
3 肿瘤微环境对铁死亡的影响 3.1 炎症反应与铁死亡慢性炎症对于促肿瘤形成至关重要,在慢性炎症反应中,炎细胞(如中性粒细胞等)浸润可以释放各种促炎因子,通过多种机制促进肿瘤的形成[16]。肿瘤微环境中的多数炎细胞及促炎因子可通过抑制肿瘤细胞铁死亡途径以促进肿瘤的发生和发展。CircABCB10沉默通过调节miR-326/趋化因子配体5(chemokine ligand 5,CCL5)轴促进直肠癌细胞的铁死亡和凋亡,炎症趋化因子CCL5可抑制直肠癌细胞铁死亡的发生[17]。环状RNA-白细胞介素4受体(Circ-interleukin-4 receptor,Circ-IL4R)可通过调节miR-541-3p/GPX4轴抑制肝细胞癌铁死亡以促进肿瘤形成[18]。
炎症发应对癌细胞铁死亡有双重作用。中性粒细胞可以通过铁死亡途径促进胶质母细胞瘤进展中的肿瘤坏死,对肿瘤细胞铁死亡有积极作用[19]。高迁移率族蛋白-B1(high mobility group box 1,HMGB1)作为一种促炎细胞因子,通过RAS-JNK/p38途径发挥促进白血病细胞铁死亡作用[20]。炎症相关因素对肿瘤细胞铁死亡产生的2种相反影响的内在机制值得深入研究。
3.2 免疫与铁死亡癌症免疫编辑是免疫系统介导的过程,包括3个阶段:消除、平衡和逃逸。在消除阶段,正在发展的肿瘤明显已被免疫细胞成功根除[21],CD8+细胞毒性T淋巴细胞(CD8+ cytotoxic T lymphocytes,CTLs)在这阶段起到重要作用[22]。CTLs主要释放IFN-γ与肿瘤坏死因子α(tumor necrosis factor α,TNFα),参与肿瘤消除阶段[23]。
针对肿瘤免疫疗法对肿瘤细胞铁死亡途径的影响的研究发现,肿瘤免疫疗法激活CTLs后,释放的IFNγ抑制xCT,阻止黑色素瘤细胞摄取胱氨酸以促进脂质过氧化,从而导致肿瘤细胞铁死亡[24]。此外,前列腺素E2(prostaglandin E2,PGE2)作为重要的免疫调节剂引起了广泛关注。已有研究证明,诱导癌细胞铁死亡与前列腺素内过氧化物合酶2(prostaglandin endoperoxide synthase 2,PTGS2)的表达增加以及PGE2的释放有关[10],PGE2以及PTGS2可能促进肿瘤细胞铁死亡。而免疫系统中的重要调节因子TNFα处理白血病细胞后细胞中GPX4持续下调,并有活性氧(reactive oxygen species,ROS)产生和磷脂过氧化,这些是激活铁死亡所必需的,TNFα可能促进肿瘤细胞铁死亡[25-26]。这些研究揭示了一种免疫系统驱动癌细胞铁死亡途径以抑制肿瘤发生的新机制,免疫检查点阻断等免疫疗法在临床上显著的效果在一定程度上可能与肿瘤细胞铁死亡的驱动有关。未来可以利用免疫系统推动肿瘤细胞铁死亡,开发相关药物以提高抗肿瘤治疗的效果。
3.3 基质细胞与铁死亡基质细胞作为器官的结缔组织细胞,也是肿瘤微环境的重要构成之一。作为肿瘤微环境中最重要的基质细胞,癌相关成纤维细胞(cancer associated fibroblasts,CAFs)贯穿于肿瘤的所有阶段。CAFs通过合成基质金属蛋白酶(matrix metalloproteinase,MMP)以及细胞外基质(extracellular matrix,ECM),从而促进肿瘤的侵袭和转移[27]。
CAFs、ECM和MMP在癌细胞铁死亡方面发挥抑制作用,推动肿瘤发展。顺铂和紫杉醇可以通过激活USP7/hnRNPA1轴促进CAFs分泌外泌体miR-522减少脂质活性氧在胃癌细胞中的积累,从而抑制癌细胞的铁死亡[28]。ECM也是铁死亡的一个生理抑制因素。ECM作为肿瘤微环境的重要成分可以抑制三阴性乳腺癌细胞发生铁死亡[29]。另外,MMP-9也在推动乳腺癌细胞铁死亡过程中有抑制作用[30]。
3.4 血管生成相关因素与铁死亡血管生成是恶性肿瘤快速生长所必需的,为恶性细胞供给足够的氧气和营养。在一定条件下,低氧会诱导血管生成,由缺氧诱导因子(hypoxia inducible factor,HIF)转录因子家族控制,如HIF-1α和HIF-2α[31]。据报道,非小细胞肺癌细胞中的HIF-1α不稳定会降低铁死亡的易感性[32]。另外,单独对肾透明细胞癌细胞进行HIF-1α基因敲除或HIF-2α消融后,发现2种方法均可降低肿瘤细胞对铁死亡的敏感性[33]。HIF途径可能是多种肿瘤铁死亡易感性的主要驱动力,对促进肿瘤细胞铁死亡至关重要。
促进肿瘤血管生成的大部分因素发挥抑制肿瘤铁死亡的作用。外泌体通过参与新生血管的生成,加快肿瘤生长[34]。在RSL3诱导的乳腺癌细胞铁死亡中,外泌体分泌是一种防止铁死亡的保护机制[35]。如前所述,CAFs分泌的外泌体miR-522也可以抑制胃癌铁死亡[28]。整合素不仅促进肿瘤转移,也是促肿瘤血管形成的要素之一[36]。整合素α6β4可保护乳腺癌细胞粘附的上皮细胞和癌细胞免受erastin诱导的铁死亡[29],整合素在推动乳腺癌细胞铁死亡途径中有抑制作用。
3.5 代谢与铁死亡线粒体代谢、铁代谢、脂质代谢和谷氨酰胺代谢等多种细胞代谢过程有促进铁死亡的作用。其中线粒体在氧化代谢中起着核心作用,特别是在半胱氨酸缺乏引起的铁死亡中起着积极的作用[37]。除此之外,铁代谢和脂质代谢是引起铁死亡所必需的[7]。一些铁螯合剂和氧化铁纳米粒子最近已被用于癌症干预[38]。谷氨酰胺分解也在铁死亡中起重要作用,其中谷氨酰胺分解以及三羧酸(tricarboxylic acid,TCA)循环可以通过驱动线粒体膜电位超极化增强铁死亡的敏感性,促进肿瘤细胞铁死亡进程[39]。
硒代谢和乳酸代谢对于铁死亡途径发挥抑制作用。已有证据表明,GPX4对硒的利用是防止过氧化物引起的铁死亡所必需的,硒代谢抑制铁死亡途径[40]。近期研究表明,乳酸可通过影响HCAR1/MCT1-SREBP1-SCD1通路合成单不饱和脂肪酸,从而抑制肝癌细胞铁死亡途径[41]。通过靶向肿瘤铁死亡相关代谢,实现肿瘤细胞铁死亡的终目标,可以提高肿瘤治疗的效果。
4 结语诱导肿瘤细胞发生铁死亡作为新发现的抗肿瘤治疗策略之一,其相关铁死亡诱导药物已经用于临床肿瘤治疗,虽然给肿瘤患者带来了新希望但还有许多问题尚未解决。还需要从肿瘤的本质特征角度着手肿瘤铁死亡的研究,肿瘤微环境的各个方面已涉及铁死亡(图 1),如炎症反应、免疫、基质细胞、血管生成和代谢,这些发现为今后的肿瘤治疗提供了一些有效的途径。未来可以将铁死亡与肿瘤微环境联系起来,进一步研究肿瘤微环境中各因素对铁死亡的影响。一些肿瘤微环境中对铁死亡有影响的因素已被发掘出来,通过研究产生影响的内在机制进行筛选或合成与铁死亡诱导药物联用具有协同作用的药物是一种探索抗肿瘤药物的新方法。铁死亡协同药物可能通过加速肿瘤细胞铁死亡,增加铁死亡诱导药物在临床上抗肿瘤治疗的疗效从而改善肿瘤患者的预后。随着针对肿瘤微环境对铁死亡的影响研究的深入,采用铁死亡诱导药物和以肿瘤微环境为靶点的药物联合应用的方法将会揭开抗肿瘤治疗的新篇章。
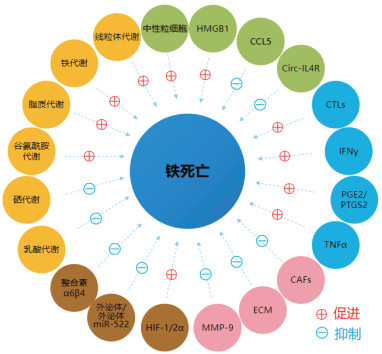
|
| 注 HMGB1:高迁移率族蛋白-B1(high mobility group box 1);CCL5:趋化因子配体5(chemokine ligand 5);Circ-IL4R:环状RNA-白细胞介素4受体(Circ-interleukin-4 receptor);CTLs:CD8+细胞毒性T淋巴细胞(CD8+ cytotoxic T lymphocytes);IFNγ:干扰素-γ(interferon-γ);PGE2:前列腺素E2(prostaglandin E2);PTGS2:前列腺素内过氧化物合酶2(prostaglandin endoperoxide synthase 2);TNFα:肿瘤坏死因子α(tumor necrosis factor α);CAFs:癌相关成纤维细胞(cancer associated fibroblasts);ECM:细胞外基质(extracellular matrix);MMP-9:基质金属蛋白酶-9(matrix metalloproteinase-9);HIF-1α:缺氧诱导因子1α(hypoxia inducible factor 1α) 图 1 肿瘤微环境中各因素对铁死亡的影响 |
| [1] |
Zhou MG, Wang HD, Zeng XY, et al. Mortality, morbidity, and risk factors in China and its provinces, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017[J]. Lancet, 2019, 394(10204): 1145-1158. DOI:10.1016/S0140-6736(19)30427-1 |
| [2] |
宋文静, 冀慧雁, 金若云, 等. 分子靶向肿瘤治疗研究现状[J]. 中国药物与临床, 2018, 18(11): 1930-1933. |
| [3] |
Hou PP, Kapoor A, Zhang Q, et al. Tumor microenvironment remodeling enables bypass of oncogenic KRAS dependency in pancreatic cancer[J]. Cancer Discov, 2020, 10(7): 1058-1077. DOI:10.1158/2159-8290.CD-19-0597 |
| [4] |
Stockwell BR, Jiang X. The chemistry and biology of ferroptosis[J]. Cell Chem Biol, 2020, 27(4): 365-375. DOI:10.1016/j.chembiol.2020.03.013 |
| [5] |
Dixon SJ, Lemberg KM, Lamprecht MR, et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death[J]. Cell, 2012, 149(5): 1060-1072. DOI:10.1016/j.cell.2012.03.042 |
| [6] |
Mou YH, Wang J, Wu JC, et al. Ferroptosis, a new form of cell death: opportunities and challenges in cancer[J]. J Hematol Oncol, 2019, 12(1): 34. DOI:10.1186/s13045-019-0720-y |
| [7] |
Stockwell BR, Jiang XJ. A physiological function for ferroptosis in tumor suppression by the immune system[J]. Cell Metab, 2019, 30(1): 14-15. DOI:10.1016/j.cmet.2019.06.012 |
| [8] |
Dixon SJ, Stockwell BR. The hallmarks of ferroptosis[J]. Annu Rev Cancer Biol, 2019, 3: 35-54. DOI:10.1146/annurev-cancerbio-030518-055844 |
| [9] |
Stockwell BR, Jiang XJ, Gu W. Emerging mechanisms and disease relevance of ferroptosis[J]. Trends Cell Biol, 2020, 30(6): 478-490. DOI:10.1016/j.tcb.2020.02.009 |
| [10] |
Yang WS, SriRamaratnam R, Welsch ME, et al. Regulation of ferroptotic cancer cell death by GPX4[J]. Cell, 2014, 156(1/2): 317-331. |
| [11] |
Stockwell BR. A powerful cell-protection system prevents cell death by ferroptosis[J]. Nature, 2019, 575(7784): 597-598. DOI:10.1038/d41586-019-03145-8 |
| [12] |
Stockwell BR, Friedmann Angeli JP, Bayir H, et al. Ferroptosis: a regulated cell death Nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171(2): 273-285. DOI:10.1016/j.cell.2017.09.021 |
| [13] |
Tang DL, Kang R, Berghe TV, et al. The molecular machinery of regulated cell death[J]. Cell Res, 2019, 29(5): 347-364. DOI:10.1038/s41422-019-0164-5 |
| [14] |
Hirschhorn T, Stockwell BR. The development of the concept of ferroptosis[J]. Free Radic Biol Med, 2019, 133: 130-143. DOI:10.1016/j.freeradbiomed.2018.09.043 |
| [15] |
Hadian K, Stockwell BR. SnapShot: ferroptosis[J]. Cell, 2020, 181(5): 1188. DOI:10.1016/j.cell.2020.04.039 |
| [16] |
Murata M. Inflammation and cancer[J]. Environ Health Prev Med, 2018, 23(1): 50. DOI:10.1186/s12199-018-0740-1 |
| [17] |
Xian ZY, Hu B, Wang T, et al. CircABCB10 silencing inhibits the cell ferroptosis and apoptosis by regulating the miR-326/CCL5 axis in rectal cancer[J]. Neoplasma, 2020, 67(5): 1063-1073. DOI:10.4149/neo_2020_191024N1084 |
| [18] |
Xu QH, Zhou LJ, Yang GH, et al. CircIL4R facilitates the tumorigenesis and inhibits ferroptosis in hepatocellular carcinoma by regulating the miR-541-3p/GPX4 axis[J]. Cell Biol Int, 2020, 44(11): 2344-2356. DOI:10.1002/cbin.11444 |
| [19] |
Yee PP, Wei YJ, Kim SY, et al. Neutrophil-induced ferroptosis promotes tumor necrosis in glioblastoma progression[J]. Nat Commun, 2020, 11(1): 5424. DOI:10.1038/s41467-020-19193-y |
| [20] |
Ye FH, Chai WW, Xie M, et al. HMGB1 regulates erastin-induced ferroptosis via RAS-JNK/p38 signaling in HL-60/NRASQ61L cells[J]. Am J Cancer Res, 2019, 9(4): 730-739. |
| [21] |
Yu YR, Ho PC. Sculpting tumor microenvironment with immune system: from immunometabolism to immunoediting[J]. Clin Exp Immunol, 2019, 197(2): 153-160. DOI:10.1111/cei.13293 |
| [22] |
Farhood B, Najafi M, Mortezaee K. CD8+ cytotoxic T lymphocytes in cancer immunotherapy: a review[J]. J Cell Physiol, 2019, 234(6): 8509-8521. DOI:10.1002/jcp.27782 |
| [23] |
Golstein P, Griffiths GM. An early history of T cell-mediated cytotoxicity[J]. Nat Rev Immunol, 2018, 18(8): 527-535. DOI:10.1038/s41577-018-0009-3 |
| [24] |
Wang WM, Green M, Choi JE, et al. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy[J]. Nature, 2019, 569(7755): 270-274. DOI:10.1038/s41586-019-1170-y |
| [25] |
陈自喜, 张孟哲, 朱兆伟, 等. 结肠癌患者外周血microRNA-21、淋巴细胞亚群及炎性因子的相关性研究[J]. 实用肿瘤杂志, 2021, 36(4): 314-319. |
| [26] |
Latchoumycandane C, Marathe GK, Zhang RL, et al. Oxidatively truncated phospholipids are required agents of tumor necrosis factor α (TNFα)-induced apoptosis[J]. J Biol Chem, 2012, 287(21): 17693-17705. DOI:10.1074/jbc.M111.300012 |
| [27] |
Denton AE, Roberts EW, Fearon DT. Stromal cells in the tumor microenvironment[J]. Adv Exp Med Biol, 2018, 1060: 99-114. |
| [28] |
Zhang HY, Deng T, Liu R, et al. CAF secreted miR-522 suppresses ferroptosis and promotes acquired chemo-resistance in gastric cancer[J]. Mol Cancer, 2020, 19(1): 43. DOI:10.1186/s12943-020-01168-8 |
| [29] |
Brown CW, Amante JJ, Goel HL, et al. The α6β4 integrin promotes resistance to ferroptosis[J]. J Cell Biol, 2017, 216(12): 4287-4297. DOI:10.1083/jcb.201701136 |
| [30] |
Zhang J, Yang J, Zuo TT, et al. Heparanase-driven sequential released nanoparticles for ferroptosis and tumor microenvironment modulations synergism in breast cancer therapy[J]. Biomaterials, 2021, 266: 120429. DOI:10.1016/j.biomaterials.2020.120429 |
| [31] |
Lugano R, Ramachandran M, Dimberg A. Tumor angiogenesis: causes, consequences, challenges and opportunities[J]. Cell Mol Life Sci, 2020, 77(9): 1745-1770. DOI:10.1007/s00018-019-03351-7 |
| [32] |
Jiang YQ, Mao C, Yang R, et al. EGLN1/c-myc induced lymphoid-specific helicase inhibits ferroptosis through lipid metabolic gene expression changes[J]. Theranostics, 2017, 7(13): 3293-3305. DOI:10.7150/thno.19988 |
| [33] |
Zou YL, Palte MJ, Deik AA, et al. A GPX4-dependent cancer cell state underlies the clear-cell morphology and confers sensitivity to ferroptosis[J]. Nat Commun, 2019, 10(1): 1617. DOI:10.1038/s41467-019-09277-9 |
| [34] |
张东焕, 张素云, 杨升. 外泌体在胃肠道肿瘤诊治中的应用[J]. 实用肿瘤杂志, 2021, 36(4): 300-305. |
| [35] |
Strzyz P. Iron expulsion by exosomes drives ferroptosis resistance[J]. Nat Rev Mol Cell Biol, 2020, 21(1): 4-5. |
| [36] |
黄梦汶, 林昶东, 陈剑峰. 整合素活化及其介导的黏着斑成熟与肿瘤转移[J]. 生理学报, 2021, 73(2): 151-159. |
| [37] |
Gao MH, Yi JM, Zhu JJ, et al. Role of mitochondria in ferroptosis[J]. Mol Cell, 2019, 73(2): 354-363. DOI:10.1016/j.molcel.2018.10.042 |
| [38] |
Wang YF, Yu L, Ding J, et al. Iron metabolism in cancer[J]. Int J Mol Sci, 2018, 20(1): 95. DOI:10.3390/ijms20010095 |
| [39] |
Kim MJ, Yun GJ, Kim SE. Metabolic regulation of ferroptosis in cancer[J]. Biology (Basel), 2021, 10(2): 83. |
| [40] |
Ingold I, Berndt C, Schmitt S, et al. Selenium utilization by GPX4 is required to prevent hydroperoxide-induced ferroptosis[J]. Cell, 2018, 172(3): 409-422. DOI:10.1016/j.cell.2017.11.048 |
| [41] |
Zhao YB, Li MH, Yao XM, et al. HCAR1/MCT1 regulates tumor ferroptosis through the lactate-mediated AMPK-SCD1 activity and its therapeutic implications[J]. Cell Rep, 2020, 33(10): 108487. DOI:10.1016/j.celrep.2020.108487 |
 2022, Vol. 37
2022, Vol. 37


