文章信息
- 石三保, 李达, 单永琪, 高广荣, 张成
- Shi Sanbao, Li Da, Shan Yongqi, Gao guangrong, Zhang Cheng
- 急诊手术影响结直肠癌患者预后的因素分析
- Analysis of prognostic factors of emergency surgery for colorectal cancer patients
- 实用肿瘤杂志, 2022, 37(5): 439-443
- Journal of Practical Oncology, 2022, 37(5): 439-443
-
通信作者
- 张成, E-mail: cz1791@126.com
-
文章历史
- 收稿日期:2021-07-14
结直肠癌是最常见的恶性肿瘤之一,其中 > 30%的患者是在出现肠梗阻、肠穿孔和消化道大出血等急症时才被发现[1-2]。近年来,随着肠梗阻导管和肠梗阻支架的广泛应用以及肠镜诊疗技术的发展,急诊手术不再是结直肠癌急症治疗的唯一方案,但是多数患者仍需急诊手术治疗[3-5]。由于外科手术技术的进步及理念的更新,越来越多的结直肠癌急症患者在急诊手术中完成肿瘤的根治性切除。然而研究显示,与择期手术结直肠癌患者比较,急诊手术患者预后仍较差[6]。目前急诊手术对结直肠癌患者的远期预后的影响仍存在争议。本研究旨在探讨急诊手术对结直肠癌患者预后的影响以及造成结直肠癌急诊手术患者与择期手术患者预后差异的原因。现报道如下。
1 资料与方法 1.1 一般资料回顾性分析自2012年1月至2013年8月北部战区总医院普通外科收治的接受根治性手术的379例结直肠癌患者临床资料。纳入标准:原发性结直肠癌;未发现同时性远处转移;行根治性手术;病理诊断为腺癌。排除标准:克罗恩病癌变、溃疡性结肠炎癌变、家族性肠息肉性癌变和色素沉着息肉综合征(Peutz-Jeghers)癌变等;其他器官恶性肿瘤病史;术后30 d内死亡;随访期间因其他原因失访。根据手术时机的不同将患者分为择期手术组(n=311)和急诊手术组(n=68)。择期手术组年龄29~89岁,(63.21±11.37)岁。急诊手术组年龄34~87岁,(64.93±12.54)岁。急诊手术组中包括肠癌并肠穿孔16例,肠癌并肠梗阻52例。本研究已通过本院伦理审批。
1.2 观察指标观察并比较两组患者的年龄、性别、急诊情况、血清癌胚抗原(carcinoembryonic antigen,CEA)水平、肿瘤部位、肿瘤直径、分化程度、TNM分期、T分期、N分期、淋巴结转移率(淋巴结转移数目/送检淋巴结数目)、微卫星状态和脉管浸润等。
1.3 研究终点及随访采用电话和门诊复查进行随访,随访时间3~79个月。主要研究终点为全因死亡,次要研究终点为肿瘤复发转移。随访方案为术后2年内每3~6个月复查1次,然后每6个月复查1次,总计为期5年,5年后每年复查1次。
1.4 统计学分析应用SPSS 19.0统计学软件进行数据分析。计量资料采用均数±标准差(x±s)表示,组间比较采用t检验。计数资料用频数(百分比)表示,组间比较采用χ2检验。采用Kaplan-Meier生存曲线进行生存分析。采用Cox比例风险回归模型进行危险因素分析。绘制受试者工作特征(receiver operating characteristic,ROC)曲线确定计量资料的界值。以P < 0.05为差异具有统计学意义。
2 结果 2.1 急诊手术组与择期手术组患者临床特征比较与择期手术组患者比较,急诊手术组患者肿瘤好发于结肠,且最常见于左半结肠癌,淋巴结转移率较高,血清CEA > 5 ng/mL、肿瘤直径≥5 cm、T4期、N2期和脉管浸润的比例均较高,差异均具有统计学意义(均P < 0.05,表 1)。两组间性别、年龄、输血治疗、分化程度、TNM分期和微卫星状态等比较,差异均无统计学意义(均P > 0.05)。
| 临床特征 | 急诊手术组(n=68) | 择期手术组(n=311) | t/χ2值 | P值 |
| 年龄(x±s,岁) | 64.93±12.54 | 63.21±11.37 | 1.105 | 0.270 |
| 性别 | 1.302 | 0.254 | ||
| 男性 | 36(52.9) | 188(60.5) | ||
| 女性 | 32(47.1) | 123(39.5) | ||
| 血清CEA水平 | 23.116 | < 0.01 | ||
| > 5 ng/mL | 34(50.0) | 67(21.5) | ||
| ≤5 ng/mL | 34(50.0) | 244(78.5) | ||
| 输血治疗 | 10(14.7) | 45(14.5) | 0.003 | 0.960 |
| 肿瘤部位 | 49.044 | < 0.01 | ||
| 直肠 | 6(8.8) | 173(55.6) | ||
| 结肠 | 62(91.2) | 138(44.4) | ||
| 肿瘤直径 | 30.604 | < 0.01 | ||
| ≥5 cm | 52(76.5) | 123(39.5) | ||
| < 5 cm | 16(23.5) | 188(60.5) | ||
| 分化程度 | 0.281 | 0.596 | ||
| 低分化 | 10(14.7) | 54(17.4) | ||
| 高~中分化 | 58(85.3) | 257(82.6) | ||
| TNM分期 | 3.764 | 0.052 | ||
| Ⅲ期 | 34(50.0) | 116(37.3) | ||
| Ⅰ~Ⅱ期 | 34(50.0) | 195(62.7) | ||
| T分期 | 8.424 | 0.004 | ||
| T1~T3期 | 22(32.4) | 161(51.8) | ||
| T4期 | 46(67.6) | 150(48.2) | ||
| N分期 | 4.319 | 0.038 | ||
| N0~N1期 | 54(79.4) | 276(88.7) | ||
| N2期 | 14(20.6) | 35(11.3) | ||
| 淋巴结转移率(x±s,%) | 15.4±2.8 | 7.7±0.8 | 2.671 | 0.009 |
| 脉管浸润 | 34(50.0) | 86(27.7) | 12.879 | < 0.01 |
| 微卫星稳定 | 50(73.5) | 254(81.7) | 2.331 | 0.127 |
| 注CEA:癌胚抗原(carcinoembryonic antigen) | ||||
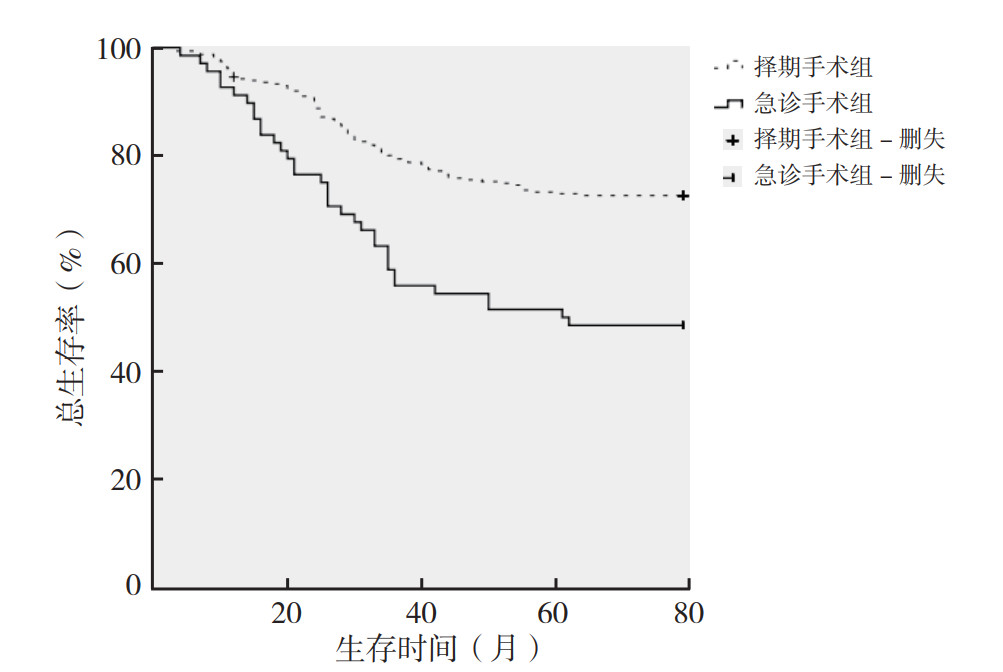
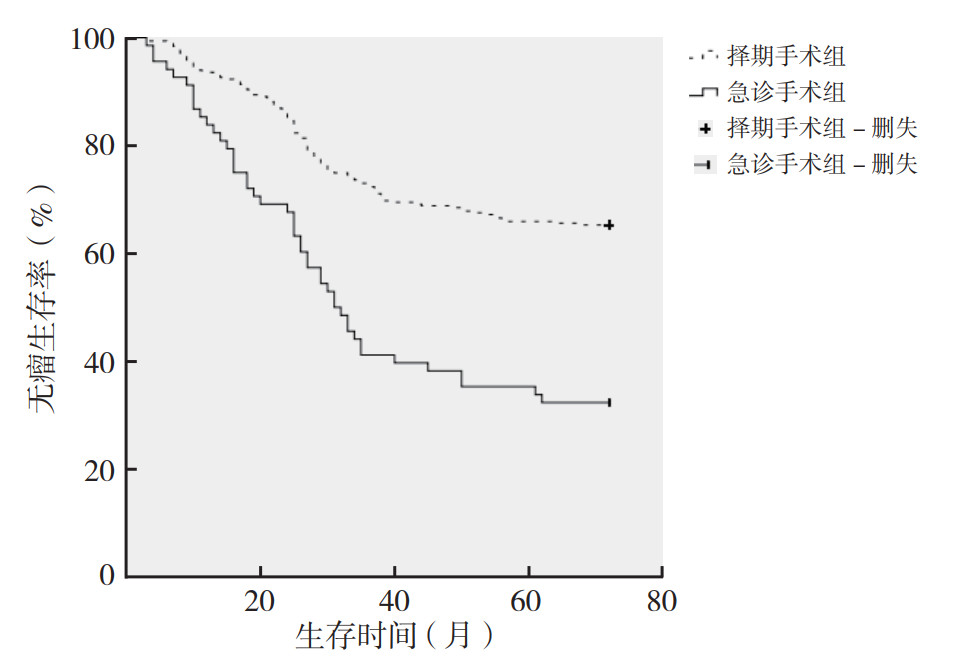
急诊手术组和择期手术组患者术后整体复发转移率分别为41.2%和19.0%(P < 0.05)。急诊手术患者更容易发生多脏器复发转移[14.7%(10/68) vs 2.3%(7/311),P < 0.05],肝转移的比例增高[23.5%(16/68) vs 11.6%(36/311),P < 0.05]。Kaplan-Meier生存曲线显示,急诊手术组和择期手术组5年总生存率分别为51.5%和72.7%,5年无瘤生存率分别为35.3%和65.9%(图 1~2)。急诊手术组5年无瘤生存率和总生存率均低于择期手术组(均P < 0.05)。
|
| 图 1 急诊手术组和择期手术组结直肠癌患者总生存曲线比较 Fig.1 Comparison of overall survival of colorectal patients between the emergency surgery and elective surgery groups |
|
| 图 2 急诊手术组和择期手术组结直肠癌患者无瘤生存曲线比较 Fig.2 Comparison of disease-free survival of colorectal patients between the emergency surgery and elective surgery groups |
多因素分析显示,血清CEA > 5 ng/mL、低分化、T4期和淋巴结转移率是结直肠癌患者术后无瘤生存率低的独立危险因素(均P < 0.05);急诊手术不是结直肠癌患者术后无瘤生存率低的独立危险因素(P > 0.05,表 2)。对急诊手术的结直肠癌患者无瘤生存危险因素进行多因素分析发现,淋巴结转移率高、血清CEA > 5 ng/mL和T4期是急诊手术组患者无瘤生存的独立危险因素(均P < 0.05,表 3)。
| 临床特征 | HR(95%CI) | P值 |
| 男性 | 0.971(0.696~1.354) | 0.862 |
| 年龄 | 0.987(0.974~1.001) | 0.069 |
| 急诊手术 | 1.348(0.850~2.140) | 0.205 |
| 血清CEA > 5 ng/mL | 2.160(1.521~3.067) | < 0.01 |
| 输血治疗 | 0.860(0.521~1.419) | 0.554 |
| 肿瘤部位(直肠) | 0.860(0.581~1.274) | 0.453 |
| 肿瘤直径≥5 cm | 1.020(0.699~1.487) | 0.920 |
| 低分化 | 1.651(1.096~2.486) | 0.016 |
| T4期 | 2.395(1.642~3.492) | < 0.01 |
| N2期 | 1.057(0.656~1.706) | 0.819 |
| 淋巴结转移率 | 4.028(1.737~9.338) | 0.001 |
| 脉管浸润 | 1.156(0.813~1.645) | 0.419 |
| 微卫星稳定 | 1.221(0.760~1.962) | 0.410 |
| 注CEA:癌胚抗原(carcinoembryonic antigen) | ||
| 临床特征 | HR(95%CI) | P值 |
| 男性 | 0.808(0.422~1.546) | 0.520 |
| 年龄 | 0.989(0.962~1.016) | 0.432 |
| 血清CEA > 5 ng/mL | 2.286(1.568~3.334) | < 0.01 |
| 输血治疗 | 1.213(0.421~3.499) | 0.554 |
| 肿瘤部位(直肠) | 1.931(0.618~6.038) | 0.258 |
| 肿瘤直径≥5 cm | 1.944(0.736~5.138) | 0.180 |
| 低分化 | 1.428(0.501~4.071) | 0.506 |
| T4期 | 2.069(1.458~2.935) | 0.032 |
| N2期 | 1.030(0.724~1.467) | 0.868 |
| 淋巴结转移率 | 3.412(1.4.9~8.265) | 0.007 |
| 脉管浸润 | 0.919(0.448~1.883) | 0.817 |
| 微卫星稳定 | 1.317(0.825~2.102) | 0.454 |
| 注CEA:癌胚抗原(carcinoembryonic antigen) | ||
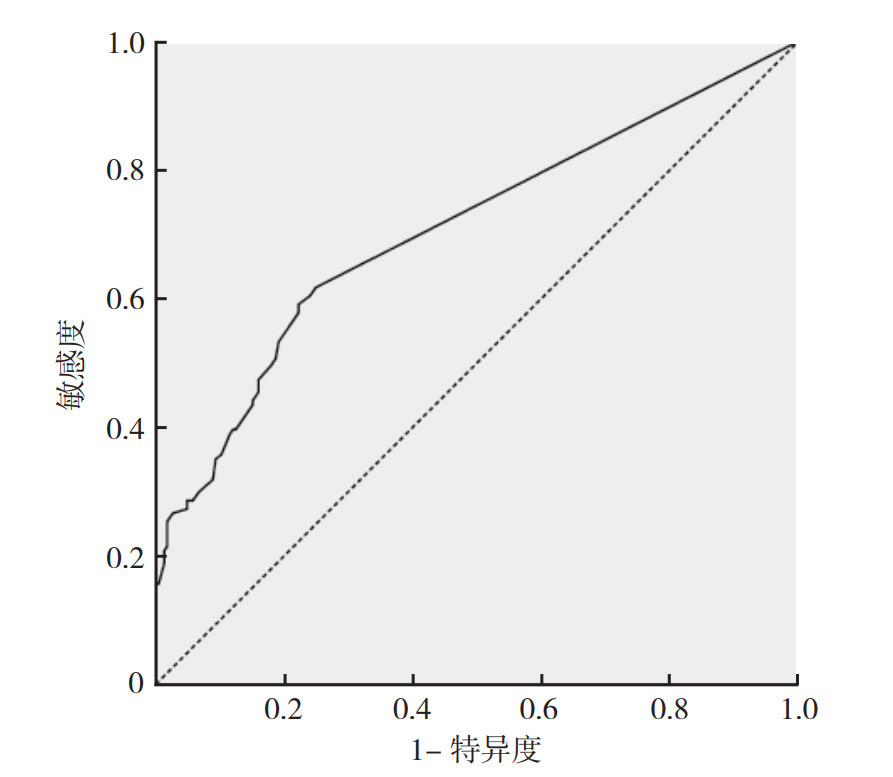
预测结直肠癌患者无瘤生存的ROC曲线的曲线下面积(area under the curve,AUC)为0.708,约登指数为0.369,界值为5.5%(敏感度为0.591,特异度为0.778;图 3)。
|
| 图 3 淋巴结转移率预测结直肠癌无瘤生存的ROC曲线 Fig.3 ROC curves of lymph node ratio predicting disease-free survival in colorectal cancer patients |
大量研究表明,急诊手术的结直肠癌患者预后较差[6-10]。本研究显示,急诊手术的结直肠癌患者术后易出现复发转移,远期生存率低。这可能与其肿瘤学特征、特殊的病理状态和术后化疗延迟等有关[10-12],而急诊手术本身对结直肠癌患者预后的影响仍存在争议[7, 11-12]。因此,本研究主要探讨急诊手术本身影响手术治疗的结直肠癌患者远期预后的因素。
与Weixler等[12]的研究结果相同,本研究结果显示,急诊手术本身并不是结直肠癌患者无瘤生存的独立危险因素。而Hogan等[11]的研究指出急诊手术是结直肠癌患者预后不良的独立危险因素。Beuran等[10]的研究结果指出肠穿孔是结直肠癌患者预后的危险因素,考虑可能与肠穿孔增加了患者肿瘤播散的风险有关。还有研究结果显示,与肠穿孔的患者比较,梗阻性结直肠癌的患者预后更差,且肠穿孔和肠梗阻都是结直肠癌患者预后的危险因素[13]。这可能是因为相关研究中纳入了姑息性手术的患者[11, 13],而本研究中急诊手术的结直肠癌患者均一期行根治性手术。
本研究发现,血清CEA > 5 ng/mL、低分化、T4期和淋巴结转移率高是结直肠癌无瘤生存的独立危险因素(均P < 0.05)。急诊手术患者淋巴结转移率高、血清CEA > 5 ng/mL和T4期患者占比均较择期手术患者增多。对急诊手术的结直肠癌患者无瘤生存进行危险因素分析发现,淋巴结转移率高、血清CEA > 5 ng/mL和T4期同时是急诊手术组患者无瘤生存的独立危险因素。因此,急诊手术的结直肠癌患者预后较差可能与其淋巴结转移率高、血清CEA > 5 ng/mL和T4期的比例较高有关。
TNM分期是目前公认的结直肠癌预后预测指标[14-16]。本研究多因素分析结果显示,T4期是结直肠癌患者无瘤生存的独立危险因素(P < 0.05),但并未发现N2期对结直肠癌患者无瘤生存有影响。有研究指出,与N分期比较,淋巴结转移率对结直肠癌患者预后的评估更加有效[17]。本研究也发现,淋巴结转移率高是结直肠癌患者无瘤生存的独立危险因素(P < 0.05)。进一步绘制ROC曲线确定淋巴结转移率的界值发现,淋巴结转移率预测结直肠癌患者无瘤生存期的界值为5.5%(敏感度为0.591,特异度为0.778),AUC为0.708,考虑其临床应用效果一般。
本研究结果显示,急诊手术组患者血清CEA > 5 ng/mL的比例较高,而且血清CEA > 5 ng/mL是结直肠癌患者无瘤生存的独立危险因素(P < 0.05)。目前,普遍认为血清CEA水平高是结直肠癌预后不良的危险因素,考虑可能与术前血清CEA水平高的患者肿瘤分期较晚,更容易出现异时性肝转移有关[18-19]。但是也有研究指出,CEA对结直肠癌患者的预后无明显影响[20]。研究还指出,术中腹腔积液CEA的检测同样为结直肠癌患者的预后提供很好的预测作用[21]。还有研究提出CEA结合糖类抗原199(carbohydrate antigen199,CA199)等肿瘤标志物应用于评估肠癌预后可获得更好的效果[6]。
综上所述,急诊手术结直肠癌患者远期预后差主要是因为其淋巴结转移率高、血清CEA > 5 ng/mL和T4期,而非急诊手术本身。结直肠癌急症的患者应积极行手术治疗,在保证患者生命安全的前提下,尽可能做到肿瘤的一期根治,不应因为其预后不良而放弃外科手术。
| [1] |
Cao MM, Li H, Sun DQ, et al. Cancer burden of major cancers in China: a need for sustainable actions[J]. Cancer Commun (Lond), 2020, 40(5): 205-210. DOI:10.1002/cac2.12025 |
| [2] |
程龙, 刘晓昌, 梅俏. 关于建立结直肠癌立体防治系统的探讨[J]. 实用肿瘤杂志, 2021, 36(1): 1-5. DOI:10.13267/j.cnki.syzlzz.2021.001 |
| [3] |
Alonso-Hernández N, Segura-Sampedro JJ, Soldevila Verdeguer CM, et al. Results of a national survey on the use of stents for the treatment of colonic obstruction[J]. Cir Esp (Engl Ed), 2020, 98(9): 533-539. DOI:10.1016/j.ciresp.2020.02.006 |
| [4] |
Andrei GN, Constantinescu G, Nedelcu C, et al. Auspicious management of a acute obstructive left colon tumor in a 93-year-old patient-case report and literature review[J]. Chirurgia (Bucur), 2017, 112(6): 734-746. DOI:10.21614/chirurgia.112.6.734 |
| [5] |
Zanghì A, Piccolo G, Cavallaro A, et al. A pilot study about the oncologic safety of colonic self-expandable metal stents (SEMS) in obstructive colon cancer: is occlusion always better than "silent" perforation?[J]. Eur Rev Med Pharmacol Sci, 2016, 20(24): 5242-5248. |
| [6] |
Youl PH, Theile DE, Moore J, et al. Outcomes following major resection for colorectal cancer in patients aged 65+ years: a population-based study in Queensland, Australia[J]. ANZ J Surg, 2021, 91(5): 932-937. DOI:10.1111/ans.16631 |
| [7] |
Littlechild J, Junejo M, Simons AM, et al. Emergency resection surgery for colorectal cancer: patterns of recurrent disease and survival[J]. World J Gastrointest Pathophysiol, 2018, 9(1): 8-17. DOI:10.4291/wjgp.v9.i1.8 |
| [8] |
Acar N, Acar T, Kamer E, et al. Should we still doubt the success of emergency oncologic colorectal surgery?: a retrospective study[J]. Turkish J Trauma Emerg Surg TJTES, 2020, 26(1): 55-62. |
| [9] |
Meyerhardt JA, Mangu PB, Flynn PJ, et al. Follow-up care, surveillance protocol, and secondary prevention measures for survivors of colorectal cancer: American Society of Clinical Oncology clinical practice guideline endorsement[J]. J Clin Oncol, 2013, 31(35): 4465-4470. DOI:10.1200/JCO.2013.50.7442 |
| [10] |
Beuran M, Negoi I, Vartic M, et al. Nonelective left-sided colon cancer resections are associated with worse postoperative and oncological outcomes: a propensity-matched study[J]. Chirurgia (Bucur), 2018, 113(2): 218-226. DOI:10.21614/chirurgia.113.2.218 |
| [11] |
Hogan J, Samaha G, Burke J, et al. Emergency presenting colon cancer is an independent predictor of adverse disease-free survival[J]. Int Surg, 2015, 100(1): 77-86. DOI:10.9738/INTSURG-D-13-00281.1 |
| [12] |
Weixler B, Warschkow R, Ramser M, et al. Urgent surgery after emergency presentation for colorectal cancer has no impact on overall and disease-free survival: a propensity score analysis[J]. BMC Cancer, 2016, 16: 208. DOI:10.1186/s12885-016-2239-8 |
| [13] |
Chen HS, Sheen-Chen SM. Obstruction and perforation in colorectal adenocarcinoma: an analysis of prognosis and current trends[J]. Surgery, 2000, 127(4): 370-376. DOI:10.1067/msy.2000.104674 |
| [14] |
张丽娜, 孔祥兴, 李昕琳, 等. 结直肠癌pT4期诊断的难点及辅助诊断方案的研究进展[J]. 实用肿瘤杂志, 2021, 36(1): 6-10. DOI:10.13267/j.cnki.syzlzz.2021.002 |
| [15] |
Wu HL, Tai YH, Lin SP, et al. The impact of blood transfusion on recurrence and mortality following colorectal cancer resection: a propensity score analysis of 4, 030 patients[J]. Sci Rep, 2018, 8(1): 13345. DOI:10.1038/s41598-018-31662-5 |
| [16] |
Giryes A, Oweira H, Mannhart M, et al. Impact of primary tumor side on the outcomes of patients with non-metastatic colon cancer; a patient-level pooled analysis of two clinical trials[J]. Expert Rev Gastroenterol Hepatol, 2018, 12(8): 843-848. DOI:10.1080/17474124.2018.1495075 |
| [17] |
Dolan RD, McSorley ST, Horgan PG, et al. Determinants of lymph node count and positivity in patients undergoing surgery for colon cancer[J]. Medicine (Baltimore), 2018, 97(13): e0185. DOI:10.1097/MD.0000000000010185 |
| [18] |
Li JQ, Gu JH, Ma XT, et al. Development and validation of a nomogram for predicting survival in Chinese Han patients with resected colorectal cancer[J]. J Surg Oncol, 2018, 118(6): 1034-1041. DOI:10.1002/jso.25213 |
| [19] |
陈鹏举, 姚云峰, 张大奎, 等. 结肠癌患者术前血清癌胚抗原水平显著升高的临床意义[J]. 中华胃肠外科杂志, 2015, 18(10): 1026-1031. |
| [20] |
Arakawa K, Hata K, Nozawa H, et al. Prognostic significance and clinicopathological features of synchronous colorectal cancer[J]. Anticancer Res, 2018, 38(10): 5889-5895. DOI:10.21873/anticanres.12932 |
| [21] |
Kim JH, Lee S, Lee SH, et al. Clinical significance of carcinoembryonic antigen in peritoneal fluid detected during operation in stage Ⅰ-Ⅲ colorectal cancer patients[J]. Intestinal Res, 2018, 16(3): 467-474. DOI:10.5217/ir.2018.16.3.467 |
 2022, Vol. 37
2022, Vol. 37


