文章信息
- 侯新芳, 李帅, 吴晨, 任军芳, 张鑫鑫
- 信迪利单抗联合化疗一线治疗晚期食管癌完全缓解一例
- 实用肿瘤杂志, 2021, 36(1): 66-69
-
通信作者
- 侯新芳,E-mail:zlyyhouxinfang1465@zzu.edu.cn
-
文章历史
- 收稿日期:2020-12-17
食管癌是我国发病率第6位和死亡率第4位的恶性肿瘤[1]。我国食管癌发病率与死亡率均高于世界平均水平[2]。病理分型上,我国86.3%的食管癌病例属鳞癌[3]。长期以来化疗是转移性食管鳞癌的标准治疗方案,但对患者生存期延长有限。近年来,免疫检查点抑制剂已在食管癌二线及以上治疗中获得临床指南推荐[4]。2020年9月欧洲肿瘤内科学会(European Society for Medical Oncology, ESMO)年会公布的KEYNOTE-590研究结果显示帕博立珠单抗联合化疗一线治疗晚期食管癌的有效性[5]。其他免疫检查点抑制剂治疗晚期食管癌的一线研究亦正在进行中。免疫联合化疗作为新的食管癌治疗方案,国内临床应用经验仍不足。本团队应用信迪利单抗联合化疗一线治疗1例术后转移的食管癌患者取得完全缓解,在此对本病例讨论分析,并进行相关文献复习。
1 病例资料患者男性,56岁,美国东部肿瘤协作组(Eastern Cooperative Oncology Group, ECOG)评分:2。2017年10月因进食哽噎于外院就诊,诊断为胸中段食管鳞状细胞癌,行胸腹腔联合食管大部切除+食管胃胸内吻合术。术后病理检查示:食管溃疡型中分化鳞状细胞癌,局部侵及食管壁浅肌层,上下切缘干净,淋巴结0/22。术后诊断:食管中段中分化鳞癌(pT2N0M0,G2,ⅡA期)。2019年4月因声音嘶哑和饮水呛咳于外院就诊,检查提示声带会厌占位。2019年5月11日行支撑喉镜下喉良性肿瘤切除术+会厌肿物切除术+鼻内镜下低温消融术,病理检查示左侧声带高级别上皮内瘤变。患者术后声嘶和呛咳加重,于外院就诊考虑恶性病变,转移瘤可能性大。2019年5月29日行支撑喉镜下左侧声带及会厌谷病变活检+低温冷切刀左侧声带室带切除术,病理检查示:左侧声带鳞状上皮慢性炎伴部分上皮重度非典型增生。患者术后出现气喘、咳嗽和痰中带血丝,2019年6月4日行气管镜检查(报告单患者丢失),活检病理示(气管上段)鳞状细胞癌。患者于外院检查肿瘤突变负荷(tumor mutational burden, TMB)为1.0。
患者食管癌术后1年半余因咳嗽和气喘20 d于2019年7月收治河南省肿瘤医院。PET-CT检查提示:(1)T1-T2水平上纵隔不规则软组织肿块影代谢活跃,肿块局部与邻近气管和食管分界不清,局部突向气管内,向上与邻近甲状腺左叶下极分界不清,考虑恶性病变并周围侵及; (2)纵隔2区肿块周围多发软组织结节影,代谢活跃,考虑多发淋巴结转移。胸部CT检查示:食管癌术后改变, 上纵隔不规则软组织影,与甲状腺左叶、气管和食管分界不清,淋巴结转移可能。患者病理标本由于种种原因,均无法借到,未行细胞程序性死亡-配体1(programmed cell death 1 ligand 1, PD-L1)等基因检测。入院诊断为食管胸中段中分化鳞癌术后多发淋巴结转移(cT4bN+M0 ⅣA期)。患者有意愿参与信迪利单抗+白蛋白结合型紫杉醇+顺铂一线治疗食管癌的临床试验,但不符合入组条件。考虑患者及家属免疫治疗意愿强烈,顺铂治疗的消化道反应或增加患者对化疗的抵触,制定信迪利单抗+白蛋白结合型紫杉醇+洛铂方案(信迪利单抗200 mg d1;白蛋白结合型紫杉醇200 mg,d1、8;洛铂30 mg,d1,21 d为1个周期)。于2019年7月4日起行信迪利单抗+白蛋白结合型紫杉醇+洛铂方案化疗6个周期。第1个周期治疗后患者咳嗽、气喘和痰中带血等症状均消失,无特殊不适。第2、4和6个周期复查CT均显示病灶明显缩小(图 1)。2019年11月10日单药信迪利单抗(200 mg d1,21 d为1个周期)维持治疗1个周期。2019年11月20日复查气管镜未见异常。2019年11月25日复查PET-CT示:上纵隔原转移灶少许软组织影,放射性摄取未见异常。2019年11月26日复查胃镜示:食管癌术后。疗效评估为完全缓解(complete response, CR; 图 2)。之后信迪利单抗(200 mg d1,21 d为1个周期,已治疗14个周期)维持治疗至今,多次复查CT疗效评估持续为CR(图 3)。治疗中患者未出现明显免疫相关不良反应。
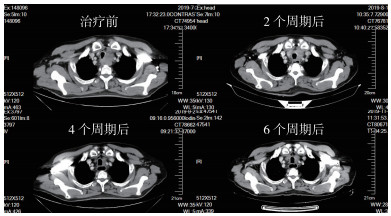
|
| 图 1 食管胸中段中分化鳞癌术后多发淋巴结转移(cT4bN+M0 ⅣA期)患者信迪利单抗联合化疗治疗2、4和6个周期后CT评估结果示肿瘤明显退缩 |
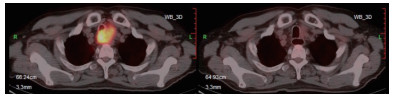
|
| 图 2 食管胸中段中分化鳞癌术后多发淋巴结转移(cT4bN+M0 ⅣA期)患者信迪利单抗联合化疗6个周期和信迪利单抗单药维持治疗1个周期后PET-CT评估示完全缓解 |
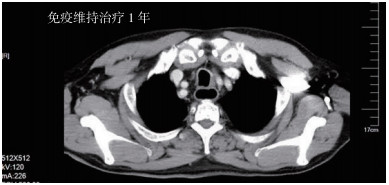
|
| 图 3 食管胸中段中分化鳞癌术后多发淋巴结转移(cT4bN+M0 ⅣA期)患者信迪利单抗单药继续维持治疗12个周期后2020年11月3日CT检查评估仍完全缓解 |
食管癌是中国高发和特发的恶性肿瘤,因其早期症状不明显,约70%的患者在初诊时疾病已进展为局部晚期,可手术患者中50%~60%在术后会复发或发生远处转移[6]。化疗是转移性食管癌的主要治疗手段,过去几十年研究进展缓慢,选择有限。一线治疗以5-氟尿嘧啶或紫杉醇联合含铂化疗为主,有效率较低且不良反应较高[7]。随着免疫治疗KEYNOTE-181、ATTRACTION-3和ESCORT结果的发布,确立免疫治疗在晚期食管癌二线治疗的地位[4]。2020年美国国家综合癌症网络(National Comprehensive Cancer Network, NCCN)与中国临床肿瘤协会(Chinese Society of Clinical Oncology, CSCO)指南均推荐其用于晚期食管癌二线及以上治疗[8-9]。KEYNOTE-590作为全球首个一线食管癌免疫治疗领域的Ⅲ期临床研究,旨在评估帕博利珠单抗联合顺铂和5-氟尿嘧啶相较顺铂和5-氟尿嘧啶一线治疗不可切除局部晚期或转移性食管癌的疗效和安全性[5]。中期分析结果显示,免疫联合化疗一线治疗方案较含铂化疗在总生存(overall survival, OS)、无进展生存(progression free survival,PFS)和客观缓解率(objective response rate,ORR)方面均显示具有统计学意义的改善。这一结果或将改变各国局部晚期或转移性食管癌一线治疗的临床实践。
免疫联合化疗有望成为局部晚期或转移性食管癌一线治疗方案,在临床推广中仍存在应用经验不足的困难,目前国内外已发表文献尚缺乏可供参考的经验。本团队因患者家属的强烈要求,使用免疫联合化疗方案一线治疗食管癌,并取得完全缓解。患者对化疗存在强烈的抵触心理,对于这种对生活质量要求较高而放弃化疗的患者,免疫治疗给这类患者带来生存的希望。免疫治疗存在长尾效应,同时也有优越的短期疗效,本例患者免疫联合化疗治疗2个周期已取得良好疗效,治疗6个周期内达到完全缓解。对于缓解后的进一步治疗计划尚缺乏明确的循证指导,本病例采用肿瘤多学科团队(multi-disciplinary team, MDT)建议,进行免疫单药维持治疗,暂不进行局部放疗。在肿瘤治疗决策中,特别是缺乏治疗经验的病例,MDT有着重要作用。治疗过程中患者耐受性好,没有明显的不良事件,考虑免疫前线治疗患者耐受性更好,并且患者6个周期内迅速获得完全缓解后进行免疫单药治疗进一步减少不良事件的发生。对于治疗耐受良好的患者仍要保持警惕,及时处理不良事件。患者外院治疗未进行PD-L1检测,入院后未能借到肿瘤标本进行检测,考虑标本保存的不确定性,随着免疫治疗的普及,术后病理是否进行常规PD-L1检测也是值得思考的问题。本团队对以下问题进行进一步思考并复习相关文献。
2.1 非免疫治疗优势人群仍可获益尽管免疫治疗在各瘤种临床研究中为一些患者带来长期生存获益,但临床应用单药有效率仍存瓶颈,需要伴随诊断筛选免疫治疗优势人群。目前获认可的生物标志物有高度微卫星不稳定性(microsatellite instability-high, MSI-H)、错配修复缺陷(mismatch repair-deficient, dMMR)、TMB和PD-L1等[10]。免疫联合治疗方案则扩大了获益人群。KEYNOTE-590结果显示,无论是全体晚期食管癌患者还是PD-L1联合阳性评分(combined positive score, CPS)≥10的晚期食管癌患者,经免疫联合化疗(帕博利珠单抗200 mg d1;顺铂80 mg/m2; 5-氟尿嘧啶800 mg/m2 d1-5,21 d为1个周期)治疗均能取得OS获益[5]; 虽然PD-L1 CPS≥10的患者OS获益更明显,死亡风险降低幅度更显著,但亚组OS分析结果显示,PD-L1 CPS<10的患者也能从免疫联合化疗方案获得OS和PFS的延长。因而无论PD-L1表达情况如何,免疫联合化疗一线治疗可用于所有局部晚期或转移性食管癌的一线治疗。尽管本例患者TMB检测为低水平,但经信迪利单抗联合化疗治疗后病灶明显缩小,PET-CT检查放射性摄取未见异常,评价疗效持续为完全缓解,生存期得到延长。
2.2 免疫联合治疗方案可进行多方面探索作为全球性研究,KEYNOTE-590研究中的化疗方案为兼顾鳞癌和腺癌的5-氟尿嘧啶联合顺铂,中国临床实践中,由于病理分型以鳞癌为主导,更多采用针对鳞癌的紫杉类联合顺铂方案[7]。本例患者应用信迪利单抗+白蛋白结合型紫杉醇+洛铂方案取得完全缓解,这一方案在中国人群中的疗效仍待大样本临床研究验证。治疗中,患者完全缓解后的下一步计划,仍需更多循证证据的指导。本例拟给予免疫单药维持联合局部放疗,MDT会诊建议无明确肿瘤残留, 暂不考虑放疗,目前患者免疫单药维持治疗,但维持治疗时间仍不明确。本病例提示,尽管免疫联合化疗的疗效已获得认可,但如何优化方案、免疫联合化疗采用序贯或同时用药以及药物使用剂量等仍需进一步探索,以期为患者带来更多生存获益。
2.3 免疫联合化疗中国人群获益更显著既往KEYNOTE-181研究免疫单药二线治疗晚期食管癌患者研究中,经帕博利珠单抗(200 mg,每3周1次)治疗, 中国患者OS生存获益高于欧美患者(中国患者:HR=0.55,95%CI:0.37~0.83;全球患者:HR=0.75,95%CI:0.61~0.93)[11]。KEYNOTE-590研究再次表明,亚洲患者OS生存获益高于非亚洲患者(亚洲:HR=0.64,95%CI:0.51~0.81;非亚洲OS:HR=0.83,95%CI:0.66~1.05)[5]。该研究入组亚洲患者占整体患者比例 > 50%,入组中国患者占比超过亚洲人群的50%, 多数患者特征与我国食管癌人群一致,其结果对于指导国内的食管癌临床实践更具实际意义。
2.4 早期应用免疫治疗可能带来更优的疗效KEYNOTE-590研究中免疫联合化疗方案治疗晚期食管癌患者的ORR达到45.0%,优于化疗组(29.3%),24个月时肿瘤持续缓解人数是化疗组的3倍[5]。高ORR提示肿瘤降期可能性增加,如果应用于新辅助治疗,可提高手术切除的概率,增加食管癌患者获得长期生存获益甚至治愈的可能。这预示基于免疫治疗的新辅助联合治疗,尤其是免疫联合化疗新辅助治疗存在较好的疗效前景。在疾病早期阶段,免疫耗竭状态的可能性更小,对免疫治疗的反应更好,早期应用免疫治疗可带来更优的疗效。
综上所述,临床研究中免疫联合化疗在辅助治疗、新辅助治疗和一线治疗中的探索可能进一步改变患者治疗结局,使食管癌治疗全方位步入免疫治疗时代。本例患者经治疗后获得完全缓解,显著提高生活质量,改善患者预后。同时仍有一些临床决策如治疗方案如何优化等需要更多数据支持,也是未来研究和探索的方向。
| [1] |
赵学科, 雷玲玲, 徐瑞华, 等. 食管鳞癌并发结直肠腺癌73例临床病理特征[J]. 实用肿瘤杂志, 2020, 35(5): 396-401. |
| [2] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. Ca-Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [3] |
陈茹, 郑荣寿, 张思维, 等. 2015年中国食管癌发病和死亡情况分析[J]. 中华预防医学杂志, 2019, 53(11): 1094-1097. |
| [4] |
Yamamoto S, Kato K. Immuno-oncology for esophageal cancer[J]. Future Oncol, 2020, 16(32): 2673-2681. DOI:10.2217/fon-2020-0545 |
| [5] |
Kato JS, Shah MA. Pembrolizumab plus chemotherapy versus chemotherapy as first-line therapy in patients with advanced esophageal cancer: the phase 3 KEYNOTE-590 study[J]. Ann Oncol, 2020, 31(Suppl 4): LBA8. |
| [6] |
宋昕, 韩文莉, 王盼盼, 等. 食管鳞癌、贲门腺癌和结肠腺癌高频突变基因谱比较[J]. 实用肿瘤杂志, 2020, 35(5): 401-407. |
| [7] |
国家卫生健康委员会. 食管癌诊疗规范(2018年版)[J]. 中华消化病与影像杂志: 电子版, 2019, 9(4): 158-192. DOI:10.3877/cma.j.issn.2095-2015.2019.04.005 |
| [8] |
Ajani JA, D'Amico TA, Bentrem DJ, et al. NCCN Clinical Practice Guidelines in oncology-esophageal and esophagogastric junction cancers (2020 version 5)[EB/OL]. (2020-12-23)[2020-12-27]. http://www.nccn.org.
|
| [9] |
郝捷, 李进, 马军, 等. 中国临床肿瘤学会(CSCO)食管癌诊疗指南2020[M]. 北京: 人民卫生出版社, 2020: 72.
|
| [10] |
Yarchoan M, Hopkins A, Jaffee EM. Tumor mutational burden and response rate to PD-1 inhibition[J]. N Engl J Med, 2017, 377(25): 2500. DOI:10.1056/NEJMc1713444 |
| [11] |
Chen J, Luo S, Qin S, et al. Pembrolizumab vs chemotherapy in patients with advanced/metastatic adenocarcinoma (AC) or squamous cell carcinoma (SCC) of the esophagus as second-line therapy: Analysis of the Chinese subgroup in KEYNOTE-181[J]. Ann Oncol, 2019, 30(Suppl 5): mdz247.086. |
 2021, Vol. 36
2021, Vol. 36


