文章信息
- 邹攀, 许红淼, 熊雨, 苏芮, 罗欢, 罗晶婧, 蔺婷, 王贤文, 何迎春
- Zou Pan, Xu Hongmiao, Xiong Yu, Su Rui, Luo Huan, Luo Jingjing, Lin Ting, Wang Xianwen, He Yingchun
- 基于免疫核心基因的喉鳞状细胞癌风险评分模型的建立
- Establishment of a risk score model for laryngeal squamous cell carcinoma based on immune hub genes
- 实用肿瘤杂志, 2022, 37(1): 44-49
- Journal of Practical Oncology, 2022, 37(1): 44-49
基金项目
- 国家自然科学基金(81874408,81973914);湖南省自然科学基金(2019JJ40216,2020JJ5419);中医药防治眼耳鼻咽喉疾病湖南省重点实验室开放基金(2018YZD04);湖南中医药大学基础医学一流学科开放基金(2018JCYX08)
-
通信作者
- 何迎春,E-mail:yingchunhe@aliyun.com
-
文章历史
- 收稿日期:2021-02-04
2. 湖南中医药大学医学院, 湖南 长沙 410208;
3. 中医药防治眼耳鼻咽喉疾病湖南省重点实验室, 湖南 长沙 410208;
4. 湖南省中医药防治眼耳鼻咽喉疾病与视功能保护工程技术研究中心, 湖南 长沙 410208;
5. 湖南中医药大学第一附属医院耳鼻喉-头颈外科, 湖南 长沙 410007
2. School of Medicine, Hunan University of Chinese Medicine, Changsha 410208, China;
3. Hunan Provincial Key Laboratory for the Prevention and Treatment of Ophthalmology and Otolaryngology Diseases with Traditional Chinese Medicine, Changsha 410208, China;
4. Hunan Provincial Ophthalmology and Otolaryngology Diseases Prevention and Treatment with Traditional Chinese Medicine and Visual Function Protection Engineering and Technological Research Center, Changsha 410208, China;
5. Department of Otolaryngology-Head and Neck Surgery, the First Hospital of Hunan University of Chinese Medicine, Changsha 410007, China
国际癌症研究机构(International Agency for Research on Cancer,IARC)发布的2018年《全球癌症报告》[1]指出,2018年全球新增癌症患者1 810万例,死亡例数达960万。头颈部鳞状细胞癌(squamous cell carcinoma of the head and neck,HNSCC)是全球第九大最常见的癌症。喉鳞状细胞癌(laryngeal squamous cell carcinoma,LSCC)是头颈部常见的恶性肿瘤,具有如酗酒或吸烟等明确危险因素[2]。2018年LSCC新增病例1.2万例。尽管在LSCC研究上投入了大量时间和精力,但CO2激光辅助经口手术[3-4]、开放性重建技术[5]、经口机器人手术[6]和放化疗[7]等新的治疗方法并没有显著改善患者的预后[8]。因此,迫切需要建立用于LSCC生存风险预测的新模型,从而为患者提供更有效和个性化的治疗。
对恶性肿瘤的认识,从传统的中心细胞癌转变成为融合了肿瘤微环境及其免疫成分的全新整体视野。肿瘤免疫学作为一种更体现个性化的新兴医学专业,旨在提高免疫系统针对过度表达或仅由肿瘤细胞表达的分子的抗肿瘤反应[9]。宿主的免疫系统强烈地影响着恶性肿瘤的发生和发展,免疫细胞的浸润已被证实为肺癌[10]、结直肠癌[11]和乳腺癌[12]等多种实体肿瘤的预后因素。已知恶性肿瘤可以通过多重机制逃避免疫系统,其中,程序性细胞死亡配体1(programmed-cell death ligand 1,PD-L1)通路被肿瘤细胞用来抑制抗肿瘤免疫反应而被认为其可作为治疗靶点,2016年,美国食品和药物管理局(Food and Drug Administration,FDA)批准了程序性死亡受体1(programmed death 1,PD-1)作为单一药物用于肿瘤表达PD-L1而铂类难治性HNSCC患者[13]。但HNSCC的免疫和抗免疫因子之间及其与免疫微环境的确切相互作用研究甚少。
随着计算机技术的飞速发展,多种生物信息学方法被开发来筛选预测各种基因和蛋白等指标进行多维度深层次分析。本文借助癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库中LSCC的转录组测序信息,分析免疫细胞浸润和免疫相关基因,进一步分析其与LSCC预后的相关性,探究其在LSCC中的重要作用,为LSCC寻找新的治疗靶点。
1 资料与方法 1.1 数据来源和数据处理2020年7月23日从TCGA数据库(https://portal.gdc.cancer.gov)下载LSCC的样本全转录组RNA-seq数据和临床相关病理学参数数据。选择年龄、性别、T分期、N分期、肿瘤分级和总生存期(overall survival,OS)等数据完整的肿瘤样本111例和12例配对正常样本共123例纳入下一步分析。111例肿瘤样本中,男性95例,女性16例;年龄38~83岁,中位年龄61.8岁。12例正常样本中,男性9例,女性3例;年龄45~72岁,中位年龄65.3岁。利用R软件中的“limma”包进行LSCC组织及癌旁组织差异表达基因分析,筛选出LSCC中的差异表达基因。
1.2 免疫相关核心基因的筛选2020年7月23日从ImmPort数据库(https://www.immport.org/shared/home)中导出已被证实的2 466个免疫相关基因。将免疫相关基因与LSCC差异表达基因取交集,通过单因素Cox回归分析获得与OS相关的免疫核心基因。
1.3 风险评分模型的构建及验证利用单因素及多因素Cox风险回归筛选LSCC患者预后的独立因素,根据风险评分公式计算每例LSCC患者的风险评分[14]:风险评分(risk score)=βmRNA1×mRNA1表达水平+βmRNA2×mRNA2表达水平+…+βmRNAn×mRNAn表达水平(β为Cox回归系数),并根据中位数将该LSCC患者分为高风险组和低风险组,应用R软件中“survival”包采用Kaplan-Meier法对高风险组和低风险组进行生存分析,并应用R软件中“survivcomp”包绘制受试者工作特征(receiver operating characteristic,ROC)曲线并计算曲线下面积(area under curve,AUC)来评价风险评分模型的预测能力。
1.4 统计学分析采用R软件(v3.6.3)进行数据分析。生存分析采用Kaplan-Meier和Log-rank检验法。以P<0.05为差异具有统计学意义。
2 结果 2.1 免疫相关差异基因的筛选对LSCC组织与癌旁组织进行差异表达分析发现共6 800个差异表达基因,其中4 787个基因表达上调,2 013个基因表达下调(图 1A~1B)。将这6 800个差异表达基因与来自ImmPort的2 466个免疫相关基因取交集,共筛选出387个差异表达的免疫相关基因,其中270个基因表达上调,117个基因表达下调(图 1C~1D)。
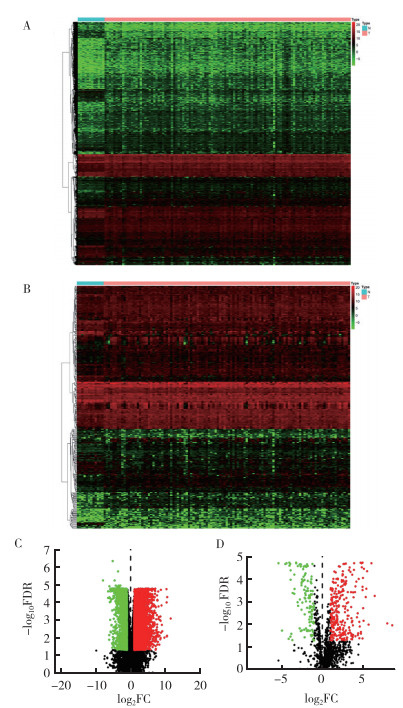
|
| 注 A:LSCC组织与癌旁组织差异表达基因的热图;B:LSCC组织与癌旁组织差异表达免疫相关基因的热图;C:LSCC组织与癌旁组织差异表达基因的火山图;D:LSCC组织与癌旁组织差异表达免疫相关基因的火山图;红点表示表达上调基因;绿点表示表达下调基因;FDR:错误发现率(false discovery rate);FC:差异倍数(fold change) 图 1 LSCC组织与癌旁组织差异表达基因及差异表达免疫相关基因的热图和火山图 Fig.1 Heatmap and volcano map of differentially expressed genes between LSCC tissues and adjacent tissues |
为了减少采样偏倚,将111例LSCC患者中OS>3个月或随访时间>3个月的患者共108例纳入后续生存相关分析。108例患者中,男性93例,女性15例;年龄41~80岁,中位年龄62.2岁。通过单因素Cox回归分析获得与LSCC患者OS相关的免疫核心基因34个(表 1),其中STC2和TUBB3免疫核心基因的P<0.01和HR>1提示其为高风险基因,且基因表达越高,风险越大,可能OS越短,也说明其与LSCC预后相关。
| ID | HR | P值 | ID | HR | P值 | |
| STC2 | 1.000 | <0.01 | TFRC | 1.000 | 0.020 | |
| TUBB3 | 1.001 | 0.001 | ZAP70 | 0.999 | 0.020 | |
| PDGFA | 1.000 | 0.001 | RAET1L | 1.000 | 0.025 | |
| TLR2 | 1.000 | 0.001 | PPBP | 1.002 | 0.025 | |
| ARG2 | 1.001 | 0.002 | PLAUR | 1.000 | 0.027 | |
| FCGR3B | 1.001 | 0.003 | SEMA6D | 1.000 | 0.027 | |
| AHNAK | 1.000 | 0.003 | PGLYRP1 | 1.023 | 0.028 | |
| RBP1 | 1.000 | 0.004 | INHBA | 1.000 | 0.029 | |
| CCL2 | 1.000 | 0.009 | IL1B | 1.000 | 0.031 | |
| OSM | 1.001 | 0.009 | PDGFB | 1.000 | 0.031 | |
| AQP9 | 1.000 | 0.009 | SSTR1 | 1.012 | 0.031 | |
| PAEP | 1.002 | 0.011 | GAL | 1.001 | 0.036 | |
| FPR2 | 1.001 | 0.012 | FGA | 1.005 | 0.042 | |
| CXCL11 | 1.000 | 0.012 | EPO | 0.990 | 0.045 | |
| IL17F | 1.030 | 0.013 | LTBP1 | 1.000 | 0.046 | |
| IL22 | 1.021 | 0.014 | PPARG | 1.001 | 0.049 | |
| PROK2 | 1.001 | 0.014 | FCN2 | 0.670 | 0.049 |
基于上述预后相关免疫核心基因建立风险评分模型公式计算出LSCC患者风险评分,根据中位数将患者分成高风险组和低风险组(图 2)。利用Log-rank检验对两组进行Kaplan-Meier分析,结果表明,高风险组患者OS短于低风险组(P<0.01,图 3A)。绘制ROC曲线评价风险评分模型对LSCC预后的预测能力。该风险评分模型预测LSCC患者5年OS率的AUC值为0.930(图 3B),提示该模型具有良好的5年OS率预测能力。
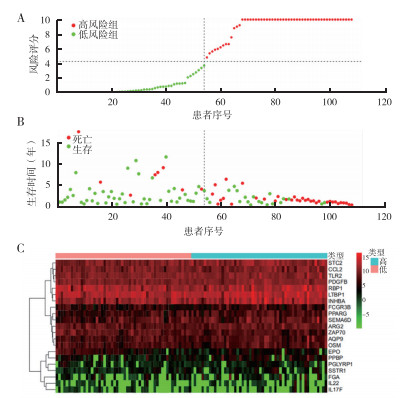
|
| 注 A:108例入组患者风险评分;B:随访终点高风险组和低风险组患者生存情况;C:免疫核心基因与风险等级火山图 图 2 基于预后相关免疫核心基因的风险评分模型 Fig.2 Risk scoring model based on prognostic-related immune hub genes |
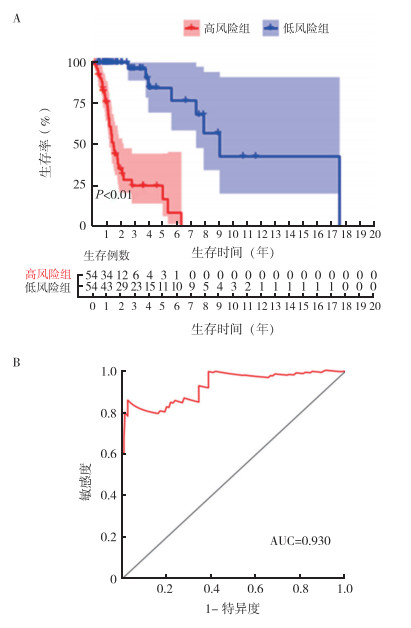
|
| 注 A:高风险组和低风险组患者生存曲线;B:5年生存预测的ROC曲线 图 3 高风险组和低风险组患者的生存曲线及5年生存相关ROC曲线 Fig.3 Survival curves and ROC curves for 5-year survival of patients in the high-risk and low-risk groups |
为进一步验证该模型能否独立预测LSCC的预后,本研究结合临床病理学参数进行多因素Cox回归分析。结果显示,患者性别是LSCC预后的保护因素、N分期晚和高风险评分为LSCC预后的危险因素(P<0.05),而患者年龄和T分期与LSCC预后无关(P>0.05,图 4)。
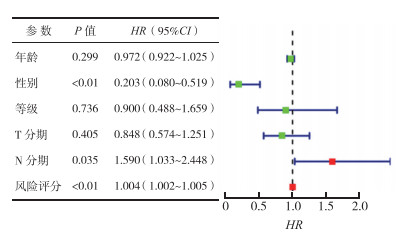
|
| 图 4 患者临床参数Cox回归的森林图 Fig.4 Forest plots for Cox regression analysis of clinical parameters |
利用生物信息学技术对现有的数据库信息进行再次挖掘和整理是目前探索肿瘤发病机制的有效方法之一。慕之勇等[15]利用TCGA数据库及生物学信息分析方法分别对肝细胞癌免疫相关基因进行筛选,并对其预后进行分析。本文采用相同的数据挖掘方法,对LSCC这一生物多样性和基因组异质性疾病进行研究,系统地筛选了LSCC预后差异表达基因,且筛选出34个预后相关免疫核心基因,根据免疫核心基因构建了一个有效的风险评分模型,并对该模型进行了初步验证。
炎性反应和免疫功能紊乱对肿瘤微环境的影响在实质肿瘤的发生和发展中起着至关重要的作用[16]。免疫疗法旨在增强免疫系统的活性以根除癌细胞[17]。免疫治疗通过激活人体本身的免疫系统,依靠自身的免疫功能作用于恶性肿瘤细胞,目前已在多种肿瘤如非小细胞肺癌[18]和口腔癌[19]等实体瘤的治疗中展示出强大的抗肿瘤活性。多个肿瘤免疫治疗药物已经获得美国FDA批准临床应用。而随着技术的进步,人们逐渐了解到肿瘤微环境的免疫环境的复杂性和多样性以及其对免疫治疗的重要影响,通过进一步分析和了解肿瘤免疫微环境将有助于免疫治疗反应的改善。
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)是一类广泛有效的免疫疗法[20],可阻断抑制性免疫检查点途径,以重新激活针对癌症的免疫应答,PD-L1作为一种生物标志物已经被广泛分析[21],并且在多个实体瘤中显示出中等的预测价值[22]。有研究应用免疫组织化学方法检测PD-L1在LSCC、癌旁和声带白斑组织中的表达发现,PD-L1在LSCC组织中的表达高于癌旁组织,且与LSCC分期、组织学分化及颈部淋巴结转移密切相关[23]。
本研究还发现,免疫相关基因STC2和TUBB3可能与LSCC免疫调控有关。国内外研究也表明,STC2和TUBB3的表达与肿瘤患者的预后密切相关,其高表达导致乳腺癌、鼻咽癌、子宫颈癌和胃癌的不良预后[24-27]。LSCC组织中STC2蛋白的表达与侵袭甲状腺软骨、T分期、淋巴转移、临床分期和病理分化有关,循环中的STC2 mRNA可能是有用的血液标志物,而STC2蛋白可能是LSCC术后不良结局的预后标志物[28]。
综上所述,基于TCGA数据库,本研究通过对LSCC的表达数据进行生物信息学分析共筛选出387个差异表达基因和34个预后相关免疫核心基因,进一步对免疫核心基因进行单因素分析得到生物标志物STC2和TUBB3。基于免疫核心基因构建的风险评分模型中为探索LSCC免疫治疗的靶点提供新的思路。然而免疫核心基因作用的分子机制和相关信号传导通路及免疫细胞在LSCC中的作用尚不清楚,这需要进一步研究探索。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 70(4): 313. |
| [2] |
Zygogianni AG, Kyrgias G, Karakitsos P, et al. Oral squamous cell cancer: early detection and the role of alcohol and smoking[J]. Head Neck Oncol, 2011, 3(1): 2. DOI:10.1186/1758-3284-3-2 |
| [3] |
Lucioni M, Marioni G, Bertolin A, et al. Glottic laser surgery: outcomes according to 2007 ELS classification[J]. Eur Arch Oto-rhino-laryngol, 2011, 268(12): 1771. DOI:10.1007/s00405-011-1695-7 |
| [4] |
Lovato A, Franz L, Carraro V, et al. Maspin expression and anti-apoptotic pathway regulation by bcl2 in laryngeal cancer[J]. Ann Diagn Pathol, 2020, 45: 151471. DOI:10.1016/j.anndiagpath.2020.151471 |
| [5] |
乐慧君, 陈思宇, 李芸, 等. 喉癌诊疗策略及进展[J]. 临床耳鼻咽喉头颈外科杂志, 2019, 487(11): 14-18. |
| [6] |
黄晓明. 机器人辅助下咽喉头颈外科手术的进展[J]. 临床耳鼻咽喉头颈外科杂志, 2018, 32(14): 1043-1047. |
| [7] |
Colevas AD, Yom SS, Pfister DG, et al. NCCN Guidelines insights: Head and neck cancers, version 1.2018[J]. Nat Compr Cancer Netw, 2018, 16(5): 479-490. DOI:10.6004/jnccn.2018.0026 |
| [8] |
Gatta G, Botta L, Sánchez MJ, et al. Prognoses and improvement for head and neck cancers diagnosed in Europe in early 2000s: The EUROCARE-5 population-based study[J]. Eur J Cancer, 2015, 51(15): 2130-2143. DOI:10.1016/j.ejca.2015.07.043 |
| [9] |
Zinzindohoue F, Zeitoun G, Berger A, et al. Immunology and personalized medicine in oncology[J]. Bull Cancer, 2014, 101(Suppl): 12-17. |
| [10] |
Bremnes RM, Busund LT, Kilv RTL, et al. The role of tumor infiltrating lymphocytes in development, progression and prognosis of non-small cell lung cancer[J]. J Thorac Oncol, 2016, 11(6): 789-800. DOI:10.1016/j.jtho.2016.01.015 |
| [11] |
Gunnarsson U, Strigård K, Edin S, et al. Association between local immune cell infiltration, mismatch repair status and systemic inflammatory response in colorectal cancer[J]. Transl Med, 2020, 18(1): 178. DOI:10.1186/s12967-020-02336-6 |
| [12] |
Desmedt C, Salgado R, Fornili M, et al. Immune infiltration in invasive lobular breast cancer[J]. J Natl Cancer Inst, 2018, 110(7): 768-776. DOI:10.1093/jnci/djx268 |
| [13] |
Cohen EEW, Bell RB, Bifulco CB, et al. The Society for Immunotherapy of Cancer consensus statement on immunotherapy for the treatment of squamous cell carcinoma of the head and neck (HNSCC)[J]. J Immunother Cancer, 2019, 7(1): 184. DOI:10.1186/s40425-019-0662-5 |
| [14] |
何林秀. 基于生物信息学的高级别浆液性卵巢癌铂类耐药相关基因筛选及预后分析[D]. 辽宁: 中国医科大学药理学, 2018.
|
| [15] |
慕之勇, 王文生, 朱建儒, 等. 肝细胞癌免疫相关基因与预后: 基于TCGA生物信息学分析[J]. 胃肠病学和肝病学杂志, 2020, 29(6): 610-617. DOI:10.3969/j.issn.1006-5709.2020.06.003 |
| [16] |
Hanahan D, Weinberg RA. Hallmarks of cancer: The next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [17] |
Farkona S, Diamandis EP, Blasutig IM. Cancer immunotherapy: the beginning of the end of cancer[J]. BMC Med, 2016, 14(1): 1-18. DOI:10.1186/s12916-015-0545-7 |
| [18] |
Patel SP, Kurzrock R. PD-L1 expression as a predictive biomarker in cancer immunotherapy[J]. Mol Cancer Therapeut, 2015, 14(4): 847-856. DOI:10.1158/1535-7163.MCT-14-0983 |
| [19] |
Hartner L. Chemotherapy for oral cancer[J]. Dent Clin North Am, 2018, 62(1): 87-97. DOI:10.1016/j.cden.2017.08.006 |
| [20] |
赵菁, 胡涵光, 翁姗姗, 等. 免疫检查点抑制剂在结直肠癌中的研究进展[J]. 实用肿瘤杂志, 2020, 35(6): 13-18. |
| [21] |
徐一清, 刘勇. PD-1/PD-L1抑制剂免疫相关不良反应的研究进展[J]. 实用肿瘤杂志, 2020, 35(6): 19-22. |
| [22] |
Carbognin L, Pilotto S, Milella M, et al. Differential activity of nivolumab, pembrolizumab and MPDL3280A according to the tumor expression of programmed death-ligand-1(PD-L1): Sensitivity analysis of trials in melanoma, lung and genitourinary cancers[J]. PLoS One, 2015, 10(6): e0130142. DOI:10.1371/journal.pone.0130142 |
| [23] |
Yu D, Cheng J, Xue K, et al. Expression of programmed death-ligand 1 in laryngeal carcinoma and its effects on immune cell subgroup infiltration[J]. Pathol Oncol Res, 2018, 25(4): 1437-1443. |
| [24] |
Jiang ST, Wang HQ, Yang TC, et al. Expression of stanniocalcin 2 in breast cancer and its clinical significance[J]. Curr Med Sci, 2019, 39(6): 978-983. DOI:10.1007/s11596-019-2131-2 |
| [25] |
Lin S, Guo Q, Wen J, et al. Survival analyses correlate stanniocalcin 2 overexpression to poor prognosis of nasopharyngeal carcinomas[J]. J Exp Clin Cancer Res, 2014, 33(1): 26. DOI:10.1186/1756-9966-33-26 |
| [26] |
Zwenger AO, Gabriel G, Julian I, et al. Expression of ERCC1 and TUBB3 in locally advanced cervical squamous cell cancer and its correlation with different therapeutic regimens[J]. Int J Biol Markers, 2015, 30(3): 301-314. DOI:10.5301/jbm.5000161 |
| [27] |
管福军, 方志华, 任立群, 等. 抑制TUBB3基因表达对胃癌细胞增殖、凋亡、侵袭和迁移的影响及机制研究[J]. 国际消化病杂志, 2019, 39(5): 329-334. DOI:10.3969/j.issn.1673-534X.2019.05.006 |
| [28] |
Han Z, Li YY, Zhang WQ, et al. Expression of stanniocalcin-1 and stanniocalcin-2 in laryngeal squamous cell carcinoma and correlations with clinical and pathological parameters[J]. PLoS One, 2014, 9(4): e95466. DOI:10.1371/journal.pone.0095466 |
 2022, Vol. 37
2022, Vol. 37


