文章信息
- 唐杰, 陈重
- 男性肺腺癌对侧乳腺转移超声造影一例
- 实用肿瘤杂志, 2022, 37(4): 367-368
-
通信作者
- 陈重,E-mail:652167125@qq.com
-
文章历史
- 收稿日期:2021-09-21
患者男性,57岁,于2021年6月4日到西部战区总医院就诊,主诉为“右侧腋窝包块4个月余,切除后复发2个月伴皮肤溃疡”,既往病史无。查体示,右侧腋窝包块伴皮肤溃疡,右侧乳头无凹陷溢液,右侧乳晕区及右胸壁皮肤局限性增厚呈褐色,质硬。超声检查示,右乳外下象限乳晕深面低回声区,范围约24.0 mm×12.0 mm,边界较清,形态不规则,分叶状,内见微小钙化(图 1),彩色多普勒显示低回声区内少许点状血流信号,周边软组织增厚、回声增强;右侧腋窝多发淋巴结肿大,较大者约27.0 mm×12.0 mm,部分呈融合状。常规超声诊断:(1)右乳外下象限乳晕深面极低回声区伴微小钙化,根据乳腺影像报告和数据系统(Breast Imaging Reporting And Data System,BI-RADS)分级:4c类,男性乳腺癌待排;(2)右侧腋窝淋巴结肿大, 考虑转移性。超声造影显示病灶整体为不均匀低增强,增强后边界欠清,形态欠规则,提示恶性可能(图 2)。于2021年6月14日局麻下行右乳晕深面低回声区及右腋窝肿大淋巴结穿刺活检术。实验室检查示,糖类抗原125(carbohydrate antigen 125,CA125)160.4 U/mL(参考值< 35 U/mL);癌胚抗原366.5 ng/mL(参考值< 7.2 ng/mL)。病理检查示,低分化腺癌,排除转移来源后可考虑乳腺导管来源(图 3);免疫组织化学检查示(图 4),雌激素受体(-),孕激素受体(-),人类表皮生长因子受体2(++),转录因子GATA3(+),巨囊性病液体蛋白(+),Ki-67(+,30%),CK5/6(+),CK7(+),CK8/18(+),E-cadherin(+),p63(-),甲状腺转录因子1(-),WT-1(-)。行胸腹部增强CT检查示,左肺上叶尖后段占位伴肺内转移。于2021年6月20日行肺部结节穿刺活检,病理检查示,肺非小细胞癌。结合2处病灶的病理检查结果最终确诊为左肺上叶周围型肺腺癌伴远处转移(对侧乳腺及腋窝淋巴结转移)。
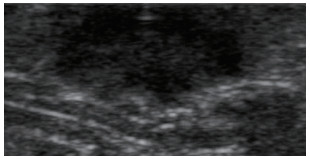
|
| 注 病灶表现为极低回声,边界较清,形态欠规则,呈分叶状 图 1 男性肺腺癌对侧乳腺转移患者右乳晕深面病灶二维超声检查结果 |
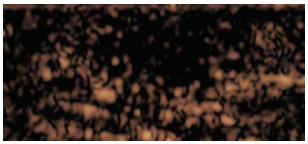
|
| 注 病灶表现为整体不均匀低增强,边界欠清,形态欠规则,内较多充盈缺损 图 2 男性肺腺癌对侧乳腺转移患者右乳晕深面病灶超声造影检查结果 |
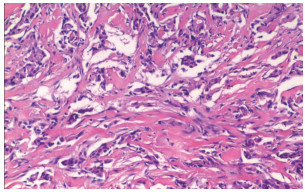
|
| 注 病灶纤维组织中条索状分布的异型癌细胞,倾向低分化型 图 3 男性肺腺癌对侧乳腺转移患者右乳晕深面病灶组织病理检查结果(HE×200) |
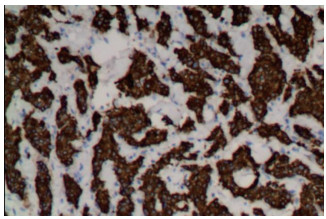
|
| 注 病灶组织细胞角蛋白8/18(+),提示上皮细胞来源,考虑腺癌 图 4 男性肺腺癌对侧乳腺转移患者右乳晕深面病灶组织免疫组织化学检查结果 |
乳腺继发性肿瘤少见,约占乳腺恶性肿瘤的0.2%~7.0%,而男性乳腺继发性肿瘤更罕见,查阅国内外文献只有几例相关报道,与女性比较,男性乳腺缺乏腺小叶只有少量导管和纤维脂肪组织,发生转移性恶性肿瘤概率很小。肺癌常见转移部位为肺、脑和肝等部位,转移病理类型主要为小细胞癌,其次为腺癌和鳞癌。乳腺继发性肿瘤多为对侧乳腺癌转移,主要病理类型为浸润性导管癌,因此男性肺腺癌转移至对侧乳腺实属罕见[1-6]。分析本例肺癌远处转移至对侧乳腺途径可能为胸内淋巴转移或肿瘤细胞通过胸导管进入静脉经体循环转移,也可能经血行转移至对侧乳腺[7-8]。病理上不能根据癌细胞形态学区分原发性和继发性,只能结合免疫组织化学检查区分癌细胞来源。
乳腺继发性肿瘤临床表现多样[1-4],与其他转移癌易转移至肌层不同[8],本例男性乳腺转移癌病灶位置浅表,与肌层界限清晰而与皮肤脂肪层关系密切。本病灶常规超声具有典型恶性征象(图 3),极低回声,边界较清,形态欠规则,呈分叶状,有微小钙化,周边软组织增厚、回声增强,伴同侧胸壁及腋窝淋巴结肿大,根据乳腺BI-RADS分类标准可分为4类及以上,具有穿刺活检指征不易漏诊,这与已有研究对乳腺继发性恶性肿瘤超声图像的研究结果相符[2, 5-10],但常规超声表现很难鉴别病灶为原发性或转移性。原发性乳腺癌超声造影具有典型特征:高增强为主,增强后边界不清,形态不规则,边界呈蟹足样,增强后病灶明显大于二维超声显示范围,病灶较大时内部有充盈缺损[5]。转移性乳腺癌超声造影表现国内外目前无相关报道。本例病灶造影表现与原发性乳腺癌明显不同,病灶从周边开始增强,增强方式为向心性,整体为不均匀低增强,增强后边界欠清,形态欠规则,增强后病灶范围无明显变化,即使病灶较小内部仍有较多充盈缺损(图 4),病灶内造影剂退出时间较周边软组织早。继发性乳腺肿瘤目前数量较少无法总结其超声造影的图像特点,主要依靠病理诊断。本病例报道旨在提高对转移性乳腺癌超声图像的认识,尤其老年男性发现乳腺恶性肿块时诊断需提高警惕,应综合考虑到转移癌可能。
| [1] |
Koch A, Richter-Marot A, Wissler MP, et al. Mammary metastasis of extramammary cancers: current knowledge and diagnostic difficulties[J]. Gynecol Obstet Fertil, 2013, 41(11): 653-659. DOI:10.1016/j.gyobfe.2013.09.013 |
| [2] |
万雪, 彭玉兰. 肺癌乳腺转移超声图像特点并文献复习[J]. 中华医学超声杂志: 电子版, 2020, 17(2): 169-171. DOI:10.3877/cma.j.issn.1672-6448.2020.02.015 |
| [3] |
Guerrouaz MA, Samba S, BenSghier A, et al. Breast metastasis from a non-small cell lung cancer: a case report[J]. Cureus, 2020, 12(3): e7460. |
| [4] |
Ishikawa Y, Tabei I, Fushimi A, et al. Male breast metastasis of ureteral cancer: a case report[J]. Surg Case Rep, 2020, 6(1): 58. DOI:10.1186/s40792-020-00804-1 |
| [5] |
谢玉蓉, 龙力, 席珊珊, 等. 男性乳腺发育症和男性乳腺癌的X线和超声影像分析[J]. 肿瘤影像学, 2018, 27(3): 193-197. |
| [6] |
周雪雁, 潘晓芳, 张博, 等. 三维剪切波弹性成像定量参数与乳腺癌组织学预后因素的关系[J]. 实用肿瘤杂志, 2021, 36(6): 566-571. |
| [7] |
吴均, 任晓秋, 俞勇, 等. 男性乳腺癌临床病理特征及预后分析[J]. 实用肿瘤杂志, 2020, 35(6): 517-523. |
| [8] |
沈松杰, 韩志军, 于双妮, 等. 乳腺癌合并恶性肺结节: 乳腺癌肺转移? 还是乳腺和肺双原发癌?[J]. 协和医学杂志, 2020, 11(1): 109-114. |
| [9] |
王豪, 宋嫣. 男性乳腺癌并腹壁肌层转移超声表现1例[J]. 中国超声医学杂志, 2019, 35(2): 191. DOI:10.3969/j.issn.1002-0101.2019.02.034 |
| [10] |
徐茂林, 李芳, 刘玉林, 等. 肺腺癌乳腺转移超声及MRI表现1例[J]. 中国临床医学影像杂志, 2019, 30(3): 227-228. |
 2022, Vol. 37
2022, Vol. 37


