文章信息
- 袁梦依, 王培山, 孟瑞霞, 杨建军, 周成茂, 刘国胜
- Yuan Mengyi, Wang Peishan, Meng Ruixia, Yang Jianjun, Zhou Chengmao, Liu Guosheng
- 术后淋巴细胞数与单核细胞数的比值对合并高血压的肺癌患者手术预后的预测价值
- Prognostic value of postoperative lymphocyte-to-monocyte ratio in lung cancer patients with hypertension
- 实用肿瘤杂志, 2023, 38(1): 26-32
- Journal of Practical Oncology, 2023, 38(1): 26-32
基金项目
- 河南省医学科技攻关计划项目(2018020936)
-
通信作者
- 王培山, E-mail: wangpeishan168@126.com
-
文章历史
- 收稿日期:2021-10-25
2. 新乡市中心医院麻醉科, 河南 新乡 453000;
3. 郑州大学第一附属医院麻醉科, 河南 郑州 450000
2. Department of Anesthesiology, Xinxiang Central Hospital, Xinxiang 453000, China;
3. Department of Anesthesiology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450000, China
肺癌是世界范围内发病率和死亡率皆高的恶性肿瘤之一[1]。高血压是世界疾病负担和死亡率的最大影响因素,每年约940万例死亡,新发病例逐年增加[2]。目前,肺癌的治疗方式包括手术治疗(开胸/腔镜手术)、放化疗、靶向治疗和免疫治疗等多种方式。外科手术根治性切除是早期肺癌的首选治疗方式,术后的生存情况受多种因素影响。有研究表明,高血压对肺癌手术患者预后的影响可通过治疗药物如肾素血管紧张素系统阻断剂(renin-angiotensin system blockers,RASBs)等的使用对上皮-间质转化过程产生影响、抑制肿瘤的迁移和增殖从而改善预后,但高血压本身的直接影响尚未可知[3]。筛选影响合并高血压肺癌患者术后发生恶性转移或者良性转归的因素可作为目前的研究方向,为临床预后诊断及随访策略制定提供参考。高血压患者外周血液中存在明显的淋巴细胞和单核细胞系统的激活,是一个长期发展的慢性炎性反应过程[4]。炎性反应与肿瘤微环境的关系密切,可影响肿瘤的发生、发展、增殖和转移等多个过程[5-6]。本研究探索炎性反应指标淋巴细胞数与单核细胞数的比值(lymphocyte-to-monocyte ratio,LMR)对合并高血压的肺癌患者术后生存预后的影响价值。
1 资料与方法 1.1 一般资料选取2014年1月至2019年12月在新乡市中心医院行肺叶切除术的合并高血压的肺癌患者215例。纳入标准:(1)年龄≥18岁;(2)病理检查确诊为肺癌;(3)合并高血压疾病;(4)术前未进行新辅助化疗;(5)接受肺叶切除的全麻手术治疗。排除标准:(1)一般资料不全或失访的患者;(2)缺少术后1周内血液学检测指标的患者;(3)伴有术前感染或其他血液学或自身免疫性疾病;(4)术后伴严重肺部感染;(5)确诊时即为终末期,无手术治疗机会。
所有患者年龄30~80岁,(63±9)岁。其中男性127例,女性88例。所有患者在术前及术后1周内常规进行血液学检测,检查血常规,包括白细胞、红细胞、粒细胞、淋巴细胞和单核细胞等。根据术后第3天结果计算LMR。通过临床病历系统及麻醉科手麻系统,收集性别、年龄、体质量、饮酒史、吸烟史、出血量、麻醉时长、麻醉药物、肿瘤部位、肿瘤分期、肿瘤分化程度、术前及术后1周内血液学检测指标、术后住院时间和术后并发症等资料。本研究经过新乡市中心医院伦理审查委员会的批准,患者信息严格保密。
1.2 随访随访从患者手术结束出院开始,2年内每3个月随访1次,2年以后每半年或1年随访1次,直至随访终止日期(2021年7月30日)或者患者死亡日期。主要随访方式包括门诊及电话随访等,随访内容包括影像学检查(CT和MRI检查等)、血液学检查(血常规和肿瘤标志物等)、临床症状和生存及复发转移情况等。
1.3 观察指标主要观察指标是总生存期(overall survival,OS)和无进展生存期(progression-free survival,PFS),次要观察指标为术中出血量、术后住院时间和术后并发症。OS指患者从确诊疾病日期起至死亡日期或者随访终止日期。PFS指患者手术治疗日期至肿瘤复发或转移等发生疾病进展的日期。在随访过程中失访患者按照排除标准剔除。
1.4 统计学分析采用SPSS 25.0及易侕统计软件进行数据分析。通过绘制受试者工作特征(receiver operating characteristic,ROC)曲线确定LMR的最佳截断值,以该值为界点划分为高LMR组和低LMR组。应用Kaplan-Meier法绘制生存曲线,log-rank检验比较组间OS和PFS。计数资料采用频数(百分比)表示,组间比较采用χ2检验。计量资料采用均数±标准差(x±s)表示,组间比较采用两独立样本t检验。应用Cox比例风险回归模型单因素及多因素分析合并高血压的肺癌患者全麻手术治疗疗效及预后的独立危险因素。以P < 0.05为差异具有统计学意义。
2 结果 2.1 炎性反应指标的截断值术后LMR值预测合并高血压的肺癌患者手术预后的ROC曲线下面积(area under the curve,AUC)为0.608(图 1)。约登指数取最大值时(敏感度37.1%和特异度89.7%),LMR为2.14。以该值为LMR的最佳截断值分为高LMR组(n=67例)和低LMR组(n=148例)。
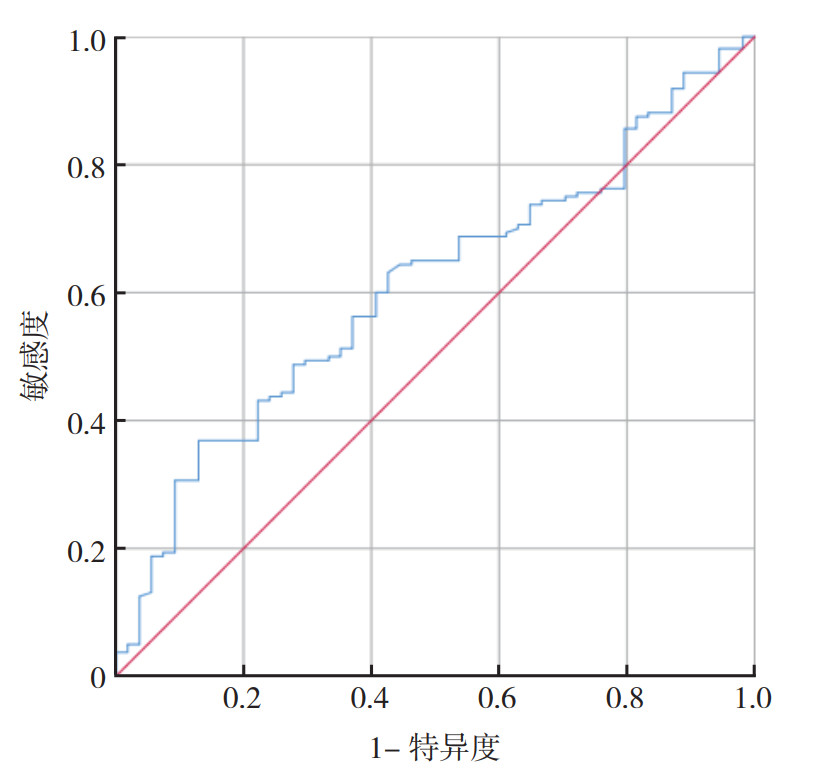
|
| 注 LMR:淋巴细胞数与单核细胞数的比值(lymphocyte-to-monocyte ratio) 图 1 术后LMR预测合并高血压的肺癌患者手术预后的的ROC曲线 Fig.1 ROC curve based on postoperative LMR predicting the prognosis of lung cancer patients with hypertension |
高LMR组和低LMR组患者在性别、术中出血量、手术及麻醉时长、肿瘤TNM分期和分化程度等方面比较,差异均具有统计学意义(均P < 0.05),而在住院时间上比较,差异无统计学意义(P > 0.05,表 1)。
| 临床特征 | 低LMR组(n=148) | 高LMR组(n=67) | P值 |
| 体质量(kg,x±s) | 64.1±10.5 | 66.6±10.7 | 0.170 |
| 手术时长(min,x±s) | 167.0±53.5 | 155.3±57.6 | 0.048 |
| 术中出血量(mL,x±s) | 199.5±281.4 | 133.1±174.1 | 0.004 |
| 术后住院时间(d,x±s) | 12.9±7.2 | 11.6±5.6 | 0.144 |
| 尿量(mL,x±s) | 293.2±146.2 | 304.5±135.3 | 0.638 |
| 性别 | 0.049 | ||
| 男性 | 94(63.5) | 33(49.3) | |
| 女性 | 54(36.5) | 34(50.7) | |
| 年龄 | 0.128 | ||
| < 60岁 | 38(25.7) | 24(35.8) | |
| ≥60岁 | 110(74.3) | 43(64.2) | |
| 肿瘤部位 | 0.952 | ||
| 右肺 | 89(60.1) | 40(59.7) | |
| 左肺 | 59(39.9) | 27(40.3) | |
| 右美托咪定 | 0.626 | ||
| 否 | 100(67.6) | 43(64.2) | |
| 是 | 48(32.4) | 24(35.8) | |
| 吸入麻醉药 | 0.512 | ||
| 否 | 37(25.0) | 14(20.9) | |
| 是 | 111(75.0) | 53(79.1) | |
| 麻醉时长 | 0.039 | ||
| < 3 h | 51(34.5) | 33(49.3) | |
| ≥3 h | 97(65.5) | 34(50.7) | |
| 分化程度 | 0.003 | ||
| 低分化 | 72(48.6) | 18(26.9) | |
| 中高分化 | 76(51.4) | 49(73.1) | |
| TNM分期 | 0.001 | ||
| Ⅰ~Ⅱ期 | 76(51.4) | 50(74.6) | |
| Ⅲ~Ⅳ期 | 72(48.6) | 17(25.4) | |
| 注 LMR:淋巴细胞数与单核细胞数的比值(lymphocyte-to-monocyte ratio) | |||
单因素分析显示,合并高血压的肺癌患者OS相关的临床因素是年龄、TNM分期、肿瘤分化程度、术前LMR、术后LMR、手术时长和术中出血量等(均P < 0.05,表 2);PFS相关的临床因素是TNM分期、肿瘤分化程度、术前LMR、术后LMR、吸入麻醉药、手术时长和术中出血量等(均P < 0.05)。Cox多因素分析显示,肿瘤TNM分期、术后LMR值和术中出血量均是患者OS及PFS的独立影响因素(均P < 0.05,表 3),而术前LMR不是患者OS和PFS的独立影响因素(均P > 0.05)。
| 变量 | 单因素分析 | 多因素分析 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 性别 | 0.591 | 0.174 | |||
| 男性 | 1.0 | 1.0 | |||
| 女性 | 0.9(0.5~1.5) | 1.6(0.8~3.0) | |||
| 年龄 | 0.048 | 0.081 | |||
| < 60岁 | 1.0 | 1.0 | |||
| ≥60岁 | 2.0(1.0~4.0) | 2.0(0.9~4.4) | |||
| 体质量 | 1.0(1.0~1.0) | 0.893 | 1.0(1.0~1.1) | 0.271 | |
| 手术时长 | 1.0(1.0~1.0) | 0.025 | 1.0(1.0~1.0) | 0.375 | |
| 术中出血量 | 1.0(1.0~1.0) | < 0.01 | 1.0(1.0~1.0) | 0.023 | |
| 术后住院时间 | 1.0(1.0~1.0) | 0.375 | 1.0(1.0~1.0) | 0.440 | |
| 尿量 | 1.0(1.0~1.0) | 0.082 | 1.0(1.0~1.0) | 0.099 | |
| 肿瘤部位 | 0.084 | 0.513 | |||
| 右肺 | 1.0 | 1.0 | |||
| 左肺 | 0.6(0.3~1.1) | 0.8(0.4~1.6) | |||
| 右美托咪定 | 0.129 | 0.073 | |||
| 否 | 1.0 | 1.0 | |||
| 是 | 0.6(0.3~1.2) | 0.5(0.2~1.1) | |||
| 吸入麻醉药 | 0.145 | 0.569 | |||
| 否 | 1.0 | 1.0 | |||
| 是 | 0.7(0.4~1.2) | 0.8(0.4~1.6) | |||
| 麻醉时长 | 0.141 | 0.976 | |||
| < 3 h | 1.0 | 1.0 | |||
| ≥3 h | 1.5(0.9~2.7) | 1.0(0.4~2.5) | |||
| 分化程度 | < 0.01 | 0.182 | |||
| 低分化 | 1.0 | 1.0 | |||
| 中高分化 | 0.4(0.2~0.6) | 0.6(0.3~1.2) | |||
| TNM分期 | < 0.01 | < 0.01 | |||
| Ⅰ~Ⅱ期 | 1.0 | 1.0 | |||
| Ⅲ~Ⅳ期 | 10.0(5.2~19.2) | 17.1(7.7~37.7) | |||
| 术后LMR | 0.015 | 0.013 | |||
| 低 | 1.0 | 1.0 | |||
| 高 | 0.4(0.2~0.8) | 0.3(0.1~0.8) | |||
| 术前LMR | 0.039 | 0.623 | |||
| 低 | 1.0 | 1.0 | |||
| 高 | 1.5(1.1~2.3) | 0.9(0.4~1.8) | |||
| 注 LMR:淋巴细胞数与单核细胞数的比值(lymphocyte-to-monocyte ratio) | |||||
| 变量 | 单因素分析 | 多因素分析 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 性别 | 0.426 | 0.325 | |||
| 男性 | 1.0 | 1.0 | |||
| 女性 | 0.8(0.5~1.4) | 1.4(0.7~2.8) | |||
| 年龄 | 0.116 | 0.516 | |||
| < 60岁 | 1.0 | 1.0 | |||
| ≥60岁 | 1.7(0.9~3.5) | 1.3(0.6~2.9) | |||
| 体质量 | 1.0(1.0~1.0) | 0.627 | 1.0(1.0~1.1) | 0.246 | |
| 手术时长 | 1.0(1.0~1.0) | 0.009 | 1.0(1.0~1.0) | 0.161 | |
| 术中出血量 | 1.0(1.0~1.0) | < 0.01 | 1.0(1.0~1.0) | 0.005 | |
| 术后住院时间 | 1.0(1.0~1.0) | 0.235 | 1.0(1.0~1.0) | 0.945 | |
| 尿量 | 1.0(1.0~1.0) | 0.119 | 1.0(1.0~1.0) | 0.262 | |
| 肿瘤部位 | 0.053 | 0.084 | |||
| 右肺 | 1.0 | 1.0 | |||
| 左肺 | 0.6(0.3~1.0) | 0.6(0.3~1.1) | |||
| 右美托咪定 | 0.102 | 0.075 | |||
| 否 | 1.0 | 1.0 | |||
| 是 | 0.6(0.3~1.1) | 0.5(0.2~1.1) | |||
| 吸入麻醉药 | 0.026 | 0.316 | |||
| 否 | 1.0 | 1.0 | |||
| 是 | 0.5(0.3~0.9) | 0.7(0.4~1.3) | |||
| 麻醉时长 | 0.118 | 0.498 | |||
| < 3 h | 1.0 | 1.0 | |||
| ≥3 h | 1.6(0.9~2.8) | 0.7(0.3~1.8) | |||
| 分化程度 | < 0.01 | 0.109 | |||
| 低分化 | 1.0 | 1.0 | |||
| 中高分化 | 0.3(0.2~0.5) | 0.6(0.3~1.1) | |||
| TNM分期 | < 0.01 | < 0.01 | |||
| Ⅰ~Ⅱ期 | 1.0 | 1.0 | |||
| Ⅲ~Ⅳ期 | 8.7(4.5~16.6) | 9.9(4.6~21.4) | |||
| 术后LMR | 0.017 | 0.037 | |||
| 低 | 1.0 | 1.0 | |||
| 高 | 0.4(0.2~0.9) | 0.4(0.2~0.9) | |||
| 术前LMR | 0.023 | 0.218 | |||
| 低 | 1.0 | 1.0 | |||
| 高 | 0.5(0.3~0.9) | 0.5(0.4~1.1) | |||
| 注 LMR:淋巴细胞数与单核细胞数的比值(lymphocyte-to-monocyte ratio) | |||||
低LMR组患者3年和5年OS率为68.8%和45.4%。高LMR组3年和5年OS率为86.0%和71.3%。两组OS比较,差异具有统计学意义(P=0.011,图 2)。低LMR组患者3年和5年PFS率为59.6%和35.8%。高LMR组3年和5年PFS率为78.3%和69.6%。两组PFS比较,差异也具有统计学意义(P=0.013,图 3)。
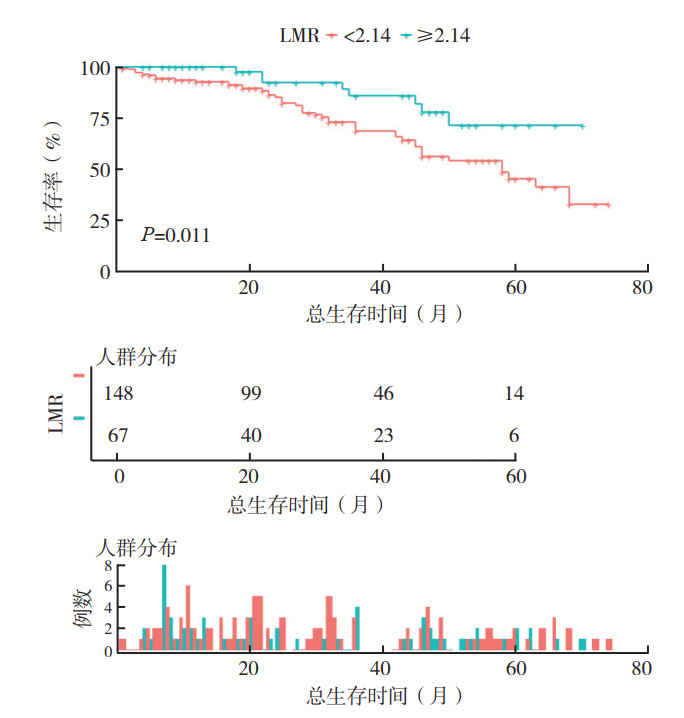
|
| 注 LMR:淋巴细胞数与单核细胞数的比值(lymphocyte-to-monocyte ratio) 图 2 高LMR组和低LMR组患者总生存曲线比较 Fig.2 Comparison of overall survival curves between the high and low LMR groups |
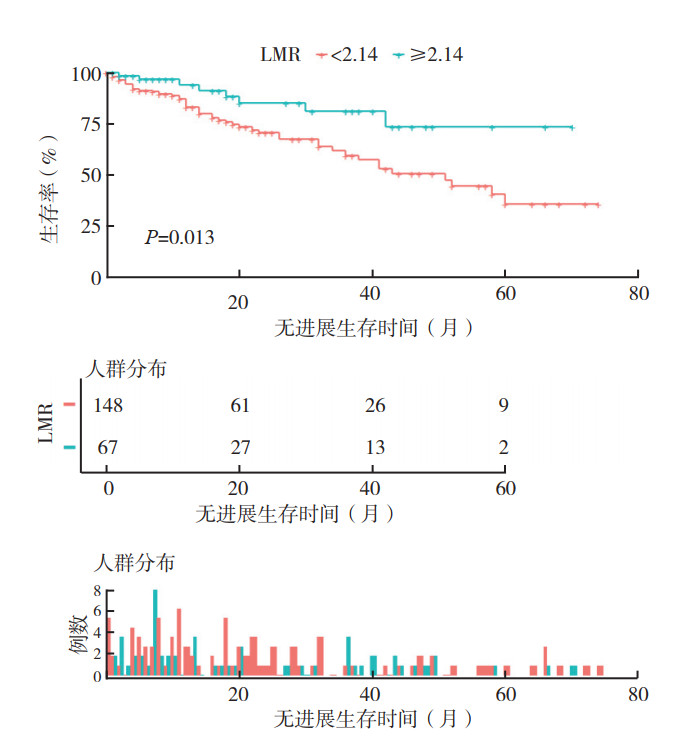
|
| 注 LMR:淋巴细胞数与单核细胞数的比值(lymphocyte-to-monocyte ratio) 图 3 高LMR组和低LMR组患者无进展生存曲线比较 Fig.3 Comparison of progression-free survival curves between the high and low LMR groups |
本研究以合并高血压的肺癌患者为主要研究对象,主要研究术后患者炎性反应指标LMR对其生存预后的预测价值。白细胞、单核细胞和淋巴细胞等免疫炎性反应细胞既是肿瘤微环境的重要组成元素,也是人体免疫系统的关键成分,且在肿瘤的发生、发展及转移等多个环节中发挥重要作用[7-8]。免疫炎性反应系统在肿瘤发展中发挥双重作用,一方面通过先天免疫及获得性免疫抑制肿瘤发展,另一方面,聚集于肿瘤微环境中的炎性反应及免疫细胞可能通过修饰或转化含有高可塑性成分的系统参与免疫抑制微环境的形成,从而引发肿瘤细胞的免疫逃逸,进而促进肿瘤发展[9-10]。当肺癌细胞侵袭宿主时,可激活机体的淋巴细胞产生淋巴因子,激活细胞免疫及体液免疫,消灭肿瘤细胞,中和细胞毒素,从而引发宿主抗肿瘤免疫反应过程。升高的淋巴细胞可以通过增加细胞毒性死亡的诱导并抑制肺癌肿瘤细胞的增殖和侵袭而在肿瘤防御中发挥作用[11]。故在肿瘤发生和发展过程中,尤其是早期,淋巴细胞多为升高状态。相关研究证据表明,单核细胞可以分化为肿瘤相关巨噬细胞(tumor-associated macrophage,TAM),TAM包含M1和M2两种类型,其中M1型参与肿瘤细胞的识别和破坏过程,而M2型则促进实体肿瘤周边肿瘤的侵袭和转移[12]。TAM可以通过多种途径促进肿瘤的发生及免疫抑制,包括分泌表皮细胞生长因子(epidermal growth factor,EGF)和血小板衍生生长因子(platelet derived growth factor,PDGF)等生长因子促进肿瘤细胞的增殖;释放基质金属蛋白酶(matrix metalloproteinase,MMP;如MMP2和MMP9)等促肿瘤细胞转移因子参与肿瘤的侵袭与转移等[13]。除此之外,单核细胞还可以刺激肿瘤细胞或免疫细胞产生多种趋化因子,例如血管内皮生长因子、肿瘤坏死因子α和单核细胞趋化蛋白-1,促进肿瘤发生、血管生成和远处转移。另有研究认为,单核细胞主要在癌症的侵袭和转移中起作用,而不是在肿瘤细胞的增殖中起作用[14]。炎性反应参与高血压的发病机制,而高血压是由补体、炎性反应细胞的激活及循环免疫细胞的改变而引发的[15]。临床研究显示,炎性反应的诱导损伤与高血压的发展过程相关[16]。
关于炎性反应指标对于肿瘤患者生存预后的影响,目前有不同研究观点。有研究通过X-Tile软件确定LMR及血小板数和淋巴细胞数的比值(platelet-to-lymphocyte ratio,PLR)的最佳截断值分别为2.6和196.2,经分析认为术前LMR值是非小细胞肺癌(non-small-cell lung cancer,NSCLC)患者OS及PFS的独立危险因素, 而PLR则被证明与NSCLC预后并无明显相关性[17]。另有研究证明术后炎性反应指标如中性粒细胞数和淋巴细胞数的比值(neutrophil-to-lymphocyte ratio,NLR)等相较于术前指标,对OS及PFS有更显著的预测价值[18],与本研究结论大体一致。另有多项研究认为,术前或术后免疫炎性反应指标与多种肿瘤患者不良生存预后有密切联系[19-20]。本研究以LMR为观察指标,通过ROC曲线确定LMR的截断值为2.14。生存分析结果认为,高LMR组患者预后优于低LMR组,说明炎性反应指标LMR与预后有相关性。术前进行新辅助放化疗会对患者术后血液学的改变造成一定影响,在本研究中会影响观察指标对生存预后的影响,所以在患者筛选入组前排除放化疗患者,提高结果的准确性。另外,本研究认为术中麻醉药物的使用,如右美托咪定等静脉麻醉药及吸入麻醉药如七氟醚等的使用并非患者生存预后的独立危险因素,这与以往的研究结论并不完全一致[21]。以往研究报道,在细胞实验中右美托咪定对肺癌A549细胞的增殖和迁移有一定程度上的促进作用,而吸入麻醉药目前没有发现有明确影响[21]。
相较于以往对肺癌患者的研究,本研究对象为接受手术治疗的合并高血压的肺癌患者,更具有针对性,最终结果与以往研究相似[22-23]。虽然排除了术前放化疗的影响,但相较于术前指标对预后的影响,术后炎性反应指标受到的其他干扰因素更多。另外本研究为单中心研究,样本量有限,在研究过程中可能存在选择偏倚。因此本研究具有一定的局限性和地理差异,需进一步发展多中心、前瞻性研究。
炎性反应指标与肺癌术后生存之间的关系是近些年围术期研究的热点。炎性反应指标简便易得,检查手段价格低廉,且大量研究证明其对多种肿瘤患者生存预后的预测价值,因此是未来肿瘤研究发展的趋势。未来可以更深一步从分子机制或者细胞水平入手,探讨炎性反应指标如LMR等对行手术治疗的合并高血压的肺癌患者生存预后的影响。
| [1] |
Didkowska J, Wojciechowska U, Mańczuk M, et al. Lung cancer epidemiology: contemporary and future challenges worldwide[J]. Ann Transl Med, 2016, 4(8): 150. DOI:10.21037/atm.2016.03.11 |
| [2] |
Lim SS, Vos T, Flaxman AD, et al. A comparative risk assessment of burden of disease and injury attributable to 67 risk factors and risk factor clusters in 21 regions, 1990-2010:a systematic analysis for the Global Burden of Disease Study 2010[J]. Lancet, 2012, 380(9859): 2224-2260. DOI:10.1016/S0140-6736(12)61766-8 |
| [3] |
李健. 高血压和肾素-血管紧张素系统阻断剂对肺癌病人结局的影响[D]. 济南: 山东大学, 2017.
|
| [4] |
Agita A, Alsagaff MT. Inflammation, immunity, and hypertension[J]. Acta Med Indones, 2017, 49(2): 158-165. |
| [5] |
Greten FR, Grivennikov SI. Inflammation and cancer: triggers, mechanisms, and consequences[J]. Immunity, 2019, 51(1): 27-41. DOI:10.1016/j.immuni.2019.06.025 |
| [6] |
闫存玲, 郭子健. 肺癌实验室诊断专家共识[J]. 山东大学学报: 医学版, 2018, 56(10): 9-17, 30. DOI:10.6040/j.issn.1671-9352.0.2017.512 |
| [7] |
刘处处, 吴美龙, 严哲, 等. 术前中性粒细胞与淋巴细胞比值在肝内胆管细胞癌肝部分切除术后的预后价值的meta分析[J]. 实用肿瘤杂志, 2021, 36(6): 514-519. |
| [8] |
Budisan L, Zanoaga O, Braicu C, et al. Links between infections, lung cancer, and the immune system[J]. Int J Mol Sci, 2021, 22(17): 9394. DOI:10.3390/ijms22179394 |
| [9] |
Li LH, Yu R, Cai TG, et al. Effects of immune cells and cytokines on inflammation and immunosuppression in the tumor microenvironment[J]. Int Immunopharmacol, 2020, 88: 106939. DOI:10.1016/j.intimp.2020.106939 |
| [10] |
Khandia R, Munjal A. Interplay between inflammation and cancer[J]. Adv Protein Chem Struct Biol, 2020, 119: 199-245. |
| [11] |
Shibutani M, Maeda K, Nagahara H, et al. A high preoperative neutrophil-to-lymphocyte ratio is associated with poor survival in patients with colorectal cancer[J]. Anticancer Res, 2013, 33(8): 3291-3294. |
| [12] |
Hutterer GC, Stoeckigt C, Stojakovic T, et al. Low preoperative lymphocyte-monocyte ratio (LMR) represents a potentially poor prognostic factor in nonmetastatic clear cell renal cell carcinoma[J]. Urol Oncol, 2014, 32(7): 1041-1048. DOI:10.1016/j.urolonc.2014.04.001 |
| [13] |
Liang ZW, Ge XX, Xu MD, et al. Tumor-associated macrophages promote the metastasis and growth of non-small-cell lung cancer cells through NF-κB/PP2Ac-positive feedback loop[J]. Cancer Sci, 2021, 112(6): 2140-2157. DOI:10.1111/cas.14863 |
| [14] |
Park KY, Li GD, Platt MO. Monocyte-derived macrophage assisted breast cancer cell invasion as a personalized, predictive metric to score metastatic risk[J]. Sci Rep, 2015, 5: 13855. DOI:10.1038/srep13855 |
| [15] |
Xiao L, Harrison DG. Inflammation in hypertension[J]. Can J Cardiol, 2020, 36(5): 635-647. |
| [16] |
Rodriguez-Iturbe B, Pons H, Johnson RJ. Role of the immune system in hypertension[J]. Physiol Rev, 2017, 97(3): 1127-1164. |
| [17] |
Yan HX, Cai LL, Chen SS, et al. Preoperative lymphocyte-to-monocyte ratio versus platelet-to-lymphocyte ratio as a prognostic predictor for non-small cell lung cancer patients[J]. J Med Biochem, 2020, 39(2): 160-164. |
| [18] |
Jin F, Han AQ, Shi F, et al. The postoperative neutrophil-to-lymphocyte ratio and changes in this ratio predict survival after the complete resection of stage Ⅰ non-small cell lung cancer[J]. Onco Targets Ther, 2016, 9: 6529-6537. |
| [19] |
陈自喜, 张孟哲, 朱兆伟, 等. 结肠癌患者外周血microRNA-21、淋巴细胞亚群及炎性因子的相关性研究[J]. 实用肿瘤杂志, 2021, 36(4): 314-319. |
| [20] |
Goto W, Kashiwagi S, Asano Y, et al. Predictive value of lymphocyte-to-monocyte ratio in the preoperative setting for progression of patients with breast cancer[J]. BMC Cancer, 2018, 18(1): 1137. |
| [21] |
Vahabi S, Eatemadi A. Effects of anesthetic and analgesic techniques on cancer metastasis[J]. Biomedecine Pharmacother, 2017, 87: 1-7. |
| [22] |
Zhai B, Chen J, Wu J, et al. Predictive value of the hemoglobin, albumin, lymphocyte, and platelet (HALP) score and lymphocyte-to-monocyte ratio (LMR) in patients with non-small cell lung cancer after radical lung cancer surgery[J]. Ann Transl Med, 2021, 9(12): 976. |
| [23] |
Zhao K, Wang C, Shi F, et al. Combined prognostic value of the SUVmax derived from FDG-PET and the lymphocyte-monocyte ratio in patients with stage ⅢB-ⅠV non-small cell lung cancer receiving chemotherapy[J]. BMC Cancer, 2021, 21(1): 66. |
 2023, Vol. 38
2023, Vol. 38


