文章信息
- 赵一鉴, 刘敏, 荆冠军
- Zhao Yijian, Liu Min, Jing Guanjun
- Lnc-MALAT1在肝癌组织中的表达及对化疗敏感性的影响
- Expression pattern of lnc-MALAT1 in liver cancer patients and its effect on chemotherapy sensitivity
- 实用肿瘤杂志, 2020, 35(1): 53-58
- Journal of Practical Oncology, 2020, 35(1): 53-58
基金项目
- 陕西省卫计委科技计划(2016D065)
-
作者简介
- 赵一鉴(1984-), 男, 陕西商州人, 主治医师, 硕士生, 从事消化道肿瘤基础与临床研究.
-
通信作者
- 荆冠军, E-mail:150111136@qq.com
-
文章历史
- 收稿日期:2018-10-25
2. 延安大学附属医院肿瘤科, 陕西 延安 716000
2. Department of Oncology, Affiliated Hospital of Yan'an University, Yan'an 716000, China
中国肝癌发病率居全球首位,其肝癌死亡率在各种肿瘤中居第3位[1]。早期肝癌的治疗手段主要为手术治疗,但由于多数患者发现时已处于中晚期,手术效果不甚理想,且转移和复发率较高[1-3],因此,化疗是中晚期肝癌治疗的主要手段。常见的化疗药物如5氟尿嘧啶、顺铂、多柔比星和丝裂霉素等都显著提高肝癌患者的生存率[4-5],然而耐药特别是多药耐药(multi-drug resistance,MDR)日渐成为肝癌患者化疗的阻碍[6],所以探讨肝癌耐药新机制,寻找行之有效的干预手段成为改善肝癌治疗及耐药现状的关键,而近年来长链非编码RNA(long non-coding RNAs,lncRNAs)作为一个新兴的肿瘤研究热点受到越来越多的关注。
1 资料与方法 1.1 一般资料收集2010年1月至2012年1月商洛市中心医院收治的92例肝癌患者肿瘤组织及对应癌旁正常组织。其中男性73例,女性19例;年龄28~76岁,(53.9±9.8)岁,中位年龄54岁。期间每隔1年通过电话对患者进行1次随访追踪其生存状态和生活质量情况。随访时间1个月~5.7年,中位29个月。患者相互之间不存在血缘关系。
1.2 主要试剂耗材肝癌细胞HpG2购自中国科学院上海细胞生物研究所;RPIM-1640培养液和胎牛血清购自上海逍鹏生物公司;8 μm孔径transwell小室购自美国CORNING公司;长链非编码-肺腺癌转移相关转录子1(long non-coding metastasis-associated lung adenocarcinoma transcript 1,lnc-MALAT1)过表达质粒购自上海吉凯基因公司,转染试剂Lipofectamine 3000购自美国Invitrogen公司;引物购自上海生工。氟尿嘧啶及顺铂购自上海逍鹏生物公司。
1.3 实时荧光定量PCR实验采用TRIzol法提取肿瘤组织及对应癌旁正常组织总RNA,并使用TAKARA反转录试剂盒(PrimeScript RT reagent Kit with gDNA Eraser)反转录制备cDNA文库;使用ABI 7900HT PCR仪进行实验,qPCR mix选用SYBR Green PCR Master Mix,反应体系根据其说明书配置,结果采用2-ΔΔCt法进行分析;使用管家基因(β-actin,ACTB)作为内参基因,基因相对表达量以癌组织表达量高于对应癌旁正常组织为高表达,反之为低表达。
1.4 细胞培养本研究使用HpG2细胞,所用培养液为含10%胎牛血清的RPIM-1640培养液,培养环境为37℃、5%CO2、饱和湿度。
1.5 细胞转染实验使用HpG2细胞转染MALAT1过表达质粒(过表达组),转染空载体为对照组,转染所用试剂为Lipofectamine 3000,操作步骤严格按照说明书进行。转染后常规培养48 h,收集细胞用于后续实验检测。
1.6 CCK-8实验取转染后处于对数生长期细胞,取胰蛋白酶消化重悬后的细胞计数,接种于96孔培养板中,每孔接种200个细胞,每组设置5个平行孔;接种5个96孔板用于不同时间点(0 h、24 h、48 h、72 h和96 h)加入CCK-8试剂后在450 nm波长下检测其吸光度(absorbance,A)值。
1.7 化疗药物敏感性实验取转染后处于对数生长期细胞,取胰蛋白酶消化重悬后的细胞计数,接种于96孔培养板中,每孔接种2×104个细胞,每组设置5个平行孔;分别按对数浓度梯度(0.001、0.01、0.1、1、10和100 ng/mL)设置化疗药物氟尿嘧啶和顺铂的浓度滴度加药,常规培养24 h后PBS清洗96孔培养板,加入含20%CCK-8试剂的培养液,2 h后在450 nm波长下检测A值。
1.8 统计学分析采用SPSS 19.0软件进行数据分析。采用配对t检验分析癌组织和对应癌旁正常组织中lncRNA表达水平的差异。采用Pearson′s χ2检验和独立样本t检验分析不同肝癌患者临床特征及疾病进展中lncRNA表达水平的差异。采用Kaplan-Meier法绘制生存曲线,用Log-rank检验比较生存差异。使用独立t检验分析细胞迁移和侵袭能力差异。采用重复测量的方差分析方法分析细胞增殖能力的差异(CCK-8实验及化疗药物敏感性实验)。以P < 0.05为差异具有统计学意义。
2 结果 2.1 lnc-MALAT1在肝癌组织中高表达采用实时荧光定量PCR检测肝癌组织和癌旁正常组织发现,肝癌组织中lnc-MALAT1的表达量高于对应癌旁正常组织[(0.020±0.067) vs (0.007±0.020),P < 0.01,图 1],平均达2.8倍。
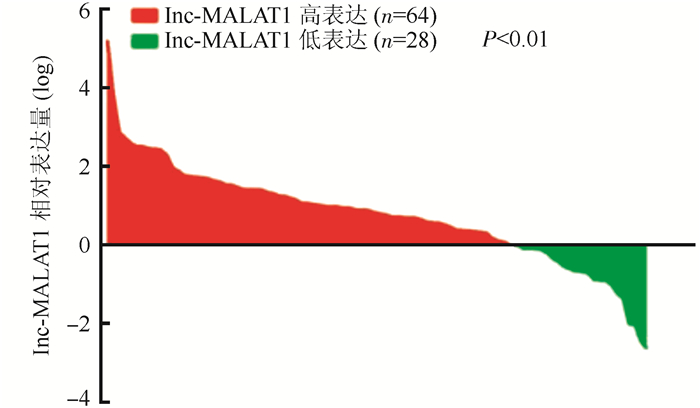
|
| 注 lnc-MALAT1在肝癌组织及对应癌旁正常组织中的相对表达情况(取对数值), 红色部分为肝癌组织中lnc-MALAT1相对表达量高于癌旁正常组织[69. 6% (64 /92)]; 绿色部分为肝癌组织中lnc-MALAT1相对表达量低于癌旁正常组织 图 1 lnc-MALAT1在肝癌组织中高表达 Fig.1 lnc-MALAT1 was highly expressed in liver cancer tissues |
分析lnc-MALAT1表达水平与肝癌患者临床特征之间的关系显示,lnc-MALAT1高表达在肝癌患者临床分期(P=0.002)、是否原发病灶(P=0.027)、淋巴结转移(P=0.026)、远端转移(P=0.004)、化疗(P=0.012)和乙肝表面抗原(hepatitis B surface antigen,HBsAg;P=0.039)方面比较,差异均具有统计学意义(表 1)。
| 临床特征 | 低表达 | 高表达 | χ2值 | P值 |
| 总例数 | 28 | 64 | ||
| 年龄 | 0.129 | 0.720 | ||
| < 60岁 | 20(29.4) | 48(70.6) | ||
| ≥60岁 | 8(33.3) | 16(66.7) | ||
| 性别 | 1.540 | 0.105 | ||
| 女 | 8(42.1) | 11(57.9) | ||
| 男 | 20(27.4) | 53(72.6) | ||
| 分期 | 9.857 | 0.002 | ||
| Ⅰ+Ⅱ期 | 13(56.5) | 10(43.5) | ||
| Ⅲ+Ⅳ期 | 15(21.7) | 54(78.3) | ||
| T | 4.866 | 0.027 | ||
| 1+2 | 17(42.5) | 23(57.5) | ||
| 3+4 | 11(21.1) | 41(78.8) | ||
| N | 4.958 | 0.026 | ||
| 0 | 24(37.5) | 40(62.5) | ||
| 1 | 4(25.0) | 24(85.7) | ||
| M | 8.151 | 0.004 | ||
| 0 | 24(40.7) | 35(59.3) | ||
| 1 | 4(12.1) | 29(87.9) | ||
| 化疗 | 6.255 | 0.012 | ||
| 未化疗 | 17(44.7) | 21(55.3) | ||
| 化疗 | 11(20.4) | 43(79.6) | ||
| 肝硬化 | 1.322 | 0.250 | ||
| 无 | 13(25.5) | 38(74.5) | ||
| 有 | 15(36.6) | 26(63.4) | ||
| HBsAg | 4.255 | 0.039 | ||
| 未检出 | 5(62.5) | 3(37.5) | ||
| 检出 | 23(27.4) | 61(72.6) | ||
| HBcAb | 0.485 | 0.486 | ||
| 未检出 | 4(40.0) | 6(60.0) | ||
| 检出 | 24(29.3) | 58(70.7) | ||
| 注 HBsAg:乙肝表面抗原(hepatitis B surface antigen) | ||||
分析lnc-MALAT1表达量与肝癌患者生存随访资料之间的关系发现,lnc-MALAT1高表达患者的总生存时间短于低表达患者,差异具有统计学意义[(26.69±16.02)个月vs (37.14±15.77)个月,P=0.027,图 2]。

|
| 图 2 lnc-MALAT1高表达和低表达患者总生存曲线比较 Fig.2 Comparison of overall survival of liver cancer patients with high and low expression of lnc-MALAT1 |
CCK-8实验验证过表达lnc-MALAT1后对肝癌细胞增殖能力的影响。通过重复测量的方差分析显示,HpG2细胞增殖48 h后,过表达lnc-MALAT1组细胞增殖速度较对照组细胞快。
过表达组和对照组细胞转染后0和24 h的A450 nm值比较,差异均无统计学意义[(0.317±0.027) vs (0.315±0.009),(0.337±0.027) vs (0.328±0.016),均P>0.05]。过表达组和对照组细胞转染后48、72和96 h的A450 nm值比较,差异均具有统计学意义[(0.510±0.027)vs (0.456±0.037),P=0.045;(0.635±0.051)vs (0.513±0.057),P=0.013;(0.841±0.068) vs (0.672±0.033),P=0.002;图 3]。

|
| 注 *P < 0. 05 图 3 过表达lnc-MALAT1促进肝癌细胞HpG2增殖 Fig.3 Overexpression of lnc-MALAT1 promotes the proliferation of HpG2 liver cancer cell lines |
过表达组和对照组HpG2细胞对氟尿嘧啶的IC50分别为(14.72±3.89)ng/mL和(3.15±0.89)ng/mL(P < 0.01,图 4A)。过表达组和对照组对顺铂的IC50分别为(53.26±6.36)ng/mL和(8.23±1.65)ng/mL(P < 0.01,图 4B)。过表达组细胞对氟尿嘧啶及顺铂的敏感性降低。
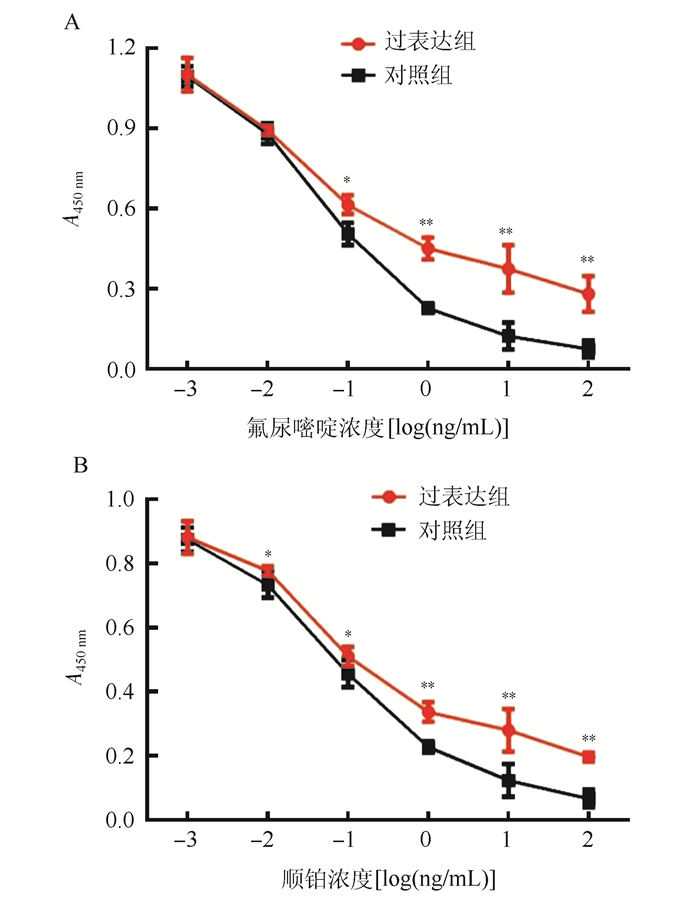
|
| 注 A:不同浓度氟尿嘧啶处理后细胞增殖情况; B:不同浓度顺铂处理后细胞增殖情况; *P < 0. 05;**P < 0. 01 图 4 过表达lnc-MALAT1降低肝癌细胞HpG2多化疗药物的敏感性 Fig.4 Overexpression of lnc-MALAT1 inhibited the sensitivity of chemotherapy in HpG2 liver cancer cells |
肝癌是临床上常见的恶性肿瘤,发病率和死亡率均居高不下[7]。在我国,肝癌病死率在肿瘤中排第2位[8-9],而制约肝癌患者有效提高生存期的主要原因为肝癌患者发现时多数为中晚期、肝癌发展迅速、转移及复发[3]。在肝癌发生和发展过程中,多种原因能够导致肝癌迅速进展、转移和复发[10-11]。近年来越来越多的证据显示,非编码RNA如miRNA等,特别是lncRNA在肝癌的发生和发展中起到调控作用[12-16],且lncRNA广泛参与肿瘤细胞耐药过程[6, 17-19]。
lncRNAs是一类长度>200个核苷酸、缺乏编码蛋白质能力的RNA序列[16],是一类具有转录水平和转录后水平调控作用的非编码RNA,其在肿瘤耐药中的作用日渐受到重视[6, 20-21]。目前,研究显示,lncRNA在肿瘤发生和发展过程中起到关键的调控作用,且有较多lncRNA参与肿瘤耐药的过程[22]。MALAT1是最早被发现报道的lncRNA之一[23]。Lnc-MALAT1最早被报道于非小细胞肺癌中[24]。Lnc-MALAT1通过影响运动相关基因增强肺腺癌细胞的迁移能力[25],且在膀胱癌中能够抑制肿瘤细胞凋亡,促进肿瘤细胞浸润侵袭[26]。在非小细胞肺癌中,lnc-MALAT1能够通过调节DNA甲基化来促进肺癌细胞侵袭[27]。其在肿瘤发生和发展中所起作用已有较多研究,但是其在肿瘤耐药方面的研究尚不多,有报道lnc-MALAT1在直肠癌组织中高表达,且其高表达能够降低直肠癌细胞对氟尿嘧啶和顺铂的敏感性[18]。目前能够见到lnc-MALAT1在多种肿瘤中所起作用,且多有lnc-MALAT1介导肿瘤细胞耐药的报道[26-30],但是尚未见到lnc-MALAT1在介导肝癌细胞耐药所起作用的报道。
本研究通过单纯病例研究的方法探讨lnc-MALAT1在肝癌组织中的表达,发现lnc-MALAT1在肝癌组织中的表达量较癌旁正常组织增加,提示lnc-MALAT1表达与肝癌的发生和发展密切相关。进一步分析lnc-MALAT1表达和肝癌患者TNM分期以及生存期缩短等有关,与韩树坤等[31]的研究结果一致。lnc-MALAT1高表达的化疗患者生存期较低表达患者短,提示lnc-MALAT1与肝癌患者化疗敏感性有关。进一步通过化疗敏感性实验验证发现,lnc-MALAT1高表达组细胞增殖活力较对照组好,提示lnc-MALAT1在肝癌发生和发展中发挥促癌作用,且能够促进肝癌细胞发生耐药。
综上所述,本研究证实,lnc-MALAT1在肝癌中高表达,且与肝癌分期和进展密切相关。lnc-MALAT1能够促进肝癌细胞增殖,发挥促癌作用。通过化疗敏感性实验证实,lnc-MALAT1能够降低肝癌细胞对顺铂的敏感性,促进肝癌细胞耐药,但其产生耐药的机制还需要进一步实验验证。
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Sun Y, Wang Y, Li M, et al. Long term trends of liver cancer mortality by gender in urban and rural areas in China:an age-period-cohort analysis[J]. BMJ Open, 2018, 8(2): e020490.. DOI:10.1136/bmjopen-2017-020490 |
| [3] |
Allemani C, Matsuda T, Carlo VD, et al. Global surveillance of trends in cancer survival 200014(CONCORD-3):analysis of individual records for37513025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries[J]. Lancet, 2018, 391(10125): 1023-1075. DOI:10.1016/S0140-6736(17)33326-3 |
| [4] |
Rahbari NN, Mehrabi A, Mollberg NM, et al. Hepatocellular carcinoma:current management and perspectives for the future[J]. Ann Surg, 2011, 253(3): 453-469. DOI:10.1097/SLA.0b013e31820d944f |
| [5] |
黄泽坚, 吕萍, 于宝丹, 等. 靶向CD24单克隆抗体增强肝癌化疗敏感性的实验研究[J]. 实用肿瘤杂志, 2019, 34(3): 215-218. |
| [6] |
汤嵩, 江啸, 王翔, 等. 原发性肝癌多药耐药相关机制的研究进展[J]. 中国肿瘤临床与康复, 2018, 25(8): 1020-1024. |
| [7] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [8] |
Zheng R, Zeng H, Zhang S, et al. Estimates of cancer incidence and mortality in China, 2013[J]. Chin J Cancer, 2017, 36(1): 66. |
| [9] |
孙惠川, 王征, 周俭, 等. 2017年版中国肝癌诊断和治疗规范解读[J]. 实用肿瘤杂志, 2018, 33(1): 1-3. |
| [10] |
Hanahan D, Weinberg RA. Hallmarks of cancer:the next generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [11] |
吴伟, 王亚奇, 尚闯, 等. HNF1β在不同病理类型肝癌中的表达差异[J]. 实用肿瘤杂志, 2018, 33(3): 246-249. |
| [12] |
李岑岑.猪肝脏组织中lincRNA的分子进化和甲基化模式研究[D].华中农业大学生命科学与技术学院, 2017.
|
| [13] |
Zhang L, Yang Z, Trottier J, et al. Long noncoding RNA MEG3 induces cholestatic liver injury by interaction with PTBP1 to facilitate shp mRNA decay[J]. Hepatology, 2017, 65(2): 604-615. DOI:10.1002/hep.28882 |
| [14] |
Wu L, Zhang L, Zheng S. Role of the long non-coding RNA HOTAIR in hepatocellular carcinoma[J]. Oncol Lett, 2017, 14(2): 1233-1239. DOI:10.3892/ol.2017.6312 |
| [15] |
Pan J, Tong S, Tang J. LncRNA expression profiles in HBV-transformed human hepatocellular carcinoma cells treated with a novel inhibitor of human La protein[J]. J Viral Hepat, 2017, 25(4): 391-400. |
| [16] |
Zhang D, Cao C, Liu L, et al. Up-regulation of lncRNA SNHG20 predicts poor prognosis in hepatocellular carcinoma[J]. J Cancer, 2016, 7(5): 608-617. DOI:10.7150/jca.13822 |
| [17] |
丁祥黎, 龚泉, 颜汝平, 等. lncRNA在调控膀胱癌上皮-间质转化中作用的研究进展[J]. 实用肿瘤杂志, 2017, 32(3): 275-278. |
| [18] |
王栋, 金岚, 王今, 等. MALAT1在结直肠癌组织细胞中的表达及对化疗敏感性的影响[J]. 中国医药导报, 2016, 13(32): 12-16. |
| [19] |
王春涛, 李鹏, 付涛. 长链非编码RNA在结直肠癌中的研究进展[J]. 实用肿瘤杂志, 2019, 34(6): 492-496. |
| [20] |
Batista PJ, Chang HY. Long noncoding RNAs:cellular address codes in development and disease[J]. Cell, 2013, 152(6): 1298-1307. DOI:10.1016/j.cell.2013.02.012 |
| [21] |
陈天天, 王文锐, 陈素莲, 等. 乳腺癌紫杉醇耐药细胞中lncRNA和mRNA表达谱筛选[J]. 蚌埠医学院学报, 2018, 43(10): 1322-1328. |
| [22] |
Xiao Z, Qu Z, Chen Z, et al. LncRNA HOTAIR is a prognostic biomarker for the proliferation and chemoresistance of colorectal cancer via MiR-203a-3p-mediated Wnt/ss-catenin signaling pathway[J]. Cell Physiol Biochem, 2018, 46(3): 1275-1285. DOI:10.1159/000489110 |
| [23] |
Wilusz J E, Freier SM, Spector DL. 3' End processing of a long nuclear-retained noncoding RNA yields a tRNA-like cytoplasmic RNA[J]. Cell, 2008, 135(5): 919-932. DOI:10.1016/j.cell.2008.10.012 |
| [24] |
Ji P, Diederichs S, Wang W, et al. MALAT-1, a novel noncoding RNA, and thymosin beta4 predict metastasis and survival in early-stage non-small cell lung cancer[J]. Oncogene, 2003, 22(39): 8031-8041. DOI:10.1038/sj.onc.1206928 |
| [25] |
Tano K, Mizuno R, Okada T, et al. MALAT-1 enhances cell motility of lung adenocarcinoma cells by influencing the expression of motility-related genes[J]. FEBS Lett, 2010, 584(22): 4575-4580. DOI:10.1016/j.febslet.2010.10.008 |
| [26] |
Xie H, Liao X, Chen Z, et al. LncRNA MALAT1 inhibits apoptosis and promotes invasion by antagonizing miR-125b in bladder cancer cells[J]. J Cancer, 2017, 8(18): 3803-3811. DOI:10.7150/jca.21228 |
| [27] |
Guo F, Guo L, Li Y, et al. MALAT1 is an oncogenic long non coding RNA associated with tumor invasion in non-small cell lung cancer regulated by DNA methylation[J]. Int J Clin Exp Pathol, 2015, 8(12): 15903-15910. |
| [28] |
Wang WW, Zhou XL, Song YJ, et al. Combination of long noncoding RNA MALAT1 and carcinoembryonic antigen for the diagnosis of malignant pleural effusion caused by lung cancer[J]. Onco Targets Ther, 2018, 11(2): 2333-2344. |
| [29] |
Lin Q, Guan W, Ren W, et al. MALAT1 affects ovarian cancer cell behavior and patient survival[J]. Oncol Rep, 2018, 39(6): 2644-2652. |
| [30] |
Jiao D, Li Z, Zhu M, et al. LncRNA MALAT1 promotes tumor growth and metastasis by targeting miR-124/foxq1 in bladder transitional cell carcinoma (BTCC)[J]. Am J Cancer Res, 2018, 8(4): 748-760. |
| [31] |
韩树坤, 李忠民, 韩冰, 等. 长链非编码RNA MALAT1在肝癌组织中的表达及其在肝癌细胞增殖与侵袭转移中的作用[J]. 中国普通外科杂志, 2018, 27(1): 49-55. |
 2020, Vol. 35
2020, Vol. 35


