文章信息
- 钱嘉惠, 杨成城, 温彬宇, 张少辉, 张栋, 马亦湘, 周春宇
- Qian Jiahui, Yang Chengcheng, Wen Binyu, Zhang Shaohui, Zhang Dong, Ma Yixiang, Zhou Chunyu
- 基于TCGA数据库分析三阴性乳腺癌预后与铁死亡相关lncRNA的关系
- Analysis of relationship between prognosis and ferroptosis-related lncRNAs in triple-negative breast cancer patients based on TCGA database
- 实用肿瘤杂志, 2022, 37(5): 411-418
- Journal of Practical Oncology, 2022, 37(5): 411-418
基金项目
- 北京市中医药科技发展资金项目(JJ-2020-39)
-
通信作者
- 周春宇, E-mail: 13601252798@163.com
-
文章历史
- 收稿日期:2021-08-30
2. 北京中医药大学东方医院普通外科, 北京 100078;
3. 北京中医药大学东方医院实验中心, 北京 100078;
4. 北京中医药大学医院管理处, 北京 100029
2. General Surgery, Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100078, China;
3. Experimental Centre, Dongfang Hospital, Beijing University of Chinese Medicine, Beijing 100078, China;
4. Department of Hospital Management, Beijing University of Chinese Medicine, Beijing 100029, China
乳腺癌是来源于乳腺腺体上皮组织中的恶性肿瘤。2018年,美国预计乳腺癌发病例数将达到268 670例,死亡将达到41 400例,发病率位居女性恶性肿瘤的首位[1]。根据我国肿瘤登记中心2018年的数据,2014年中国女性乳腺癌发病率为41.82/10万,死亡率为9.90/10万[2]。近10年来,乳腺癌的发病率与死亡率均呈上升趋势[3]。尽管我国乳腺癌的发病率低于西方发达国家,但患者例数急剧增加。虽然随着医疗手段的逐步完善,乳腺癌的病死率有所下降,但仍是女性高危性恶性肿瘤[4-5]。目前,研究中将乳腺癌细胞分为4种分子亚型;三阴性乳腺癌(triple-negative breast cancer,TNBC)作为一种特殊的病理分子亚型,占所有乳腺癌病理类型的10.0%~20.8%,具有较高的恶性生物学特征,且无法使用内分泌治疗药物并缺少靶向药物,5年内发生术后进展的概率高于其他基因亚型[6], 由于没有靶向治疗指标,化疗仍是这类乳腺癌最重要治疗方式,此种类型乳腺癌是临床治疗中的难点[7]。
铁是正常细胞复制、代谢和生长的必需元素,参与许多生物过程,例如细胞呼吸、氧代谢和能量代谢等。由于癌细胞具有较高增殖率,癌细胞(包括乳腺癌细胞)表现出铁吸收增加和铁流出减少的趋势[8]。另外铁死亡可触发肿瘤微环境中炎性反应相关的免疫抑制,从而有利于肿瘤生长[9], 因此铁代谢在癌症中发挥重要作用。最近有研究发现,不同表型的乳腺癌细胞对铁死亡的敏感性不同,TNBC对铁死亡比雌激素受体(estrogen receptor,ER)阳性乳腺癌更敏感[10],触发乳腺癌的铁死亡细胞死亡似乎是一种有效的治疗策略。谷氨酰胺在铁死亡中起关键作用,是谷氨酸的重要来源,胱氨酸/谷氨酸反向转运体可摄取胱氨酸,排出谷氨酸,为谷胱甘肽合成提供原料[11]。限制谷氨酰胺摄入或抑制胱氨酸/谷氨酸反向转运体活性会增加细胞内活性氧(reactive oxygen species,ROS)水平并减缓TNBC的生长[8]。胱氨酸通过激活GCN2-eIF2α-ATF4-CHAC1通路诱导TNBC细胞铁死亡[12]。目前已有证据证明,铁死亡途径有助于增强化疗药物疗效(顺铂和多柔比星),增强化疗耐药癌症的细胞毒性,致敏癌症放疗,并放大光热和光动力学治疗的功效[13]。有研究采用叶酸标记外泌体,开发了靶向外泌体包裹的erastin(erastin@FA-exo),与游离erastin比较,erastin@FA-exo通过细胞内谷胱甘肽耗竭和ROS过度生成促进铁死亡,对MDA-MB-231细胞的增殖和迁移表现出更好的抑制作用[14]。铁死亡细胞死亡会抑制肿瘤生长,因此,更好地了解铁死亡有助于发现新的治疗策略以改善癌症治疗。
长链非编码RNA(long non-coding RNA,lncRNA)是包含 > 200个核苷酸的RNA,不参与蛋白质翻译,但在基因调控中起关键作用,可调节染色质功能、调节无膜核小体的组装和功能、改变细胞质mRNA的稳定性和翻译以及干扰信号通路来影响基因表达[15],并调节DNA、RNA和蛋白质相互作用[16],影响癌症发生、进展和转移, 因此,lncRNA可以发挥致癌或抑制肿瘤的作用[17]。lncRNA的异常表达和铁死亡的异常改变都是肿瘤细胞中的常见现象,并且均与肿瘤进展有关[9],有望成为癌症精确治疗的新靶点。然而,lncRNA和铁死亡之间的联系以及在TNBC中的作用尚不清楚,需要进一步研究。本研究旨在使用生物信息学方法初步探讨铁死亡相关lncRNA在TNBC患者中预后的意义,试图寻找具有潜在利用价值的生物标志物。利用美国癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库鉴定出17个与TNBC预后密切相关的lncRNA,成功构建的风险预测模型可较好地预测TNBC患者预后,间接说明铁死亡相关lncRNA与患者的预后具有相关性。
1 资料与方法 1.1 临床资料选取TCGA数据库(https://portal.gdc.cancer.gov/repository)中2000年1月至2020年12月收录并具有完整随访信息的TNBC样本155例,均经病理检查确诊。患者均为女性。年龄29~85岁,中位年龄52岁;20~40岁20例,> 40~60岁83例,> 60岁52例。肿瘤分期Ⅰ期20例,Ⅱ期113例,Ⅲ期19例,Ⅳ期3例。原发肿瘤浸润T1期30例,T2期109例,T3期12例,T4期4例。淋巴结转移M0期136例,未转移19例;N0期60例,N0 (i-)期31例,N0 (i+)期3例,N1期17例,N1a期19例,N1b期5例,N1c期1例,N1mi期3例,N2期6例,N2a期5例,N3期1例,N3a期2例,N3b期1例,N3c期1例。下载该乳腺癌数据集相关转录组测序RNAseq数据及样本相关临床数据,用于后续分析。
1.2 TNBC差异铁死亡基因筛选基于美国国家生物信息中心数据库(National Center of Biotechnology Information,NCBI)挖掘能够调控肿瘤发生和发展的铁死亡基因382个,用于后续对照分析。提取155例TNBC样本中铁死亡基因,通过R包limma对肿瘤组织和癌旁组织作基因的差异表达分析。对获取的差异铁死亡基因采用Pearson相关性分析法进行共表达分析,以确定差异铁死亡相关的lncRNA,筛选的条件为Pearson相关系数 > 0.4,P < 0.05。
1.3 与TNBC预后有关的铁死亡lncRNA用R语言limma包提取TNBC样本的生存期及生存状态(155例患者生存136例,死亡19例),随访时间2000年1月至2020年12月,用R语言Survival包对基因与TNBC预后时间的关系进行Cox单因素回归分析。以P < 0.05为差异具有统计学意义。HR > 1代表该lncRNA是高危因素,反之为保护因素。
1.4 预后模型的构建与验证通过单变量Cox回归分析筛选出与生存期密切相关的lncRNA(P < 0.05),为了达到最大化减小过度拟合风险的目的,采用LASSO Cox回归分析构建预后模型。回归分析中的自变量为交集lncRNA表达量,因变量是TNBC患者的总体生存率和状态,得出最优模型的lncRNA及对应的回归系数。根据每个lncRNA标准化表达水平及其相应的回归系数计算每例患者的风险评分(风险评分=lncRNA1表达量×相应的回归系数+…+lncRNAn表达量×相应的回归系数)。根据风险评分中位数,将患者分为高风险组和低风险组,运用R包“Survminer”构建生存曲线,采用SPSS 20.0软件进行受试者工作特征(receiver operating characteristic,ROC)曲线分析。预后危险因素的分析采用单因素和多因素Cox回归分析。为了评估模型的独立预后价值,进一步对年龄、TNM分期和分级等单变量进行多变量分析,同时使用SPSS 20.0软件进行ROC曲线分析,对多变量独立预后的价值进行比较。
1.5 功能富集分析通过R软件“ClusterProfiler”对高和低风险组中的差异基因进行基因本体(Gene Ontology,GO)和京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomics,KEGG)分析。
1.6 统计学分析所有数据分析均基于R平台(Version4.0.2)和SPSS 20.0软件。在肿瘤组织和癌旁组织差异分析时采用t检验。高和低风险组组间总生存率比较采用Kaplan-Meier法。对获取的铁死亡基因采用Pearson相关性分析进行共表达分析,以确定与铁死亡相关的lncRNA。采用单因素和多因素Cox回归分析来确定总生存期的独立预后因素。以P < 0.05为差异具有统计学意义。
2 结果 2.1 差异基因及lncRNA基于TCGA数据库下载TNBC数据集相关转录组测序RNAseq数据,收集铁死亡基因382个,提取各铁死亡基因表达量,对肿瘤组织和正常组织进行差异分析,共得出42个差异铁死亡基因(Pearson相关系数 > 0.4,P < 0.05),与差异基因集共表达的lncRNA共计310个。
2.2 铁死亡预后相关lncRNA取与差异铁死亡基因共表达的310个lncRNA进行Cox单因素回归分析显示,17个lncRNA表达水平与TNBC患者生存时间相关(均P < 0.05,表 1)。
| lncRNA | P值 | HR(95%CI) |
| SGMS1-AS1 | 0.039 | 6.731(1.102~41.098) |
| AC103760.1 | 0.008 | 6.251(1.597~24.475) |
| AP001505.1 | 0.006 | 1.056(1.016~1.097) |
| AC015908.2 | < 0.01 | 3.487(1.792~6.787) |
| LINC01014 | 0.004 | 1.059(1.019~1.100) |
| AC084125.4 | 0.010 | 2.239(1.214~4.129) |
| AC105219.1 | 0.002 | 1.168(1.060~1.287) |
| AC010329.1 | 0.002 | 1.549(1.179~2.035) |
| LINC01615 | 0.049 | 1.140(1.000~1.299) |
| AC092164.1 | 0.038 | 1.438(1.021~2.024) |
| AC109322.1 | 0.002 | 1.194(1.066~1.337) |
| AC083967.1 | 0.024 | 1.034(1.004~1.065) |
| TTC39A-AS1 | 0.047 | 2.187(1.011~4.731) |
| LINC02568 | 0.018 | 1.897(1.118~3.218) |
| AL353801.3 | 0.015 | 1.975(1.140~3.421) |
| AL353708.3 | 0.010 | 2.759(1.275~5.971) |
| LINC01910 | 0.046 | 1.580(1.009~2.474) |
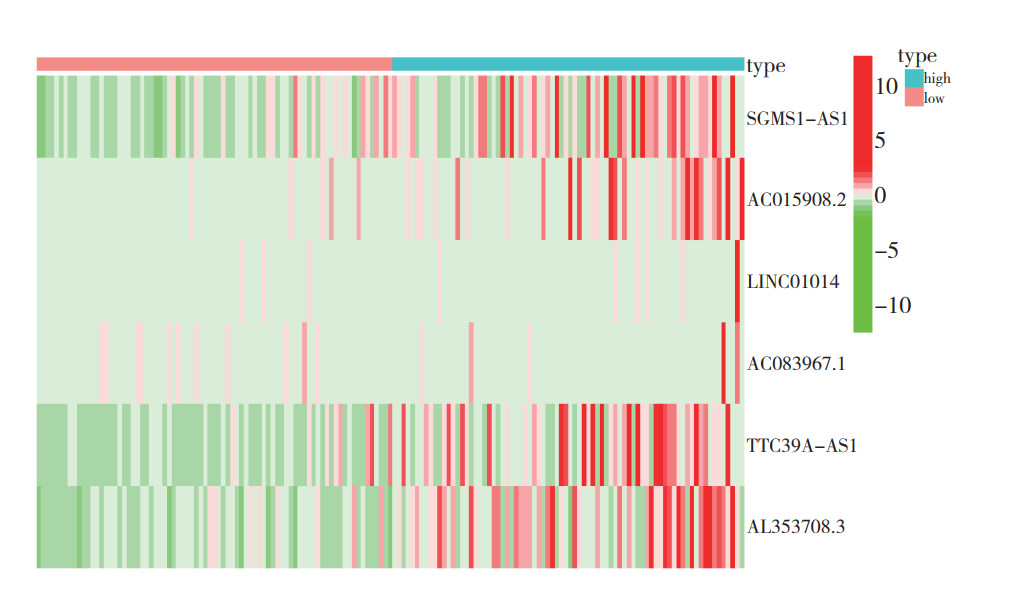
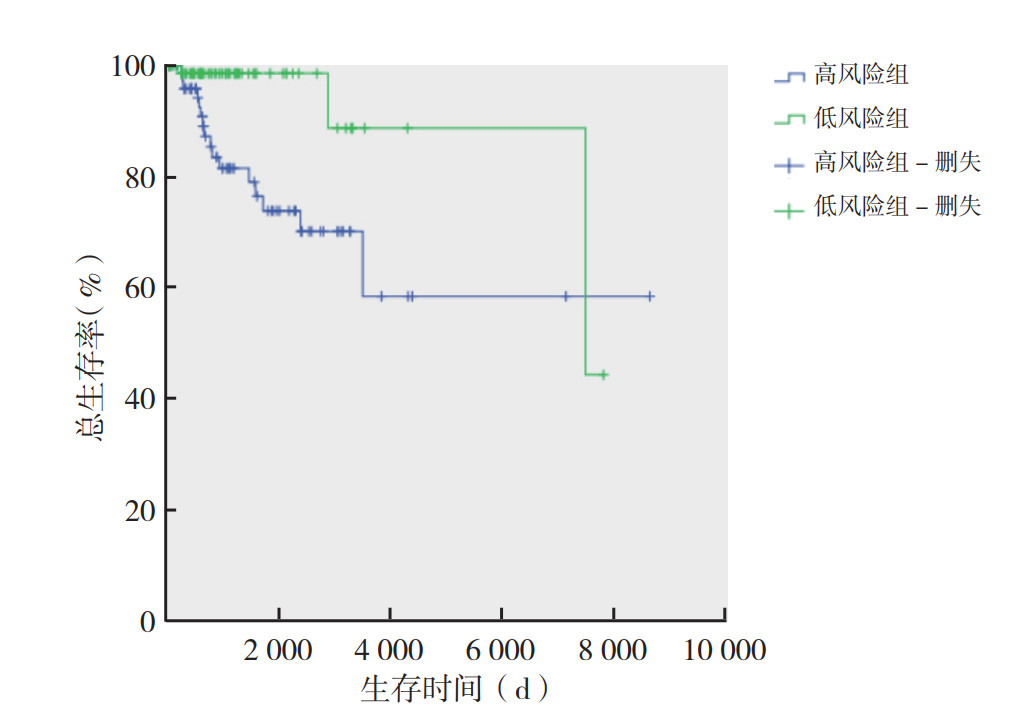
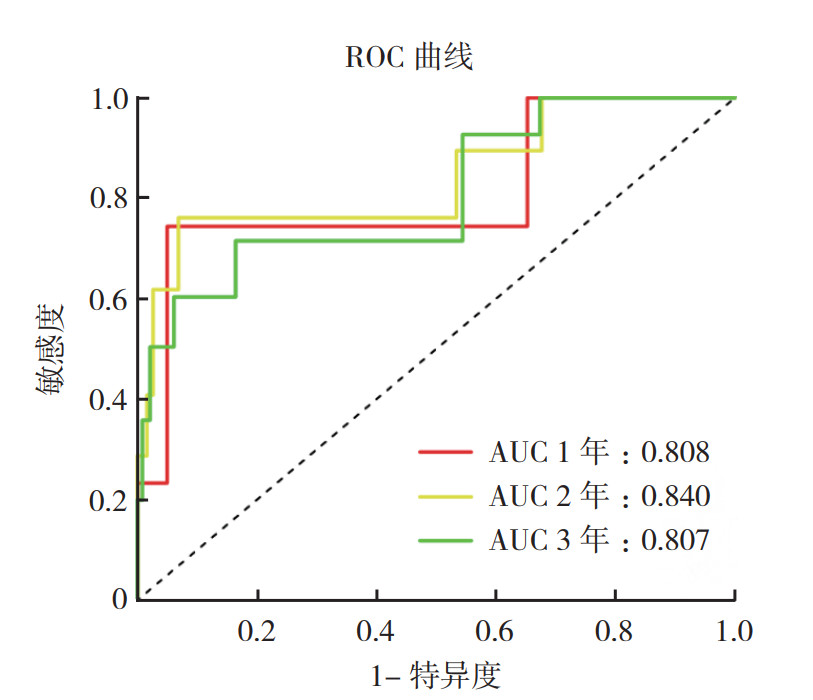
取TNBC患者生存时间相关的这17个lncRNA进行LASSO回归分析,构建TNBC患者生存风险预测模型,最终该模型由其中6个lncRNA(SGMS1-AS1、AC015908.2、LINC01014、AC083967.1、TTC39A-AS1和AL353708.3)构成(图 1)。根据每个lncRNA标准化表达水平及其相应的回归系数计算每例患者的风险评分。根据得到的风险评分将患者分为高风险组和低风险组,Kaplan-Meier法进行生存分析表明,两组患者生存时间比较,差异具有统计学意义(P=0.009,图 2)。该模型预测TNBC患者1、2和3年总生存率的ROC曲线下面积(area under the curve,AUC)分别为0.808、0.840和0.807(图 3),表明该模型的敏感度和特异度较高。
|
| 图 1 TNBC患者风险评分预测模型中lncRNA表达情况 Fig.1 LncRNA expression in a risk score prediction model for TNBC patients |
|
| 图 2 高风险组和低风险组TNBC患者的总生存曲线 Fig.2 Overall survival curves for TNBC patients in the high and low risk groups |
|
| 图 3 TNBC患者生存风险预测模型ROC曲线 Fig.3 ROC curve for survival risk prediction model for TNBC patients |
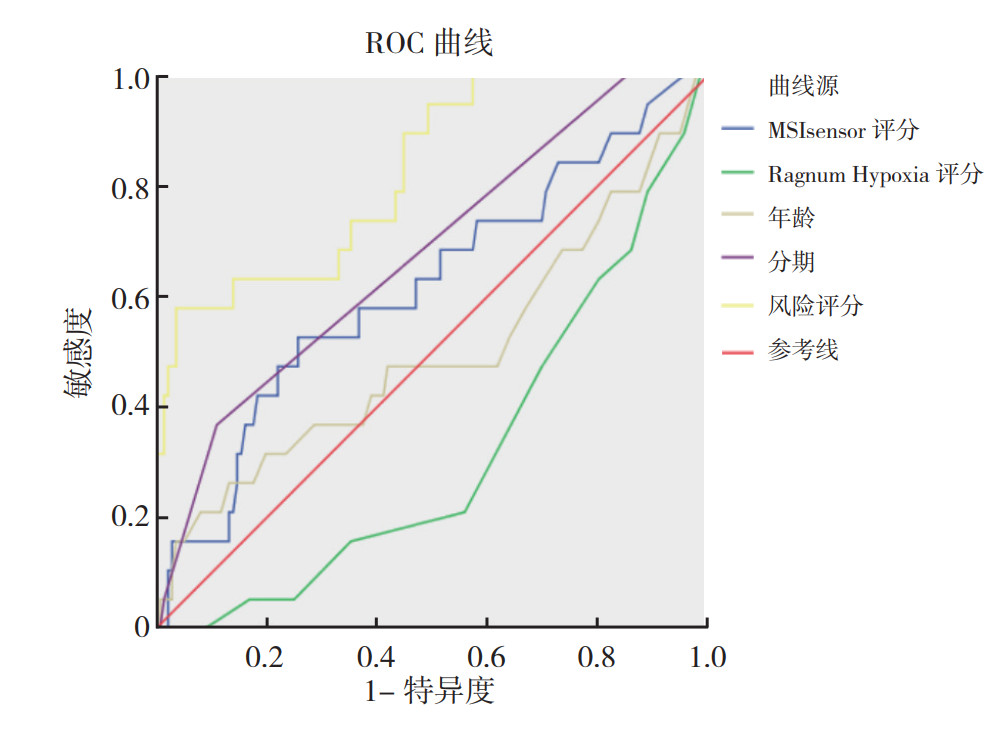
将风险评分作为变量,结合其他临床病理特征(年龄、TNM分期、Ragnum Hypoxia评分和MSIsensor评分)进行单变量和多变量Cox回归分析来识别与预后相关的危险因素,结果显示风险评分可作为独立预后指标(P < 0.01, 表 2)。对变量MSIsensor评分、Ragnum Hypoxia评分、年龄、分期和风险评分进行独立预后价值比较,AUC分别为0.617、0.318、0.500、0.676和0.824(图 4),表明本风险模型可较好地预测TNBC患者预后。
| 变量 | 单因素分析 | 多因素分析 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 年龄 | 1.020(0.984~1.057) | 0.275 | 1.028(0.990~1.067) | 0.125 | |
| Ragnum Hypoxia评分 | 0.907(0.831~0.990) | 0.028 | 1.134(0.803~0.986) | 0.026 | |
| MSIsensor评分 | 1.171(0.968~1.419) | 0.105 | 0.890(0.825~1.560) | 0.438 | |
| 分期 | 1.701(1.071~2.702) | 0.024 | 1.410(0.824~2.363) | 0.192 | |
| 风险评分 | 1.100(1.066~1.137) | < 0.01 | 1.104(1.065~1.146) | < 0.01 | |
|
| 图 4 MSIsensor评分、Ragnum Hypoxia评分、年龄、分期和风险评分预测TNBC患者生存时间的ROC曲线 Fig.4 ROC curves of MSIsensor score, Ragnum Hypoxia score, age, stage, and risk score predicting survival time of TNBC patients |
通过GO和KEGG通路富集分析42个差异铁死亡基因的生物学功能(图 5)。在生物过程方面,主要集中在对氧化应激的反应、对金属离子的反应、对类固醇激素的反应、对活性氧的反应和细胞对氧化应激的反应。关于分子功能,主要集中在铁离子结合、氧化作用与烟酰胺腺嘌呤二核苷酸(磷酸)[nicotinamide adenine diuncleotide (phosphate) hydrogen,NAD(P)H]还原酶活性、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP)活性、作用于供体CH-OH基团和类固醇脱氢酶活性。KEGG通路分析集中在人类T淋巴细胞白血病病毒Ⅰ型(human T-lymphotropic virus type 1,HTLV-1)感染、癌症、核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain,NOD)受体信号通路、肿瘤坏死因子(tumor necrosis factor,TNF)信号通路、类固醇激素生物合成、沙门氏菌感染和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路等。
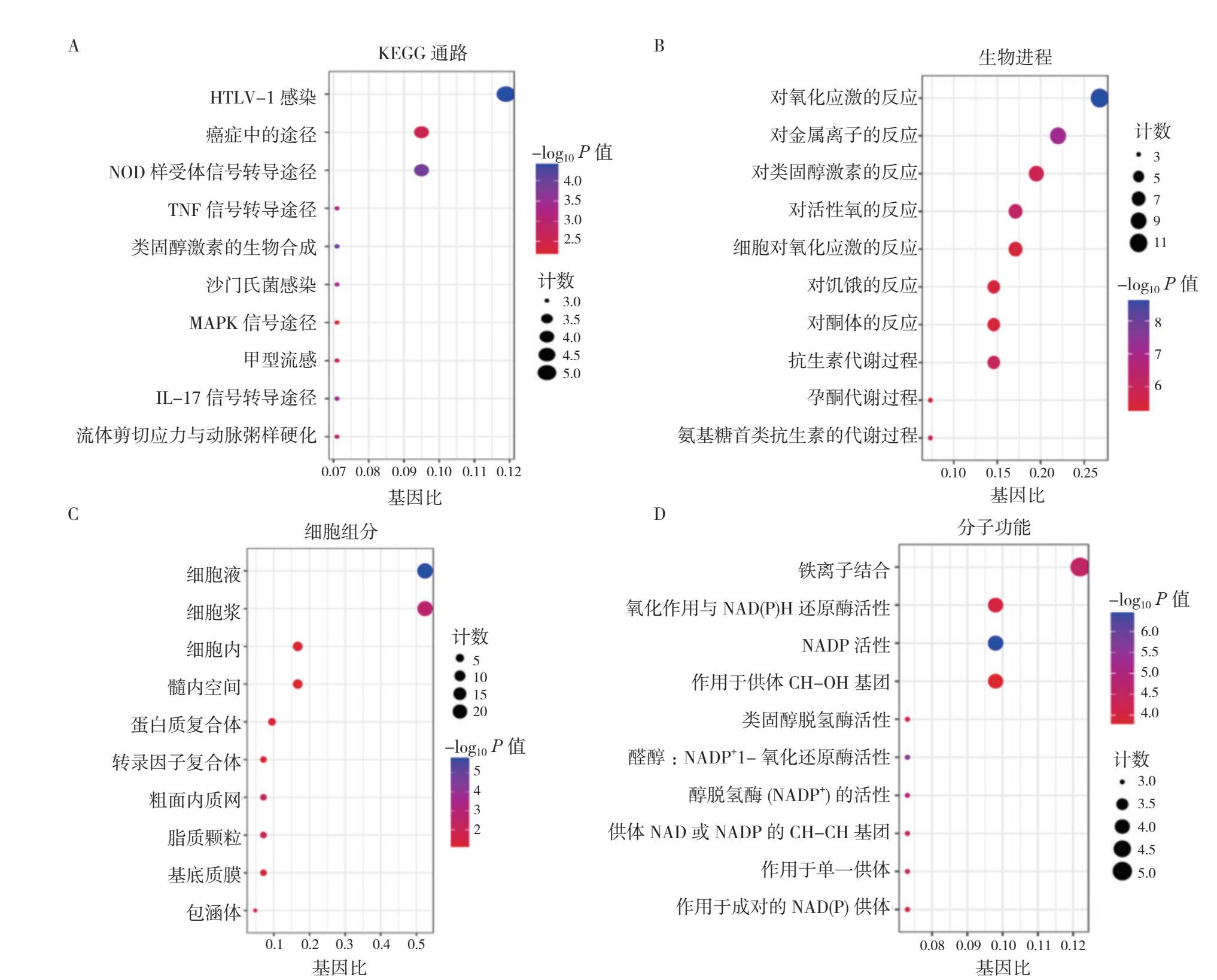
|
| 注 A:KEGG通路富集分析;B:生物进程;C:细胞组分;D:分子功能;HTLV-1:人类T淋巴细胞白血病病毒Ⅰ型(human T-lymphotropic virus type 1);NOD:核苷酸结合寡聚化结构域(nucleotide-binding oligomerization domain);TNF:肿瘤坏死因子(tumor necrosis factor);MAPK:丝裂原活化蛋白激酶(mitogen-activated protein kinases);IL-17:白细胞介素-17(interleukin 17);NAD(P)H:烟酰胺腺嘌呤二核苷酸(磷酸)[nicotinamide adenine diuncleotide (phosphate) hydrogen];NADP:烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate);NAD:烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide) 图 5 TNBC肿瘤组织-正常乳腺组织差异基因功能富集和KEGG通路富集 Fig.5 Functional enrichment of TNBC tumor tissue-normal breast tissue differential gene and KEGG pathway enrichment |
乳腺癌是女性中最常见的癌症,尽管已经应用手术、放疗、化疗、内分泌治疗和靶向治疗等手段进行治疗,但乳腺癌患者的预后仍不令人满意。TNBC患者无法从内分泌治疗或曲妥珠单抗中获益[13],此外,BRCA1基因突变在TNBC患者中以高频率存在,导致TNBC侵袭性增加,所有这些特征都导致TNBC患者的不良预后[18]。因此,迫切需要为这些需要更精确干预的患者开发新的治疗管理。
肿瘤免疫微环境与体内铁代谢和体内平衡有关,铁死亡可以暴露肿瘤抗原,从而提高TIME的免疫原性和免疫治疗的效果[19],在肿瘤免疫中起关键作用[20]。另外铁死亡在肿瘤的治疗中显示出巨大的潜力,特别是在耐药的情况下增强对化疗药物的敏感性,如顺铂联合铁死亡诱导剂erastin能改善抗肿瘤活性[21]。研究显示,TNBC对铁死亡较敏感,触发乳腺癌的铁死亡细胞死亡似乎是一种有效的治疗策略。因此,更好地了解调节铁死亡敏感性的过程有助于发现新的治疗策略以改善TNBC的治疗疗效[8]。
近年来,随着高通量测序技术的发展,大量的非编码基因被发现在肿瘤的发生和发展中起重要作用。lncRNA作为一种转录因子在多种生物过程中发挥着至关重要的作用,在肿瘤的发生和发展以及肿瘤细胞的浸润转移过程中扮演着重要的角色[15]。lncRNA的异常表达和铁死亡的异常改变都是肿瘤细胞中的常见现象,并且均与肿瘤进展有关[22]。本研究探讨铁死亡相关的lncRNA与TNBC预后之间的关联。研究结果表明,共17个lncRNA与TNBC的预后相关。进一步构建的由6个铁死亡相关lncRNA组成的TNBC风险预测模型可有效地将患者分为低风险组和高风险组,组间预后存在差异,说明6个铁死亡相关的lncRNA可能是TNBC的良好预后因素。其中LINC01014是新发现的磷脂酰肌醇-3-激酶催化亚基α(phosphatidylinositol 3-kinase catalytic subunit alpha,PIK3CA)对应的lncRNA,PIK3CA的突变导致肿瘤转化,从而加速癌症进展。而在乳腺癌患者中PIK3CA的突变较为普遍,PIK3CA突变在TNBC、人类表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)阳性乳腺癌中和HR+/HER2-型乳腺癌中的发生率分别为16%、31%和42%[23]。LINC01014低表达可抑制PIK3CA,并通过调节PI3K-AKT-mTOR信号通路增强癌细胞对铁死亡的敏感性,可提高食管癌吉非替尼化疗的敏感性,达到增强癌症的治疗效果[24-25]。研究显示,SGMS1-AS1可能通过调节miR-106a-5p抑制肺腺癌的进展[26]。另有研究指出,miR-106a-5p参与调节乳腺癌细胞中信号传导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)诱导的铁死亡,被认为是治疗乳腺癌的潜在靶点[27]。以上结果为SGMS1-AS1调节铁死亡抑制肿瘤进展提供潜在可能。TTC39A-AS1在细胞核和细胞质中都有分布,当敲低TTC39A-AS1时会使乳腺癌细胞周期阻滞在G1期,并下调雌激素靶基因的表达,促进乳腺癌细胞的生长增殖和克隆形成;因其仅在乳腺癌中特异性高表达属性,故可作为非常有前景的潜在的乳腺癌治疗靶点[28]。
在肿瘤进展中,lncRNA介导的铁死亡有广阔的研究前景。本研究只初步探索了铁死亡相关lncRNA的预测预后的能力,而TNBC中铁死亡相关lncRNA的具体机制及相互联系尚未完全了解。本研究存在不足之处:本研究的预测模型仅在TCGA数据集上得到验证,未来需评估是否适用于临床患者;本研究基于传统的统计方法,尽管很多研究已经证明这些方法的可行性,但仍需开发更多的方法来提高预后模型的准确性。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
Chen WQ, Sun KX, Zheng RS, et al. Cancer incidence and mortality in China, 2014[J]. Chin J Cancer Res, 2018, 30(1): 1-12. DOI:10.21147/j.issn.1000-9604.2018.01.01 |
| [3] |
Wild CP, Weiderpass E, Stewart BW. World Cancer Report: Cancer research for cancer prevention[M]. Lyon: International Agency for Research on Cancer, 2020: 382-393.
|
| [4] |
黄佳欢, 雷蕾, 王晓稼. 白蛋白结合型紫杉醇治疗晚期乳腺癌的研究进展[J]. 实用肿瘤杂志, 2021, 36(6): 496-501. DOI:10.13267/j.cnki.syzlzz.2021.099 |
| [5] |
郑思悦, 陈楚莹, 陈佳艺, 等. 乳腺癌的术前放疗: 差异化人群, 差异化目标[J]. 实用肿瘤杂志, 2021, 36(2): 99-104. |
| [6] |
Goldhirsch A, Wood WC, Coates AS, et al. Strategies for subtypes: dealing with the diversity of breast cancer: highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011[J]. Ann Oncol, 2011, 22(8): 1736-1747. DOI:10.1093/annonc/mdr304 |
| [7] |
Gradishar WJ, Anderson BO, Balassanian R, et al. Breast cancer, version 4. 2017, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2018, 16(3): 310-320. DOI:10.6004/jnccn.2018.0012 |
| [8] |
Li ZQ, Chen LN, Chen C, et al. Targeting ferroptosis in breast cancer[J]. Biomark Res, 2020, 8(1): 58. DOI:10.1186/s40364-020-00230-3 |
| [9] |
Chen X, Kang R, Kroemer G, et al. Broadening horizons: the role of ferroptosis in cancer[J]. Nat Rev Clin Oncol, 2021, 18(5): 280-296. DOI:10.1038/s41571-020-00462-0 |
| [10] |
Doll S, Proneth B, Tyurina YY, et al. ACSL4 dictates ferroptosis sensitivity by shaping cellular lipid composition[J]. Nat Chem Biol, 2017, 13(1): 91-98. DOI:10.1038/nchembio.2239 |
| [11] |
Albrecht P, Lewerenz J, Dittmer S, et al. Mechanisms of oxidative glutamate toxicity: the glutamate/cystine antiporter system xc- as a neuroprotective drug target[J]. CNS Neurol Disord Drug Targets, 2010, 9(3): 373-382. DOI:10.2174/187152710791292567 |
| [12] |
Chen MS, Wang SF, Hsu CY, et al. CHAC1 degradation of glutathione enhances cystine-starvation-induced necroptosis and ferroptosis in human triple negative breast cancer cells via the GCN2-eIF2α-ATF4 pathway[J]. Oncotarget, 2017, 8(70): 114588-114602. DOI:10.18632/oncotarget.23055 |
| [13] |
Zhang Z, Lu ML, Chen CL, et al. Holo-lactoferrin: the link between ferroptosis and radiotherapy in triple-negative breast cancer[J]. Theranostics, 2021, 11(7): 3167-3182. DOI:10.7150/thno.52028 |
| [14] |
Yu MY, Gai CC, Li Z, et al. Targeted exosome-encapsulated erastin induced ferroptosis in triple negative breast cancer cells[J]. Cancer Sci, 2019, 110(10): 3173-3182. DOI:10.1111/cas.14181 |
| [15] |
Statello L, Guo CJ, Chen LL, et al. Gene regulation by long non-coding RNAs and its biological functions[J]. Nat Rev Mol Cell Biol, 2021, 22(2): 96-118. DOI:10.1038/s41580-020-00315-9 |
| [16] |
Robinson EK, Covarrubias S, Carpenter S. The how and why of lncRNA function: an innate immune perspective[J]. Biochim Biophys Acta Gene Regul Mech, 2020, 1863(4): 194419. DOI:10.1016/j.bbagrm.2019.194419 |
| [17] |
Peng WX, Koirala P, Mo YY. lncRNA-mediated regulation of cell signaling in cancer[J]. Oncogene, 2017, 36(41): 5661-5667. DOI:10.1038/onc.2017.184 |
| [18] |
Alli E, Sharma VB, Sunderesakumar P, et al. Defective repair of oxidative DNA damage in triple-negative breast cancer confers sensitivity to inhibition of poly(ADP-ribose) polymerase[J]. Cancer Res, 2009, 69(8): 3589-3596. DOI:10.1158/0008-5472.CAN-08-4016 |
| [19] |
Ganz T, Nemeth E. Iron homeostasis in host defence and inflammation[J]. Nat Rev Immunol, 2015, 15(8): 500-510. DOI:10.1038/nri3863 |
| [20] |
Wang WM, Green M, Choi JE, et al. CD8+ T cells regulate tumour ferroptosis during cancer immunotherapy[J]. Nature, 2019, 569(7755): 270-274. DOI:10.1038/s41586-019-1170-y |
| [21] |
Hangauer MJ, Viswanathan VS, Ryan MJ, et al. Drug-tolerant persister cancer cells are vulnerable to GPX4 inhibition[J]. Nature, 2017, 551(7679): 247-250. DOI:10.1038/nature24297 |
| [22] |
Lu L, Liu LP, Zhao QQ, et al. Identification of a ferroptosis-related lncRNA signature as a novel prognosis model for lung adenocarcinoma[J]. Front Oncol, 2021, 11: 675545. DOI:10.3389/fonc.2021.675545 |
| [23] |
Martínez-Sáez O, Chic N, Pascual T, et al. Frequency and spectrum of PIK3CA somatic mutations in breast cancer[J]. Breast Cancer Res, 2020, 22(1): 1-45. DOI:10.1186/s13058-019-1178-0 |
| [24] |
Yi JM, Zhu JJ, Wu J, et al. Oncogenic activation of PI3K-AKT-mTOR signaling suppresses ferroptosis via SREBP-mediated lipogenesis[J]. Proc Natl Acad Sci USA, 2020, 117(49): 31189-31197. DOI:10.1073/pnas.2017152117 |
| [25] |
Fu X, Cui GH, Liu SS, et al. Linc01014 regulates gefitinib resistance in oesophagus cancer via EGFR-PI3K-AKT-mTOR signalling pathway[J]. J Cell Mol Med, 2020, 24(2): 1670-1675. DOI:10.1111/jcmm.14860 |
| [26] |
Liu T, Yang CL, Wang WZ, et al. lncRNA SGMS1-AS1 regulates lung adenocarcinoma cell proliferation, migration, invasion, and EMT progression via miR-106a-5p/MYLI9 axis[J]. Thorac Cancer, 2021, 12(14): 2104-2112. DOI:10.1111/1759-7714.14043 |
| [27] |
Zhang HM, Ge ZC, Wang ZH, et al. Circular RNA RHOT1 promotes progression and inhibits ferroptosis via mir-106a-5p/STAT3 axis in breast cancer[J]. Aging (Albany NY), 2021, 13(6): 8115-8126. |
| [28] |
张君娜. lncRNA-TTC39A-AS1通过调控雌激素受体靶基因促进雌激素受体阳性乳腺癌细胞生长增殖[J]. 现代肿瘤医学, 2020, 28(9): 1426-1433. |
 2022, Vol. 37
2022, Vol. 37


