文章信息
- 马云秀, 李东海, 赵甲升
- 甲状旁腺腺瘤的临床病理观察
- 实用肿瘤杂志, 2021, 36(6): 562-565
-
通信作者
- 马云秀, E-mail: 18919178858@163.com
-
文章历史
- 收稿日期:2020-06-15
甲状旁腺腺瘤为甲状旁腺实质细胞发生的良性肿瘤,临床较少见,术前不易诊断,确诊常需依据病理检查。为提高对该病的认识,本文报道6例,并复习相关文献探讨其临床和病理学特征、诊断和鉴别诊断。
1 资料与方法 1.1 一般资料收集兰州市第一人民医院病理科2016年3月至2018年10月诊断的6例甲状旁腺腺瘤的临床资料。
1.2 方法标本均经4%甲醛固定,石蜡包埋,3 μm厚切片并行常规HE染色。免疫组织化学染色采用MaxVision两步法(即用型快捷免疫组织化学MaxVisionTM3/HRP试剂盒),所用一抗Vimentin、B细胞淋巴瘤-2(B cell lymphoma-2,Bcl-2)、嗜铬素A(chromogranin A,CgA)、细胞角蛋白19(cytokeratin 19,CK19)、细胞角蛋白(广谱)[cytokeratin(pan),CK(pan)]、CyclinD1、甲状腺球蛋白(thyroglobulin,Tg)、降钙素(calcitonin,CT)、甲状旁腺素(parathyroid hormone,PTH)和Ki-67以及二抗均购自福州迈新生物技术开发有限公司。免疫组织化学染色步骤严格按照试剂盒说明书进行。
2 结果 2.1 临床资料6例患者中女性4例,男性2例;年龄45~62岁,平均52岁;均为临床发现颈部无痛性包块,以甲状腺肿收住入院。2例腹部B型超声提示有肾结石;5例血清钙升高,血磷降低;1例血清钙正常,血磷降低;2例B型超声提示囊性变。
2.2 病理检查肿瘤为灰红色肿块,最大径2~7 cm,表面大部光滑,切面为囊状或实性,灰红色质软,1例包膜不完整与周围组织黏连。镜检:肿瘤细胞弥漫分部,局部呈巢状、滤泡状排列,肿瘤细胞为主细胞、嗜酸性细胞、水样透明细胞和各种过度细胞混合存在,5例以主细胞为主,另1例以嗜酸性细胞为主,肿瘤细胞形态单一,核中等大小,未见核分裂相,间质血窦丰富。6例肿瘤细胞均形态单一,核中等大小,未见核分裂相,间质血窦丰富,1例肿瘤组织浸润包膜并局部坏死(图 1)。
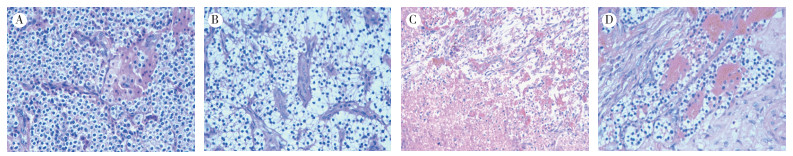
|
| 注 A:肿瘤细胞弥漫分布,以主细胞为主,内见嗜酸性细胞,瘤细胞形态单一,核中等大小,未见核分裂相,间质血窦丰富(HE×400);B:肿瘤细胞为水样透明细胞(HE×400);C:非典型腺瘤,肿瘤组织内可见出血坏死(HE×200);D:非典型腺瘤,局部肿瘤组织浸润包膜(HE×400) 图 1 甲状旁腺腺瘤病理检查结果 |
肿瘤细胞PTH、CK19、CK(pan)和Bcl-2均阳性,5例CgA阳性,1例阴性,5例CyclinD1阴性,1例阳性(阳性者为非典型腺瘤),6例Tg、CT和Vimentin均阴性,5例Ki-67阳性细胞数为1%~2%,另1例非典型腺瘤Ki-67阳性细胞数为5%(图 2)。5例病理诊断为甲状旁腺腺瘤,1例诊断为非典型腺瘤。随访至今未见复发或转移。
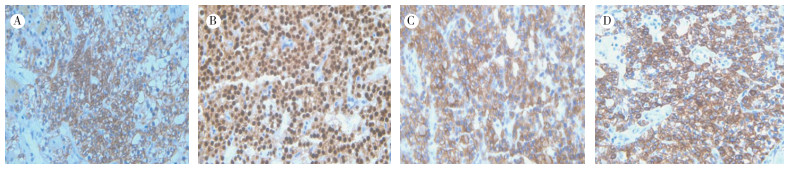
|
| 注 A:免疫表型PTH阳性B:非典型腺瘤免疫表型CyclinD1阳性;C:免疫表型CK19阳性;D:免疫表型CgA阳性 图 2 甲状旁腺腺瘤免疫组织化学检查结果(SP×400) |
甲状旁腺腺瘤为甲状旁腺实质细胞发生的良性肿瘤,临床较少见,目前病因尚不明确,有人认为可能与头部和颈部接触过放射线有关[1]。细胞分裂周期73基因(cell division cycle 73,CDC73)是位于1号染色体q21-q31上的基因,被认为是一种肿瘤抑制基因,其在一些影响甲状旁腺功能紊乱的疾病中处于失活状态。甲状旁腺腺瘤与HRPT2基因相关联,该基因与甲状旁腺功能亢进症有一定的关系。甲状旁腺腺瘤是甲状旁腺功能亢进的常见原因[2]。非典型腺瘤是腺瘤的一种特殊类型,世界卫生组织(World Health Organization,WHO)关于非典型腺瘤的定义比较模糊,即肿瘤没有明确的包膜和血管侵犯的证据,其他特征与甲状旁腺癌相似[3]。
3.1 临床特点甲状旁腺腺瘤女性多见,男女比约为1∶3,任何年龄均可发生,但发病高峰年龄是50岁和60岁,也有数例发生于儿童的病例报道[4]。约75%的腺瘤累及1个下部甲状旁腺,15%累及1个上部甲状旁腺,其余10%发生于异位甲状旁腺。甲状旁腺腺瘤可发生在甲状腺内、食管后和纵隔,罕见情况下,也可发生于心包内、迷走神经或颌下腺等部位[5]。甲状旁腺腺瘤患者典型的临床表现为高钙血症和低磷血症,并血清PTH升高,部分患者有泌尿系结石,有少数病例报道以眼睑痉挛为主要表现。国内有报道原发性甲状旁腺功能亢进症的患者恶性组术前血钙及PTH水平较良性组大幅度升高[6],国外也有类似研究,良性病变组PTH可升高至正常上限的2倍左右[7],甲状旁腺癌组可升高至5~10倍[8]。因此,临床发现患者PTH及血钙水平较高时,应警惕甲状旁腺癌。
3.2 组织学特点大体多表现为棕褐色,有包膜的肿块,肿瘤大小和质量差别很大,多数腺瘤很小,以至于颈部触诊时不能发现。腺瘤可以发生灶性出血、钙化和囊性变。镜检肿瘤细胞弥漫分布、巢状、滤泡状或假乳头状排列,肿瘤细胞为主细胞、嗜酸性细胞、水样透明细胞和各种过度细胞混合存在或以一种细胞为主,形态单一,核中等大小,缺乏核分裂像,间质血窦丰富,少见病例可出现富含染色质的奇异细胞核的肿瘤细胞,与其他内分泌器官(如肾上腺和甲状腺等)肿瘤类似,细胞的非典型性、核分裂活性和坏死并不能作为恶性的诊断依据[3]。个别病例可见散在明显的成熟性B和T淋巴细胞,偶尔混有浆细胞,其可能伴肿瘤细胞的退行性改变,可能有或无自身免疫性发病机制[9]。本组中5例以主细胞为主,1例以嗜酸性细胞为主,细胞均未见明显异型性,但1例出现包膜侵犯和坏死组织故诊断为非典型腺瘤。甲状旁腺非典型腺瘤和甲状旁腺癌的共同特征包括:(1)肿瘤与周围组织黏连;(2)不规则宽大胶原纤维带;(3)肿瘤细胞呈实体状、巢片状或梁状生长,而不是呈滤泡样或腺泡样排列;(4)肿瘤细胞的非典型性;(5)核分裂活性;(6)凝固性坏死;(7)包膜增厚及侵犯。如果腺瘤中出现≥2个上述特征,同时又不具有诊断甲状旁腺癌的可靠证据,即可诊断为非典型腺瘤[10]。有学者把具有包膜和血管侵犯而未穿透包膜、无淋巴结及远处转移的甲状旁腺肿瘤定义为微小浸润性甲状旁腺癌[11],但笔者认为定义为非典型腺瘤更为准确。
3.3 免疫组织化学甲状旁腺腺瘤表达PTH、各种类型的角蛋白和神经内分泌标志物如CgA、突触素(synaptophysin,Syn)和神经元特异性烯醇化酶(neuron specific endolase,NSE),腺瘤的PTH染色强度一般比周围残存的正常腺体弱。腺瘤细胞还表达神经纤维细丝蛋白(neurofilament,NF)而在正常甲状旁腺细胞中不表达。本组中1例非典型腺瘤表达CyclinD1,其余5例均阴性,CyclinD1阳性是否提示肿瘤预后不良有待更多的研究。
3.4 鉴别诊断 3.4.1 主细胞增生由于95%的原发性甲状旁腺功能亢进是由腺瘤和主细胞增生引起,所以二者的鉴别是病理和外科医师最常遇到的问题,从手术范围来说如为腺瘤只需行腺瘤切除,如为增生则应把3个甲状旁腺全部切除,第4个甲状旁腺作次全切除。原发性主细胞增生一般外形不规则无包膜,镜下形态与腺瘤相似,轻度核异型性可见于增生,但如果异型很明显并有完整包膜,则应考虑为腺瘤,一般腺瘤间质内无脂肪细胞,细胞内脂质少,与正常甲状旁腺无移行过程和无小叶结构,其次肿块周围有一圈正常的甲状旁腺实质,并且确定有≥1个正常的甲状旁腺,应考虑腺瘤。如果≥2个腺体增大和异常,则应考虑原发性主细胞增生。免疫组织化学检查结果在甲状旁腺增生和腺瘤中无明显差异,但甲状旁腺增生时p27阳性细胞数量3倍于腺瘤,提示免疫组织化学检查p27可用于区别增生和腺瘤。
3.4.2 甲状旁腺癌多数甲状旁腺癌显示明显的非典型性,一般核增大和大核仁是最重要的诊断线索,核的多型性在甲状旁腺癌和甲状旁腺腺瘤中都较常见,所以甲状旁腺腺瘤和甲状旁腺癌的鉴别非常困难,但诊断甲状旁腺癌的确切依据为:血管侵犯、周围神经侵犯、穿透包膜并在邻近组织中生长和(或)转移,血管侵犯应该在肿瘤包膜或周围软组织,而不是在肿瘤内部。肿瘤组织中出现坏死、大核仁和核分裂像 > 5/50高倍视野(high power field,HPF)构成的三组合,也提示甲状旁腺癌的可能性大,核分裂在鉴别良恶性上最有价值,因正常甲状旁腺和甲状旁腺腺瘤中无或极少有核分裂。目前尚无可以作为甲状旁腺良恶性肿瘤鉴别诊断的抗体。p53、Bcl-2、CyclinD1以及视网膜母细胞瘤基因蛋白(retinoblastoma gene protein,Rb)对良恶性肿瘤诊断的意义有不少报道,但结果并不一致。国内外研究报道,CgA和Syn在甲状旁腺癌中表达较甲状旁腺腺瘤中减少,另外Ki-67增殖指数 > 5%时,提示恶性变和复发的高风险[12]。2004年,Tan等[13]开发抗parafibromin蛋白的单克隆抗体,并报道parafibromin蛋白的缺失对确诊甲状旁腺癌的敏感度为96%,特异度为99%,肿瘤细胞核中parafibromin的完全缺失对辅助诊断甲状旁腺癌是非常有帮助的。近年来有学者进行统计学研究,在预测甲状旁腺癌患者预后方面,parafibromin免疫组织化学染色阴性比CDC73测序更有前景[14]。
3.4.3 甲状腺病变甲状旁腺腺瘤内可见滤泡,易与甲状腺组织混淆,在一些腺瘤中见到正常甲状旁腺的边缘有助于腺瘤的诊断。甲状旁腺腺瘤中的乳头状形态易被误诊为甲状腺乳头状癌,但缺乏乳头状癌细胞核的特点。此外免疫组织化学检查PTH、甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)和Tg有助于鉴别诊断。
3.5 治疗和预后典型的甲状旁腺腺瘤为良性肿瘤,手术完整切除后即可治愈。偶尔,可遇到双叶或多叶腺瘤不易完全切除,手术时腺瘤包膜的破坏可引起腺瘤样甲状旁腺种植,引起甲状旁腺功能亢进的复发。非典型腺瘤是恶性潜能未定的肿瘤,这些患者术后应该密切随访,如果出现甲状旁腺功能亢进症以及局部复发和(或)转移的症状即为甲状旁腺癌。
| [1] |
Rahbari R, Sansano IG, Elaraj DM. Prior head and neck radiation exposure is not a contraindication to minimally invasive parathyroidectomy[J]. J Am Coll Surg, 2010, 210(6): 942-948. DOI:10.1016/j.jamcollsurg.2010.02.041 |
| [2] |
朱鸿虹, 王伟斌, 吴伟强, 等. 原发性色素性结节性肾上腺皮质病伴罕见甲状旁腺腺瘤一例[J]. 实用肿瘤杂志, 2019, 34(4): 370-373. |
| [3] |
Delellis RA, Lloyd RV, Heitz PU, et al. World Health Organization classification of tumours. Pathology and genetics of tumours of endocrine organs[M]. Lyon: IABC Press, 2004: 124-126.
|
| [4] |
Rahman MM, Karim SS, Joarder AI. Parathyroid carcinoma in a 10 years old female child[J]. Mymensingh Med J, 2015, 24(3): 619-623. |
| [5] |
Kong SY, Shang GW, Song K. Ectopic parathyroid adenoma in the submandibular region: a case report[J]. Br J Oral Maxillofac Surg, 2019, 57(10): 1150-1152. DOI:10.1016/j.bjoms.2019.10.296 |
| [6] |
Zhao L, Liu JM, He XY, et al. The changing clinical patterns of primary hyperparathyroidism in Chinese patients: data from 2000 to 2010 in a single clinical center[J]. J Clin Endocrinol Metab, 2013, 98(2): 721-728. DOI:10.1210/jc.2012-2914 |
| [7] |
Kirdak T, Duh QY, Kebebew E, et al. Do patients undergoing parathyroidectomy for primary hyperparathyroidism in San Francisco, CA, and Bursa, Turkey, differ?[J]. Am J Surg, 2009, 198(2): 188-192. DOI:10.1016/j.amjsurg.2008.09.031 |
| [8] |
Marcocci C, Cetani F, Rubin MR, et al. Parathyroid carcinoma[J]. J Bone Miner Res, 2008, 23(12): 1869-1880. DOI:10.1359/jbmr.081018 |
| [9] |
李红, 朱伦, 李跃武. 甲状旁腺腺瘤5例临床病理分析[J]. 临床与实验病理学杂志, 2016, 32(3): 339-340. |
| [10] |
刘宝岳, 左庆瑶, 孙晓淇. 甲状旁腺非典型腺瘤临床病理学观察[J]. 诊断病理学杂志, 2017, 24(7): 524-531. DOI:10.3969/j.issn.1007-8096.2017.07.012 |
| [11] |
Priyanka S, Kumar VS, Nahar SU, et al. Minimally invasive parathyroid carcinoma-A missing entity between parathyroid adenoma and carcinoma: Scintigraphic and histological features[J]. Clin Endocrinol, 2019, 91(6): 842-850. DOI:10.1111/cen.14088 |
| [12] |
张冬雪, 姜涛, 傅月玥, 等. 原发性甲状旁腺功能亢进症84例临床病理分析[J]. 诊断病理学杂志, 2017, 24(7): 481-485. DOI:10.3969/j.issn.1007-8096.2017.07.001 |
| [13] |
Tan MH, Morrison C, Wang P, et al. Loss of parafibromin immunoreactivity is a distinguishing feature of parathyroid carcinoma[J]. Clin Cancer Res, 2004, 10(19): 6629-6637. DOI:10.1158/1078-0432.CCR-04-0493 |
| [14] |
Zhu R, Wang Z, Hu Y. Prognostic role of parafibromin staining and CDC73 mutation in patients with parathyroid carcinoma: A systematic review and metastological featureslinical cenpatient data[J]. Clin Endocrinol, 2020, 92(4): 295-302. DOI:10.1111/cen.14161 |
 2021, Vol. 36
2021, Vol. 36


