文章信息
- 吴均, 任晓秋, 俞勇, 杨君, 潘蕾, 郑庆辉
- Wu Jun, Ren Xiaoqiu, Yu Yong, Yang Jun, Pan Lei, Zheng Qinghui
- 男性乳腺癌临床病理特征及预后分析
- Clinicopathological features and prognosis of male breast cancer
- 实用肿瘤杂志, 2020, 35(6): 517-523
- Journal of Practical Oncology, 2020, 35(6): 517-523
基金项目
- 浙江省医药卫生科技计划项目基金(2020KY500)
-
作者简介
- 吴均(1992-),男,浙江温州人,住院医师,硕士,从事乳腺和甲状腺疾病临床研究.
-
通信作者
- 任晓秋,E-mail: rxq@zju.edu.cn
-
文章历史
- 收稿日期:2019-11-20
2. 浙江大学医学院附属第二医院放疗科,浙江 杭州 310009
2. Department of Radiation Oncology, the Second Affiliated Hospital, Zhejiang University School of Medicine, Hangzhou 310009, China
男性乳腺癌是一种较少见的恶性肿瘤,发病率在恶性肿瘤中 < 1%,约占所有乳腺癌的1%,但近年来其发病率有增长趋势[1-2]。男性乳腺癌较女性预后更差,其5年生存率和总生存率比女性患者分别低约10%和15%,在考虑临床病理因素差异后,男性乳腺癌诊断后的死亡率仍高于女性[3]。男性乳腺癌因病例数有限,难以开展有效的前瞻性临床试验,临床诊治主要参考女性乳腺癌的治疗模式,一般推荐以乳房切除+腋窝前哨淋巴结活检术或改良根治术为主的手术方式,术后辅以必要的放化疗治疗和内分泌治疗[4]。本文目的在于比较国内外男性乳腺癌患者的临床病理特征,利用数据库数据回顾性分析手术及放化疗在不同分期患者中和预后的关系。
1 资料与方法 1.1 一般资料收集2007年3月1日至2019年1月31日期间于浙江大学医学院附属第二医院(n=35)和浙江省立同德医院(n=5)就诊的40例男性乳腺癌患者的临床病理资料,年龄35~82岁,中位年龄64岁。
收集美国肿瘤监测、流行病学和最终结果(The Surveillance, Epidemiology, and End Results,SEER)数据库2010年至2016年登记初诊的3 532例男性乳腺癌患者临床病理资料及预后信息,年龄22~105岁,中位年龄68岁,选取其中3 425例完成随访病例进行生存分析。
1.2 方法将来自上述2家三甲医院的男性乳腺癌患者资料和SEER数据库资料进行汇总对比,比较的临床病理资料包括初诊年龄、一般情况、病理类型、原发灶位置、分期、雌激素受体(estrogen receptor, ER)表达情况、孕激素受体(progesterone receptor,PR)表达情况、人类表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)表达情况、是否手术、是否放化疗、随访时间及生存情况等。分析SEER数据库资料,比较手术和放化疗在不同临床分期患者中和总生存(overall survival,OS)的关系。
1.3 统计学分析采用SPSS 25.0及GraphPad Prism 8软件进行统计学分析和绘图。计数资料采用频数(百分比)表示,组间比较采用Pearson χ2检验或Fisher精确检验。采用Kaplan-Meier法作生存曲线,采用Log-rank进行生存分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床病理特点比较2家三甲医院40例男性乳腺癌初诊平均年龄为63.2岁(中位发病年龄64岁,范围35~82岁),较SEER数据库登记初诊的平均年龄67.3岁(中位发病年龄68岁,范围22~105岁)年轻约4岁(P < 0.01)。两组数据最常见病理类型均为浸润性导管癌,但2家三甲医院的数据显示有约37.8%的患者非此类型,要高于SEER数据库(17.9%,P=0.002;表 1)。最常见的分子亚型均为Luminal A型(导管A型),占 > 80%,其次为Luminal B型(导管B型),均约占13%。ER阳性率均约95%,PR阳性率均约90%,HER2阳性率均仅约13%,国内外数据比较,差异均无统计学意义(均P > 0.05)。TNM分期两组数据比较,差异无统计学意义(P=0.782),2家三甲医院34例(6例不详)患者资料显示,初诊0~Ⅱ期患者约占76.5%(26/34),Ⅲ期占23.5%(8/34),无初诊Ⅳ期患者。SEER数据显示,初诊0~Ⅱ期患者占74.3%(2 487/3 343),Ⅲ期占16.6%(554/3 343),8.6%(302/3 343)的患者初诊即发现远处转移。2家三甲医院39例(1例不详)患者最常见的手术方式为乳房切除+腋窝前哨淋巴结活检(行或未行腋窝清扫),约占53.8%(21/39),其次为改良根治术(15/39,38.5%)。SEER数据库缺乏针对原发灶手术具体手术方式的记录,2家三甲医院40例患者其他临床病理资料总结于表 2。
| 临床特征 | 三甲医院(n=40) | SEER数据库(n=3 532) | χ2值 | P值 | 临床特征 | 三甲医院(n=40) | SEER数据库(n=3 532) | χ2值 | P值 | |
| ER | 0.475 | 0.357 | 化疗史 | 0.038 | 0.846 | |||||
| 阳性 | 34(94.4) | 3 197(96.6) | 有 | 15(37.5) | 1 272(36.0) | |||||
| 阴性 | 2(5.6) | 114(3.4) | 无/不明 | 25(62.5) | 2 260(64.0) | |||||
| 不明 | 4 | 221 | 放疗史 | 3.396 | 0.065 | |||||
| PR | 0.907 | 0.578 | 有 | 5(12.5) | 890(25.2) | |||||
| 阳性 | 34(94.4) | 2 949(89.6) | 无/不明 | 35(87.5) | 2 642(74.8) | |||||
| 阴性 | 2(5.6) | 343(10.4) | 手术史 | 4.371 | 0.036 | |||||
| 不明 | 4 | 240 | 有 | 39(97.5) | 3 038(86.0) | |||||
| HER2 | 0.001 | > 0.999 | 无/不明 | 1(2.5) | 494(14.0) | |||||
| 阳性 | 4(13.3) | 410(13.1) | 原发部位 | 1.800 | 0.180 | |||||
| 阴性 | 26(86.7) | 2 714(86.9) | 左侧 | 25(64.1) | 1 851(53.3) | |||||
| 不明 | 10 | 408 | 右侧 | 14(35.9) | 1 620(46.7) | |||||
| T分期 | 0.472 | 0.794 | 双侧 | 1 | 0 | |||||
| 0~2 | 31(91.2) | 2 883(87.2) | 不明 | 0 | 61 | |||||
| 3~4 | 3(8.8) | 422(12.8) | 分子分型 | 0.008 | 0.607 | |||||
| 不明 | 6 | 227 | HR+/HER2-(Luminal A) | 25(83.3) | 2 640(84.8) | |||||
| N分期 | 3.872 | 0.144 | ||||||||
| 0 | 27(69.2) | 1 923(57.0) | HR+/HER2+(Luminal B) | 4(13.3) | 378(12.1) | |||||
| 1 | 6(15.4) | 1 007(29.8) | ||||||||
| 2~3 | 6(15.4) | 444(13.2) | HR-/HER2+(HER2过表达) | 0(0.0) | 29(0.9) | |||||
| 不明 | 1 | 158 | ||||||||
| M分期 | 3.669 | 0.074 | HR-/HER2-(三阴性) | 1(3.3) | 66(2.1) | |||||
| 0 | 39(100.0) | 3 207(91.4) | ||||||||
| 1 | 0(0.0) | 302(8.6) | 不明 | 10 | 419 | |||||
| 不明 | 1 | 23 | 病理类型 | 9.750 | 0.002 | |||||
| 分期 | 0.076 | 0.782 | 浸润性导管癌 | 23(62.2) | 2 817(82.1) | |||||
| 0~Ⅱ期 | 26(76.5) | 2 487(74.4) | 其他 | 14(37.8) | 616(17.9) | |||||
| Ⅲ~Ⅳ期 | 8(23.5) | 856(25.6) | 不明 | 3 | 99 | |||||
| 不明 | 6 | 189 | ||||||||
| 注 ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterone receptor);HER2:人类表皮生长因子受体2(human epidermal growth factor receptor 2);HR:激素受体(hormone receptor);SEER:美国肿瘤监测、流行病学和最终结果(The Surveillance, Epidemiology, and End Results) | ||||||||||
| 临床特征 | 例数(%) |
| 手术方式 | |
| 单纯乳房切除术 | 2(5.0) |
| 单侧乳房切除+腋窝前哨淋巴结活检 | 18(46.0) |
| 单侧乳房切除+腋窝前哨淋巴结活检+清扫 | 3(8.0) |
| 改良根治术 | 15(38.0) |
| 仅腋窝清扫 | 1(3.0) |
| 不明 | 1 |
| Ki-67 | |
| < 15% | 13(45.0) |
| 15%~30% | 11(38.0) |
| > 30% | 5(17.0) |
| 不明 | 11 |
| AR | |
| 阳性 | 7(100.0) |
| 阴性 | 0(0.0) |
| 不明 | 33 |
| 第二肿瘤 | |
| 有 | 6(15.0) |
| 无/不明 | 34(85.0) |
| 注 AR:雄激素受体(androgen receptor) | |
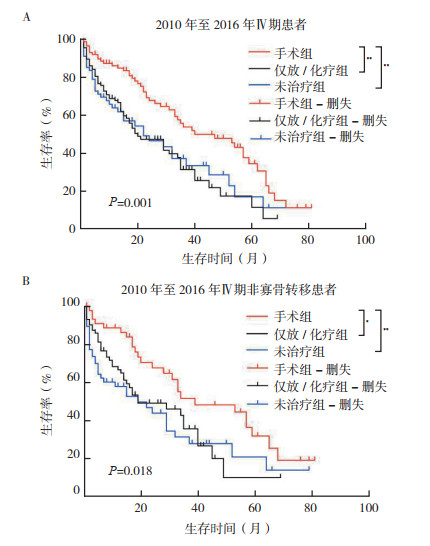
在SEER数据库Ⅰ~Ⅲ期患者中,原发灶手术组(包括仅行手术或手术+辅助放/化疗)患者总生存预后优于未手术组患者(HR=0.196,95%CI:0.117 7~0.324 5,P < 0.01)。在Ⅳ期患者中,原发灶手术组OS也优于仅行放化疗组及未治疗组(P=0.001, 图 1A)。在排除寡骨转移Ⅳ期患者后(即在单个内脏转移或多处转移患者中),原发灶手术组的总体生存仍优于未手术患者(P=0.018, 图 1B),且手术组与非手术组之间原发灶大小(T分期)比较,差异无统计学意义(P=0.499)。
|
| 注 A:原发灶手术在所有Ⅳ期患者中与总生存的关系;B:原发灶手术在非寡骨转移的Ⅳ期患者中与总生存的关系;*P < 0.05;**P < 0.01 图 1 SEER数据库Ⅳ期男性乳腺癌患者原发灶手术与总生存的关系 Fig.1 The correlation between primary lesion excision and overall survival in stage Ⅳ male breast cancer cases from SEER database |
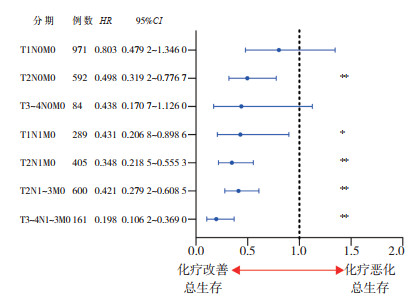
SEER数据库3 532例患者资料显示,有化疗史患者ER和PR阴性率及HER2阳性率更高(P < 0.01),原发灶分化程度更差(P < 0.01),TNM分期也相对更晚(P < 0.01)。在分期为T1N0M0的有原发灶手术史患者中,化疗并不能提高OS(HR=0.803,95%CI:0.479 2~1.346 0,P=0.406),但在T1N1M0(HR=0.431,95%CI:0.206 8~0.898 6,P=0.025)和T2N0M0(HR=0.498,95%CI:0.319 2~0.776 7,P=0.002)患者中,原发灶手术辅以化疗能改善总生存。进一步分析辅助化疗在不同分期术后患者中与OS的关系提示,化疗在原发灶 > 2 cm(HR=0.488,95%CI:0.326 1~0.728 6,P=0.001)或淋巴结阳性非Ⅳ期术后患者(HR=0.496,95%CI:0.397 8~0.617 6,P < 0.01)中能改善OS(图 2)。
|
| 注 *p < 0.05;**p < 0.01 图 2 辅助化疗在SEER数据库不同TNM分期男性乳腺癌患者中与总生存的关系 Fig.2 The correlation between adjuvant chemotherapy and overall survival in male breast cancer cases with different TNM stages from SEER database |
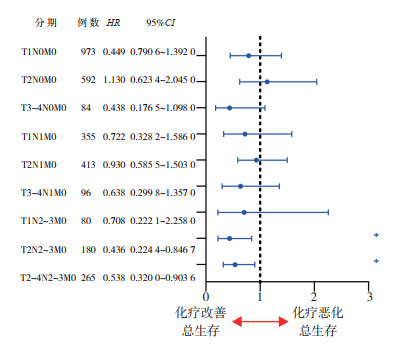
SEER数据显示,有放疗史患者较未放疗患者ER阴性率更高(P=0.002), 但PR阴性率(P=0.170)及HER2阳性率(P=0.840)比较,差异均无统计学意义。有放疗史患者原发灶分化程度更差,T分期和N分期也相对更晚(均P < 0.01)。原发灶手术辅以放疗仅在T2~4N2~3M0分期的男性乳腺癌患者中能改善OS(HR=0.538,95%CI:0.320 0~0.903 6,P=0.019),在更早分期的患者中则不能改善OS(HR=0.937,95%CI:0.776 2~1.131 0,P=0.496,图 3)。
|
| 注 *p < 0.05 图 3 辅助放疗在SEER数据库不同TNM分期男性乳腺癌患者中与总生存的关系 Fig.3 The correlation between adjuvant radiation and overall survival in male breast cancer cases with different TNM stages from SEER database |
本文回顾性分析比较了2家三甲医院40例男性乳腺癌患者及SEER数据库3 532例男性乳腺癌患者的临床病理资料,并分析手术和放化疗在不同分期患者中对OS的影响。结果显示,中国男性乳腺癌患者平均发病年龄可能较国外患者更小。手术不仅能改善Ⅰ~Ⅲ期患者的OS,在存在内脏转移或多发转移的Ⅳ期患者中,针对原发灶的手术也可能改善患者OS。笔者还发现,化疗可在原发灶 > 2 cm或淋巴结阳性非Ⅳ期术后患者中改善OS,放疗仅在T2~4N2~3M0分期的患者中能改善OS。
目前国内外已均有报道提示,男性乳腺癌患者发病年龄要晚于女性[5-6],而在女性乳腺癌患者中,包括我国在内的亚裔女性平均患病年龄普遍比西方女性年轻[7-8]。本研究结果显示,我国男性乳腺癌发病年龄可能也有相似特点——比西方国家年轻。男性乳腺癌与女性比较,其ER和PR表达率更高[9]。本研究也显示ER和PR阳性率达95%,激素受体阳性[包括ER和(或)PR阳性]HER2阴性型占比 > 80%,与已报道数据相仿[10]。男性乳腺癌HER2阳性率一般认为要低于女性,国外一项多国多中心研究报道HER2阳性率约为8.6%(91/1 054)[11],较本研究结果阳性率更低,其他一些小样本研究的报道结果也存在不一致[10],这可能和HER2检测手段的准确性及检测标准的改变有关。目前可以基本明确的是,男性乳腺癌几乎都是激素受体(包括雌激素、孕激素及雄激素受体)阳性的类型,HER2过表达型和三阴型是相当罕见的,如临床病理结果提示为HER2过表达型或三阴性乳腺癌,再次检测复核应是必不可少的。
男性乳腺癌的手术方式一般以全乳切除辅以前哨淋巴结活检或改良根治术为主。本研究数据显示,2家三甲医院39例患者(1例不明)中97.4%(38/39)接受乳房切除术(行或未行腋窝清扫)。保乳手术也可在某些特定的患者中进行,一般只考虑在年龄较大、手术耐受性差或有保乳意愿且能接受术后放疗的患者中选择性进行[12]。研究报道,接受保乳手术的男性乳腺癌患者较接受乳房切除者预后并没有更差[13],但全乳房切除仍是男性乳腺癌较公认的手术方式。针对Ⅳ期患者原发灶手术是否有意义的问题在男性和女性乳腺癌患者中都存在很大争议,一项分析Ⅳ期女性乳腺癌患者原发灶手术与预后关系的荟萃分析报道在某些特定的Ⅳ期患者(包括寡转移、寡骨转移及切缘阴性患者)中,原发灶手术可能改善预后[14]。本研究结果提示,在Ⅳ期男性乳腺癌中,原发灶手术能改善OS,且在排除寡骨转移患者后,原发灶手术仍与更长的OS相关。个别研究报道结果与本研究相似[15-16],但不可否认的是手术可能侧面筛选出了一般情况更好、可以耐受手术的Ⅳ期患者,进一步的结论有待前瞻性临床试验验证。另外,T分期较早、ER阳性及初诊年龄较轻(≤65岁)仍是所有Ⅳ期患者更好预后的相关因素[15-16],原发灶手术仅可考虑在这部分一般情况良好、激素受体阳性、年龄较轻且手术意愿强的特定患者中选择性进行。
辅助化疗在男性乳腺癌中的指征并不完全明确,且并无大样本前瞻性临床研究开展,临床治疗一般参考女性乳腺癌治疗指南进行[4]。本研究结果提示,在原发灶 > 2 cm或淋巴结阳性患者中辅助化疗能改善OS,这与女性乳腺癌的辅助化疗指征相符。一项涵盖134例男性患者的回顾性研究通过单因素生存分析及Cox多因素回归分析提示,辅助化疗并不能提高患者无瘤生存(disease-free survival,DFS)时间,但是可能改善具有高复发风险因素患者的OS[17]。另外,虽然男性和女性乳腺癌的生物学特性存在差别,21基因复发风险评分对男性乳腺癌的预后也具有指导作用,可考虑作为是否行术后化疗的参考[18-19],借鉴女性乳腺癌辅助化疗指南治疗男性患者仍是目前比较可行的方法。辅助放疗在男性乳腺癌中是否能改善预后仍不明确。有研究回顾性分析664例接受乳房切除术的Ⅰ~Ⅲ期男性乳腺癌患者(中位随访时间26.2年)后发现,放疗能改善Ⅲ期患者的远期OS,但不能改善Ⅰ~Ⅱ期患者的生存[20]。另有研究报道,原发灶术后辅助放疗有改善更大肿瘤、淋巴结阳性及分期较晚患者预后的趋势[21]。本研究结果也提示,放疗在T2N2M0以上分期的局部晚期患者中辅助原发灶手术能改善OS,且放疗组ER阴性率更高且分化程度更差,提示放疗在分期较晚且存在较多风险因素的患者中辅助手术可能改善生存。
由于男性乳腺癌几乎都是激素受体表达阳性的类型,内分泌治疗在男性乳腺癌的治疗中占据重要地位。总结2家三甲医院数据显示,多数患者术后接受的是他莫昔芬口服内分泌治疗,仅有少数患者因难以耐受其不良反应而改用芳香化酶抑制剂(aromatase inhibitor,AI)。研究报道,男性患者对他莫昔芬的耐受性相对较好,仅有 < 5%的患者因难以耐受胃肠道或心血管方面不良反应而停药[22]。但值得注意的是,由于男性性激素产生机制的差异,他莫昔芬与AI比较在单药内分泌辅助治疗时有更好的疗效[23]。因此,他莫昔芬仍是男性患者术后内分泌治疗的首选。在晚期患者中,AI单药治疗更是不被推荐,而应和促性腺激素释放激素类似物(如戈舍瑞林)联用。已有研究报道,阿那曲唑+戈舍瑞林+唑来膦酸的组合在肿瘤负荷较低的晚期骨转移男性乳腺癌一线治疗中能取得显著疗效[24]。另外,在晚期激素受体阳性女性乳腺癌一、二线内分泌治疗中取得较好疗效的细胞周期蛋白依赖性激酶4/6(cyclin-dependent kinases 4/6,CDK4/6)抑制剂也已被FDA批准用于激素受体阳性HER2阴性晚期男性乳腺癌的治疗[25],这也让晚期男性乳腺癌的治疗多了一种选择。
男性乳腺癌作为一种少见肿瘤,缺乏临床研究数据,其最佳治疗模式并不清楚,目前临床治疗主要参考女性标准,但总体预后仍劣于女性。男性乳腺癌生物学特性与女性不尽相同,提示目前参考女性治疗指南的模式可能并不完全适合男性患者,更多前瞻性多中心研究对于加深对男性乳腺癌的了解很有必要。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69(1): 7-34. DOI:10.3322/caac.21551 |
| [2] |
Yetkin G, Celayir MF, Tanik C, et al. Male breast cancer: A 10 year retrospective case series in a tertiary care hospital[J]. J Pak Med Assoc, 2019, 69(8): 1209-1212. |
| [3] |
Wang F, Shu X, Meszoely I, et al. Overall mortality after diagnosis of breast cancer in men vs women[J]. JAMA Oncol, 2019, 5(11): 1589-1596. DOI:10.1001/jamaoncol.2019.2803 |
| [4] |
Giordano SH. Breast cancer in men[J]. N Engl J Med, 2018, 378(24): 2311-2320. DOI:10.1056/NEJMra1707939 |
| [5] |
丁颖, 龙汉安, 叶入裴, 等. 男性乳腺癌与女性乳腺癌临床病理学特征对比分析[J]. 西南医科大学学报, 2019, 42(1): 40-43. |
| [6] |
Giordano SH, Cohen DS, Buzdar AU, et al. Breast carcinoma in men: a population-based study[J]. Cancer, 2004, 101(1): 51-57. DOI:10.1002/cncr.20312 |
| [7] |
Fan L, Strasser-Weippl K, Li JJ, et al. Breast cancer in China[J]. Lancet Oncol, 2014, 15(7): e279-289. DOI:10.1016/S1470-2045(13)70567-9 |
| [8] |
Pathy NB, Yip CH, Taib NA, et al. Breast cancer in a multi-ethnic Asian setting: results from the Singapore-Malaysia hospital-based breast cancer registry[J]. Breast (Edinburgh, Scotland), 2011, 20(Suppl 2): 75-80. |
| [9] |
Fentiman IS. The biology of male breast cancer[J]. Breast, 2018, 38(1): 132-135. |
| [10] |
Chavez-Macgregor M, Clarke CA, Lichtensztajn D, et al. Male breast cancer according to tumor subtype and race: a population-based study[J]. Cancer, 2013, 119(9): 1611-1617. DOI:10.1002/cncr.27905 |
| [11] |
Cardoso F, Bartlett JMS, Slaets L, et al. Characterization of male breast cancer: results of the EORTC 10085/TBCRC/BIG/NABCG International Male Breast Cancer Program[J]. Ann Oncol, 2018, 29(2): 405-417. DOI:10.1093/annonc/mdx651 |
| [12] |
De La Cruz LM, Thiruchelvam PTR, Shivani J, et al. Saving the male breast: a systematic literature review of breast-conservation surgery for male breast cancer[J]. Ann Surg Oncol, 2019, 26(12): 3939-3944. DOI:10.1245/s10434-019-07588-1 |
| [13] |
Cloyd JM, Hernandez-Boussard T, Wapnir IL. Outcomes of partial mastectomy in male breast cancer patients: analysis of SEER, 1983-2009[J]. Ann Surg Oncol, 2013, 20(5): 1545-1550. DOI:10.1245/s10434-013-2918-5 |
| [14] |
Xiao W, Zou Y, Zheng S, et al. Primary tumor resection in stage Ⅳ breast cancer: A systematic review and meta-analysis[J]. Eur J Surg Oncol, 2018, 44(10): 1504-1512. DOI:10.1016/j.ejso.2018.08.002 |
| [15] |
Chen W, Huang Y, Lewis GD, et al. Treatment outcomes and prognostic factors in male patients with stage Ⅳ breast cancer: a population-based study[J]. Clin Breast Cancer, 2018, 18(1): e97-105. DOI:10.1016/j.clbc.2017.07.005 |
| [16] |
Muzaffar M, Kachare S, Vohra N. Impact of primary tumor surgery in stage Ⅳ male breast cancer[J]. Clin Breast Cancer, 2017, 17(3): e143-149. DOI:10.1016/j.clbc.2016.11.001 |
| [17] |
Yu XF, Wang C, Chen B, et al. The effect of adjuvant chemotherapy in male breast cancer: 134 cases from a retrospective study[J]. ESMO Open, 2017, 2(2): e000134. DOI:10.1136/esmoopen-2016-000134 |
| [18] |
Massarweh SA, Sledge GW, Miller DP, et al. Molecular characterization and mortality from breast cancer in men[J]. J Clin Oncol, 2018, 36(14): 1396-1404. DOI:10.1200/JCO.2017.76.8861 |
| [19] |
Turashvili G, Gonzalez-Loperena M, Brogi E, et al. The 21-gene recurrence score in male breast cancer[J]. Ann Surg Oncol, 2018, 25(6): 1530-1535. DOI:10.1245/s10434-018-6411-z |
| [20] |
Eggemann H, Ignatov A, Stabenow R, et al. Male breast cancer: 20-year survival data for post-mastectomy radiotherapy[J]. Breast Care (Basel), 2013, 8(4): 270-275. DOI:10.1159/000354122 |
| [21] |
Madden NA, Macdonald OK, Call JA, et al. Radiotherapy and male breast cancer: a population-based registry analysis[J]. Am J Clin Oncol, 2016, 39(5): 458-462. DOI:10.1097/COC.0000000000000078 |
| [22] |
Wibowo E, Pollock PA, Hollis N, et al. Tamoxifen in men: a review of adverse events[J]. Andrology, 2016, 4(5): 776-788. DOI:10.1111/andr.12197 |
| [23] |
Eggemann H, Ignatov A, Smith BJ, et al. Adjuvant therapy with tamoxifen compared to aromatase inhibitors for 257 male breast cancer patients[J]. Breast Cancer Res Treat, 2013, 137(2): 465-470. DOI:10.1007/s10549-012-2355-3 |
| [24] |
王国聪, 靳福全, 边莉, 等. 男性乳腺癌内分泌治疗一例报道[J]. 实用肿瘤杂志, 2017, 32(2): 180-183. |
| [25] |
Wedam S, Fashoyin-Aje L, Bloomquist E, et al. FDA approval summary: palbociclib for male patients with metastatic breast cancer[J]. Clin Cancer Res, 2020, 26(6): 1208-1212. DOI:10.1158/1078-0432.CCR-19-2580 |
 2020, Vol. 35
2020, Vol. 35


