文章信息
- 赵珊珊, 于明新, 王纯雁
- Zhao Shanshan, Yu Mingxin, Wang Chunyan
- 外阴及阴道恶性黑色素瘤预后因素分析
- Analysis of prognostic factors of vulvar and vaginal malignant melanoma
- 实用肿瘤杂志, 2019, 34(4): 343-347
- Journal of Practical Oncology, 2019, 34(4): 343-347
-
作者简介
- 赵珊珊(1986-), 女, 辽宁沈阳人, 主治医师, 硕士, 从事妇科肿瘤诊治研究.
-
通信作者
- 于明新, E-mail:yumingxin@cancerhosp-ln-cmu.com
-
文章历史
- 收稿日期:2018-09-11
恶性黑色素瘤是一种起源于神经嵴的弥散神经内分泌细胞肿瘤,好发于皮肤和黏膜,近年来发病率呈上升趋势[1]。女性生殖系统恶性黑色素瘤是一种少见疾病,仅占恶性黑色素瘤的1%~5%,占黏膜型恶性黑色素瘤的20%,最常见的发病部位为外阴,也可以发生于阴道和子宫颈等其他部位,较生长于皮肤或其他黏膜的恶性黑色素瘤预后差[2]。国际癌症数据(National Cancer Data Base)统计的女性生殖系统恶性黑色素瘤5年生存率只有11.4%,其他报道5年生存率10%~47%[3-5]。外阴黑色素瘤好发于外阴光滑的黏膜,如大阴唇内侧、小阴唇、阴蒂和阴道口,也可发生于外阴其他部位,约占女性生殖系统黑色素瘤的76%。其次为阴道约占女性生殖系统黑色素瘤的19%。女性生殖系统恶性黑色素瘤缺乏特有的分期系统,一般报道习惯于用国际妇产科协会所规定的女性生殖系统癌症的临床分期,也有学者建议女性黑色素瘤应使用皮肤黑色素瘤美国癌症联合会分期。目前女性生殖系统恶性黑色素瘤的诊治国际上仍没有相关指南,由于发病率低,此类研究少。本次研究对本院收治的外阴及阴道恶性黑色素瘤病例的临床病理资料进行回顾性分析,分析相关因素及治疗方式对预后的影响。
1 资料与方法 1.1 一般资料收集本院从2008年9月至2017年3月外阴及阴道恶性黑色素瘤病例34例(外阴16例,阴道18例)。临床病理资料记录患者的年龄、FIGO分期、AJCC分期(第8版)、Breslow厚度、Clark分级、肿瘤大小、切缘范围、是否合并溃疡和淋巴结转移情况。
1.2 手术方式手术方式分为根治性或局部切除,外阴恶性黑色素瘤的手术方式参考外阴癌,包括广泛性外阴切除、外阴局部扩大切除和外阴局部切除手术,同时根据病灶的部位行单侧或双侧腹股沟淋巴结清扫,阴道恶性黑色素瘤的手术范围参考阴道癌,包括全阴道切除、部分阴道切除、阴道局部扩大切除和阴道肿物切除。病灶位于阴道下1/3手术方式参照外阴癌,同时清扫腹股沟淋巴结,病灶位于阴道上1/3时手术方式参照子宫颈癌,行(次)广泛性子宫切除,清扫盆腔淋巴结。伴有盆腔其他脏器转移时行盆腔脏器切除术。
1.3 随访从疾病确诊日期开始直至疾病复发转移为累积无瘤生存时间,从疾病确诊日期开始直至死亡为累积总生存时间。随访时间截止至2017年9月,最短随访时间2个月,最长随访时间92个月,中位随访时间22个月,失访5例。
1.4 统计学分析应用Excel软件录入病例基本信息,SPSS24软件进行统计学分析。生存率计算采用Kaplan-Meier法,与生存率相关的因素分析采用Log-rank检验,Cox比例风险模型进行预后的多因素分析。以P < 0.05为差异具有统计学意义。
2 结果 2.1 临床特征34例外阴及阴道恶性黑色素瘤病例中,外阴癌16例,阴道癌18例。患者年龄38~84岁,平均63岁,中位年龄62岁。FIGO分期Ⅰ期20例,Ⅱ期4例,Ⅲ期6例,Ⅳ期4例。AJCC分期ⅡA期2例,ⅡB期16例,ⅡC期5例,Ⅲ期7例,Ⅳ期4例。Breslow厚度分级2级2例,3级1例,4级24例,无法评估7例。Clark分级1级1例,2级1例,3级1例,4级1例,5级10例,无法评估20例。合并溃疡8例,无溃疡26例。肿瘤大小4~45 mm,平均24 mm。肿瘤距切缘距离 < 10 mm 2例,10~19 mm 12例,20~30 mm 12例,无法评估8例。淋巴结转移6例,淋巴结阴性14例。
2.2 治疗方法手术治疗患者27例。其中,根治性手术17例,包括外阴广泛性切除+腹股沟淋巴结清扫5例,外阴广泛性切除+全阴道+腹股沟淋巴结清扫1例,子宫广泛性切除+全阴道切除+盆腔淋巴结清扫3例,子宫广泛性切除+全阴道切除+部分外阴切除+盆腔淋巴结清扫2例,子宫次广泛切除+全阴道切除+腹股沟淋巴结清扫4例,子宫广泛性切除+全阴道切除+直肠切除+肠造瘘术1例,全子宫切除+全阴道切除1例;局部切除手术10例,包括外阴局部扩大切除2例,外阴局部扩大切除+单侧腹股沟淋巴结清扫2例,外阴局部扩大切除+左侧腹股沟淋巴结清扫+右臀部肿物切除1例,外阴局部切除+阴道壁转移结节切除+腹股沟淋巴结清扫1例,阴道部分切除1例,阴道局部扩大切除+双侧腹股沟淋巴结清扫1例,阴道壁肿物切除1例,阴道后壁部分切除+会阴直肠切除+肠造瘘术1例。20例患者行腹股沟淋巴结或盆腔淋巴结清扫,其中淋巴结转移6例,淋巴结阴性14例,5例因年龄较大(平均75岁)未行淋巴结清扫,2例因晚期行盆腔联合脏器切除未行淋巴结清扫。7例未接受手术治疗,其中3例确诊后放弃治疗,2例接收盆腔放疗配合达卡巴嗪/紫杉醇+卡铂方案化疗,1例达卡巴嗪+铂类化疗,1例紫杉醇+卡铂配合自体细胞免疫疗法治疗。
术后辅助治疗包括化疗、放疗、生物化疗及免疫治疗。达卡巴嗪+铂类±长春新碱方案化疗5例,达卡巴嗪+铂类±长春新碱方案化疗配合干扰素联合治疗4例,紫杉醇+卡铂方案配合免疫治疗1例,化疗配合盆腔适型放疗2例(剂量50 Gy/25 F),白介素2/自体细胞因子诱导的杀伤细胞(cytokine-induced killer,CIK)免疫治疗5例。
2.3 生存时间截止至2017年9月,34例患者无瘤生存时间为0~72个月,中位无瘤生存时间14个月,1年和2年累积无瘤生存率为50.8%和39.1%。外阴恶性黑色素瘤中位累积无瘤生存时间27个月,1年和2年累积无瘤生存率59.1%和50.6%;阴道恶性黑色素中位累积无瘤生存时间9个月,1年和2年累积无瘤生存率44.1%和29.4%。两组间比较累积无瘤生存时间,差异无统计学意义(P=0.583,图 1)。
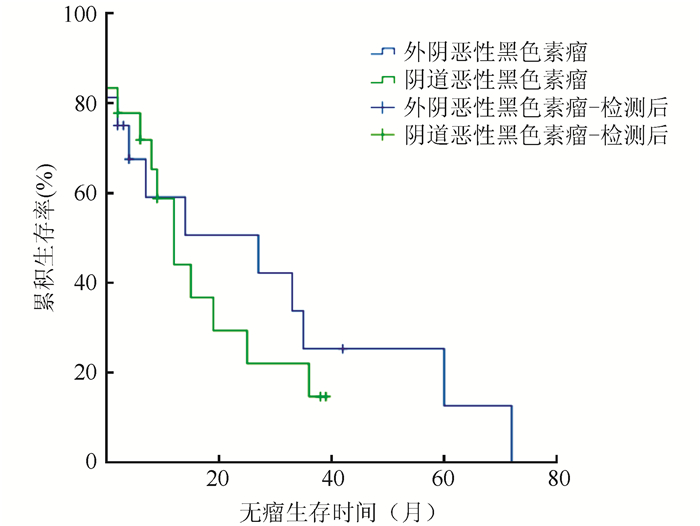
|
| 图 1 外阴及阴道恶性黑色素瘤无瘤生存曲线 Fig.1 Disease-free survival curve for vulvar and vaginal malignant melanoma |
所有患者总生存时间为0~92个月,中位总生存时间30个月,1、2和5年累积总生存率为80.4%、61.6%和26.1%。外阴恶性黑色素瘤中位总生存时间为45个月,1、2和5年总生存率分别为93.3%、68.4%和46.9%,阴道恶性黑色素中位总生存时间为25个月,1、2和5年总生存率分别为69.6%、55.7%和0%。两组间总生存时间比较,差异具有统计学意义(P=0.036,图 2)。
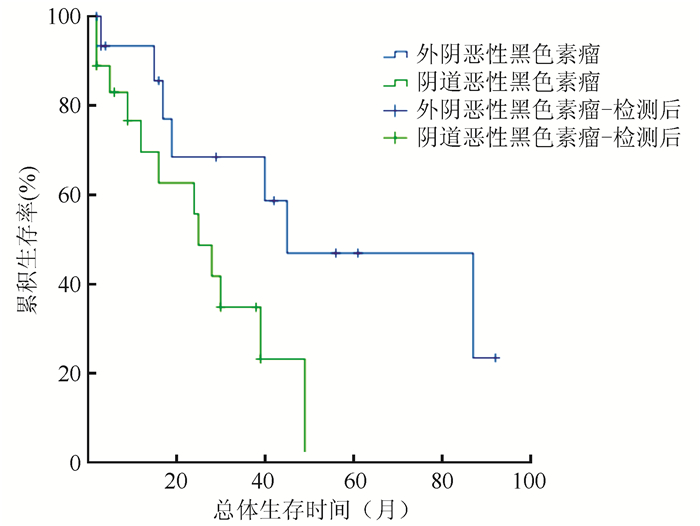
|
| 图 2 外阴及阴道恶性黑色素瘤总生存时间曲线 Fig.2 Overall survival curve of vulvar and vaginal malignant melanoma |
单因素分析中,肿瘤直径≥30 mm和合并溃疡为易复发的危险因素(P=0.005)。多因素分析中,肿瘤大小为累积无瘤生存时间的独立危险因素(OR=3.818,95%CI:1.115~13.072,P=0.033)。对总生存时间的单因素分析显示,恶性黑色素发病部位、肿瘤大小、是否合并溃疡、术后辅助治疗和手术方式为影响预后的危险因素(P < 0.05)。多因素分析中,恶性黑色瘤发病部位、肿瘤大小和是否合并溃疡为影响预后的独立危险因素(P < 0.05,表 1)。年龄、FIGO分期、AJCC分期、切缘距离和淋巴结转移与肿瘤预后无关(P>0.05)。
| 临床因素 | B | SE | P值 | OR | 95%CI |
| 发病部位 | 2.693 | 1.142 | 0.018 | 14.774 | 1.575~138.555 |
| 肿瘤大小 | 1.887 | 0.805 | 0.019 | 6.600 | 1.362~31.973 |
| 合并溃疡 | 2.028 | 0.907 | 0.025 | 7.596 | 1.284~44.930 |
| 辅助治疗 | 1.455 | 0.843 | 0.084 | 4.284 | 0.821~22.354 |
| 手术范围 | 0.680 | 0.928 | 0.464 | 1.973 | 0.320~12.157 |
恶性黑色素瘤预后与发病部位有最直接的关系,生殖系统恶性黑色素瘤生存率较皮肤恶性黑色素瘤低原因主要考虑由于肿瘤生长部位导致延误就诊,另外丰富的血管和淋巴管网导致疾病早期易扩散和转移。本研究发现,原发于阴道的恶性黑色瘤较外阴恶性黑色瘤预后更差,中位累积无瘤生存时间缩短18个月,中位总生存时间缩短20个月。外阴及阴道恶性黑色素瘤的临床病理特征分析发现,阴道恶性黑色素瘤晚期出现远处转移比例高,肿瘤的厚度、浸润深度和伴随溃疡的程度均较外阴恶性黑色素瘤重,这些高危的因素可能导致阴道恶性黑色素预后更差。Udager等[6]回顾性分析1985年至2013年59例妇科恶性黑色素瘤资料发现,除外外阴恶性黑色瘤,其余类型的妇科恶性黑色瘤临床结局差。夷恬进等[7]也认为病灶位于阴道、AJCC分期、肿瘤浸润深度和手术边缘有无肿瘤累及是独立的预后影响因素。肿瘤大小作为提示肿瘤分期的关键要素,必然对预后也有较大的影响。本研究将肿瘤直径分为 < 10 mm、10~19 mm、20~29 mm、30~39 mm和≥40 mm 5组,分析发现,当肿瘤直径≥30 mm生存率下降,多因素分析发现,肿瘤大小为影响预后的危险因素。一项多中心临床资料分析发现,肿瘤大小及AJCC分期是外阴恶性黑色素复发和转移的预后因素,文中提到在42例纳入分析的外阴恶性黑色素瘤肿瘤大小为(30.8±18.3)mm,未提及肿瘤大小与预后的关系[8]。另有研究显示,当肿瘤直径 < 3 cm时预后较好[9-10]。皮肤恶性黑色素瘤AJCC分期将是否合并溃疡作为原发肿瘤分期的依据。研究发现,在皮肤恶性黑色素瘤中溃疡是影响预后的重要因素[11],如T1a期患者5年生存率约为85%,T2a期约为70%,T3a期为55%,T4a期为45%,而有溃疡的患者则相应分别减少15%。本研究中外阴及阴道恶性黑色瘤合并溃疡同样为影响预后的重要因素。另有研究提到Clark和Breslow系统在外阴及阴道恶性黑色素中是非常重要的预后因素[12-13]。本研究时间因跨度较长,病理资料中关于Clark及Breslow系统缺失信息多,未得到相应的结论。
3.2 不同手术方式对预后的影响外阴及阴道恶性黑色素瘤主要治疗手段仍是手术治疗,但目前对于手术范围及淋巴结清扫仍没有明确的指南建议。外阴恶性黑色素瘤传统采用外阴癌的外阴根治性切除及双侧腹股沟淋巴结整块切除术,对于外阴中部的肿瘤,手术可包括中部器官切除术或部分切除术。近年较多学者对几十年累积的临床资料作回顾性分析,并受启发于皮肤黑色素瘤的研究,对外阴黑色素瘤临床病理行为进一步探讨,趋于一致的观点认为根据肿瘤侵犯深度及其生长扩散范围选择适当的手术[14]。阴道恶性黑色素瘤传统观点是最大限度手术切除肿瘤及区域淋巴结,必要时手术应扩大。近年来研究认为,根治性手术治疗外阴及阴道恶性黑色素瘤患者并不受益,因为60%复发是远处转移,成多病灶高侵袭的特点[15]。有学者建议,手术切缘根据肿瘤厚度决定,肿瘤厚度 < 1 mm切缘>1 cm,肿瘤厚度1~4 mm切缘>2 cm。本研究术后出现远处复发转移率为50%,而根治性切除后也仍有局部复发的病例,多因素分析中累积总生存时间与手术范围无关,也不能由于手术范围延长累计无瘤生存时间,鉴于根治性切除增加术后并发症,外阴及阴道恶性黑色素瘤的手术范围逐渐由根治性切除过渡为局部扩大切除[16]。淋巴结对预后有影响,但对于淋巴结处理方法没有统一的意见,是否常规进行淋巴结清扫仍有争议,部分研究认为淋巴结清扫应根据前哨淋巴结检测结果决定[17]。Rodriguez等[18]认为前哨淋巴结可减少手术并发症,但目前对于前哨淋巴结的应用仍在研究中,对于肿瘤厚度大的前哨淋巴结检测成功率高,在皮肤恶性黑色素瘤中,病灶 < 1 mm,淋巴结转移率5%,但病灶>4 mm,淋巴结转移率70%,建议前哨淋巴结检测可应用在病灶厚度1~4 mm的病例。Seifried等[19]研究85例外阴及阴道恶性黑色瘤患者的临床病理资料发现,切缘>1 cm的5年无瘤生存时间和总生存时间有提高。
3.3 辅助治疗的价值辅助治疗主要包括化疗、放疗、生物化疗、免疫治疗及靶向治疗。化疗是辅助治疗的一种,用于术前消瘤或术后辅助治疗,但对辅助治疗的效果尚无统一观点。Tcheung等[20]报道85例女性生殖系统恶性黑色素瘤,术后辅助放化疗的生存时间无明显延长。有研究发现,在女性生殖系统恶性黑色素瘤治疗中,术前新辅助化疗能缩小肿瘤,缩小手术范围,减少术后并发症,但不能提高患者的无进展生存时间和总生存时间[6]。本研究中1例术前完成4个周期新辅助化疗,术后病理阴道壁仅见少量异型细胞,淋巴结有黑色素但未见恶性细胞,患者随访至截稿共39个月未复发。放疗应用于不能耐受手术、术前放疗消瘤、术后补充治疗和复发后姑息治疗。手术联合术后辅助放疗是一种综合治疗方法。Frumovitz等[21]报道20例阴道恶性黑色素瘤患者行手术联合术后辅助放疗的结果,较对照组的13例单纯手术者,中位生存期延长13个月。有研究显示,免疫治疗联合化疗对患者有高反应性,但化疗不良反应增加且没有提高总生存时间[22]。免疫治疗在皮肤转移性黑色素瘤中已有随机临床试验证实可以延长无瘤生存时间及总生存时间,然而是否能改善生殖道黑色素瘤患者的预后还未明确。近年来随着分子生物学的进展,不断发现恶性黑色素瘤不同亚型突变的癌基因,包括BRAF、NRAS和c-KIT,推动临床潜在靶向药物的应用,个体化靶向治疗和免疫靶向治疗是目前研究的方向,成为未来治疗的新趋势。最近美国FDA批准ipilimumab、nivolumab、pembrolizumab、vemurafenib、dabrafenib和trametinib药物应用于晚期恶性上皮黑色素瘤并取得良好的疗效,对外阴及阴道恶性黑色素瘤尚无研究结果,但可能会使更多的女性生殖系统恶性黑色素瘤患者受益[23-24]。
| [1] |
Simard EP, Ward EM, Siegel R, et al. Cancers with increasing incidence trends in the United States:1999 through 2008[J]. CA Cancer J Clin, 2012, 62(4): 118-128. |
| [2] |
Hou JY, Baptiste C, Hombalegowda RB, et al. Vulvar and vaginal melanoma:A unique subclass of mucosal melanoma based on a comprehensive molecular analysis of 51 cases compared with 2253 cases of nongynecologicmelanoma cancer[J]. Cancer, 2017, 123(8): 1333-1344. DOI:10.1002/cncr.30473 |
| [3] |
Vaysse C, Pautier P, Filleron T, et al. A large retrospective multicenter study of vaginal melanomas:implications for new management[J]. Melanoma Res, 2013, 23(2): 138-146. DOI:10.1097/CMR.0b013e32835e590e |
| [4] |
Mert I, Semaan A, Winer I, et al. Vulvar/vaginalmelanoma:an updated surveillance epidemiology and end results database review, comparison with cutaneous melanoma and significance of racial disparities[J]. Int J Gynecol Cancer, 2013, 23(6): 1118-1125. DOI:10.1097/IGC.0b013e3182980ffb |
| [5] |
Haiducu ML, Hinek A, Astanehe A, et al. Extracutaneous melanoma epidemiology in British Columbia[J]. Melanoma Res, 2014, 24(4): 377-380. DOI:10.1097/CMR.0000000000000075 |
| [6] |
Udager AM, Frisch NK, Hong LJ, et al. Gynecologic melanomas:A clinicopathologic and molecular analysis[J]. Gynecol Oncol, 2017, 147(2): 351-357. DOI:10.1016/j.ygyno.2017.08.023 |
| [7] |
夷恬进, 王平, 江炜, 等. 29例原发性外阴、阴道恶性黑色素瘤诊治及预后影响因素分析[J]. 四川大学学报(医学版), 2014, 45(4): 724-727. |
| [8] |
Iacoponi S, Rubio P, Garcia E, et al. Prognostic factors of recurrence and survival in vulvar melanoma:subgroup analysis of the vulvar cancer study[J]. Int J Gynecol Cancer, 2016, 26(7): 1307-1312. DOI:10.1097/IGC.0000000000000768 |
| [9] |
Miner TJ, Delgado R, Zeisler J, et al. Primary vaginal melanoma:A critical analysis of therapy[J]. Ann Surg Oncol, 2004, 11(1): 34-39. DOI:10.1007/BF02524343 |
| [10] |
杨莉, 吴小华, 张志毅, 等. 原发性宫颈及阴道恶性黑色素瘤51例的临床分析[J]. 中国癌症杂志, 2013, 23(7): 540-546. DOI:10.3969/j.issn.1007-3969.2013.07.011 |
| [11] |
Ward WH, Farma JM. Cutaneous melanoma:Etiology and therapy[M]. Brisbane (AU): Codon Publications, 2017: 67-78.
|
| [12] |
Piura B. Management of primary melanoma of the female urogenital tract[J]. Lancet Oncol, 2008, 9(10): 973-981. DOI:10.1016/S1470-2045(08)70254-7 |
| [13] |
Ferraiol D, Lamblin G, Mathevet P, et al. Genital melanoma:prognosis factors and treatment modality[J]. Arch Gynecol Obstet, 2016, 294(5): 1037-1045. DOI:10.1007/s00404-016-4144-4 |
| [14] |
Sinasac SE, Petrella TM, Rouzbahman M, et al. Melanoma of the vulva and vagina:surgical management and outcomes based on a clinicopathologic review of 68 cases[J]. J Obstet Gynaecol Can, 2018. |
| [15] |
Lallas A, Apalla Z, Chaidemenos G. New trends in dermoscopy to minimize the risk of missing melanoma[J]. J Skin Cancer, 2012, 2012: 820474. |
| [16] |
Gadducci A, Carinelli S, Guerrieri ME, et al. Melanoma of the lower genital tract:Prognostic factors and treatment modalities[J]. Gynecol Oncol, 2018, 150(1): 180-189. DOI:10.1016/j.ygyno.2018.04.562 |
| [17] |
Campaner AB, Fernandes GL, Cardoso FA, et al. Vulvar melanoma:relevant aspects in therapeutic management[J]. An Bras Dermatol, 2017, 92(3): 398-400. DOI:10.1590/abd1806-4841.20174941 |
| [18] |
Rodriguez AO. Female genital tract melanoma:the evidence is only skin deep[J]. Curr Opin Obstet Gynecol, 2005, 17(1): 1-4. DOI:10.1097/00001703-200502000-00002 |
| [19] |
Seifried S, Haydu LE, Quinn MJ, et al. Melanoma of the vulva and vagina:principles of staging and their relevance to management based on a clinicopathologic analysis of 85 cases[J]. Ann Surg Oncol, 2015, 22(6): 1959-1966. DOI:10.1245/s10434-014-4215-3 |
| [20] |
Tcheung WJ, Selim MA, Herndon JE, et al. Clinicopathologic study of 85 cases of melanoma of the female genitalia[J]. J Am Acad Dermatol, 2012, 67(4): 598-605. DOI:10.1016/j.jaad.2011.11.921 |
| [21] |
Frumovitz M, Etchepareborda M, Sun CC, et al. Primary malignant melanoma of the vagina[J]. Obstet Gynecol, 2010, 116(6): 1358-1365. DOI:10.1097/AOG.0b013e3181fb8045 |
| [22] |
Janco JM, Markovic SN, Weaver AL, et al. Vulvar and vaginal melanoma:Case series and review of current management options including neoadjuvant chemotherapy[J]. Gynecol Oncol, 2013, 129(3): 533-537. DOI:10.1016/j.ygyno.2013.02.028 |
| [23] |
张海桥, 钱璐, 林胜友. Nivolumab一线治疗晚期恶性黑色素的研究进展[J]. 实用肿瘤杂志, 2018, 33(4): 383-386. |
| [24] |
Chlopik A, Selim MA, Peng Y, et al. Prognostic role of tumoral PDL1 expression and peritumoral FoxP3+ lymphocytes in vulvar melanomas[J]. Hum Pathol, 2018, 73: 176-183. DOI:10.1016/j.humpath.2017.12.022 |
 2019, Vol. 34
2019, Vol. 34


