文章信息
- 袁静, 王海燕, 邢永华, 苏占海, 刘皎茹, 李永宁, 吴穹, 杨惠
- 基于铁死亡调控的癌症治疗研究进展
- 实用肿瘤杂志, 2023, 38(1): 73-79
基金项目
- 国家自然科学基金资助项目(81860762);青海省卫生计生科研指导性计划课题(2018-wjzdx-131)
-
通信作者
-
吴穹, E-mail: 13997126828@163.com
杨惠, E-mail: yanghui_nm@126.com
-
文章历史
- 收稿日期:2021-12-15
2. 青海大学医学院青藏高原中藏药抗肿瘤基础与应用研究实验室, 青海 西宁 810016
癌症作为引起全球人类死亡的第二大疾病,每年有超过1 810万例新增病例和960万例死亡病例。癌症的基本治疗策略是在不损害非恶性细胞的情况下选择性地消除癌细胞[1]。治疗手段主要为药物结合放疗、化疗和免疫疗法诱导癌细胞死亡。然而,由于癌细胞对凋亡获得性及内源性的抵抗,导致临床过程中通过诱导癌细胞凋亡达到治疗的效果十分有限。此外,癌症的渐进式治疗可引发癌细胞耐药,导致许多患者出现多药耐药(multidrug resistance,MDR)[2],而MDR为癌症患者化疗失败的主要原因[3]。因此,如何靶向清除肿瘤细胞和有效控制耐药细胞增殖始终是癌症临床治疗亟待解决的关键问题。
由于细胞存在多种调节性死亡形式,因此能够考虑通过不同分子调控达到清除肿瘤细胞的目的。其中铁死亡作为一种由铁催化、多不饱和脂肪酸的过度氧化介导的细胞调节性坏死,与癌症、神经退行性疾病和缺血/再灌注损伤等多种疾病有关[4]。大量研究报道指出,多种化合物和抗癌药物能够通过触发铁死亡来介导癌症进展。因此,如何利用铁死亡途径有针对性的治疗不同类型的癌症已经逐渐成为癌症研究的关键问题之一[5]。因此,本文针对铁死亡调控机制和铁死亡在各种癌症治疗策略中的应用进行简要综述,以期为后续铁死亡理论的深入研究以及铁死亡在癌症化疗及免疫治疗等领域的应用提供基础参考资料。
1 铁死亡及其调控机制自2003年首次发现这种细胞特异性程序性非凋亡死亡后,直至2012年被首次命名为铁死亡;针对铁死亡的分子调控机制研究逐年深入[4-16]。铁死亡作为一种铁依赖性的细胞程序性死亡,区别于细胞凋亡、细胞坏死和细胞自噬[17]。在形态上,铁死亡的细胞表现出典型的坏死性形态,并出现大量的嵴减少、膜凝聚和外膜破裂的同质异形小线粒体[6]。在机制上,细胞在二价铁或酯氧合酶的作用下,通过催化细胞膜上高表达的不饱和脂肪酸发生脂质过氧化,即产生活性氧(reactive oxygen species,ROS)[7],从而诱导死亡[8]。铁死亡的发生主要与多个细胞代谢调控系统密切相关,其中涉及铁代谢紊乱、氨基酸抗氧化系统失衡和脂质过氧化物集聚等[6-10]。主要参与调控的几条信号转导通路为胱氨酸/半胱氨酸[Cyst(e)ine]/谷胱甘肽(glutathione, r-glutamyl cysteingl+glycine,GSH)/谷胱甘肽过氧化物酶4(glutathione peroxidase4, GPX4)、烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADPH)/辅酶Q10(coenzyme Q10,CoQ10)/铁死亡抑制蛋白1(ferroptosis suppressor protein 1,FSP1)、四氢生物蝶呤(tetrahydrobiopterin,BH4)/GTP环氢化酶1(GTP cyclohydrolase 1,GCH1)/二氢叶酸还原酶(dihydrofolate reductase,DHFR)及多不饱和脂肪酸代谢途径与脂质过氧化途径等[4-19]。针对铁死亡的分子调控,由于胱氨酸/谷氨酸逆向转运体(System Xc-,Sys Xc-)在细胞膜上广泛分布,并介导细胞外半胱氨酸和细胞内谷氨酸以1∶1的比例互换,因此,当细胞内的胱氨酸通过NADPH还原反应转化为半胱氨酸促进GSH的合成,GSH调节ROS信号重置细胞氧化还原稳态,最终调控脂质氧化还原过程[8]。除了胱氨酸/谷氨酸逆向转运蛋白溶质载体家族7成员11(solute carrier family 7 member 11,SLC7A11,也称为xCT)-GSH-GPX4轴外,NAD(P)H/CoQ10/FSP1信号通路被证实是重要的铁死亡调控通路。研究表明,氧化还原酶通过NAD(P)H催化NAD(P),将CoQ10还原为CoQ10H2,并再生CoQ10[9]。泛素作为一种抗氧化剂捕获脂质过氧化物自由基,阻止脂质过氧化物生成,抑制铁死亡发生。并且BH4作为一种强大的抗氧化剂捕获自由基,能促进CoQH2再生,通过激活下游GCH1及DHFR等分子对抗脂质过氧化[10]。另外,细胞膜中的关键成分为多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)对自由基介导的氧化具有双键脆弱性,因此PUFA是脂质过氧化的主要底物,通过操纵PUFA的生产和降解对铁死亡调控也有重要作用[10]。综上可知,铁死亡分子调控机制十分复杂(图 1)。
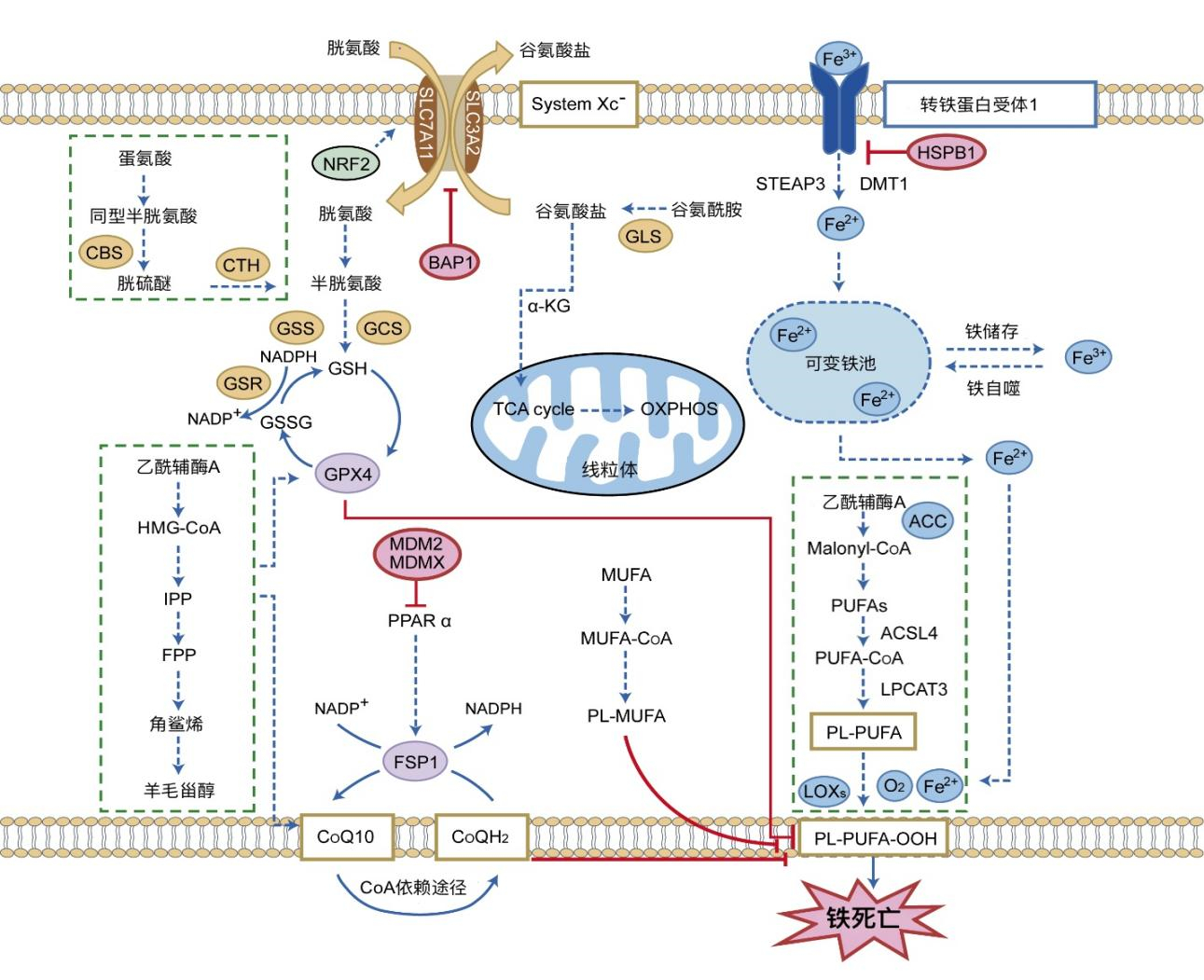
|
| 注 CBS:胱硫醚β合成酶(cystathionine β synthase);CTH:胱硫醚-γ-裂解酶(cystathionine gamma-lyase);NRF2:细胞核因子E2相关因子2(nuclear factor E2-related factor);SLC7A11:溶质载体家族7成员11(solute carrier family 7 member 11);SLC3A2:溶质载体家族3成员2(solute carrier family 3 member 2);System Xc-:胱氨酸/谷氨酸逆向转运体;BAP1:BRCA1相关蛋白1(BRCA1-associated protein 1);GCS:谷氨酰半胱氨酸合成酶(glutamylcysteine synthetase);GSS:谷胱甘肽合成酶(glutathione synthetase);GSR:谷胱甘肽二硫还原酶(glutathione reductase);NADP+:烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate);NADPH:还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate);GSH:谷胱甘肽(glutathione, r-glutamyl cysteingl+glycine);GPX4:谷胱甘肽过氧化物酶4(glutathione peroxidase 4);GSSG:氧化型谷胱甘肽(L-glutathione oxidized);HMG-CoA:羟甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl-coenzyme A);IPP:异戊烯焦磷酸(isopentenyl pyrophosphate);FPP:法尼基焦磷酸(farnesyl pyrophosphate);GLS:谷氨酰胺酶(glutaminase);TCA cycle:三羧酸循环(tricarboxylic acid cycle);OXPHOS:氧化磷酸化(oxidative phosphorylation);MDM2:鼠双微体基因2(murine double minute 2);MDMX:murine double minute X;PPARα:过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor alpha);FSP1:铁死亡抑制蛋白1(ferroptosis suppressor protein 1);CoQ10:辅酶Q10;CoQH2:还原型辅酶Q;MUFA: 单不饱和脂肪酸(monounsaturated fatty acids); MUFA-CoA:monounsaturated fatty acyl CoA;PL-MUFA:phospholipid-bound monounsaturated fatty acids;STEAP3:前列腺六次跨膜蛋白3(six-transmembrane epithelial antigen of the prostate 3);HSPB1:热休克蛋白B1(heat shock protein B1);DMT1:二价金属离子转运蛋白1(divalent metal transporter 1);PUFAs:多不饱和脂肪酸(polyunsaturated fatty acids);PUFA–CoA:辅酶A激活的多不饱和脂肪酸(coenzyme A-activated polyunsaturated fatty acid);PL-PUFA:phospholipid polyunsaturated fatty acid;ACSL4:长链脂酰辅酶A合成酶4(acyl-coA synthetase long-chain family member 4);LPCAT3:溶血磷脂酰胆碱酰基转移酶3(lysophosphatidylcholine acyltransferase 3);LOXs:脂氧合酶(lipoxygenases);PL-PUFA-OOH:脂质过氧化物(phospholipid-polyunsaturated fatty acid-hydroperoxide) 图 1 铁死亡分子调控机制 |
头颈部癌症(head and neck cancer, HNC)主要包括口、鼻和咽部肿瘤。大量研究指出,GPX4的抑制剂RSL3和ML-162可以诱导HNC细胞铁死亡,青蒿素(artemisinin,ART)也可以通过GSH耗竭和ROS积累诱导HNC细胞的铁死亡[20]。然而,由于核转录因子E2相关因子2(nuclear factor-erythroid 2-related factor 2,Nrf2)/抗氧化反应元件(antioxidant response element,ARE)信号的上调,耐顺铂的HNC细胞对铁死亡诱导剂和ART不敏感,这种抗性可以通过阻断Nrf2-ARE通路来消除,从而恢复其对铁蛋白酶的敏感性[21]。此外,CDGSH铁硫结构域2(CDGSH iron-sulfur domain 2,CISD2)对于头颈部肿瘤细胞的抗氧化作用也很关键。CISD2的功能中断会导致线粒体铁和脂质ROS积累的增加,从而诱发铁死亡过程[22]。新进研究表明,谷氧还蛋白5(glutaredoxin 5,GLRX5)可以通过干扰铁代谢信号,从而促进脂质过氧化反应并增加细胞内游离铁离子[23]。
2.2 乳腺癌乳腺癌是女性最致命的癌症类型之一,尤其是三阴性乳腺癌(triple-negative breast cancer,TNBC),约占所有乳腺癌病例的10%~20%[24]。研究显示,三阴性乳腺癌细胞株的一个亚群高度依赖xCT来获得环境半胱氨酸;xCT抑制剂通过促进铁死亡发生抑制肿瘤生长[25]。另一项研究结果表明,xCT可以与黏蛋白1C亚基(MUC1-C)和CD44剪接变体(CD44v)相互作用,使其在质膜表面保持稳定,因此维持GSH表达水平可以防止TNBC细胞的铁死亡。最新研究发现,二甲双胍可通过抑制xCT纤维化,从而使其稳定性降低,从而进一步诱导铁死亡[26]。溶酶体破坏剂siramesine和酪氨酸激酶抑制剂lapatinib为临床治疗乳腺癌的药物[27],二者可以干扰ROS信号和铁平衡,进一步导致乳腺癌细胞的铁死亡[28]。另有研究表明,柳氮磺胺吡啶可通过钝化Sys Xc-和GPX4,从而诱发雌激素受体(estrogen receptor,ER)低表达乳腺癌细胞的铁死亡[29]。除此之外,新近研究结果表明,通过抑制GPX4促进铁死亡可以增强吉非替尼的TNBC治疗效果[29]。
2.3 肺癌肺癌是目前发病率和死亡率增长最快的癌症之一,又可分为小细胞肺癌(small cell lung cancer, SCLC)和非小细胞肺癌(non-small-cell lung cancer,NSCLC)。其中肺腺癌作为患病率较高的NSCLC,其患者肺组织中通常表现为半胱氨酸脱硫酶NFS1过表达,NFS1具有较高的抗氧化能力,能够避免癌细胞发生铁死亡[30]。因此提示限制NFS1表达可促进铁死亡发生而抑制肺腺癌进展。另一项研究结果表明,携带丝氨酸/苏氨酸蛋白激酶11(serine/threonine kinase 11,STK11)和Kelch样环氧氯丙烷相关蛋白1(Kelch-like ECH-associated protein 1,KEAP1)突变的肺腺癌患者硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturases 1,SCD1)蛋白表达上调,因此可以用过抑制SCD1增强铁死亡抑制癌细胞扩散[31]。此外,针对表皮生长因子受体(epidermal growth factor receptor,EGFR)野生型肺癌患者在使用抗癌药物吉非替尼治疗时,反而会抑制顺铂诱发的铁死亡从而降低治疗效果[28],由此提示,基于铁死亡理论治疗肺癌患者仍需要大量临床调查研究。
2.4 胃癌在胃癌细胞中,erastin可诱导铁死亡的发生,其中Ⅰ型半胱氨酸双加氧酶(cysteine dioxygenase type 1,CDO1)在该过程中发挥重要作用。CDO1与半胱氨酸竞争性结合,限制GSH合成并最终导致铁死亡[11]。然而,通常在胃癌的临床治疗过程中往往是通过抑制COD1活性防止ROS产生,维持线粒体功能稳定,减少脂质过氧化最终抑制铁死亡[32]。除了肿瘤细胞,肿瘤相关成纤维细胞(tumor-associated fibroblast,TAF)也促进肿瘤的生长和发展,甚至参与肿瘤细胞耐药调控。有研究指出,TAF分泌的外泌体miR-522可以通过抑制花生四烯酸-15-脂加氧酶(arachidonate-15-lipoxygenase,ALOX15)活性来防止脂质ROS积累,抑制细胞铁死亡[33]。以上研究提示,ALOX15可以作为胃癌靶向治疗的候选基因。另有新的研究发现,用于治疗晚期胃癌的抗血管生成药apatinib可以通过抑制GPX4在胃癌细胞中的表达来诱导脂质过氧化,从而诱导铁死亡[34]。
2.5 胰腺癌胰腺癌是一种高度致命的肿瘤,平均5年生存率 < 10%。青蒿琥酯(artesunate,ART)可以特异性诱导细胞内ROS升高,导致胰腺导管腺癌细胞中的铁死亡[35]。此外,强力分化诱导剂Cotylenin A(CN-A)和ROS诱导剂异硫氰酸苯乙酯(phenethyl isothiocyanate,PEITC)的组成,诱导细胞产生ROS进一步诱发铁死亡[36]。另一项研究指出,抑制半胱氨酸摄取会诱导胰腺导管腺癌中的铁死亡,并且SLC7A11的缺失和胱氨酸(e)酶的过表达也可诱导铁死亡从而控制胰腺癌细胞生长[37]。
2.6 肝细胞癌肝细胞癌(hepatocellular carcinoma,HCC)是一种高度异质性的疾病,患者生存率极低。此类癌症对很多临床常用药物(如索拉非尼等)有明显的不良反应和耐药性。然而索拉非尼是介导过氧化调控诱导铁死亡的主要临床药物之一,因此针对HCC的临床治疗存在较大困难[38-40]。目前有研究表明,erastin与索拉非尼合用,可降低索拉非尼的耐药性,这可能成为HCC治疗新策略[32]。在HCC病理过程中视网膜母细胞瘤蛋白(retinoblastoma protein,pRb)功能丧失会促进索拉非尼诱导的铁死亡并导致肿瘤细胞死亡。此外,装载天然omega-3脂肪酸和二十二碳六烯酸(low-density lipoprotein-docosahexaenoic acid,LDL-DHA)的纳米颗粒能够选择性抑制HCC细胞生长并抑制因GSH耗竭、GPX4失活和脂质过氧化引起的肝肿瘤,最终导致铁死亡[39]。综上所述,基于铁死亡理论治疗肝细胞癌仍需大量体内外实验来提供基础参考依据。
2.7 结肠癌与直肠癌在结肠癌与直肠癌疾病进展过程中,p53作为控制细胞增殖、代谢、死亡和分化的关键因子,同样参与铁死亡的调控过程。p53通过直接结合SLC7A11启动子区域或通过影响ALOX蛋白诱导铁死亡来抑制SLC7A11转录[7, 40]。然而,p53还通过p21上调维持GSH水平来防止铁死亡发生。并且p53可以通过转录非依赖性方式抑制二肽基肽酶-4(dipeptidyl peptidase-4,DPP4)来抑制erastin刺激的铁死亡[41]。此外,p53和铁死亡之间的相互作用与细胞环境和特异性诱导因素密切相关[42],因此,针对结肠与直肠癌应用铁死亡机制进行临床治疗十分困难,急需进一步明确p53参与铁死亡调控的具体作用。
2.8 肾细胞癌肾细胞癌(renal cell carcinoma,RCC)是一种破坏性疾病,对常规癌症疗法的抵抗力极强。有研究表明,透明细胞肾细胞癌(clear cell renal cell carcinoma,ccRCC)能够通过GSH/GPX通路紊乱而诱发铁死亡[43]。顺铂可降低细胞内GSH水平,且已运用到各种肿瘤的临床治疗中,但由于DNA损伤和细胞凋亡,顺铂在治疗癌症的临床应用中,常产生耐药性。研究表明,与单一使用顺铂或erastin比较,两药合用可增加抗肿瘤效果[44]。另一项研究结果表明,PDZ结合基序转录共激活因子(transcriptional co-activator with PDZ-binding motif,TAZ)能够调节上皮膜蛋白1(epithelial membrane protein 1,EMP1)表达诱导NADPH氧化酶4(NADPH oxidase 4,NOX4)产生ROS介导铁死亡,最终杀死癌细胞[45]。上述研究结果提示,RCC细胞中的铁死亡诱导可以成为肾癌临床治疗的有效方案。
2.9 黑素瘤在黑色素瘤的研究中,黑色素瘤的渐进分化亚型与铁死亡调控密切相关。针对microRNA对铁死亡调节的研究结果表明,miR-137可以直接作用于谷氨酰胺转运蛋白溶质载体家族1成员5(solute carrier family 1 member 5,SLC1A5)来负向调节铁死亡,而miR-9通过针对谷氨酸-草酰乙酸转氨酶1(glutamate oxaloacetate transaminase 1,GOT1)正向调节铁死亡[46]。在线粒体中,线粒体复合物Ⅰ的抑制能增加ROS积累,最终导致铁死亡。此外,erastin在线粒体外膜与线粒体电压依赖性阴离子通道2(voltage-dependent anion channel 2,VDAC2)和VDAC3结合,引发神经前体细胞表达的发育下调基因4(neuronal precursor cell expressed developmentally downregulated 4,NEDD4)依赖性降解触发铁死亡[47]。以上利用铁死亡机制治疗黑素瘤的研究多局限于体外细胞实验,因此亟待进一步临床试验验证其治疗效果。
2.10 卵巢癌卵巢癌是引起女性死亡的主要因素之一。雄激素受体(androgen receptor,AR)可以提高卵巢癌细胞中ROS导致的铁死亡。高级别浆液性卵巢癌(high-grade serous ovarian carcinoma,HGSOC)是恶性卵巢癌的常见亚型。在患者的HGSOC细胞中,存在铁代谢紊乱,由于转铁蛋白受体1(transferrin receptor 1,TFR1)的增加可伴随铁离子泵和膜铁转运蛋白(ferroportin,FPN)表达降低,从而加速肿瘤的生长和转移[48]。以上研究提示,卵巢癌患者维持铁代谢平衡将提高癌细胞对铁死亡诱导剂的敏感性,因此在卵巢癌治疗过程中应及时纠正铁代谢紊乱。
3 展望综上所述,基于铁死亡进行癌症治疗,不同癌症具有各自的潜在治疗靶点(图 2)。未来针对铁死亡机制的研究仍需进一步明确各分子的调控作用,以便完善人们对铁死亡的认知,并为治疗癌症药物的研发提供参考依据。目前,大量铁死亡诱导剂被用来治疗癌症,但多数化合物靶向作用较差,不良反应强。新近研究结果表明,大量中藏药如黄芪、葛根、银杏、青蒿及丹参等中药材能够通过诱导铁死亡治疗癌症,此外四君子汤和脑泰方等方剂也可通过调控铁死亡发挥癌症治疗效果[49-51]。以上提示,中藏药在基于铁死亡途径治疗癌症方面具有重大研究价值,未来应加大对中藏药及其化学成分的发掘,靶向性的通过铁死亡机制治疗不同癌症。
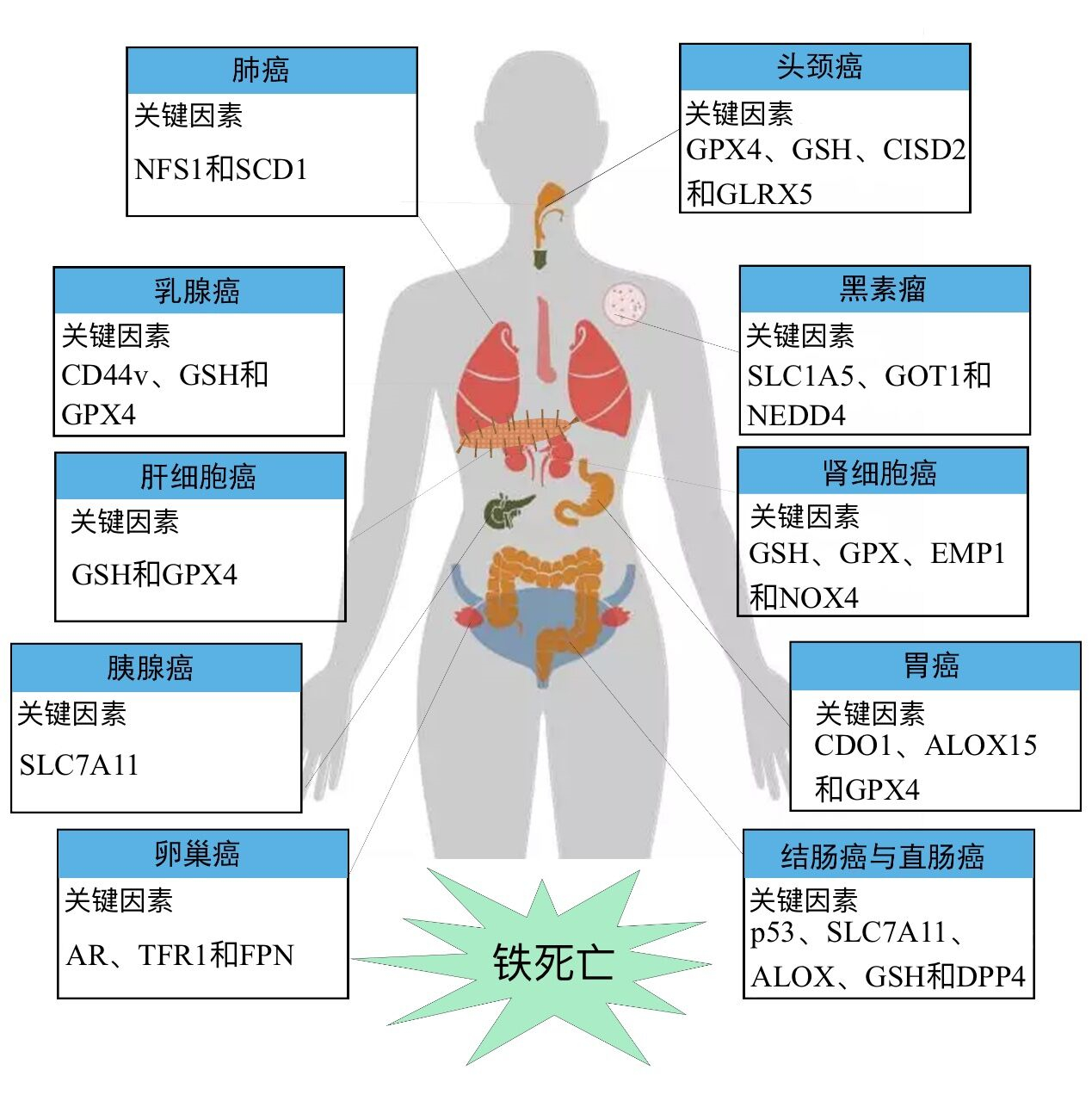
|
| 注 SCD1:硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1);CD44v:CD44的剪接变异体;GSH:谷胱甘肽(glutathione, r-glutamyl cysteingl+glycine);CPX4:谷胱甘肽过氧化物酶4(glutathione peroxidase 4);SLC7A11:溶质载体家族7成员11(solute carrier family 7 member 11);AR:雄激素受体(androgen receptor);TFR1:转铁蛋白受体1(transferrin receptor 1);FPN:膜铁转运蛋白(ferroportin);CISD2:CDGSH铁硫结构域2(CDGSH iron-sulfur domain 2);GLRX5:谷氧还蛋白5(glutaredoxin 5);SLC1A5:溶质载体家族1成员5(solute carrier family 1 member 5);GOT1:谷氨酸-草酰乙酸转氨酶(glutamate oxaloacetate transaminase 1);NEDD4:神经前体细胞表达的发育下调基因4(neuronal precursor cell expressed developmentally downregulated 4);EMP1:上皮膜蛋白1(epithelial membrane protein 1);NOX4:NADPH氧化酶4(NADPH oxidase 4);CDO1:I型半胱氨酸双加氧酶(cysteine dioxygenase type 1);ALOX15:花生四烯酸-15-脂加氧酶(arachidonate-15-lipoxygenase);DPP4:二肽基肽酶-4(dipeptidyl peptidase-4) 图 2 基于铁死亡治疗不同癌症的潜在治疗靶点 |
| [1] |
Mattiuzzi C, Lippi G. Cancer statistics: a comparison between World Health Organization (WHO) and global burden of disease (GBD)[J]. Eur J Public Health, 2020, 30(5): 1026-1027. DOI:10.1093/eurpub/ckz216 |
| [2] |
DeWeerdt S. A global drive to eliminate cervical cancer[J]. Nature, 2020, 580(7804): S2-4. DOI:10.1038/d41586-020-01036-x |
| [3] |
Zhou YL, Shen Y, Chen C, et al. The crosstalk between autophagy and ferroptosis: what can we learn to target drug resistance in cancer?[J]. Cancer Biol Med, 2019, 16(4): 630-646. DOI:10.20892/j.issn.2095-3941.2019.0158 |
| [4] |
Conrad M, Pratt DA. Publisher correction: the chemical basis of ferroptosis[J]. Nat Chem Biol, 2020, 16(2): 223-224. DOI:10.1038/s41589-019-0434-z |
| [5] |
Sun YT, Chen P, Zhai BT, et al. The emerging role of ferroptosis in inflammation[J]. Biomed Pharmacother, 2020, 127: 110108. DOI:10.1016/j.biopha.2020.110108 |
| [6] |
Chen X, Kang R, Kroemer G, et al. Ferroptosis in infection, inflammation, and immunity[J]. J Exp Med, 2021, 218(6): e20210518. DOI:10.1084/jem.20210518 |
| [7] |
Hassannia B, Vandenabeele P, Vanden Berghe T. Targeting ferroptosis to iron out cancer[J]. Cancer Cell, 2019, 35(6): 830-849. DOI:10.1016/j.ccell.2019.04.002 |
| [8] |
Gao MH, Monian P, Quadri N, et al. Glutaminolysis and transferrin regulate ferroptosis[J]. Mol Cell, 2015, 59(2): 298-308. DOI:10.1016/j.molcel.2015.06.011 |
| [9] |
Angeli JPF, Shah R, Pratt DA, et al. Ferroptosis inhibition: mechanisms and opportunities[J]. Trends Pharmacol Sci, 2017, 38(5): 489-498. DOI:10.1016/j.tips.2017.02.005 |
| [10] |
Stockwell BR, Friedmann Angeli JP, Bayir H, et al. Ferroptosis: a regulated cell death nexus linking metabolism, redox biology, and disease[J]. Cell, 2017, 171(2): 273-285. DOI:10.1016/j.cell.2017.09.021 |
| [11] |
Torii S, Shintoku R, Kubota C, et al. An essential role for functional lysosomes in ferroptosis of cancer cells[J]. Biochem J, 2016, 473(6): 769-777. DOI:10.1042/BJ20150658 |
| [12] |
Dixon SJ. Ferroptosis: bug or feature?[J]. Immunol Rev, 2017, 277(1): 150-157. DOI:10.1111/imr.12533 |
| [13] |
Gao MH, Jiang XJ. To eat or not to eat-the metabolic flavor of ferroptosis[J]. Curr Opin Cell Biol, 2018, 51: 58-64. DOI:10.1016/j.ceb.2017.11.001 |
| [14] |
Tang QH, Bai LL, Zou Z, et al. Ferroptosis is newly characterized form of neuronal cell death in response to arsenite exposure[J]. Neurotoxicology, 2018, 67: 27-36. DOI:10.1016/j.neuro.2018.04.012 |
| [15] |
Jhelum P, Santos-Nogueira E, Teo W, et al. Ferroptosis mediates cuprizone-induced loss of oligodendrocytes and demyelination[J]. J Neurosci, 2020, 40(48): 9327-9341. DOI:10.1523/JNEUROSCI.1749-20.2020 |
| [16] |
Stockwell BR. A powerful cell-protection system prevents cell death by ferroptosis[J]. Nature, 2019, 575(7784): 597-598. DOI:10.1038/d41586-019-03145-8 |
| [17] |
裴珍珍, 王革生, 郑粲. 头颈部鳞状细胞癌铁死亡相关lncRNA预后模型的建立与验证[J]. 实用肿瘤杂志, 2022, 37(6): 530-542. DOI:10.13267/j.cnki.syzlzz.2022.089 |
| [18] |
You JH, Lee J, Roh JL. Mitochondrial pyruvate carrier 1 regulates ferroptosis in drug-tolerant persister head and neck cancer cells via epithelial-mesenchymal transition[J]. Cancer Lett, 2021, 507: 40-54. DOI:10.1016/j.canlet.2021.03.013 |
| [19] |
侯婉云, 刘发煇, 龙朴泽, 等. 肿瘤微环境对铁死亡的影响[J]. 实用肿瘤杂志, 2022, 37(4): 371-375. |
| [20] |
Shui SF, Zhao ZL, Wang H, et al. Non-enzymatic lipid peroxidation initiated by photodynamic therapy drives a distinct ferroptosis-like cell death pathway[J]. Redox Biol, 2021, 45: 102056. DOI:10.1016/j.redox.2021.102056 |
| [21] |
Lin RY, Zhang ZH, Chen LF, et al. Dihydroartemisinin (DHA) induces ferroptosis and causes cell cycle arrest in head and neck carcinoma cells[J]. Cancer Lett, 2016, 381(1): 165-175. DOI:10.1016/j.canlet.2016.07.033 |
| [22] |
Roh JL, Kim EH, Jang H, et al. Nrf2 inhibition reverses the resistance of cisplatin-resistant head and neck cancer cells to artesunate-induced ferroptosis[J]. Redox Biol, 2017, 11: 254-262. DOI:10.1016/j.redox.2016.12.010 |
| [23] |
Lee J, You JH, Shin D, et al. Inhibition of glutaredoxin 5 predisposes cisplatin-resistant head and neck cancer cells to ferroptosis[J]. Theranostics, 2020, 10(17): 7775-7786. DOI:10.7150/thno.46903 |
| [24] |
Li HF, Li L, Xue C, et al. A novel ferroptosis-related gene signature predicts overall survival of breast cancer patients[J]. Biology (Basel), 2021, 10(2): 151. |
| [25] |
Xu Z, Tang JH. RelB silencing to reverse tamoxifen resistance by regulating GPx4 and ferroptosis in breast cancer[J]. J Clin Oncol, 2020, 38(15_suppl): e12513. DOI:10.1200/JCO.2020.38.15_suppl.e12513 |
| [26] |
Yang JJ, Zhou YL, Xie SD, et al. Metformin induces Ferroptosis by inhibiting UFMylation of SLC7A11 in breast cancer[J]. J Exp Clin Cancer Res, 2021, 40(1): 206. DOI:10.1186/s13046-021-02012-7 |
| [27] |
Ma S, Henson ES, Chen Y, et al. Ferroptosis is induced following siramesine and lapatinib treatment of breast cancer cells[J]. Cell Death Dis, 2016, 7(7): e2307. DOI:10.1038/cddis.2016.208 |
| [28] |
Lachaier E, Louandre C, Godin C, et al. Sorafenib induces ferroptosis in human cancer cell lines originating from different solid tumors[J]. Anticancer Res, 2014, 34(11): 6417-6422. |
| [29] |
Yu HC, Yang CC, Jian L, et al. Sulfasalazine-induced ferroptosis in breast cancer cells is reduced by the inhibitory effect of estrogen receptor on the transferrin receptor[J]. Oncol Rep, 2019, 42(2): 826-838. |
| [30] |
Bebber CM, Thomas ES, Stroh J, et al. Ferroptosis response segregates small cell lung cancer (SCLC) neuroendocrine subtypes[J]. Nat Commun, 2021, 12(1): 2048. DOI:10.1038/s41467-021-22336-4 |
| [31] |
Blankstein AR, Ma SM, Gibson SB. Abstract 4293:Siramesine and lapatinib induce ferroptosis in glioblastoma and lung adenocarcinoma cells[J]. Cancer Res, 2017, 77(13_suppl): 4293. |
| [32] |
Lu B, Chen XB, Ying MD, et al. The role of ferroptosis in cancer development and treatment response[J]. Front Pharmacol, 2017, 8: 992. |
| [33] |
Xu GX, Wang H, Li XL, et al. Recent progress on targeting ferroptosis for cancer therapy[J]. Biochem Pharmacol, 2021, 190: 114584. DOI:10.1016/j.bcp.2021.114584 |
| [34] |
Zhao LY, Peng YM, He SX, et al. Apatinib induced ferroptosis by lipid peroxidation in gastric cancer[J]. Gastric Cancer, 2021, 24(3): 642-654. DOI:10.1007/s10120-021-01159-8 |
| [35] |
Tang R, Hua J, Xu J, et al. The role of ferroptosis regulators in the prognosis, immune activity and gemcitabine resistance of pancreatic cancer[J]. Ann Transl Med, 2020, 8(21): 1347. DOI:10.21037/atm-20-2554a |
| [36] |
Eling N, Reuter L, Hazin J, et al. Identification of artesunate as a specific activator of ferroptosis in pancreatic cancer cells[J]. Oncoscience, 2015, 2(5): 517-532. DOI:10.18632/oncoscience.160 |
| [37] |
Yamaguchi Y, Kasukabe T, Kumakura S. Piperlongumine rapidly induces the death of human pancreatic cancer cells mainly through the induction of ferroptosis[J]. Int J Oncol, 2018, 52(3): 1011-1022. |
| [38] |
Li ZJ, Dai HQ, Huang XW, et al. Artesunate synergizes with sorafenib to induce ferroptosis in hepatocellular carcinoma[J]. Acta Pharmacol Sin, 2021, 42(2): 301-310. DOI:10.1038/s41401-020-0478-3 |
| [39] |
Nie JH, Lin BL, Zhou M, et al. Role of ferroptosis in hepatocellular carcinoma[J]. J Cancer Res Clin Oncol, 2018, 144(12): 2329-2337. DOI:10.1007/s00432-018-2740-3 |
| [40] |
Choi BH, Colon T, Jiang J, et al. Regulation of ferroptosis in KRas mutant cancer cells[J]. FASEB J, 2020, 34(S1): 1. |
| [41] |
Wolff WI, Shinya H. Earlier diagnosis of cancer of the colon through colonic endoscopy (colonoscopy)[J]. Cancer, 1974, 34(3): 912-931. |
| [42] |
Xu MY, Tao J, Yang YD, et al. Ferroptosis involves in intestinal epithelial cell death in ulcerative colitis[J]. Cell Death Dis, 2020, 11(2): 86. |
| [43] |
Zhu J, Kong W, Xie ZW. Expression and prognostic characteristics of ferroptosis-related genes in colon cancer[J]. Int J Mol Sci, 2021, 22(11): 5652. |
| [44] |
Guo J, Xu B, Han Q, et al. Ferroptosis: a novel anti-tumor action for cisplatin[J]. Cancer Res Treat, 2018, 50(2): 445-460. |
| [45] |
Yang WS, Stockwell BR. Ferroptosis: death by lipid peroxidation[J]. Trends Cell Biol, 2016, 26(3): 165-176. |
| [46] |
Jasim KA, Gesquiere AJ. Ultrastable and biofunctionalizable conjugated polymer nanoparticles with encapsulated iron for ferroptosis assisted chemodynamic therapy[J]. Mol Pharm, 2019, 16(12): 4852-4866. |
| [47] |
Basit F, van Oppen LM, Schöckel L, et al. Mitochondrial complex I inhibition triggers a mitophagy-dependent ROS increase leading to necroptosis and ferroptosis in melanoma cells[J]. Cell Death Dis, 2017, 8(3): e2716. |
| [48] |
Basuli D, Tesfay L, Deng Z, et al. Iron addiction: a novel therapeutic target in ovarian cancer[J]. Oncogene, 2017, 36(29): 4089-4099. |
| [49] |
张启立, 赵磊, 夏鹏飞, 等. 基于铁死亡理论的中医药防治肿瘤研究进展[J]. 中国实验方剂学杂志, 2021, 27(22): 222-231. |
| [50] |
Lou JS, Zhao LP, Huang ZH, et al. Ginkgetin derived from Ginkgo biloba leaves enhances the therapeutic effect of cisplatin via ferroptosis-mediated disruption of the Nrf2/HO-1 axis in EGFR wild-type non-small-cell lung cancer[J]. Phytomedicine, 2021, 80: 153370. |
| [51] |
Wu CY, Yang YH, Lin YS, et al. Dihydroisotanshinone Ⅰ induced ferroptosis and apoptosis of lung cancer cells[J]. Biomedecine Pharmacother, 2021, 139: 111585. |
 2023, Vol. 38
2023, Vol. 38


