文章信息
- 喻唯, 刘小平, 李胜, 甘莉娟, 龚青
- Yu Wei, Liu Xiaoping, Li Sheng, Gan Lijuan, Gong Qing
- 基于TCGA数据库分析CD6表达与子宫颈癌预后的相关性
- Association between CD6 expression and prognosis of cervical cancer based on TCGA database
- 实用肿瘤杂志, 2021, 36(1): 52-56
- Journal of Practical Oncology, 2021, 36(1): 52-56
-
通信作者
- 龚青,E-mail:doctorgq@163.com
-
文章历史
- 收稿日期:2019-11-24
2. 武汉大学中南医院泌尿外科,湖北 武汉 430071;
3. 武汉大学中南医院生物样本库,湖北 武汉 430071;
4. 武汉大学中南医院妇瘤科,湖北 武汉 430071;
5. 武汉大学中南医院妇产科,湖北 武汉 430071
2. Department of Urology, Zhongnan Hospital of Wuhan University, Wuhan 430071, China;
3. Biological Sample Database, Zhongnan Hospital of Wuhan University, Wuhan 430071, China;
4. Department of Gynecology, Zhongnan Hospital of Wuhan University, Wuhan 430071, China;
5. Department of Obstetrics and Gynecology, Zhongnan Hospital of Wuhan University, Wuhan 430071, China
子宫颈癌是女性最常见的恶性肿瘤之一,在全球范围内,其发病率和死亡率均位居女性肿瘤的第4位[1-2]。尽管子宫颈癌在筛查以及治疗上取得一定的进展[3],但其分子机制尚未完全阐明[4]。特异性的分子可以作为生物标志物促进肿瘤早期诊断和治疗靶点[5]。
白细胞分化抗原6(cluster of differentiation 6, CD6)是Ⅰ型跨膜糖蛋白,属于古老而高度保守的清道夫受体超家族[6]。CD6几乎在所有发育和成熟的T淋巴细胞中都有表达,可能是T淋巴细胞的重要调节分子[7]。CD6的生理作用尚不清晰,有研究指出,CD6与自身免疫性疾病和某些肿瘤的发生和发展有密切的关系[8]。然而,目前缺乏CD6基因与子宫颈癌患者预后关系的研究。
癌症基因组图谱(The Cancer Genome Atlas,TCGA)是由美国国立癌症研究所(the National Cancer Institute)和国家人类基因组研究所(the National Human Genome Research Institute)联合开展的具有里程碑意义的癌症基因组学项目,提供癌症临床数据和各组学数据,后者包括基因组、表观基因组、转录组和蛋白质组数据[9]。本研究利用TCGA中的宫颈鳞状细胞癌与宫颈腺癌数据集(the Cancer Genome Atlas-Cervical Squamous Cell Carcinoma and Endocervical Adenocarcinoma, TCGA-CESC),探讨CD6表达水平与子宫颈癌临床病理特征及预后的相关性,并采取基因富集的方法预测CD6推动肿瘤发生和发展的生物学通路,以期为临床上子宫颈癌的预后判断和靶向治疗奠定基础。
1 资料与方法 1.1 资料下载与整理从TCGA官网上下载子宫颈癌数据集TCGA-CESC(https://www.cancer.gov),包括临床信息和基因表达资料,将基因表达资料中的CD6表达资料按照样本编号与临床资料进行匹配,同时排除非原发性肿瘤以及不含生存信息和基因表达数据的样本,最终得到样本290例。由于TCGA-CESC中没有无瘤生存期相关资料,故从NCBI的基因表达汇编(Gene Expression Omnibus, GEO)数据库中下载GSE44001数据集(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE44001),用于进行生存分析的外部独立验证。GSE44001收录的样本均为2002年1月至2008年9月在韩国成均馆大学医学院三星医疗中心接受治疗的早期子宫颈癌患者,研究者对其进行长达5年的随访,最后共纳入300个样本进行预后分析。其中,CD6基因对应的探针为ILMN_1746565。
1.2 临床相关性分析由于TCGA-CESC的临床资料相较于GSE44001更为丰富,故利用其进行回顾性研究与总生存期分析,而运用后者的无瘤生存期资料对TCGA-CESC的生存分析结果作进一步验证。使用R软件survminer包的surv_cutpoint寻找截点,将资料按CD6表达量分为低表达组和高表达组。这是基于maxstat(最大选择的排名统计)统计量确定连续变量的最佳切点的方法。在TCGA-CESC中,分别比较CD6高表达组和低表达组在年龄、肿瘤分期、更年期状态和组织学类型4个方面的差异,从而推断CD6表达水平与临床病理特征的相关性。此外,在TCGA-CESC中,利用生存分析的方法探索CD6高表达组和低表达组总生存率之间的差异; 在GSE44001中探讨两组间无瘤生存率的差异。二者相互验证,以明确CD6表达量与子宫颈癌预后的关联性。
1.3 基因富集分析采用GSEA 4.0进行基因富集分析,寻找CD6影响肿瘤发生和发展的可能生物通路。首先准备好芯片表达谱数据集文件和表型文件,后者按前述方法划分为CD6高表达组和低表达组。以从GSEA网站MsigDB数据库中获取的“HALLMARK”作为参照基因集,置换次数为1 000次。
1.4 统计学分析利用卡方检验比较两组各个临床病理特征的分布差异,生存分析则用Log-rank(Mantel-Cox)法比较两组间的总生存率的差异。以P < 0.05为差异具有统计学意义。采用R 3.6.0软件进行统计学分析和绘图。基因富集分析中,以P < 0.01和错误发现率(false discovery rate,FDR) < 0.25作为显著富集的基因集。
2 结果 2.1 CD6表达水平与子宫颈癌的临床病理特征的关系利用TCGA-CESC数据集中子宫颈癌患者的临床信息进行回顾性分析。CD6高表达组和低表达组分别包含样本153例和137例(表 1)。高表达组年龄24~85岁,中位年龄47岁; 低表达组年龄20~88岁,中位年龄46岁。子宫颈癌组织的CD6的表达水平在肿瘤分期(χ2=10.514,P=0.015)和组织学类型(χ2=10.446,P=0.001)方面比较,差异均具有统计学意义,而在年龄和更年期状态方面比较,差异均无统计学意义(均P > 0.05)。
| 临床特征 | 总例数 | CD6表达水平(例,%) | χ2值 | P值 | |
| 高(n=153) | 低(n=137) | ||||
| 年龄 | 2.666 | 0.103 | |||
| <50岁 | 174 | 85(55.6) | 89(65.0) | ||
| ≥50岁 | 116 | 68(44.4) | 48(35.0) | ||
| 肿瘤分期 | 10.514 | 0.015 | |||
| Ⅰ期 | 159 | 84(54.9) | 75(54.7) | ||
| Ⅱ期 | 64 | 39(25.5) | 25(18.2) | ||
| Ⅲ期 | 41 | 23(15.0) | 18(13.1) | ||
| Ⅳ期 | 20 | 4(2.6) | 16(11.7) | ||
| 缺失值 | 6 | 3(2.0) | 3(2.2) | ||
| 更年期状态* | 1.247 | 0.536 | |||
| 前期 | 123 | 62(40.5) | 61(44.5) | ||
| 中期 | 25 | 15(9.8) | 10(7.3) | ||
| 后期 | 81 | 46(30.1) | 35(25.5) | ||
| 缺失值 | 61 | 30(19.6) | 31(22.6) | ||
| 组织学类型 | 10.446 | 0.001 | |||
| 鳞癌 | 240 | 137(89.5) | 103(75.2) | ||
| 非鳞癌 | 50 | 16(10.5) | 34(24.8) | ||
| 注 *前期指距离末次月经<6个月且未行双侧卵巢切除术和雌激素替代治疗,中期指距离末次月经6~12个月,后期指未行子宫切除的情况下距离末次月经>12个月或既往双侧卵巢切除; CD6:白细胞分化抗原6(cluster of differentiation 6) | |||||
在TCGA-CESC数据集中,CD6低表达组(n=137)和高表达组(n=153)子宫颈癌患者的5年总生存率分别为51.1%和78.1%(Log-rank=14.990,P < 0.01,HR=2.554,95%CI:1.589~4.107;图 1)。在GSE44001数据集中,CD6低表达组(n=29)和高表达组(n=271)患者的5年无瘤生存率分别70.0%和86.1%(Log-rank=6.312,P=0.012,HR=4.655,95%CI:1.402~15.450),表明CD6低表达组的5年无瘤生存率低于高表达组,与TCGA-CESC数据集生存分析的结果一致。
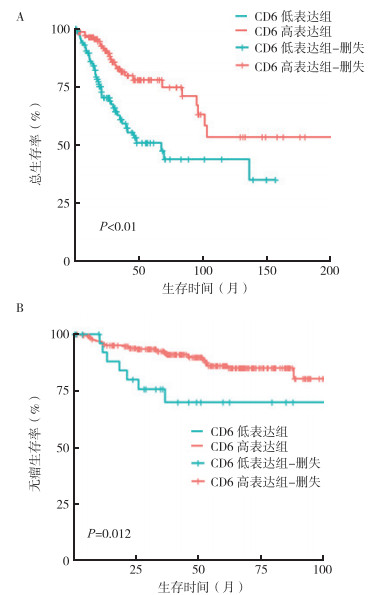
|
| 注 A:总生存曲线(TCGA-CESC); B:无瘤生存曲线(GSE44001) 图 1 子宫颈癌患者CD6高表达组和低表达组总生存曲线和无瘤生存曲线比较 Fig.1 Comparison of overall and disease-free survival curves between the high expression group and low expression group of CD6 among cervical cancer patients |
利用基因集富集分析方法探究CD6调节子宫颈癌的可能机制,即探寻受CD6调控的生物通路基因集。以“HALLMARK”作为参照基因集显示,CD6低表达的子宫颈癌样本富集IL2_STAT5信号通路、IL6_JAK_STAT3信号通路、磷脂酰肌醇-3激酶信号通路、KRAS信号通路上调、干扰素γ响应、干扰素α响应、同种异体移植排斥、炎性反应响应、胸腺、补体、顶端表面和异型生物质代谢相关的基因集(表 2)。
| 基因集 | 富集分数 | 标准化富集分数 | 错误发现率 | P值 |
| IL2_STAT5_SIGNALING | 0.645 | 2.047 | 0.021 | <0.01 |
| PI3K_AKT_MTOR_SIGNALING | 0.448 | 2.099 | 0.024 | <0.01 |
| INTERFERON_GAMMA_RESPONSE | 0.779 | 1.964 | 0.030 | <0.01 |
| ALLOGRAFT_REJECTION | 0.825 | 1.995 | 0.030 | <0.01 |
| INFLAMMATORY_RESPONSE | 0.733 | 1.925 | 0.030 | <0.01 |
| IL6_JAK_STAT3_SIGNALING | 0.723 | 1.900 | 0.031 | <0.01 |
| APOPTOSIS | 0.487 | 1.820 | 0.037 | <0.01 |
| COMPLEMENT | 0.671 | 2.112 | 0.042 | <0.01 |
| APICAL_SURFACE | 0.600 | 1.781 | 0.044 | <0.01 |
| KRAS_SIGNALING_UP | 0.592 | 1.754 | 0.047 | <0.01 |
| INTERFERON_ALPHA_RESPONSE | 0.782 | 1.833 | 0.038 | 0.002 |
| XENOBIOTIC_METABOLISM | 0.457 | 1.623 | 0.083 | 0.004 |
子宫颈癌由于其高发病率和高死亡率,是全球尤其是发展中国家的主要疾病负担之一[10]。WHO在2018年将消灭子宫颈癌作为全球公共卫生目标[11]。中国作为最大的发展中国家,子宫颈癌的现状不容乐观,据GLOBOCAN估计,中国的子宫颈癌患者数在2030年将达到93 500例,2050年将达到186 600例[12]。早期及时的治疗能有效降低子宫颈癌的死亡率[13]。由于子宫颈癌与人乳头瘤病毒(human papillomavirus,HPV)感染高度相关,而高危险性的HPV感染容易诱发基因突变[14]。因此,寻找与子宫颈癌预后相关的分子靶标,并将其运用于子宫颈癌的诊断和治疗极为迫切[15]。
本研究是首个探究CD6与子宫颈癌预后的相关性的研究。CD6是清道夫受体超家族的一员,其胞外部分包括3个清道夫受体域,胞内部分虽然缺乏激酶活性,但具有信号转导蛋白磷酸化和募集的位点[16]。早在19世纪80年代,CD6就被发现是淋巴细胞表面受体之一[8]。CD6与某些损伤和病理过程相关[8]。CD6与自身免疫性疾病有密切的关系,如多发性硬化症[17]和银屑病[18]。
本研究发现,相较于CD6高表达组,CD6低表达的子宫颈癌患者的肿瘤分期更高,鳞癌的可能性也更大。此外,CD6低表达组的总生存率和无瘤生存率更低。T细胞活化后的CD6下调会影响淋巴细胞的存活和增殖反应,且CD6下调与细胞凋亡易患性增加相关[19]。这在一定程度可以解释本研究的结果,即CD6下调导致淋巴细胞凋亡增加,从而不利于癌细胞的清除。然而,也有研究指出,CD6的高表达可能与某些癌症的不良预后相关,因为其配体CD166和CD138在多种肿瘤细胞上高表达[8]。但事实上,CD6的功能尚不明确,以往的细胞内实验在CD6诱导或抑制T淋巴细胞活化方面得出相反的结论[7]。因此,CD6作用需要通过细胞内实验和细胞外实验来进一步明确,这也是本研究的局限性所在。
此外,本研究通过基因富集的方法,发现CD6高表达富集多种与免疫相关的基因,如IL2_STAT5信号通路、干扰素响应、同种异体移植排斥和胸腺等相关的基因,这说明CD6在调节机体免疫水平方面扮演着重要角色,这与以往的研究相一致[8, 17-19]。目前研究发现,子宫颈癌的发生与高危险性HPV感染密切相关,而HPV发挥作用主要依靠炎性反应[20]。本研究发现CD6高表达富集炎性反应响应相关基因,这在一定程度上可以说明CD6在子宫颈癌中的作用不可忽视。此外,富集的基因中包含与细胞增殖、分化、凋亡和葡萄糖转运相关的基因(磷脂酰肌醇-3激酶信号通路和IL-6-JAK-STAT3信号通路),这为进一步探讨CD6在肿瘤的发展过程中发挥作用的机制提供可能的思路。
总之,基于TCGA的子宫颈癌数据集,本研究表明,CD6的低表达与高肿瘤分级和不良预后相关,其机制可能与免疫调控和细胞增殖分化调节有关,因此,CD6可能作为子宫颈癌患者预后的评价分子,这为子宫颈癌的诊断和治疗提供新的思路。但其具体是如何发挥作用的,还需要通过实验的方法来进一步探讨。
| [1] |
Kontostathi G, Zoidakis J, Anagnou NP, et al. Proteomics approaches in cervical cancer: focus on the discovery of biomarkers for diagnosis and drug treatment monitoring[J]. Expert Rev Proteomics, 2016, 13(8): 731-745. DOI:10.1080/14789450.2016.1210514 |
| [2] |
WHO. Human papillomavirus (HPV) and cervical cancer[EB/OL]. (2019-1-24)[2019-10-12]. https://www.who.int/news-room/fact-sheets/detail/human-papillomavirus-(hpv)-and-cervical-cancer
|
| [3] |
Wuerthner BA, Avila-Wallace M. Cervical cancer: Screening, management, and prevention[J]. Nurse Pract, 2016, 41(9): 18-23. DOI:10.1097/01.NPR.0000490390.43604.5f |
| [4] |
Zhang L, Huang H, Zhang L, et al. URG4 overexpression is correlated with cervical cancer progression and poor prognosis in patients with early-stage cervical cancer[J]. BMC Cancer, 2014, 14(1): 885. DOI:10.1186/1471-2407-14-885 |
| [5] |
Zong S, Liu X, Zhou N, et al. E2F7, EREG, miR-451a and miR-106b-5p are associated with the cervical cancer development[J]. Arch Gynecol Obstet, 2019, 299(4): 1089-1098. DOI:10.1007/s00404-018-5007-y |
| [6] |
Martínez VG, Moestrup SK, Holmskov U, et al. The conserved scavenger receptor cysteine-rich superfamily in therapy and diagnosis[J]. Pharmacol Rev, 2011, 63(4): 967-1000. DOI:10.1124/pr.111.004523 |
| [7] |
Li Y, Singer NG, Whitbred J, et al. CD6 as a potential target for treating multiple sclerosis[J]. Proc Natl Acad Sci U S A, 2017, 114(10): 2687-2692. DOI:10.1073/pnas.1615253114 |
| [8] |
Consuegra-Fernández M, Lin F, Fox DA, et al. Clinical and experimental evidence for targeting CD6 in immune-based disorders[J]. Autoimmun Rev, 2018, 17(5): 493-503. DOI:10.1016/j.autrev.2017.12.004 |
| [9] |
Tomczak K, Czerwińska P, Wiznerowicz M. The Cancer Genome Atlas (TCGA): an immeasurable source of knowledge[J]. Contemp Oncol (Pozn), 2015, 19(1A): A68-77. |
| [10] |
Bhat S, Kabekkodu SP, Noronha A, et al. Biological implications and therapeutic significance of DNA methylation regulated genes in cervical cancer[J]. Biochimie, 2016, 121: 298-311. DOI:10.1016/j.biochi.2015.12.018 |
| [11] |
Zhao F, Qiao Y. Cervical cancer prevention in China: a key to cancer control[J]. Lancet, 2019, 393(10175): 969-970. DOI:10.1016/S0140-6736(18)32849-6 |
| [12] |
Di J, Rutherford S, Chu C. Review of the cervical cancer burden and population-based cervical cancer screening in China[J]. Asian Pac J Cancer Prev, 2015, 16(17): 7401-7407. DOI:10.7314/APJCP.2015.16.17.7401 |
| [13] |
Tsikouras P, Zervoudis S, Manav B, et al. Cervical cancer: screening, diagnosis and staging[J]. J BUON, 2016, 21(2): 320-325. |
| [14] |
Steenbergen RD, Snijders PJ, Heideman DA, et al. Clinical implications of (epi)genetic changes in HPV-induced cervical precancerous lesions[J]. Nat Rev Cancer, 2014, 14(6): 395-405. DOI:10.1038/nrc3728 |
| [15] |
Dizon DS, Mackay HJ, Thomas GM, et al. State of the science in cervical cancer: where we are today and where we need to go[J]. Cancer, 2014, 120(15): 2282-2288. DOI:10.1002/cncr.28722 |
| [16] |
Fox DA. The role of CD6 in autoimmune diseases[J]. Cell Mol Immunol, 2018, 15(11): 1001-1002. DOI:10.1038/s41423-018-0015-1 |
| [17] |
Kofler DM, Farkas A, von Bergwelt-Baildon M, et al. The link between CD6 and autoimmunity: genetic and cellular associations[J]. Curr Drug Targets, 2016, 17(6): 651-665. DOI:10.2174/1389450117666160201105934 |
| [18] |
Consuegra-Fernández M, Julià M, Martínez-Florensa M, et al. Genetic and experimental evidence for the involvement of the CD6 lymphocyte receptor in psoriasis[J]. Cell Mol Immunol, 2018, 15(10): 898-906. DOI:10.1038/cmi.2017.119 |
| [19] |
Carrasco E, Escoda-Ferran C, Climent N, et al. Human CD6 down-modulation following T-cell activation compromises lymphocyte survival and proliferative responses[J]. Front Immunol, 2017, 8: 769. DOI:10.3389/fimmu.2017.00769 |
| [20] |
徐帅师, 聂文佳, 张咏梅. 子宫颈癌筛查中DNA倍体及HPV检查结果分析[J]. 实用肿瘤杂志, 2020, 35(1): 59-61. |
 2021, Vol. 36
2021, Vol. 36


