文章信息
- 杨宏伟, 陈茂山, 李芳芳, 侯令密, 黄云辉
- Yang Hongwei, Chen Maoshan, Li Fangfang, Hou Lingmi, Huang Yunhui
- 放疗治疗初诊Ⅳ期全乳切除乳腺癌的价值:一项基于SEER数据库的研究
- Utility of radiation therapy in initially diagnosed stage Ⅳ breast cancer patients with total mastectomy: a study based on SEER database
- 实用肿瘤杂志, 2020, 35(6): 524-529
- Journal of Practical Oncology, 2020, 35(6): 524-529
基金项目
- 四川省卫计委科研课题(17PJ599)
-
作者简介
- 杨宏伟(1963-),男,四川遂宁人,副主任医师,硕士生,从事乳腺癌临床研究.
-
通信作者
- 杨宏伟,E-mail:yhw.sn@163.com
-
文章历史
- 收稿日期:2019-07-14
2. 遂宁市中心医院手术室,四川 遂宁 629000;
3. 川北医学院附属医院乳腺甲状腺外科,四川 南充 637000
2. Operating Room, Suining Central Hospital, Suining 629000, China;
3. Department of Breast and Thyroid Surgery, Affiliated Hospital of North Sichuan Medical College, Nanchong 637000, China
初诊转移性乳腺癌(metastatic breast cancer,MBC)在新诊乳腺癌中所占比例约为3%~10%,该类患者预后极差,中位生存时间在18~30个月[1-2]。MBC属不可治愈疾病,既往一直主张以全身治疗为主,一般不建议进行局部处理[3-5]。随着诊治手段的进步,使初诊MBC患者的生存时间不断延长,需根据患者的不同特点制定不同的管理策略[1, 4]。目前,研究证实,部分初诊MBC患者接受外科手术可以提高生存率和改善生活质量,而局部外科手术后放疗能否带来生存获益尚不明确[3, 6-9]。本研究提取美国国立癌症研究所监测、流行病学和结果(Surveillance, Epidemiology, and End Results,SEER)数据库中1990年至2014年病理诊断为浸润性乳腺癌的病例资料,分析放疗在接受全乳切除的初诊Ⅳ期乳腺癌中的价值。
1 资料与方法 1.1 资料来源通过SEER*Stat v8.3.5软件提取SEER数据库中1990年至2014年病理诊断为浸润性乳腺癌患者的病例资料。
1.2 筛选标准纳入标准:(1)诊断年龄≥18岁;(2)性别为女性;(3)确诊年份为1990年至2014年;(4)病理类型为浸润性乳腺癌;(5)国际抗癌联盟/美国癌症联合会(Union for International Cancer Control/American Joint Committee on Cancer,UICC/AJCC)第6版解剖分期[10]为Ⅳ期;(6)接受全乳切除治疗。排除标准:(1)多源性癌;(2)放疗数据不完整。
1.3 数据提取提取患者的诊断年龄、种族、婚姻状况、肿瘤大小、组织学分级、转移部位、分子分型、治疗信息、生存时间及生存结局等资料。采用第6版UICC/AJCC的TNM解剖分期系统[10]对病例进行肿瘤分期;诊断年龄分为≤55岁和 > 55岁[11];肿瘤 > 5 cm有局部放疗指征,因此肿瘤大小分为≤5 cm和 > 5 cm;根据激素受体(hormone receptor,HR)和人表皮生长因子受体2(human epidermal growth factor receptor-2,HER2)的状态分为HR+/HER2-、HR+/HER2+、HR-/HER2+和HR-/HER2-[三阴性乳腺癌(triple negative breast cancer,TNBC)]4种乳腺癌分子亚型。研究结局指标为乳腺癌特异生存,非乳腺癌相关死亡数据作为删失数据。
1.4 统计学分析应用Stata SE13.0软件进行统计分析。采用χ2检验比较放疗组与未放疗组患者临床病理特征差异。采用Kaplan-Meier法计算生存率,生存率比较采用Log-rank法,生存曲线交叉时采用Renyi检验,单因素检验P < 0.1的因素纳入Cox比例风险模型进行多因素分析。Cox多因素分析中所纳入变量赋值情况见表 1。以P < 0.05为差异具有统计学意义。
| 因素 | 变量 | 赋值 |
| 诊断年龄 | X1 | ≤55岁=0,> 55岁=1 |
| 人种 | X2 | 白人=0,黑人=1,亚裔=2,其他=3 |
| 婚姻状态 | X3 | 已婚=0,未婚=1,未知=2 |
| 肿瘤大小 | X4 | ≤5 cm=0,> 5 cm=1,未知=2 |
| 组织学分级 | X5 | 1级=0,2级=1,3或4级=2 |
| 是否化疗 | X6 | 否或未知=0,化疗=1 |
| 是否放疗 | X7 | 否=0,放疗=1 |
| ER状态 | X8 | 阴性=0,阳性=1,未知=2 |
| PR状态 | X9 | 阴性=0,阳性=1,未知=2 |
| HER2状态 | X10 | 阴性=0,阳性=1,未知=2 |
| 分子分型 | X11 | HER2-/HR+=1,HER2+/HR+=2,HER2+/HR-=3,HER2-/HR-=4,未知=5 |
| 转移类型 | X12 | 非脏器转移=0,脏器转移=1,未知=2 |
| 生存结局 | Y1 | 生存、删失或非乳腺癌死亡=0,乳腺癌相关死亡=1 |
| 注 ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterone receptor);HER2:人表皮生长因子受体2(human epidermal growth factor receptor-2);HR:激素受体(hormone receptor) | ||
检出27 924例患者,经筛选6 925例符合要求纳入分析,筛选流程见图 1。纳入患者中位年龄59岁(四分位距:33~87岁),中位随访39个月(四分位距:18~91个月)。放疗组2 895例(41.81%),未放疗组4 030例(58.19%)。两组间临床病理特征参数分布比较,年龄、婚姻状态、病理类型、是否化疗、ER、PR和HER2状态差异均具有有统计学意义(均P < 0.05),种族和组织学分级差异均无统计学意义(均P > 0.05,表 2)。
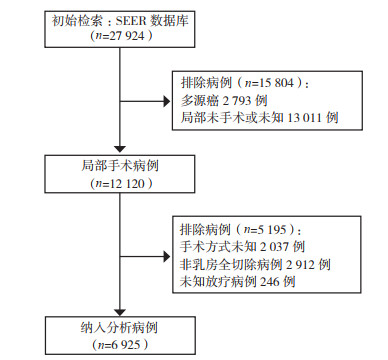
|
| 图 1 病例筛选流程图 Fig.1 Flow chart of patient selection |
| 临床病理特征 | 总例数(n=6 925) | 放疗组(n=2 895) | 非放疗组(n=4 030) | P值 |
| 年龄 | < 0.01 | |||
| ≤55岁 | 2 912 | 1 386(47.88) | 1 526(37.87) | |
| > 55岁 | 4 013 | 1 509(51.12) | 2 504(62.13) | |
| 种族 | 0.216* | |||
| 白种人 | 5 253 | 2 187(75.54) | 3 066(76.08) | |
| 黑种人 | 1 108 | 453(15.65) | 655(16.25) | |
| 亚裔 | 556 | 253(8.74) | 303(7.52) | |
| 其他 | 8 | 2(0.07) | 6(0.15) | |
| 婚姻状态 | < 0.01 | |||
| 已婚 | 3 197 | 1 428(49.33) | 1 769(43.90) | |
| 未婚 | 3 447 | 1 363(47.08) | 2 084(51.71) | |
| 未知 | 281 | 104(3.59) | 177(4.39) | |
| 病理类型 | 0.018 | |||
| 非特殊类型 | 6 542 | 2 757(95.23) | 3 785(93.92) | |
| 特殊类型 | 383 | 138(4.77) | 245(6.08) | |
| 肿瘤大小 | 0.762 | |||
| ≤5 cm | 2 170 | 896(30.95) | 1 274(31.61) | |
| > 5 cm | 2 294 | 972(33.58) | 1 322(32.80) | |
| 未知 | 2 461 | 1 027(35.47) | 1 434(35.58) | |
| 组织学分级 | 0.106 | |||
| 1级 | 321 | 111(3.83) | 203(5.04) | |
| 2级 | 2 111 | 913(31.53) | 1 205(29.90) | |
| 3或4级 | 4 493 | 1 871(64.63) | 2 622(65.06) | |
| 化疗 | < 0.01 | |||
| 是 | 4 578 | 2 175(75.13) | 2 403(59.63) | |
| 否/未知 | 2 347 | 720(24.87) | 1 627(40.37) | |
| ER | < 0.01 | |||
| 阳性 | 1 994 | 756(26.11) | 1 238(30.72) | |
| 阴性 | 4 390 | 1 972(68.12) | 2 418(60.00) | |
| 未知 | 541 | 167(5.77) | 374(9.28) | |
| PR | < 0.01 | |||
| 阳性 | 2 868 | 1 147(39.62) | 1 721(42.70) | |
| 阴性 | 3 442 | 1 558(53.82) | 1 884(46.75) | |
| 未知 | 615 | 190(6.56) | 425(10.55) | |
| HER2 | 0.017 | |||
| 阳性 | 1 482 | 666(23.01) | 816(20.25) | |
| 阴性 | 581 | 246(8.50) | 335(8.31) | |
| 未知 | 4 862 | 1 983(68.50) | 2 879(71.44) | |
| 分子分型 | 0.008 | |||
| HER2+/HR+ | 356 | 151(5.22) | 205(5.09) | |
| HER2+/HR- | 224 | 95(3.28) | 129(3.20) | |
| HER2-/HR+ | 1 123 | 524(18.10) | 599(14.86) | |
| HRR2-/HR- | 356 | 141(4.87) | 215(5.33) | |
| 未知 | 4 866 | 1 984(68.53) | 2 882(71.51) | |
| 转移类型 | < 0.01 | |||
| 脏器转移 | 2 911 | 1 347(46.53) | 1 564(38.81) | |
| 非脏器转移 | 1 841 | 680(23.49) | 1 161(28.81) | |
| 未知 | 2 173 | 868(29.98) | 1 305(32.38) | |
| 乳腺癌特异死亡 | 4 177 | 1 719(59.21) | 2 463(61.12) | 0.109 |
| 注 ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterone receptor);HER2:人表皮生长因子受体2(human epidermal growth factor receptor-2);HR:激素受体(hormone receptor);* Fisher精确检验 | ||||
采用Kaplan-Meier法绘制的放疗组与未放疗组乳腺癌特异生存(breast cancer specific survival, BCSS)曲线交叉,采用Renyi检验示组间差异具有统计学意义(P < 0.01,图 2)。单因素Cox分析,放疗组较未放疗组提高BCSS(HR=0.87,95%CI:0.82~0.92,P < 0.01),患者年龄、种族、婚姻状态、肿瘤大小、组织学分级、ER、PR、HER2及是否化疗与BCSS有相关性(均P < 0.05,表 3)。将上述BCSS相关变量纳入多因素Cox比例风险模型进行分析,因分子分型与ER、PR和HER2变量效应重叠未纳入模型。Cox分析显示,与未放疗组比较,放疗组能进一步改善BCSS(HR=0.91,95%CI:0.85~0.97,P=0.002;表 3)。多因素Cox回归模型行预后因素分析显示,患者的年龄、种族、婚姻状态、肿瘤大小、组织学分级、是否化疗及ER、PR、HER2的状态与患者的BCSS相关(均P < 0.05,表 3)。
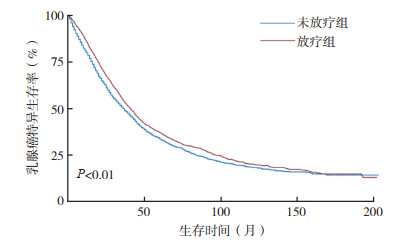
|
| 图 2 放疗和未放疗乳腺癌患者特异生存曲线 Fig.2 Breast cancer-specific survival curves of breast cancer patients with and without radiation therapy |
| 临床病理参数 | 单因素分析 | 多因素分析 | |||
| HR(95%CI) | P值 | HR(95%CI) | P值 | ||
| 年龄 | |||||
| ≤55岁 | 1 | 1 | |||
| > 55岁 | 1.29(1.21~1.37) | < 0.01 | 1.23(1.15~1.31) | < 0.01 | |
| 种族 | |||||
| 白种人 | 1 | 1 | |||
| 黑种人 | 1.42(1.31~1.54) | < 0.01 | 1.29(1.18~1.40) | < 0.01 | |
| 亚裔 | 0.94(0.87~1) | 0.044 | 0.96(0.90~1.02) | 0.153 | |
| 婚姻状态 | |||||
| 已婚 | 1 | 1 | |||
| 未婚 | 1.40(1.31~1.49) | < 0.01 | 1.23(1.17~1.30) | < 0.01 | |
| 病理类型 | |||||
| 非特殊类型 | 1 | ||||
| 特殊类型 | 1.13(0.99~1.29) | 0.063 | |||
| 肿瘤大小 | |||||
| ≤5 cm | 1 | 1 | |||
| > 5 cm | 1.51(1.39~1.64) | < 0.01 | 1.46(1.34~1.58) | < 0.01 | |
| 组织学分级 | |||||
| 1级 | 1 | 1 | |||
| 2级 | 1.27(1.07~1.52) | 0.007 | 1.26(1.05~1.51) | 0.011 | |
| 3或4级 | 1.42(1.30~1.55) | < 0.01 | 1.40(1.28~1.52) | < 0.01 | |
| 化疗 | |||||
| 否/未知 | 1 | 1 | |||
| 是 | 0.80(0.75~0.86) | < 0.01 | 0.73(0.68~0.79) | < 0.01 | |
| 放疗 | |||||
| 否 | 1 | 1 | |||
| 是 | 0.87(0.82~0.92) | < 0.01 | 0.91(0.85~0.97) | 0.002 | |
| ER | |||||
| 阴性 | 1 | 1 | |||
| 阳性 | 0.52(0.49~0.56) | < 0.01 | 0.61(0.56~0.67) | < 0.01 | |
| PR | |||||
| 阳性 | 1 | 1 | |||
| 阴性 | 0.57(0.54~0.61) | < 0.01 | 0.74(0.68~0.80) | < 0.01 | |
| HER2 | |||||
| 阴性 | 1 | 1 | |||
| 阳性 | 0.63(0.52~0.75) | < 0.01 | 0.45(0.37~0.54) | < 0.01 | |
| 转移类型 | |||||
| 非脏器转移 | 1 | ||||
| 脏器转移 | 1.08(0.99~1.17) | 0.069 | |||
| 注 ER:雌激素受体(estrogen receptor);PR:孕激素受体(progesterone receptor);HER2:人表皮生长因子受体2(human epidermal growth factor receptor-2);HR:激素受体(hormone receptor) | |||||
采用多因素Cox风险模型根据年龄、肿瘤大小、分子分型、是否化疗及转移部位进行亚组分析。结果显示,与未放疗组比较,放疗能改善年龄 > 55岁、HER2-/HR+、肿瘤 > 5 cm、非内脏转移及接受化疗患者的BCSS,在年龄≤55岁、肿瘤≤5 cm、HER2+/HR-、HER2+/HR+、TNBC、内脏转移和未接受化疗患者中放疗未带来进一步获益(图 3,表 4)。
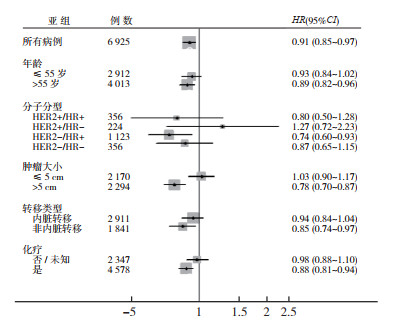
|
| 注 HER2:人表皮生长因子受体2(human epidermal growth factor receptor-2);HR:激素受体(hormone receptor) 图 3 放疗对不同亚组乳腺癌患者预后的影响 Fig.3 Effect of radiation therapy on prognosis of breast cancer patients in different subgroups |
| 亚组 | 例数 | HR(95%CI) | P值 |
| 年龄 | |||
| ≤55岁 | 2 912 | 0.93(0.84~1.02) | 0.139 |
| > 55岁 | 4 013 | 0.89(0.82~0.96) | 0.005 |
| 分子分型 | |||
| HER2+/HR+ | 356 | 0.80(0.50~1.28) | 0.355 |
| HER2+/HR- | 224 | 1.27(0.72-2.23) | 0.412 |
| HER2-/HR+ | 1 123 | 0.74(0.60~0.93) | 0.008 |
| TNBC | 356 | 0.87(0.65~1.15) | 0.320 |
| 肿瘤大小 | |||
| ≤5 cm | 2 170 | 1.03(0.90~1.17) | 0.688 |
| > 5 cm | 2 294 | 0.78(0.70~0.87) | < 0.01 |
| 化疗 | |||
| 否/未知 | 2 347 | 0.98(0.88~1.10) | 0.787 |
| 是 | 4 578 | 0.88(0.81~0.94) | 0.001 |
| 转移部位 | |||
| 内脏转移 | 2 911 | 0.94(0.84~1.04) | 0.203 |
| 非内脏转移 | 1 841 | 0.85(0.74~0.97) | 0.021 |
| 注 HER2:人表皮生长因子受体2(human epidermal growth factor receptor-2);HR:激素受体(hormone receptor);TNBC:三阴性乳腺癌(triple negative breast cancer) | |||
初诊MBC在乳腺癌中占比较低,由于其预后差,属于不可治愈的全身性疾病[1, 4]。MBC患者的治疗主要以全身性治疗为主,局部处理对生存的价值一直存有争议。既往多数患者接受外科手术用于处理出血和感染等局部问题[5, 12]。随着治疗手段的不断发展,初诊MBC患者的生存时间得到很大程度延长。有研究已证实,部分Ⅳ期乳腺癌患者接受局部手术治疗可进一步提高生存率[7-10, 13]。在局部外科手术基础上,放疗能否对患者的预后带来价值尚不明确。
在局部晚期乳腺癌患者中,全乳切除术后放疗能降低局部复发率及改善无瘤生存和总生存[12, 14-16]。放疗在局部晚期乳腺癌患者中可带来生存获益,但目前缺乏其在初诊Ⅳ期乳腺癌中带来生存获益的相关证据[8]。一项纳入308例晚期乳腺癌的回顾性研究分析局部单独放疗与局部外科手术联合或不联合放疗的生存差异,结果显示,在部分患者中放疗较手术能获得更好的局部长期控制,且生存率与手术联合放疗组相似[17]。另一项纳入581例患者研究也获得相似结果,提示在晚期乳腺癌中放疗可能在局部控制和生存方面带来获益[18]。然而,在全乳切除基础上能否进一步带来获益尚不清楚。一项回顾性分析245例初诊Ⅳ期乳腺癌患者原发灶局部治疗价值的研究发现,原发灶进行外科手术及放疗能进一步降低局部复发率和改善总生存[19]。有研究回顾性分析227例MBC患者,其中132例接受全乳切除及放疗的患者的5年总生存率及无进展生存率均高于未接受放疗者[20]。以上研究纳入病例少,其中仅少数患者接受手术联合放疗,并未进行直接对比全乳切除术后放疗与未放疗的生存差异,尚不足以证明全乳切除术后联合放疗能带来额外生存获益。本研究通过SEER数据大样本病例分析发现,在全乳切除基础上联合放疗能进一步改善初诊MBC患者的乳腺癌特异生存。有研究认为,放疗是通过电离辐射诱导并增强免疫系统的抗肿瘤能力,达到对远处转移肿瘤的抑制作用[21-23]。由于本研究纳入的病例可能存在一定的选择性偏倚,不同特征的初诊晚期患者全乳切除联合放疗是否带来获益以及获益的程度有待研究。
乳腺癌的治疗已进入基于分子分型的分类治疗时代,Ⅳ期乳腺癌亦属一类高度异质性的患者,在年龄、病理类型、分子分型和治疗敏感性方面存在差异,需根据患者的不同特征采用不同的治疗策略[8, 24-25]。现有研究提示,肿瘤负荷小、ER和PR表达及仅有骨转移的患者,可能是局部治疗的获益人群[18, 20, 26]。本研究根据年龄、肿瘤特征、治疗情况及分子分型进行亚组分析显示,在年龄 > 55岁、分子分型为HR阳性、肿瘤 > 5 cm、接受化疗及非内脏转移的患者中放疗能提高乳腺癌特殊生存,而在年龄≤55岁、肿瘤≤5 cm、HER2阳性、TNBC、内脏转移和未接受化疗患者中放疗未带来进一步获益。由此可见,并非所有接受手术的初诊MBC患者均能从放疗中获益,部分生物学行为较好及预计生存时间较长的患者可能是放疗的主要获益人群,而放疗可否改善患者生活质量有待研究。
本研究为数据库病例的回顾性分析,存在以下局限性:(1)受数据库提供的数据受限,如放疗范围、转移情况和全身治疗方案等具体信息无法获取;(2)数据更新存在一定滞后性,随访时间不够充分。尽管存在一定的局限性,基于SEER数据库的真实世界数据分析发现,放疗在部分全乳切除的初诊MBC患者中能带来乳腺癌特异生存的获益。
| [1] |
Andre F, Slimane K, Bachelot T, et al. Breast cancer with synchronous metastases: trends in survival during a 14-year period[J]. J Clin Oncol, 2004, 22(16): 3302-3308. DOI:10.1200/JCO.2004.08.095 |
| [2] |
Truong PT. Local treatment of the primary tumor in patients presenting with stage Ⅳ breast cancer: a first, and what's up ahead[J]. Int J Radiat Oncol Biol Phys, 2017, 97(3): 443-446. DOI:10.1016/j.ijrobp.2016.08.017 |
| [3] |
胡跃. 2018 SABCS乳腺癌化疗进展[J]. 实用肿瘤杂志, 2019, 34(5): 461-465. |
| [4] |
Cardoso F, Senkus E, Costa A, et al. 4th ESO-ESMO international consensus guidelines for advanced breast cancer (ABC 4) dagger[J]. Ann Oncol, 2018, 29(8): 1634-1657. DOI:10.1093/annonc/mdy192 |
| [5] |
Shien T, Iwata H. Significance of primary lesion resection in stage Ⅳ breast cancer[J]. Jpn J Clin Oncol, 2017, 47(5): 381-384. DOI:10.1093/jjco/hyx027 |
| [6] |
Lane WO, Thomas SM, Blitzblau RC, et al. Surgical resection of the primary tumor in women with de novo stage Ⅳ breast cancer: contemporary practice patterns and survival analysis[J]. Ann Surg, 2019, 269(3): 537-544. DOI:10.1097/SLA.0000000000002621 |
| [7] |
Soran A, Ozmen V, Ozbas S, et al. Randomized trial comparing resection of primary tumor with no surgery in stage Ⅳ breast cancer at presentation: protocol MF07-01[J]. Ann Surg Oncol, 2018, 25(11): 3141-3149. DOI:10.1245/s10434-018-6494-6 |
| [8] |
Mayadev J, Daly M, Chen A, et al. The potential role of radiation therapy to the primary site of disease in stage Ⅳ breast cancer presenting with synchronous metastasis[J]. Clin Breast Cancer, 2014, 14(1): 10-12. DOI:10.1016/j.clbc.2013.08.010 |
| [9] |
Nguyen DH, Truong PT. A debate on locoregional treatment of the primary tumor in patients presenting with stage Ⅳ breast cancer[J]. Expert Rev Anticancer Ther, 2011, 11(12): 1913-1922. DOI:10.1586/era.11.168 |
| [10] |
Greene FL, Page DL, Fleming ID, et al. AJCC Cancer Staging Manual[M]. 6th ed. New York: SpringerVerlag, 2002.
|
| [11] |
Yang YS, Chen YL, Di GH, et al. Prognostic value of primary tumor surgery in de novo stage Ⅳ breast cancer patients with different metastatic burdens: a propensity score-matched and population-based study[J]. Transl Cancer Res, 2019, 8(2): 614-625. DOI:10.21037/tcr.2019.03.21 |
| [12] |
Thomas A, Khan SA, Chrischilles EA, et al. Initial surgery and survival in stage Ⅳ breast cancer in the United States, 1988-2011[J]. JAMA Surg, 2016, 151(5): 424-431. DOI:10.1001/jamasurg.2015.4539 |
| [13] |
陈琳, 乐一帆, 齐晓伟. 新发Ⅳ期乳腺癌患者接受手术治疗可提高总生存率[J]. 中华乳腺病杂志: 电子版, 2018, 12(2): 119. |
| [14] |
Nielsen HM, Overgaard M, Grau C, et al. Study of failure pattern among high-risk breast cancer patients with or without postmastectomy radiotherapy in addition to adjuvant systemic therapy: long-term results from the Danish Breast Cancer Cooperative Group DBCG 82 b and c randomized studies[J]. J Clin Oncol, 2006, 24(15): 2268-2275. DOI:10.1200/JCO.2005.02.8738 |
| [15] |
Clarke M, Collins R, Darby S, et al. Effects of radiotherapy and of differences in the extent of surgery for early breast cancer on local recurrence and 15-year survival: an overview of the randomised trials[J]. Lancet, 2005, 366(9503): 2087-2106. DOI:10.1016/S0140-6736(05)67887-7 |
| [16] |
Ragaz J, Olivotto IA, Spinelli JJ, et al. Locoregional radiation therapy in patients with high-risk breast cancer receiving adjuvant chemotherapy: 20-year results of the British Columbia randomized trial[J]. J Natl Cancer Inst, 2005, 97(2): 116-126. DOI:10.1093/jnci/djh297 |
| [17] |
Bourgier C, Khodari W, Vataire AL, et al. Breast radiotherapy as part of loco-regional treatments in stage Ⅳ breast cancer patients with oligometastatic disease[J]. Radiother Oncol, 2010, 96(2): 199-203. DOI:10.1016/j.radonc.2010.02.028 |
| [18] |
Le Scodan R, Stevens D, Brain E, et al. Breast cancer with synchronous metastases: survival impact of exclusive locoregional radiotherapy[J]. J Clin Oncol, 2009, 27(9): 1375-1381. DOI:10.1200/JCO.2008.19.5396 |
| [19] |
Choi SH, Kim JW, Choi J, et al. Locoregional treatment of the primary tumor in patients with de novo stage Ⅳ breast cancer: a radiation oncologist's perspective[J]. Clin Breast Cancer, 2018, 18(2): e167-178. DOI:10.1016/j.clbc.2017.06.002 |
| [20] |
Gultekin M, Yazici O, Eren G, et al. Impact of locoregional treatment on survival in patients presented with metastatic breast carcinoma[J]. Breast, 2014, 23(6): 775-783. DOI:10.1016/j.breast.2014.08.008 |
| [21] |
Ohba K, Omagari K, Nakamura T, et al. Abscopal regression of hepatocellular carcinoma after radiotherapy for bone metastasis[J]. Gut, 1998, 43(4): 575-577. DOI:10.1136/gut.43.4.575 |
| [22] |
Formenti SC, Demaria S. Combining radiotherapy and cancer immunotherapy: a paradigm shift[J]. J Natl Cancer Inst, 2013, 105(4): 256-265. DOI:10.1093/jnci/djs629 |
| [23] |
Touquet R, Paton A. Tackling alcohol misuse at the front line[J]. BMJ, 2006, 333(7567): 510-511. DOI:10.1136/bmj.38961.556470.BE |
| [24] |
Curigliano G, Burstein HJ, Winer EP, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017[J]. Ann Oncol, 2017, 28(8): 1700-1712. DOI:10.1093/annonc/mdx308 |
| [25] |
周美琪, 邱吉利, 陈嘉妮, 等. 乳腺癌外科治疗的个体化精准之路[J]. 实用肿瘤杂志, 2018, 33(4): 377-382. |
| [26] |
Babiera GV, Rao R, Feng L, et al. Effect of primary tumor extirpation in breast cancer patients who present with stage Ⅳ disease and an intact primary tumor[J]. Ann Surg Oncol, 2006, 13(6): 776-782. DOI:10.1245/ASO.2006.03.033 |
 2020, Vol. 35
2020, Vol. 35


