文章信息
- 游星兰, 任建敏, 毛卫波, 黄建胜
- You Xinglan, Ren Jianmin, Mao Weibo, Huang Jiansheng
- 非小细胞肺癌中PD-L1的表达及其与临床病理特征的关系
- Expression of PD-L1 in non-small-cell lung cancer and its correlation with clinicopathological characteristics
- 实用肿瘤杂志, 2021, 36(6): 520-524
- Journal of Practical Oncology, 2021, 36(6): 520-524
基金项目
- 浙江省自然科学基金(LY18H160059);浙江省自然科学青年基金(LQ17H080001)
-
通信作者
- 黄建胜, E-mail: Huangxvy@163.com
-
文章历史
- 收稿日期:2020-06-16
2. 丽水市中心医院病理科, 浙江 丽水 323000
2. Department of Pathology, Lishui Central Hospital, Lishui 323000, China
肺癌是世界范围内最常见的恶性肿瘤之一,其中非小细胞肺癌(non-small-cell lung cancer,NSCLC)所占比例约为80%~85%[1],其中肺鳞癌和肺腺癌是NSCLC中的2个主要的亚型[2]。在中国,肺癌的发生率和死亡率一直居高不下[3],而肿瘤自身的免疫逃逸机制是造成该现象的重要因素之一。该机制能够使肿瘤细胞对机体自身免疫系统的识别与攻击产生耐受,从而逃避T细胞等免疫细胞的杀伤作用。其中程序性死亡配体1(programmed death-ligand 1,PD-L1;又称为CD274和B7-H1)是介导免疫逃逸的关键分子之一,肿瘤细胞高表达的PD-L1分子能够与其微环境中的免疫细胞如T细胞上的程序性死亡受体1(programmed death 1,PD-1)特异性结合,从而激活免疫细胞内相关通路,抑制细胞的活化与增殖[4]。近年来,针对肿瘤的靶向治疗取得重大进展,以PD-L1/PD-1为靶点的抑制剂,如durvalumab和atezolizumab等在黑色素瘤、乳腺癌和肺癌等恶性肿瘤的治疗中取得一定成果[5-6]。但同时也存在个体差异较大和药物响应率较低等问题[7]。目前应用最广泛的预判抗PD-1/PD-L1药物疗效的检测方法是通过免疫组织化学检测肿瘤组织PD-L1的表达,并认为PD-L1高表达患者对免疫治疗的响应性更好[8]。然而在免疫治疗方案制定的过程中并不仅仅考虑特定基因的表达这一单一因素,需要综合考虑患者自身特性如过敏反应和肿瘤分期等,根据不同的情况制定相应的方案[9-10]。目前NSCLC患者肿瘤PD-L1的表达与其病理特征间的相关性鲜有研究。因此,本研究旨在检测NSCLC组织中PD-L1的表达情况,同时结合患者的临床病理特征分析两者之间的相关性,为NSCLC的免疫治疗提供指导建议及理论依据。
1 资料与方法 1.1 一般资料选择2015年2月至2018年12月在丽水市中心医院就诊的NSCLC患者107例。纳入标准:(1)经手术病理确诊;(2)为首发病例;(3)术前未进行放化疗。107例患者中男性65例,女性42例;年龄28~83岁,平均61.9岁;肺腺癌74例,肺鳞癌33例。肿瘤分期以美国癌症联合会(American Joint Committee on Cancer,AJCC)肿瘤分期手册(第8版)为标准[11]。本研究患者知情同意并经本院伦理委员会审核通过。
1.2 标本处理与免疫组织化学染色手术标本离体后即送病理科,由专科病理医师进行检查,测量肿瘤体积后用4%甲醛固定组织标本,固定时间为6~48 h,固定后进行石蜡包埋。通过切片、脱蜡、水化和抗原修复等步骤后,将玻片与靶向PD-L1的单克隆抗体(ab205921,1∶200,英国Abcam公司)在4℃孵育过夜。复温后滴加与辣根过氧化物酶(horseradish peroxidase,HRP)耦联的二抗室温孵育15 min,对二氨基联苯胺显色1 min,苏木精对比染色,中性树胶封固。
1.3 免疫组织化学染色结果判定根据所使用单抗的性质,本研究中PD-L1以肿瘤细胞膜染成黄棕色或黄褐色均匀颗粒状为阳性,并将免疫细胞染色排除在打分之外[12]。蛋白表达情况定义为肿瘤细胞所呈现的任何强度的细胞膜阳性的百分率。400倍显微镜下随机观察5个视野,每个视野计数100个细胞计算百分比,阳性细胞比例 > 10%为强阳性,1%~10%为弱阳性,< 1%为阴性。
1.4 生物信息学分析从癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库(https://tcga-data.nci.nih.gov/tcga/)获得肺腺癌与肺鳞癌的RNA测序(RNA-Seq)数据。通过R语言对PD-L1的表达进行分析。同时使用生物信息分析工具网站GEPIA(http://gepia.cancer-pku.cn/index.html)对PD-L1在肺腺癌和肺鳞癌中的表达进行分析验证。
1.5 统计学分析采用SPSS 22.0统计学软件分析数据。组间比较采用χ2检验。以P < 0.05为差异具有统计学意义。
2 结果 2.1 NSCLC组织形态及PD-L1免疫组织化学染色结果分析107例NSCLC患者中包括74例肺腺癌和33例肺鳞癌。免疫组织化学染色结果表明,在肺腺癌中有60例(81.1%)PD-L1表达为阴性,4例(5.4%)为弱阳性,10例(13.5%)为强阳性,总阳性率为18.9%。在肺鳞癌中有14例(42.4%)PD-L1表达为阴性,6例(18.2%)为弱阳性,13例(39.4%)为强阳性,总阳性率为57.6%(图 1)。PD-L1蛋白在肺鳞癌中的阳性率高于肺腺癌(χ2=10.905,P=0.001)。
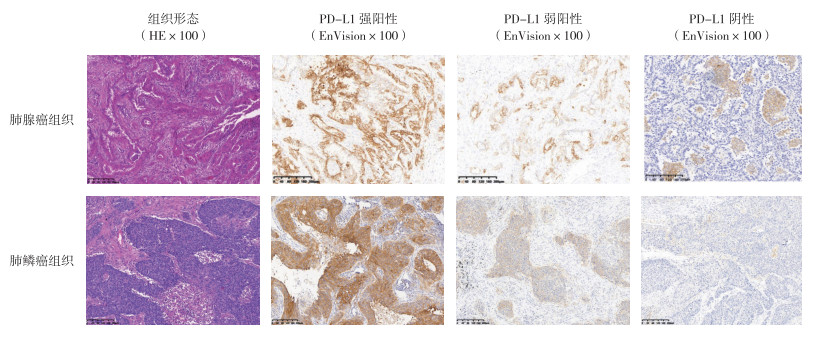
|
| 图 1 肺腺癌和肺鳞癌组织形态和PD-L1蛋白表达 Fig.1 Histological morphology and PD-L1 expression in lung adenocarcinoma and lung squamous cell carcinoma |
对TCGA数据库中的NSCLC数据分析显示,与癌旁组织比较,肺腺癌组织中的PD-L1表达下调(logFC=-0.703),且差异具有统计学意义(P < 0.01);肺鳞癌组织中PD-L1表达同样呈下调趋势(logFC=-0.373),但差异无统计学意义(P=0.078)。这一结果与从生物信息分析网站GEPIA所得到的结果一致(图 2)。
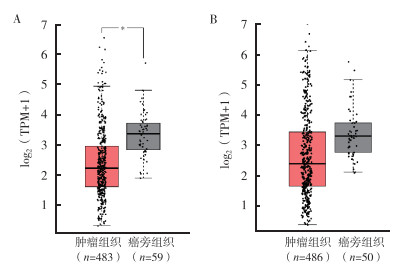
|
| 注 A:PD-L1在肺腺癌中的表达;B:PD-L1在肺鳞癌中的表达;TPM:每千个碱基的转录每百万映射读取的转录本数(transcripts per kilobase of exon model per million mapped reads);*P < 0.05 图 2 在GEPIA上验证肺腺癌和肺鳞癌中PD-L1的表达 Fig.2 Validation of PD-L1 expression in lung adenocarcinoma and lung squamous cell carcinoma on GEPIA |
将NSCLC患者按PD-L1表达情况分为阴性组、弱阳性组和强阳性组,并结合临床病理资料进行分析。结果表明,在肺腺癌中PD-L1表达在T分期(χ2=8.955,P=0.011)和TNM分期(χ2=6.166,P=0.046)方面比较,差异均具有统计学意义,而与性别、年龄、淋巴结转移和远端转移方面比较,差异均无统计学意义(均P > 0.05,表 1)。在肺鳞癌中PD-L1的表达在N分期(χ2=3.860,P=0.049)和TNM分期(χ2=7.649,P=0.022)方面比较,差异均具有统计学意义(表 2)。
| 临床病理特征 | 总例数 | PD-L1阴性(n=60) | PD-L1弱阳性(n=4) | PD-L1阳性(n=10) | χ2值 | P值 |
| 性别 | 2.710 | 0.100 | ||||
| 男性 | 33 | 24(72.7) | 4(12.1) | 5(15.2) | ||
| 女性 | 41 | 36(87.8) | 0(0.0) | 5(12.2) | ||
| 年龄 | 0.066 | 0.797 | ||||
| <62岁 | 34 | 28(82.4) | 2(5.9) | 4(11.7) | ||
| ≥62岁 | 40 | 32(80.0) | 2(5.0) | 6(15.0) | ||
| T分期 | 8.955 | 0.011 | ||||
| T1 | 61 | 52(85.2) | 2(3.3) | 7(11.5) | ||
| T2 | 9 | 7(77.8) | 1(11.1) | 1(11.1) | ||
| T3~T4 | 4 | 1(25.0) | 1(25.0) | 2(50.0) | ||
| N分期 | 2.563 | 0.109 | ||||
| N0 | 63 | 53(84.1) | 3(4.8) | 7(11.1) | ||
| N1~N2 | 11 | 7(63.6) | 1(9.1) | 3(27.3) | ||
| M分期 | 0.424 | 0.515 | ||||
| M0 | 71 | 58(81.7) | 4(5.6) | 9(12.7) | ||
| M1 | 3 | 2(66.7) | 0(0.0) | 1(33.3) | ||
| TNM分期 | 6.166 | 0.046 | ||||
| Ⅰ期 | 60 | 51(85.0) | 2(3.3) | 7(11.7) | ||
| Ⅱ期 | 5 | 2(40.0) | 2(40.0) | 1(20.0) | ||
| Ⅲ~Ⅳ期 | 9 | 7(77.8) | 0(0.0) | 2(22.2) |
| 临床病理特征 | 总例数 | PD-L1阴性(n=14) | PD-L1弱阳性(n=6) | PD-L1阳性(n=13) | χ2值 | P值 |
| 性别 | - | - | ||||
| 男性 | 32 | 14(43.8) | 6(18.7) | 12(37.5) | ||
| 女性 | 1 | 0(0.0) | 0(0.0) | 1(100.0) | ||
| 年龄 | 0.181 | 0.913 | ||||
| <62岁 | 16 | 5(31.3) | 2(12.5) | 9(56.2) | ||
| ≥62岁 | 17 | 9(53.0) | 4(23.5) | 4(23.5) | ||
| T分期 | 1.980 | 0.372 | ||||
| T1 | 4 | 3(75.0) | 0(0.0) | 1(25.0) | ||
| T2 | 13 | 5(38.5) | 3(23.0) | 5(38.5) | ||
| T3~T4 | 16 | 6(37.5) | 3(18.8) | 7(43.7) | ||
| N分期 | 3.860 | 0.049 | ||||
| N0 | 17 | 10(58.8) | 3(17.7) | 4(23.5) | ||
| N1~N2 | 16 | 4(25.0) | 3(18.8) | 9(56.2) | ||
| M分期 | - | - | ||||
| M0 | 33 | 14(42.4) | 6(18.2) | 13(39.4) | ||
| M1 | 0 | 0(0.0) | 0(0.0) | 0(0.0) | ||
| TNM分期 | 7.649 | 0.022 | ||||
| Ⅰ期 | 8 | 6(75.0) | 1(12.5) | 1(12.5) | ||
| Ⅱ期 | 12 | 6(50.0) | 3(25.0) | 3(25.0) | ||
| Ⅲ~Ⅳ期 | 13 | 2(15.4) | 2(15.4) | 9(69.2) |
PD-L1属于负性T细胞共刺激分子,基因位于人9号染色体,具有调控机体自身免疫和避免过度免疫引发自身免疫性疾病的功能[13]。但研究表明,在多种恶性肿瘤如乳腺癌和黑色素瘤等的肿瘤细胞中PD-L1处于高表达状态[14-15],并通过与其受体PD-1特异性结合抑制肿瘤微环境中T细胞的活化细胞因子分泌,最终导致肿瘤逃避免疫杀伤[4]。近年来以PD-L1/PD-1抑制剂为代表的肿瘤免疫疗法取得一定成果,为无法进行手术治疗或肿瘤多发性转移的NSCLC患者带来一线希望。但由于个体差异如肿瘤的进展情况和肿瘤细胞PD-L1表达情况等原因,相同的治疗方案往往会得到不同的治疗效果及不良反应[16]。因此深入研究PD-L1在NSCLC中的表达情况及其与患者病理特征间的关系对免疫治疗方案的制订和疗效的判断具有十分重要的意义。
本研究107例NSCLC中,74例肺腺癌,33例肺鳞癌。通过免疫组织化学检测PD-L1表达情况表明,在肺腺癌中PD-L1的表达阳性率较低(18.9%),与相关研究结果(17%)一致[17]。在非鳞状NSCLC中,PD-L1阳性率与PD-1抑制剂治疗的响应有关[18]。PD-L1的表达与PD-1抑制剂治疗效果有关。然而,据报道,在肺癌中PD-1和细胞毒性T淋巴细胞相关蛋白4(cytotoxic T lymphocyte associate protein-4,CTLA-4)途径抑制剂的客观缓解率仅为10%~20%[7]。这表明低PD-L1表达阳性率可能是肺腺癌对抑制剂免疫治疗反应率低的原因之一。结合病理资料发现,PD-L1的表达在肺腺癌患者肿瘤的T分期和TNM分期方面比较,差异均具有统计学意义(均P < 0.05),说明随着肺腺癌病理分期等级的上升,PD-L1表达也随之上升,或将有利于提高PD-1/PD-L1抑制剂治疗的敏感性[16, 19]。CheckMate-063研究中,肺鳞癌PD-L1阳性率为32.9%(25/76)[20],在CheckMate-017研究中为52.9%(119/225)[21]。本研究33例肺鳞癌中,PD-L1阳性表达19例,阳性率为57.6%,与上述2项研究的结果较为一致[20-21]。结合肺鳞癌患者病理资料表明,PD-L1的表达在肺鳞癌患者的TNM分期和淋巴结转移方面比较,差异均具有统计学意义(均P < 0.05)。比较PD-L1在2种NSCLC亚型中的阳性率发现,PD-L1在肺鳞癌中的表达高于肺腺癌,这一结论与李佳等[22]的研究结果一致。另一方面通过生物信息学分析表明,相较于正常癌旁组织,肺腺癌组织中PD-L1表达下调,而肺鳞癌组织中PD-L1表达相近,从侧面提示了肺鳞癌细胞PD-L1的表达高于肺腺癌。
综上所述,本研究结果表明,PD-L1的表达在NSCLC的不同亚型中的阳性率存在差异。这一差异可能是由于肿瘤的异质性及不同的发生和发展机制所导致。在肺腺癌和肺鳞癌中PD-L1表达都随着TNM分期升高而升高。肿瘤分期的升高可能促进PD-L1所介导的免疫逃避机制,高表达PD-L1可能促进肿瘤的发生和发展。这其中的因果关系需要更综合而深入的研究。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2016[J]. CA Cancer J Clin, 2016, 66(1): 7-30. DOI:10.3322/caac.21332 |
| [2] |
赵建国, 徐农. 非小细胞肺癌的分子分型[J]. 实用肿瘤杂志, 2014, 29(5): 399-403. |
| [3] |
Chen W, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2): 115-132. DOI:10.3322/caac.21338 |
| [4] |
He J, Hu Y, Hu M, et al. Development of PD-1/PD-L1 pathway in tumor immune microenvironment and treatment for non-small cell lung cancer[J]. Sci Rep, 2015, 5(1): 13110. DOI:10.1038/srep13110 |
| [5] |
Herbst RS, Soria JC, Kowanetz M, et al. Predictive correlates of response to the anti-PD-L1 antibody MPDL3280A in cancer patients[J]. Nature, 2014, 515(7528): 563-567. DOI:10.1038/nature14011 |
| [6] |
Schmid P, Adams S, Rugo HS, et al. Atezolizumab and nab-paclitaxel in advanced triple-negative breast cancer[J]. N Engl J Med, 2018, 379(22): 2108-2121. DOI:10.1056/NEJMoa1809615 |
| [7] |
Lafuente-Sanchis A, Zúñiga Á, Estors M, et al. Association of PD-1, PD-L1, and CTLA-4 gene expression and clinicopathologic characteristics in patients with nonsmall-cell lung cancer[J]. Clin Lung Cancer, 2017, 18(2): e109-116. DOI:10.1016/j.cllc.2016.09.010 |
| [8] |
Sunshine JC, Nguyen PL, Kaunitz GJ, et al. PD-L1 expression in melanoma: a quantitative immunohistochemical antibody comparison[J]. Clin Cancer Res, 2017, 23(16): 4938-4944. DOI:10.1158/1078-0432.CCR-16-1821 |
| [9] |
中国抗癌协会肺癌专业委员会, 中华医学会肿瘤学分会肺癌学组. Ⅲ期非小细胞肺癌多学科诊疗专家共识(2019版)[J]. 中华肿瘤杂志, 2019, 41(12): 881-890. |
| [10] |
唐浩程, 文占涛, 刘士召. 非小细胞肺癌症状及治疗方案[J]. 全科口腔医学电子杂志, 2019, 6(34): 27-31. |
| [11] |
Goldstraw P, Chansky K, Crowley J, et al. The IASLC lung cancer staging project: proposals for revision of the tnm stage groupings in the forthcoming (eighth) edition of the TNM classification for lung cancer[J]. J Thorac Oncol, 2016, 11(1): 39-51. DOI:10.1016/j.jtho.2015.09.009 |
| [12] |
Phillips T, Simmons P, Inzunza HD, et al. Development of an automated PD-L1 immunohistochemistry (IHC) assay for non-small cell lung cancer[J]. Appl Immunohistochem Mol Morphol, 2015, 23(8): 541-549. DOI:10.1097/PAI.0000000000000256 |
| [13] |
徐一清, 刘勇. PD-1/PD-L1抑制剂免疫相关不良反应的研究进展[J]. 实用肿瘤杂志, 2020, 35(6): 491-494. |
| [14] |
Bae SB, Cho HD, Oh MH, et al. Expression of programmed death receptor ligand 1 with high tumor-infiltrating lymphocytes is associated with better prognosis in breast cancer[J]. J Breast Cancer, 2016, 19(3): 242-251. DOI:10.4048/jbc.2016.19.3.242 |
| [15] |
Koelblinger P, Emberger M, Drach M, et al. Increased tumour cell PD-L1 expression, macrophage and dendritic cell infiltration characterise the tumour microenvironment of ulcerated primary melanomas[J]. J Eur Acad Dermatol Venereol, 2019, 33(4): 667-675. DOI:10.1111/jdv.15302 |
| [16] |
Puri S, Shafique M, Gray JE. Immune checkpoint inhibitors in early stage and locally advanced non-small cell lung cancer[J]. Curr Treat Options Oncol, 2018, 19(8): 39. DOI:10.1007/s11864-018-0556-7 |
| [17] |
Janzic U, Kern I, Janzic A, et al. PD-L1 expression in squamous-cell carcinoma and adenocarcinoma of the lung[J]. Radiol Oncol, 2017, 51(3): 357-362. DOI:10.1515/raon-2017-0037 |
| [18] |
Ancevski Hunter K, Socinski MA, Villaruz LC. PD-L1 testing in guiding patient selection for PD-1/PD-L1 inhibitor therapy in lung cancer[J]. Mol Diagn Ther, 2018, 22(1): 1-10. DOI:10.1007/s40291-017-0308-6 |
| [19] |
Passiglia F, Bronte G, Bazan V, et al. PD-L1 expression as predictive biomarker in patients with NSCLC: a pooled analysis[J]. Oncotarget, 2016, 7(15): 19738-19747. DOI:10.18632/oncotarget.7582 |
| [20] |
Rizvi NA, Mazieres J, Planchard D, et al. Activity and safety of nivolumab, an anti-PD-1 immune checkpoint inhibitor, for patients with advanced, refractory squamous non-small-cell lung cancer (CheckMate 063): a phase 2, single-arm trial[J]. Lancet Oncol, 2015, 16(3): 257-265. DOI:10.1016/S1470-2045(15)70054-9 |
| [21] |
Brahmer J, Reckamp KL, Baas P, et al. Nivolumab versus docetaxel in advanced squamous-cell non-small-cell lung cancer[J]. N Engl J Med, 2015, 373(2): 123-135. DOI:10.1056/NEJMoa1504627 |
| [22] |
李佳, 张菁, 李晓, 等. NSCLC原发部位和转移淋巴结中PD-L1的表达及临床分析[J]. 实用肿瘤杂志, 2017, 32(4): 332-336. |
 2021, Vol. 36
2021, Vol. 36


