文章信息
- 周雪雁, 潘晓芳, 张博, 刘琳
- Zhou Xueyan, Pan Xiaofang, Zhang Bo, Liu Lin
- 三维剪切波弹性成像定量参数与乳腺癌组织学预后因素的关系
- Relationship between quantitative parameters of three-dimensional shear wave elastography and histological prognostic factors of breast cancer
- 实用肿瘤杂志, 2021, 36(6): 566-571
- Journal of Practical Oncology, 2021, 36(6): 566-571
-
通信作者
- 潘晓芳, E-mail: xfpan801@163.com
-
文章历史
- 收稿日期:2021-02-07
三维剪切波弹性成像(three-dimensional shear wave elastography,3D-SWE)是将三维超声与剪切波弹性成像技术融合,不仅提供病变组织生物力学信息,还可提供组织之间的空间位置关系,立体全面地对病灶进行评估,更加客观准确。乳腺癌是一种异质性疾病,其治疗以临床病理特征为指导,如病理类型、肿瘤大小、组织学分级、淋巴结状态及脉管浸润等,不同的病理特征下,其临床进展、治疗反应及预后也存在差异[1]。近年来,对乳腺癌病理特征与超声诊断的相关研究较多,但少有研究将3D-SWE定量参数作为预测预后因素的指标。本研究旨在探讨3D-SWE不同切面定量参数与乳腺癌预后因素的关系。
1 资料与方法 1.1 研究对象选取2019年3月至2020年8月于本院乳腺外科手术或穿刺活检女性乳腺癌患者118例共122个结节。患者年龄30~84岁,(55.9±10.7)岁。所有患者均有病理及免疫组织化学检查结果。排除标准:乳腺隆乳术后;孕期或哺乳期妇女;病灶接受过治疗;未有病理及免疫组织化学检查结果病灶。所有入选患者均签署知情同意书。
1.2 仪器采用法国声科Aixplorer超声诊断仪。常规超声使用高频线阵探头频率4~15 MHz。三维检查使用凸阵容积探头频率5~16 MHz。3D-SWE杨氏模量值使用Q-BOXTM软件分析。
1.3 方法常规二维超声确定病灶位置,观察图像特征。在三维模式基础上启动SWE模式,探头垂直体表放置病灶正上方,不施加任何压力,同时获得三个正交切面(横断面、矢状面和冠状面),每个平面共9幅图像,观察区域硬度分布彩色图(0~180 kPa),利用定量测量工具Q-Box分别选取每个切面的感兴趣区,分别将2 mm取样框置于病灶最硬处,测量病灶最硬处的最大弹性值(maximum elasticity,Emax)、平均弹性值(mean elasticity,Emean)及弹性数据离散度值(elastic standard deviation,Esd)。同一病变重复3次测量计算均值。以上检测由两位经验丰富医师操作完成。
1.4 病理检查病理组织学分级依据2019年世界卫生组织(World Health Organization,WHO)乳腺肿瘤分级标准[2]。
分子亚型标准依据2019版《中国抗癌协会乳腺癌诊治指南与规范》将乳腺癌分为4型[3]:(1)Luminal A型,雌激素受体(estrogen receptor,ER)/孕激素受体(progesterone,PR)阳性且PR高表达,人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)阴性,Ki-67增殖指数低;(2)Luminal B型,包括HER2阴性[ER/PR阳性, HER2阴性,且Ki-67增殖指数高或PR低表达]和HER2阳性[ER/PR阳性,HER2阳性,任何状态的Ki-67];(3)ERBB2+型,HER2阳性,ER和PR阴性;(4)Basal-like型(三阴型),ER阴性,PR阴性,HER2阴性。
组织分级采用改良的Scarff-Bloom-Richardson分级系统[4],根据癌组织中小管或腺体形成、细胞核多形性和核分裂相技术进行分级。每项指标都分别评分1~3分,将这3项指标得分相加:3~5分为Ⅰ级;6~7分为Ⅱ级;8~9分为Ⅲ级。
腋窝淋巴结经石蜡切片组织病理学检查,证实淋巴结转移者为阳性,无淋巴结转移者为阴性。
1.5 统计学分析采用SPSS 22.0软件对数据进行分析。符合正态分布的计量资料采用均数±标准差(x±s)表示,组间比较采用t检验和方差分析,相关性分析采用Kendall相关系数。以P < 0.05为差异具有统计学意义。
2 结果 2.1 病理结果118例患者,122个病灶。肿瘤直径4.0~62.3 mm,(20.07±10.65)mm。病理类型:浸润癌100个,原位癌16个,黏液癌6个。分子分型:Luminal A型21个,Luminal B型84个,ERBB2+型12个,三阴型5个。组织学分级:Ⅰ级44个,Ⅱ级47个,Ⅲ级31个。腋窝淋巴结转移:阴性88个,阳性34个。
2.2 3D-SWE定量参数与乳腺癌病理类型的关系病理类型中浸润癌横断面、矢状面和冠状面的Emax、Esd和Emean均高于原位癌,差异均具有统计学意义(均P < 0.05),浸润癌与黏液癌弹性值比较,差异均无统计学意义(均P > 0.05)。肿瘤直径上浸润癌 > 原位癌 > 黏液癌,差异具有统计学意义(P < 0.05,表 1)。
| 病理类型 | 例数 | 肿瘤直径(mm) | 横断面 | 矢状面 | 冠状面 | ||||||||
| Emax | Emean | Esd | Emax | Emean | Esd | Emax | Emean | Esd | |||||
| 原位癌 | 16 | 14.8±12.8 | 106.0±68.2 | 79.0±53.6 | 15.2±11.9 | 96.6±61.9 | 71.0±49.1 | 15.5±12.2 | 110.7±74.1 | 85.0±60.8 | 13.1±13.4 | ||
| 浸润癌 | 100 | 21.2±10.2* | 170.1±52.1** | 129.8±49.7** | 25.8±15.2* | 167.6±54.1** | 130.5±95.1* | 27.9±13.6** | 170.9±50.8** | 129.5±48.8** | 22.3±12.2** | ||
| 黏液癌 | 6 | 15.0±4.8 | 140.3±43.1 | 109.6±42.1 | 18.4±6.7 | 135.1±61.8 | 111.6±55.4 | 16.5±9.2 | 135.4±54.3 | 106.3±48.3 | 17.8±14.0 | ||
| 注 Emax:最大弹性值(maximum elasticity);Emean:平均弹性值(mean elasticity);Esd:弹性数据离散度值(elastic standard deviation);*与原位癌比较,P < 0.05;**与原位癌比较,P < 0.01 | |||||||||||||
对各分子分型的横断面、矢状面和冠状面的Emax、Emean和Esd值进行两两比较显示,仅Luminal A和Luminal B型的横断面、矢状面和冠状面的Emax和Esd值比较,差异具有统计学意义(均P < 0.05,表 2),其余数值比较,差异均无统计学意义(均P > 0.05)。
| 分子分型 | 例数 | 横断面 | 矢状面 | 冠状面 | ||||||||
| Emax | Emean | Esd | Emax | Emean | Esd | Emax | Emean | Esd | ||||
| Luminal A型 | 21 | 134.7±57.9 | 105.6±49.1 | 17.4±14.1 | 133.3±61.8 | 142.8±87.5 | 19.1±13.3 | 134.8±58.6 | 106.0±48.7 | 17.1±10.9 | ||
| Luminal B型 | 84 | 164.4±55.8* | 123.9±51.4 | 25.3±15.1* | 159.0±56.3* | 114.3±51.9 | 26.8±13.2* | 164.7±54.6* | 124.3±52.0 | 25.3±11.6* | ||
| ERBB2+型 | 12 | 165.7±75.6 | 124.9±69.3 | 28.0±16.0 | 165.7±80.9 | 124.3±65.3 | 26.4±18.7 | 167.1±73.5 | 121.3±59.2 | 24.2±10.1 | ||
| Basal-like型 | 5 | 183.1±12.8 | 154.7±15.8 | 20.6±6.6 | 196.0±40.1 | 153.7±29.6 | 33.4±11.0 | 200.9±41.1 | 165.9±39.5 | 23.3±7.9 | ||
| 注 Emax:最大弹性值(maximum elasticity);Emean:平均弹性值(mean elasticity);Esd:弹性数据离散度值(elastic standard deviation);*与Luminal A型比较,P < 0.05 | ||||||||||||
组织学分级中Ⅰ级、Ⅱ级和Ⅲ级的横断面、矢状面和冠状面的Emax和Esd值比较,差异均具有统计学意义(均P < 0.05,表 3),随组织分级升高弹性值增大。
| 组织学分级 | 例数 | 横断面 | 矢状面 | 冠状面 | ||||||||
| Emax | Emean | Esd | Emax | Emean | Esd | Emax | Emean | Esd | ||||
| Ⅰ级 | 44 | 128.6±54.1 | 99.8±46.4 | 17.0±9.0 | 127.3±61.8 | 94.5±52.1 | 20.5±12.7 | 126.9±56.7 | 95.6±48.1 | 18.6±11.9 | ||
| Ⅱ级 | 47 | 163.3±55.5 | 119.8±50.2 | 27.0±15.6 | 156.2±49.1 | 126.6±27.9 | 25.3±14.0 | 162.3±51.5 | 120.6±46.6 | 26.0±11.6 | ||
| Ⅲ级 | 31 | 166.9±56.3 | 123.2±50.3 | 28.5±17.2 | 163.9±64.1 | 122.6±52.9 | 28.9±14.1 | 170.7±55.6 | 128.0±51.4 | 25.2±10.5 | ||
| F值 | 4.56 | 2.04 | 5.62 | 3.45 | 1.14 | 3.72 | 5.62 | 2.88 | 4.12 | |||
| P值 | 0.013 | 0.135 | 0.005 | 0.035 | 0.323 | 0.027 | 0.005 | 0.060 | 0.019 | |||
| 注 Emax:最大弹性值(maximum elasticity);Emean:平均弹性值(mean elasticity);Esd:弹性数据离散度值(elastic standard deviation) | ||||||||||||
腋窝淋巴结状态中阳性组横断面、矢状面和冠状面的Emax和Esd值均大于阴性组,差异均具有统计学意义(均P < 0.05)。阳性组和阴性组的横断面、矢状面和冠状面的Emean值比较,差异均无统计学意义(均P > 0.05,表 4,图 1~2)。
| 腋窝淋巴结转移 | 例数 | 横断面 | 矢状面 | 冠状面 | ||||||||
| Emax | Emean | Esd | Emax | Emean | Esd | Emax | Emean | Esd | ||||
| 阴性 | 88 | 152.1±61.2 | 117.6±54.0 | 22.0±14.1 | 147.1±61.5 | 118.6±102.6 | 24.1±13.6 | 151.9±59.2 | 117.6±52.3 | 21.9±10.6 | ||
| 阳性 | 34 | 181.2±42.8 | 133.7±47.0 | 29, 2±16.1 | 181.7±49.4 | 130.0±48.5 | 29.7±14.3 | 185.4±47.3 | 135.3±51.3 | 28.4±12.7 | ||
| t值 | -2.54 | -1.53 | -2.42 | -2.93 | -0.62 | -2.01 | -2.94 | -1.68 | -2.88 | |||
| P值 | 0.012 | 0.129 | 0.017 | 0.004 | 0.536 | 0.047 | 0.004 | 0.094 | 0.005 | |||
| 注 Emax:最大弹性值(maximum elasticity);Emean:平均弹性值(mean elasticity);Esd:弹性数据离散度值(elastic standard deviation) | ||||||||||||
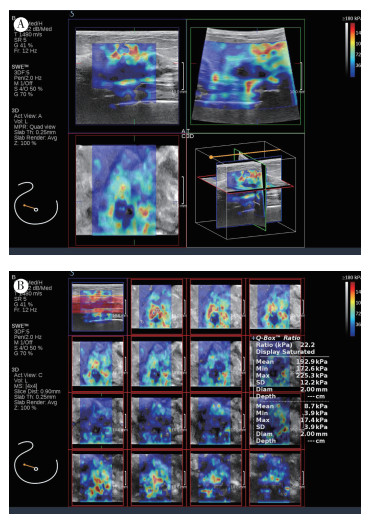
|
| 注 A:3D-SWE横切面、矢状面和冠状面弹性图;B:冠状面4×4显示模式,病灶Emax为225.3 kPa,Emean为192.9 kPa;患者女性,62岁,右乳结节,病灶大小26 mm×13 mm,BI-RADS 4C类,病理证实为浸润性导管癌,腋窝淋巴结转移阳性 图 1 腋窝淋巴结转移阳性的乳腺癌3D-SWE弹性图 Fig.1 3D-SWE elastic map of breast cancer with positive axillary lymph node metastasis |
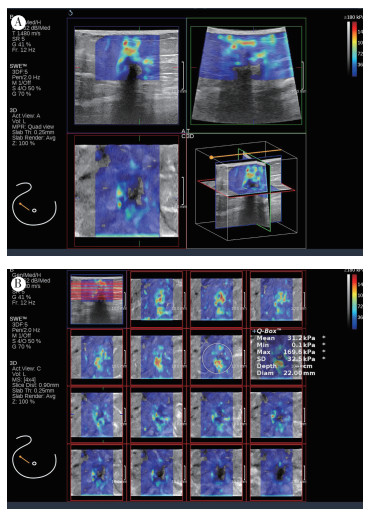
|
| 注 A:3D-SWE横切面、矢状面和冠状面弹性图;B:冠状面4×4显示模式,病灶Emax为169.6 kPa,Emean为31.2 kPa;患者女性,66岁,右乳结节,病灶大小10 mm×12 mm,BI-RADS 4C类,病理证实为浸润性导管癌,腋窝淋巴结转移阴性 图 2 腋窝淋巴结转移阴性的乳腺癌3D-SWE弹性图 Fig.2 3D-SWE elastic map of breast cancer with negative axillary lymph node metastasis |
近年来,随着弹性成像技术的不断发展,实时剪切波弹性成像技术(shear wave elastography,SWE)以其准确、实时及可重复的优点越来越受到临床医师的青睐。3D-SWE建立在二维剪切波弹性成像基础之上,利用计算机重建技术对目标组织彩色编码图进行立体重现[5],克服了二维平面的局限性,实时的获取局部组织的定性及定量参数,从而整体评估乳腺病变的软硬度。对于二维超声与乳腺癌组织预后相关研究较多,但将3D-SWE定量参数作为预测预后因素的指标鲜有报道。本研究旨在探讨3D-SWE定量参数与乳腺癌预后因素的关系。
研究发现,3D-SWE各切面定量参数Emax和Esd值在各组织学预后因素中比较,差异均具有统计学意义(均P < 0.05),在预测组织学预后方面有明显优势,优于Emean,与以往研究略有差异[6]。分析Emax是最具辨别力的参数的原因是:无论感兴趣区(regions of interest,ROI)的大小如何,肿物最高硬度通常都在ROI内,弹性值比较恒定,而Emean代表硬度的平均值,受ROI大小影响。研究表明,恶性肿瘤存在异质性,其内部质地多呈不均质,这种异质性的量化指标可以由弹性数据Esd表示,Esd可以更全面反映整个病灶内部弹性模量值和分布特征, 具有更高的诊断特异度[4]。
乳腺癌的病理分型具有多样性和复杂性等特征,因病例数有限,本研究主要分析浸润癌、原位癌及黏液癌。结果显示,浸润癌Emax、Emean及Esd值均高于原位癌。分析原因,浸润癌肿瘤细胞数量和微血管密度大于原位癌,细胞结构更致密,因此硬度更大。本研究中浸润癌的肿瘤直径大于原位癌,且已有研究表明,肿瘤大小与Emax相关,肿瘤越大,弹性值越大,随着肿瘤增大,肿瘤细胞不断增殖并浸润,更容易引起肿瘤内部和周边结蹄组织增生反应,肿瘤细胞致密程度和间质水肿也明显增加,均会导致弹性值的增加[7]。黏液癌病理图像上以大量细胞外黏液中漂浮簇状增生的细胞为特征, 黏液由癌细胞产生, 积聚在间质中, 其产生的胶冻样物有一定张力, 压迫肿瘤组织向周围组织膨胀,黏液癌出现钙化的概率较高,因此导致其弹性值较高与浸润癌相当。
Basal-like型乳腺癌具有恶性程度高、预后差和易早期发生远处转移等特点,有效改善预后已经成为临床治疗关注的热点[8]。ERBB2+型的乳腺癌浸润性强,无瘤生存期短,更易复发,且预后差[9]。因为ERBB2+型和Basal-like型乳腺癌属于高度侵袭性乳腺癌,病理表现为细胞排列紧密、微血管密度高、较多的坏死和纤维化及淋巴细胞浸润,导致肿物有更高硬度。这意味着肿块的硬度可能与侵袭性呈正相关关系。因此Basal-like型与ERBB2+型二者弹性值Emax、Emean及Esd比较,差异均无统计学意义(均P > 0.05)。ER及PR阳性时肿块具有较低的弹性值,而ER及PR为阴性时,弹性值增高[10]。Luminal B型乳腺癌Emax值高于Luminal A型,究其原因可能与其肿块内部分HER2阳性有关,而ER表达与肿块硬度呈负相关,ER表达越高,Luminal A型弹性值越低,因此,Luminal A型弹性值最低,预后较好。
随着组织学分级升高,Emax与Esd值升高,与已报道的研究结果相符[11]。乳腺癌组织学分级的评估包括中小管或腺体形成、细胞核多形性和核分裂计数,这表示组织学分级越高的肿块内的细胞数量越多和排列越紧密,而且级别越高,分化较差,侵袭性较高,因此有更高的硬度。
腋窝淋巴结状态是评估乳腺癌最重要的预后因素之一,也是确定正确治疗计划的必要条件[12]。如何能尽早并准确地判断乳腺癌患者有无腋窝淋巴结转移,预防术后癌症复发和使患者腋窝正常淋巴结不被意外清除是临床治疗的重要目的。本研究结果显示,腋窝淋巴结阳性组的横断面、纵切面和冠状面的Emax和Esd值均大于腋窝淋巴结阴性组,即肿瘤硬度越高,淋巴结转移阳性率越高,具有一定的相关性,因此可以通过肿瘤硬度来判断淋巴结转移情况。研究发现,发生淋巴结转移的乳腺癌更具有侵袭性和破坏力,且分级程度高,突破腺泡或导管基底膜的浸入力强,其硬度也大[13]。
综上所述,常规二维超声仍然是基础,3D-SWE弥补了二维超声组织硬度值等信息,尤其是定量参数Emax及Esd值,3D-SWE与常规超声联合应用,在预测乳腺癌预后因素方面提高了诊断效能,为临床确定治疗方案及预后提供了有价值的信息。但对3D-SWE技术应用仍然需要更多的样本量及多中心研究,为临床提供更有效的理论依据。
| [1] |
Youk J, Gweon H, Son E, et al. Shear-wave elastography of invasive breast cancer: correlation between quantitative mean elasticity value and immunohistochemical profile[J]. Breast Cancer Res Treat, 2013, 138(1): 119-126. DOI:10.1007/s10549-013-2407-3 |
| [2] |
Tan P, Ellis L, Allison K, et al. The 2019 World Health Organization classification of tumours of the breast[J]. Histopathology, 2020, 77(2): 181-185. DOI:10.1111/his.14091 |
| [3] |
中国抗癌协会乳腺癌专业委员会. 中国抗癌协会乳腺癌诊治指南与规范(2019年版)[J]. 中国癌症杂志, 2019, 29(8): 609-680. |
| [4] |
Meena K, Anushuya G, Rajalakshm V, et al. A study of Transferrin expression in comparison with modified Scarff-Bloom Richardson's grading system in breast carcinoma[J]. Indian J Pathol Oncol, 2016, 3(1): 38-41. DOI:10.5958/2394-6792.2016.00009.0 |
| [5] |
陈雅玲, 高毅, 王芬, 等. 乳腺病灶三维实时剪切波弹性成像定量特征及其诊断价值[J]. 中华超声影像学杂志, 2017, 26(7): 613-617. DOI:10.3760/cma.j.issn.1004-4477.2017.07.013 |
| [6] |
Evan A, Rauch F, Whelehan P, et al. Does shear wave ultrasound independently predictaxillary lymph node metastasis in women with invasive breast cancer?[J]. Breast Cancer Res Treat, 2014, 143(1): 153-157. DOI:10.1007/s10549-013-2747-z |
| [7] |
Au F, Ghai S, Lu F, et al. Quantitative shear wave elastography: correlation with prognostic histologic features and immunohistochemical biomarkers of breast cancer[J]. Acta Radiol, 2015, 22(3): 269-277. |
| [8] |
陈钦, 张苏展, 胡凯敏, 等. 铂类药物在三阴性乳腺癌新辅助化疗中的应用及前景展望[J]. 实用肿瘤杂志, 2019, 34(1): 86-89. |
| [9] |
Yao M, Fu P. Advances in anti-HER2 therapy in metastatic breast cancer[J]. Chin Clin Oncol, 2018, 7(3): 27. DOI:10.21037/cco.2018.05.04 |
| [10] |
Cho E, Ko E, Han B, et al. Shear-wave elastography of invasive ductal carcinoma: correlation between quantitative maximum elasticity value and detailed pathological findings[J]. Acta Radiol, 2016, 57(5): 521-528. DOI:10.1177/0284185115590287 |
| [11] |
Chang J, Park I, Lee S, et al. Stiffness of tumours measured by shear-wave elastography correlated with subtypes of breast cancer[J]. Eur Radiol, 2013, 23(9): 2450-2458. DOI:10.1007/s00330-013-2866-2 |
| [12] |
Cur G, Bur H, Winer E, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017[J]. Ann Oncol, 2017, 28(8): 1700-1712. DOI:10.1093/annonc/mdx308 |
| [13] |
Wang Z, Li J, Li M, et al. Study of quantitative elastography with supersonic shear imaging in the diagnosis of breast tumours[J]. Radiol Med, 2013, 118(4): 583-590. DOI:10.1007/s11547-012-0903-x |
 2021, Vol. 36
2021, Vol. 36


