文章信息
- 金天, 杨琦, 陈英, 肖乾, 丁克峰
- 结肠癌术后肺转移癌伴同期原发性肺癌再发罕见胰腺转移癌一例
- 实用肿瘤杂志, 2022, 37(2): 182-185
-
通信作者
- 肖乾,E-mail:qxiao3@zju.edu.cn
-
文章历史
- 收稿日期:2021-03-07
2. 浙江大学医学院附属第二医院病理科, 浙江 杭州 310009;
3. 浙江大学医学院附属第二医院放射科, 浙江 杭州 310009
结直肠癌是常见的消化道恶性肿瘤,发病率占全部恶性肿瘤的9.9%[1]。结直肠癌患者术后随访中发现的远隔脏器占位通常需首先考虑肿瘤转移,并与原发性肿瘤进行鉴别诊断,但同时也要警惕二者共存的情况。在结直肠癌的各种转移部位中,胰腺转移的发生率相对较低,且临床表现特异性差,不易与原发性胰腺癌鉴别,相关报道较为罕见。本院曾收治1例结肠癌术后3年出现结肠癌肺转移伴肺原发癌且术后5年再发罕见胰腺转移患者,现报道如下。
1 病例资料患者女性,68岁,因便血3个月于2012年11月26日至本院就诊,肠镜检查提示:距肛25 cm可见一菜花样肿物突向肠腔,中央凹陷,表面充血糜烂,触之易出血。肠镜下取活检,病理诊断:(距肛25 cm)腺癌。患者无家族肿瘤疾病史。入院后完善全腹部增强CT和胸部高分辨CT检查均未见明显转移灶。患者2012年12月5日于本院全麻下行腹腔镜辅助乙状结肠癌根治术。术后病理检查提示:乙状结肠高-中分化腺癌。术后分期:pT3N0M0,ⅡA期。肿瘤组织免疫组织化学检查提示:错配修复蛋白均表达(proficient mismatch repair,pMMR)。患者术后病理分期为ⅡA期,且无复发高危因素,根据美国国家综合癌症网络(National Comprehensive Cancer Network,NCCN)指南建议[2]并征得患者同意后未进行辅助化疗,转入术后定期随访监测。
2015年4月9日,患者胸部高分辨CT检查提示:右肺下叶背段结节,考虑恶性肿瘤,肺腺癌可能(图 1A);右肺上叶前段混合磨玻璃结节,考虑原位腺癌或微浸润腺癌(图 1B)。当时患者稍有咳嗽咳痰,痰中带血1次,无胸闷气急、恶寒发热、午后发热或夜间盗汗等不适。综合影像学检查,初步诊断为肺双原发癌,考虑两处病灶为同侧可切除的Ⅰ期病灶。遂于2015年4月22日于本院行右下肺背段和右上肺叶切除术联合纵隔淋巴结清扫。术中见:右下叶背段周围型肿瘤,最大径约2.5 cm,质硬,边界不清,切面灰白色。右上肺前段周围型肿瘤,最大径约1.2 cm,未侵及胸膜,质硬,界不清,切面灰白色。术后病理检查示:(右上肺)浸润性腺癌,肺原发(图 2A)。(右下肺)腺癌伴大片坏死,免疫组织化学检查示:细胞角蛋白7(cytokeratin 7,CK7)-,CK20+++,尾型同源盒基因2(caudal type homeobox 2,CDX2)+++,甲状腺转录因子-1(thyroid transcription factor-1,TTF-1)-,符合肠癌转移(图 2B)。患者术后出现肺部感染,予对症治疗后好转,于2015年6月8日至2015年10月7日接受术后mFOLFOX6方案化疗(具体方案:奥沙利铂130 mg,d1静脉滴注;亚叶酸钙0.6 g,d1静脉滴注;氟尿嘧啶0.625 g,d1静脉推注;氟尿嘧啶3.5 g,d1静脉滴注;14 d为1个周期)。患者因持续出现Ⅲ~Ⅳ度白细胞及中性粒细胞减低等骨髓抑制毒性,辅助化疗8个周期后停止化疗,转入定期随访监测。
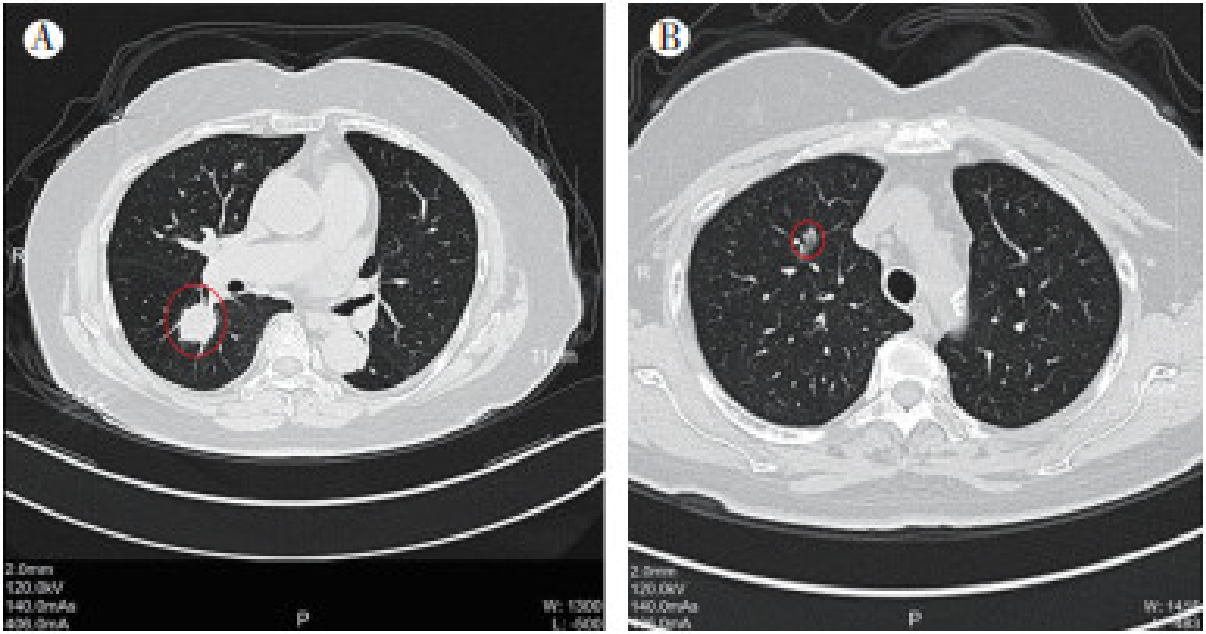
|
| 注 A:右肺下叶背段结节(红圈示),考虑恶性肿瘤,肺腺癌可能;B:右肺上叶前段混合磨玻璃结节(红圈示),考虑原位腺癌或微浸润腺癌 图 1 2015年4月结肠癌肺转移伴原发性肺癌患者胸部高分辨CT检查结果 |
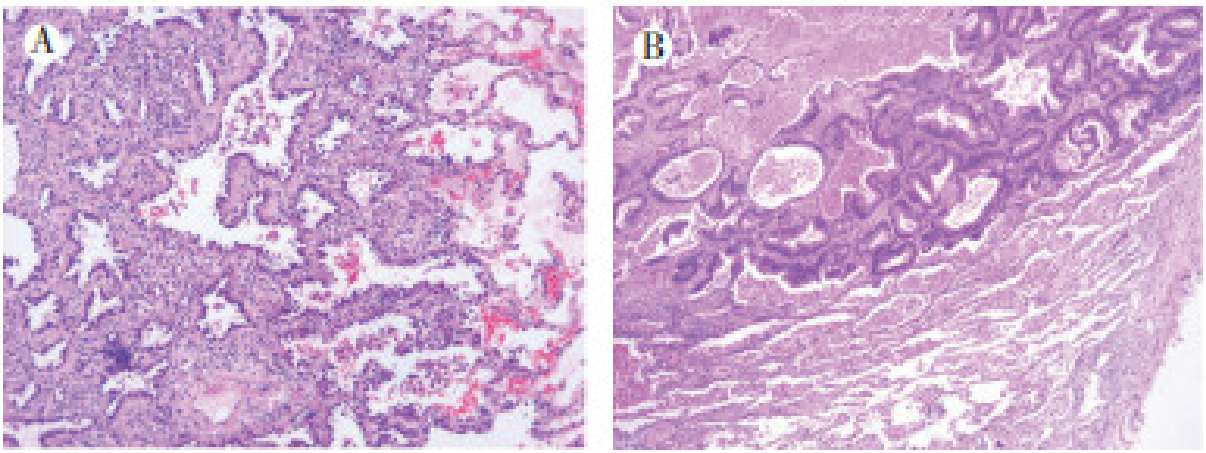
|
| 注 A:右上肺浸润性腺癌,符合肺原发肿瘤表现;B:右下肺腺癌伴大片坏死,可见肠腺管样结构,符合肠癌转移 图 2 结肠癌肺转移伴原发性肺癌患者2015年4月22日手术标本病理检查结果(HE×10) |
2018年5月21日患者出现上腹部持续疼痛,本院胰腺增强MRI检查提示:胰头部占位,提示肿瘤性病变,考虑胰腺癌可能,胰腺导管内乳头状黏液肿瘤(intraductal papillary mucinous neoplasm,IPMN)恶性变可疑(图 3)。肝功能提示:总胆红素116.3 μmol/L,直接胆红素73.7 μmol/L,间接胆红素42.6 μmol/L,谷丙转氨酶273 U/L,碱性磷酸酶441 U/L,谷草转氨酶303 U/L;肿瘤标志物检测提示:癌胚抗原(carcinoembryonic antigen,CEA)18.5 ng/mL,糖类抗原199(carbohydrate antigen 199,CA199)1 091.1 U/mL,CA242 41.5 U/mL。B型超声及超声造影检查均提示:胰腺头部占位,胰腺癌可能性大。考虑患者胰头部占位为孤立性病灶,患者有腹痛等症状且可耐受手术,遂于2018年6月5日于本院行胰十二指肠切除术。术后常规病理检查示:(胰腺)腺癌;免疫组织化学检查提示:CK7-,CK20弥漫+,CDX2弥漫+,pMMR,考虑为肠癌转移(图 4)。术后恢复良好,未进行辅助化疗。
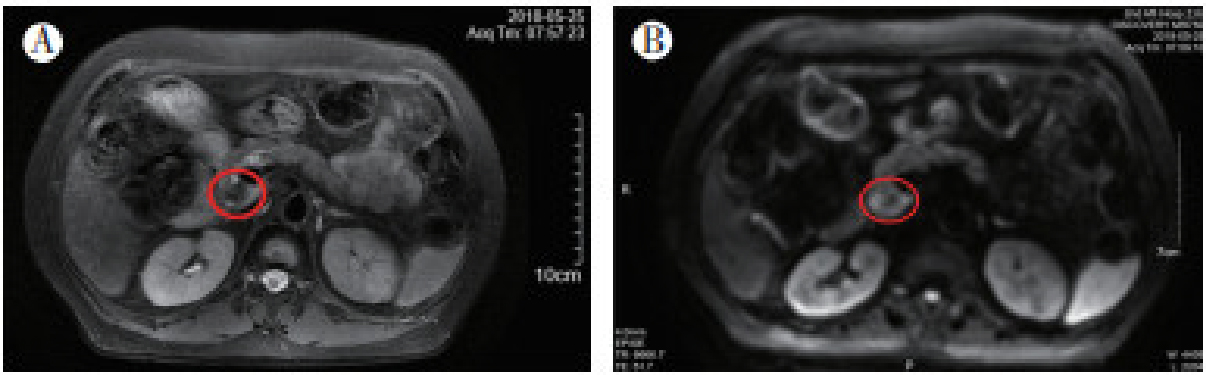
|
| 注 A:胰腺增强MRI检查T2相提示,胰头部占位(红圈示),提示肿瘤性病变,考虑胰腺癌可能,IPMN恶变可疑;B:胰腺增强MRI检查DWI相提示,胰头部占位(红圈示),提示肿瘤性病变,考虑胰腺癌可能,IPMN恶变可疑 图 3 2018年5月结肠癌胰腺转移患者胰腺增强MRI检查结果 |
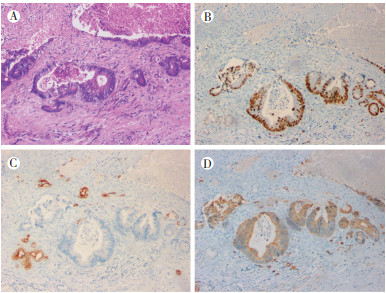
|
| 注 A:病理检查示,胰腺组织内可见腺管样肿瘤灶(HE×100);B:免疫组织化学检查示,CDX2染色可见肿瘤灶呈弥漫阳性(ABC×100);C:免疫组织化学检查示,CK7染色可见肿瘤灶呈阴性(ABC×100);D:免疫组织化学检查示,CK20染色可见肿瘤灶呈弥漫阳性(ABC×100) 图 4 结肠癌胰腺转移患者2018年6月5日手术标本病理检查示胰腺腺癌并结合免疫组织化学检查结果考虑为肠癌转移 |
2019年4月19日患者因胆管感染和败血症去世,患者总生存期为76个月。
2 讨论 2.1 多原发癌多原发癌定义为同一个体中同时或异时存在不同肿瘤。其发生率为2.4%~8%,最高可达17%[3]。目前多原发癌的诊断多采用1932年Warren等[4]制定的标准:(1)每个肿瘤都必须组织病理学证实为恶性肿瘤;(2)每个癌灶都是独立起源的,具有独立的病理类型;(3)每个肿瘤都有特有的转移途径,必须排除转移的可能性。根据不同肿瘤的诊断时间,多原发癌分为同时性癌(诊断间隔时间≤6个月)和异时性癌(诊断时间 > 6个月)。多原发癌主要发生在组织类型相似的器官,多见于上呼吸道、上消化道、泌尿生殖系统以及成对器官。其发生机制目前尚未有明确定论,可能与基因突变、免疫缺陷、遗传易患性、致癌因素的持续刺激以及既往是否采用化疗和放疗等因素有关[5-8]。多原发癌多发生在首发癌治疗后前5年,因此应加强前5年尤其是前3年的随访。本病例为异时性双原发癌,第一原发癌为结肠癌,第二原发癌为肺癌,两者之间间隔3年。患者随访检查发现肺占位,无明显相关症状,表明第一原发癌治疗后常规随访对第二原发癌的早诊早治具有重要意义。也有研究指出,第二原发癌的发生可能与第一原发癌距离很久,甚至可能在初次术后10年发生[9]。因此,随着现在肿瘤患者生存期的延长,需要对肿瘤患者进行比5年更长时间甚至是终身的随访监测。
多原发癌在治疗上与单发癌类似,而与转移癌和复发癌等有显著的区别,因此及时而准确的诊断至关重要。某一原发肿瘤出现迟发的和非典型的转移扩散、肿瘤负荷与肿瘤标志物水平的不一致、晚期和非典型转移扩散模式、环境致癌物质(如吸烟和饮酒)的持续暴露及放化疗史均提示可能存在第二原发癌[10]。影像学检查可以为诊断提供一些提示,但目前多原发癌、转移癌和复发癌主要仍是依靠组织病理学检查进行鉴别。只要不同癌灶的组织类型不同即可诊断为多原发癌;组织类型相同则需要进一步进行免疫组织化学和分子诊断技术的检测。本文报道的病例为同侧同肺叶肺原发癌合并转移性结肠腺癌,较为罕见,目前尚无大宗病例研究。国内曾报道1例相似的病例,为结肠癌术后4年发生肺转移同时伴原发性肺癌,提示在对肿瘤患者的随访中若发现远隔脏器占位要警惕转移癌与多原发癌共存的情况[11]。原发肺腺癌与转移性结肠腺癌通过HE切片鉴别较困难,免疫组织化学检查对于两者的鉴别较为准确有效。原发性肺腺癌的TTF-1和CK-7等为阳性,CDX-2、CA199和CK20则为阴性;转移性结肠腺癌则恰好相反。
对于多原发癌的治疗,目前尚无统一的方案与指南,相关研究也较为欠缺。应综合考虑肿瘤的类型、分期及患者的一般情况,采取个体化的治疗方案。本病例中,患者为异时性双原发癌,原发灶已手术切除,第二原发癌可切除且无手术禁忌,目前对于此类患者而言,手术为主的治疗方案仍为首选,应尽可能地切除每个肿瘤,必要时可行分期手术。
2.2 结肠癌胰腺转移胰腺转移癌较为罕见。有研究报道,在1 357例接受手术治疗的胰腺恶性肿瘤患者中,病理明确为胰腺转移癌的仅占2%[12]。目前已知会发生胰腺转移的原发肿瘤包括肾细胞癌、肺癌、乳腺癌、胃癌、结直肠癌和皮肤黑色素瘤等[13-14]。其中肾细胞癌是最常见的原发癌,而结直肠癌胰腺转移少见,在所有胰腺转移癌中,结直肠癌来源的仅占1.3%[15]。不同原发肿瘤发生胰腺转移的时间间隔也不相同,肾透明细胞癌发生胰腺转移的时间间隔较长,平均可达10.2年[16],而结直肠癌的转移时间间隔则较短。
胰腺转移癌的临床症状与原发性胰腺癌相似,早期也可表现为无症状[17]。影像学上,胰腺转移癌表现为低回声或低密度肿块;肿瘤标志物CA199可正常或升高。因此,临床上胰腺转移癌与原发性胰腺癌鉴别困难。超声引导下细针穿刺病理活检对鉴别诊断有帮助,但仍无法作为确诊依据。本例患者发生胰腺占位时距原发灶手术已5.5年,根据术前各项影像学检查结果,术前笔者首先考虑胰腺占位为胰腺原发癌,这对治疗方案的选择造成了一定影响。这提示在进行胰腺占位的临床诊断与鉴别诊断时,对于先前已知存在非胰腺恶性肿瘤,应将胰腺转移癌纳入考虑范围。术后标本的免疫组织化学检查对于胰腺转移癌与原发癌具有重要诊断价值。通常CK7阴性而CK20阳性则更倾向于肿瘤为结直肠癌来源,而非胰腺原发。
胰腺转移癌患者是否应接受手术治疗仍存在争议。多项研究指出,手术治疗可使胰腺癌转移患者获得较好的疾病缓解与生存获益[17-19]。研究显示,接受胰腺切除术的胰腺转移癌患者其5年生存率约为30%[13]。Sperti等[17]指出胰腺转移癌患者的所有症状(腹痛和黄疸等)在术后都能得到完全缓解,且所有接受手术治疗的患者均未发生围手术期死亡事件。在Crippa等[20]的研究中,胰腺转移癌的手术并发症发生率及围手术期死亡率与胰腺原发肿瘤无明显差别。这些研究均提示,对于可耐受手术的和肿瘤可切除的胰腺转移癌患者,手术治疗是一个安全而有效的可选方案。本例患者接受胰十二指肠切除术治疗,手术过程顺利,术后无明显并发症发生。对于无法切除的病例,联合化疗的外科或内镜下的姑息性手术也可有效提高患者的生活质量并延长生存期[20]。对于放化疗在胰腺转移癌中的作用的研究较少,目前也尚无标准的化疗方案。有临床试验表明,卡培他滨联合吉西他滨的化疗方案对转移性胰腺癌有较好的疗效和耐受性[21]。陈凡等[22]对40例胰腺转移癌患者的研究中,采用以局部放疗为主伴或不伴全身化疗的患者局部病情多数得到控制或较为稳定;而仅采取全身化疗的患者多数病情恶化进展,提示对胰腺转移癌患者应用局部治疗方案可能是必要的。
| [1] |
张丽娜, 孔祥兴, 李昕琳, 等. 结直肠癌pT4期诊断的难点及辅助诊断方案的研究进展[J]. 实用肿瘤杂志, 2021, 36(1): 6-10. |
| [2] |
National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Colon cancer version 3.2020[EB/OL]. (2020-05-06)[2021-03-07]. http://www.nccn.org: National Comprehensive Cancer Network, 2020: COL-G 1.
|
| [3] |
Vogt A, Schmid S, Heinimann K, et al. Multiple primary tumours: challenges and approaches, a review[J]. ESMO Open, 2017, 2(2): e000172. DOI:10.1136/esmoopen-2017-000172 |
| [4] |
Warren S, Gates O. Multiple primary malignant tumor : a survey of the literature and a statistical study[J]. Am J Cancer Res, 1932, 16: 1358-1414. |
| [5] |
李宁, 徐志巧, 王晓宏. 异时性多原发癌[J]. 中国当代医药, 2009, 16(21): 105-106. DOI:10.3969/j.issn.1674-4721.2009.21.070 |
| [6] |
孙俊杰, 李双庆. 多原发癌病因及发病机制的探索[J]. 中国全科医学, 2017, 9(20): 1136-1141. |
| [7] |
Chen SC, Liu CJ, Hu YW, et al. Second primary malignancy risk among patients with gastric cancer: a nationwide population-based study in Taiwan[J]. Gastr Cancer, 2016, 19(2): 490-497. DOI:10.1007/s10120-015-0482-3 |
| [8] |
Li F, Zhong WZ, Niu FY, et al. Multiple primary malignancies involving lung cancer[J]. BMC Cancer, 2015, 15: 696. DOI:10.1186/s12885-015-1733-8 |
| [9] |
Lee WS, Lee JN, Choi S, et al. Multiple primary malignancies involving colorectal cancer-clinical characteristics and prognosis with reference to surveillance[J]. Langenbecks Arch Surg, 2010, 395(4): 359-364. DOI:10.1007/s00423-009-0553-1 |
| [10] |
Copur MS, Manapuram S. Multiple primary tumors over a lifetime[J]. Oncology, 2019, 33(7): 629384. |
| [11] |
李桃, 赵敏, 周颖, 等. 结肠癌肺转移伴原发性肺癌1例[J]. 临床与实验病理学杂志, 2019, 35(12): 1494-1495. |
| [12] |
Roland CF, van Heerden JA. Nonpancreatic primary tumors with metastasis to the pancreas[J]. Surg Gynecol Obstet, 1989, 168(4): 345-347. |
| [13] |
Reddy S, Wolfgang CL. The role of surgery in the management of isolated metastases to the pancreas[J]. Lancet Oncol, 2009, 10(3): 287-293. DOI:10.1016/S1470-2045(09)70065-8 |
| [14] |
郑雷. 走出胰腺癌认识五大误区, 优化胰腺癌个体治疗[J]. 实用肿瘤杂志, 2020, 35(5): 383-386. |
| [15] |
Tani R, Hori T, Yamada M, et al. Metachronous pancreatic metastasis from rectal cancer that masqueraded as a primary pancreatic cancer: A rare and difficult-to-diagnose metastatic tumor in the pancreas[J]. Am J Case Rep, 2019, 20: 1781-1787. DOI:10.12659/AJCR.918669 |
| [16] |
Sellner F, Tykalsky N, De Santis M, et al. Solitary and multiple isolated metastases of clear cell renal carcinoma to the pancreas: an indication for pancreatic surgery[J]. Ann Surg Oncol, 2006, 13(1): 75-85. DOI:10.1245/ASO.2006.03.064 |
| [17] |
Sperti C, Pasquali C, Berselli M, et al. Metastasis to the pancreas from colorectal cancer: is there a place for pancreatic resection?[J]. Dis Colon Rectum, 2009, 52(6): 1154-1159. DOI:10.1007/DCR.0b013e31819f7397 |
| [18] |
Huang Q, Zhou H, Liu C, et al. Surgical resection for metastatic tumors in the pancreas: A single-center experience and systematic review[J]. Ann Surg Oncol, 2019, 26(6): 1649-1656. DOI:10.1245/s10434-019-07258-2 |
| [19] |
Lee CW, Wu RC, Hsu JT, et al. Isolated pancreatic metastasis from rectal cancer: a case report and review of literature[J]. World J Surg Oncol, 2010, 8: 26. DOI:10.1186/1477-7819-8-26 |
| [20] |
Crippa S, Angelini C, Mussi C, et al. Surgical treatment of metastatic tumors to the pancreas: a single center experience and review of the literature[J]. World J Surg, 2006, 30(8): 1536-1542. DOI:10.1007/s00268-005-0464-4 |
| [21] |
Herrmann R, Bodoky G, Ruhstaller T, et al. Gemcitabine plus capecitabine compared with gemcitabine alone in advanced pancreatic cancer: a randomized, multicenter, phase Ⅲ trial of the Swiss Group for Clinical Cancer Research and the Central European Cooperative Oncology Group[J]. J Clin Oncol, 2007, 25(16): 2212-2217. DOI:10.1200/JCO.2006.09.0886 |
| [22] |
陈凡. 胰腺转移癌40例临床分析[J]. 中华消化杂志, 2008, 28(10): 714-715. DOI:10.3760/j.issn:0254-1432.2008.10.024 |
 2022, Vol. 37
2022, Vol. 37


