文章信息
- 徐霞, 陈丽荣
- 肺原发上皮—肌上皮癌一例
- 实用肿瘤杂志, 2021, 36(2): 171-173
-
通信作者
- 陈丽荣, E-mail: zrclr@zju.edu.cn
-
文章历史
- 收稿日期:2020-11-26
患者男性,48岁,因右侧胸痛不适1个月余于2016年2月22日收住浙江大学医学院附属第二医院胸外科,当时无咳嗽咳痰,无胸闷气急,无发热、乏力和盗汗等。2016年1月27日行胸部增强CT检查示,右肺下叶外基底段见一结节状密度增高影,边界尚清,分叶状,内密度均匀,大小23.1 mm×23.0 mm×24.6 mm,增强后病灶内轻度强化,病灶边缘强化;恶性待排(图 1)。患者无基础疾病,入院完善相关检查,肿瘤标志物在正常范围内,头颅CT、全身骨显像、肾上腺彩超和锁骨上淋巴结彩超等未见特殊,于2016年3月2日行肺叶切除术,术中肿块位于右肺下叶,呈周围型,未见明显胸膜凹陷。
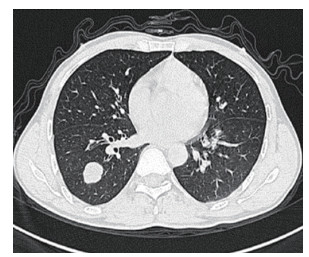
|
| 图 1 胸部CT检查提示右肺下叶外基底段结节且呈短分叶状 |
病理检查:送检右肺下叶切除标本1个,大小12.5 cm×8.5 cm×3 cm,距支气管切缘2.0 cm,距胸膜1.0 cm,可见一灰白结节,大小2.4 cm×1.8 cm,质地中等,边界尚清。送检淋巴结8组。镜下观察:低倍镜下可见肿瘤与周围组织边界尚清,无明显包膜,肿瘤细胞呈腺管状生长,腺样结构大小不一,形态不规则,腔内可见嗜酸性物质,未见明显坏死(图 2A~2B);高倍镜下见肿瘤腺管样结构由不同比例的2种细胞组成,内层细胞呈矮柱状,胞质嗜酸,核位于中央,外层细胞呈多边形,胞质透明,核偏位,核分裂象可见,4/10高倍镜视野(high power field,HPF),间质可见纤维细胞穿插增生(图 2C)。免疫组织化学检查示,肿瘤内层细胞表达上皮细胞膜抗原(epithelial membrane antigen,EMA)、细胞角蛋白18(cell keratin 18,CK18)和甲状腺转录因子1(thyroid transcription factor-1,TTF-1),外侧细胞表达CK5/6、平滑肌肌动蛋白(smooth muscle actin,SMA)、钙调节蛋白(Calponin)、p63和CK34BE12,Ki-67阳性(约5%),不表达CK20、CD117、S-100及神经胶质纤维酸性蛋白(glial fibrillary acidic protein,GFAP;图 3)。肿瘤腺管样结构周围及管腔内黏液样物质过碘酸-雪夫氏染色(periodic acid-Schiff stain,PAS)阳性。分子检测:BRAF V600E(1799T > A)基因未发现突变;KRAS基因突变检测Gly12Asp、Gly12Ala、Gly12Val、Gly12Ser、Gly12Arg、Gly12Cys及Gly13Asp未发现突变;表皮生长因子受体(epidermal growth factor receptor,EGFR)突变检测Ex19、Ex21、Ex18及Ex20位点均未发现突变。病理诊断:(右肺下叶)肺原发上皮-肌上皮癌(pulmonary epithelial-myoepithelial carcinoma,PEMC)。淋巴结阴性。患者术后未接受辅助性治疗,随访4年余,未见复发或转移。
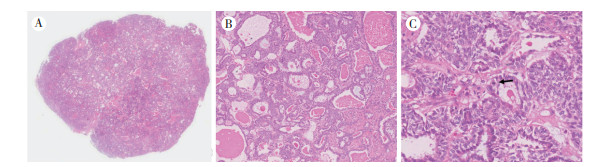
|
| 注 A:界限尚清楚的结节状结构,呈腺腔样排列(HE×3);B:肿瘤细胞呈腺腔样排列,腺管大小不规则,腔内可见嗜酸性物质,未见坏死(HE×40);C:肿瘤组织腺腔壁由2层细胞组成,内层细胞呈矮柱状,胞质嗜酸,核位于中央,外层细胞呈多边形,胞质偏透明,核偏位,核分裂像可见(HE×200);箭头示核分裂像 图 2 右肺下叶肿块病理检查结果 |
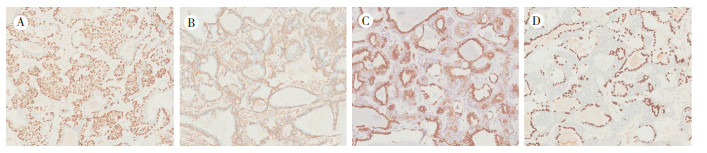
|
| 注 A:肿瘤腺管外层细胞p63蛋白表达阳性;B:肿瘤腺管外层细胞SMA蛋白表达阳性;C:肿瘤腺管内层细胞CK18蛋白表达阳性;D:肿瘤腺管内层细胞TTF-1蛋白表达阳性 图 3 右肺下叶肿块免疫组织化学检查结果(SP×100) |
上皮-肌上皮癌(epithelial-myoepithelial carcinoma,EMC)是由腺上皮和肌上皮构成的低度恶性肿瘤,多数发生于涎腺组织,偶见发生于鼻、乳腺和肺咽旁系等其他部位[1]。PEMC是罕见的发生于肺或支气管的涎腺源性肿瘤[2]。PEMC细胞学形态相对温和,核分裂像不多见,多数病例预后良好,但仍存在一部分转移复发的病例报道。Nguyen等[3]报道过1例PEMC转移至支气管周脂肪组织及支气管周淋巴结。Muslimani等[4]报道过1例复发性PEMC。该2例病例细胞异型性均不明显,核分裂像少见。Song等[5]报道1例复发转移至胸壁组织的PEMC,该复发转移病例具有一定的细胞学异型性,核分裂像可见,推测肿瘤体积大、高比例的肌上皮组成以及肌上皮p27缺失等可能是导致肿瘤复发的因素。目前对PEMC的良恶性的诊断标准虽尚未完全一致,世界卫生组织(World Health Organization,WHO)对其仍统一以PEMC命名,涵盖其恶性潜能,以引起临床及患者的重视。
PEMC多发生于成年患者,无明显性别优势,与吸烟关系不大,临床上多无典型体征,长在支气管旁的肿瘤可早期出现咳嗽、咳痰、胸闷和胸痛等症状,确诊需要临床病理检查及免疫组织化学检查相结合。大体上PEMC多边界清,切面灰白质硬。光学显微镜下肿瘤由肌上皮细胞和不等量的形成导管的腺上皮组成,典型的可呈双层腺管状结构,内层细胞呈腺上皮分化,一般较小,立方状,外层细胞呈肌上皮分化,较大,通常呈透明细胞样,部分可呈梭形或浆细胞样分化,个别病例可出现乳头状结构,坏死及核分裂像均不多见[6]。由于PEMC形态学结构较为特殊,其确诊还部分依赖于免疫组织化学结果,给穿刺活检及冰冻诊断带来一定的挑战性。既往研究报道,PEMC在活检小标本及冰冻诊断中诊断准确率相对较低,易诊断为腺癌、黏液腺癌或腺样囊性癌等[5]。免疫组织化学方面:由于肿瘤具有一定的异质性,不同的腺上皮和肌上皮标志物在不同个体的PEMC中具有一定的差异。内层细胞大多表达CK7、CK18、EMA和癌胚抗原等,腺上皮标志阳性。本例病例内层腺上皮细胞TTF-1表达阳性,提示具有肺泡上皮分化,这与一些研究报道的PEMC可表达TTF-1相一致[5, 7]。外层细胞多表达p63、Calponin、SMA、CK5/6、S-100、CK34BE12和波形蛋白等,肌上皮标志阳性。基因表达方面,本例病例对肺癌中常见的3种突变[包括EGFR、KRAS和BRAF(V600)]进行检测[8-9],均未发现突变。既往对PEMC进行KRAS、EGFR、间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)和人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER2)等突变基因检测的报道也未发现突变[6, 10]。1例PEMC进行二代测序发现,HRAS基因第61号密码子由谷氨酰胺突变为精氨酸[11],与既往报道的涎腺EMC的突变类型一致[12],猜测PEMC的分子改变更接近于头颈部涎腺来源的EMC。但目前对PEMC进行分子检测的文章极少,仍需要更多的分子样本研究来加深认识。
本例肿瘤最大径2.4 cm,分叶状,主体位于周围肺组织,边界尚清,切面灰白色;镜下呈腺管状结构,由不同比例的腺上皮和肌上皮细胞组成,肌上皮呈透明细胞样,核分裂像可见。免疫组织化学内层细胞表达EMA、CK18和TTF-1,外侧细胞表达CK5/6、SMA、Calponin、p63和CK34BE12。基因检测BRAF、EGFR和KRAS未发现突变。结合组织学形态及相关临床病史资料,可以确诊为PEMC,需与以下肿瘤鉴别诊断。(1)细支气管腺瘤:远端型细支气管腺瘤由基底细胞和腔面的Ⅱ型肺泡细胞或Clara细胞构成,含少量甚至没有黏液细胞和纤毛细胞,形态上与PEMC相似。但前者细胞排列较为有序,不密集,构成的腺样结构较一致,无透明细胞样改变,间质反应不明显,呈良性表现,基底细胞和腔面细胞均表达TTF-1,不表达SMA、S-100或Calponin等[13-14]。(2)腺癌(贴壁型,腺泡型):由单层细胞结构组成,细胞重叠,核异型性明显。(3)黏液表皮样癌:由黏液细胞、鳞状细胞及中间型细胞构成,黏液细胞呈黏液染色阳性,黏液表皮样癌也可表达p63和CK5/6,但肌上皮标记阴性。(4)腺样囊性癌:由导管上皮与肌上皮细胞呈筛状、小管状和腺样排列,周围有丰富的黏液样和透明变性样基质。(5)肌上皮癌:肿瘤细胞呈巢团状或实性片状排列,免疫组织化学仅表达肌上皮标志。组织学形态及免疫组织化学均与PEMC不同。(6)多形性腺瘤:由腺上皮细胞和在黏液样和(或)软骨样基质中混合的肌上皮细胞组成。(7)转移性EMC:患者经全身检查,可排除其他脏器或部位占位性病变。
PEMC比较罕见,其病因和临床预后未十分明了,目前尚缺乏统一的标准治疗方法,临床上多以手术切除为主,放化疗效果不明确。本例患者随访4年余,未见复发或转移征象。推测PEMC整体预后良好,部分病例有转移复发的风险,仍需要引起患者及临床医师的重视,定期随访及复查。由于报道总数较少,该类病例还需要更多的样本量及随访数据来进一步明确其生物学行为。
| [1] |
Seethala RR, Barnes EL, Hunt JL. Epithelial-myoepithelial carcinoma: a review of the clinicopathologic spectrum and immunophenotypic characteristics in 61 tumors of the salivary glands and upper aerodigestive tract[J]. Am J Surg Pathol, 2007, 31(1): 44-57. DOI:10.1097/01.pas.0000213314.74423.d8 |
| [2] |
Westacott LS, Tsikleas G, Duhig E, et al. Primary epithelial-myoepithelial carcinoma of lung: a case report of a rare salivary gland type tumour[J]. Pathology, 2013, 45(4): 420-422. DOI:10.1097/PAT.0b013e328360dfa0 |
| [3] |
Nguyen CV, Suster S, Moran CA. Pulmonary epithelial-myoepithelial carcinoma: a clinicopathologic and immunohistochemical study of 5 cases[J]. Hum Pathol, 2009, 40(3): 366-373. DOI:10.1016/j.humpath.2008.08.009 |
| [4] |
Muslimani AA, Kundranda M, Jain S, et al. Recurrent bronchial epithelial-myoepithelial carcinoma after local therapy[J]. Clin Lung Cancer, 2007, 8(6): 386-388. DOI:10.3816/CLC.2007.n.020 |
| [5] |
Song DH, Choi IH, Ha SY, et al. Epithelial-myoepthelial carcinoma of the tracheobronchial tree: the prognostic role of myoepithelial cells[J]. Lung Cancer, 2014, 83(3): 416-419. DOI:10.1016/j.lungcan.2014.01.005 |
| [6] |
Guleria P, Madan K, Kumar S, et al. Pulmonary epithelial myoepithelial carcinoma with papillary architecture: an uncommon morphology of a rare tumour[J]. Pathology, 2019, 51(4): 443-445. DOI:10.1016/j.pathol.2018.12.421 |
| [7] |
Chang T, Husain AN, Colby T, et al. Pneumocytic adenomyoepithelioma: a distinctive lung tumor with epithelial, myoepithelial, and pneumocytic differentiation[J]. Am J Surg Pathol, 2007, 31(4): 562-568. DOI:10.1097/01.pas.0000213426.76621.2a |
| [8] |
王思斯, 明陈, 哲孙, 等. 非小细胞肺癌生存预测列线图的构建与验证[J]. 实用肿瘤杂志, 2020, 35(4): 327-334. |
| [9] |
杨文丽, 申旺, 彭雨, 等. EML4-ALK在非小细胞肺癌中的表达及其临床病理特征[J]. 实用肿瘤杂志, 2018, 33(3): 250-254. |
| [10] |
Okudela K, Yazawa T, Tajiri M, et al. A case of epithelial-myoepithelial carcinoma of the bronchus-a review of reported cases and a comparison with other salivary gland-type carcinomas of the bronchus[J]. Pathol Res Pract, 2010, 206(2): 121-129. DOI:10.1016/j.prp.2009.03.003 |
| [11] |
陈亮, 李庆姝, 付广, 等. 肺上皮-肌上皮癌1例并文献复习[J]. 中国肺癌杂志, 2020, 23(2): 127-132. |
| [12] |
Urano M, Nakaguro M, Yamamoto Y, et al. Diagnostic significance of HRAS mutations in epithelial-myoepithelial carcinomas exhibiting a broad histopathologic spectrum[J]. Am J Surg Pathol, 2019, 43(7): 984-994. DOI:10.1097/PAS.0000000000001258 |
| [13] |
Chang JC, Montecalvo J, Borsu L, et al. Bronchiolar adenoma: expansion of the concept of ciliated muconodular papillary tumors with proposal for revised terminology based on morphologic, immunophenotypic, and genomic analysis of 25 cases[J]. Am J Surg Pathol, 2018, 42(8): 1010-1026. DOI:10.1097/PAS.0000000000001086 |
| [14] |
高何, 杜晓刘, 陈春妮, 等. 细支气管腺瘤15例临床病理学观察[J]. 中华病理学杂志, 2020, 49(6): 556-561. |
 2021, Vol. 36
2021, Vol. 36


